Інтраопераційна гіпертермічна внутрішньочеревна хіміоперфузія в комбінованому лікуванні пацієнтів із місцево-поширеним та дисемінованим раком шлунка
Ярема Р.Р.1, Фецич Т.Г.1, Огорчак М.А.2, Зубарев Г.П. 2, Олийнык Ю.Ю. 1, Матусяк М.Б. 2, Зубарев Н.Г1, Гиря П.И. 2, Ковальчук Ю.Я.2, Сафиян В.И. 2
- 1Львівський національний медичний університет імені Данила Галицького
- 2Львівський державний онкологічний регіональний лікувально-діагностичний центр, Львів
Резюме. Проаналізовано результати застосування інтраопераційної гіпертермічної внутрішньочеревної хіміоперфузії (hyperthermic intraperitoneal chemoperfusion — HIPEC) у комбінованому лікуванні 49 хворих на поширений рак шлунка. Післяопераційні ускладнення розвинулися у 26,5% випадків, післяопераційна летальність становила 4,1%. Комбіноване лікування хворих на серозоінвазивний рак шлунка дозволило знизити рівень метахронного карциноматозу очеревини з 73,7 до 11,1% (р<0,001) та підвищити медіану виживаності з 12 до 22,5 міс (р=0,001). Медіана та 1-річна виживаність хворих на інтраперитонеально дисемінований рак шлунка при застосуванні комбінованої терапії з використанням HIPEC становили 12 міс та 68,8% відповідно, у хворих контрольної підгрупи (паліативна хіміотерапія) — 8 міс та 25% відповідно (p=0,004). Застосування HIPEC в симптоматичному режимі дозволяє ефективно ліквідувати рецидивуючий асцит у хворих з дифузним карциноматозом очеревини.

ВСТУП
Протягом останніх двох десятків років в онкології змінюється парадигма в лікуванні інтраперитонеально дисемінованих пухлин, що супроводжується впровадженням нових активних способів комбінованого лікування таких хворих із застосуванням циторедуктивних операцій та інтраопераційної гіпертермічної внутрішньочеревної хіміоперфузії (hyperthermic intraperitoneal chemotherapy — HIPEC). Такий лікувальний підхід уже сьогодні беззаперечно підтвердив свою ефективність у лікуванні хворих на колоректальний рак з карциноматозом очеревини (КО), псевдоміксому та мезотеліому очеревини, що слугувало причиною включення його в національні стандарти деяких країн Євросоюзу [1, 2]. Однак результати застосування комбінованої терапії раку шлунка (РШ) з використанням HIPEC до сьогодні залишаються обмеженими клінічним досвідом окремих клінік Японії та Європи, тому питання доцільності та ефективності проведення HIPEC у хворих на РШ залишається актуальним та дискутабельним [3–5].
Перитонеальна дисемінація є найчастішим шляхом метастазування РШ, яку діагностують у 30% усіх хворих на РШ [6, 7]. Інтраперитонеальне прогресування захворювання після радикального хірургічного лікування (метахронний карциноматоз) розвивається у 34–60% пацієнтів та є основною причиною смерті хворих на РШ [8]. Системна паліативна хіміотерапія хворих на РШ з перитонеальними імплантами характеризується низькою ефективністю [9]. Застосування таргетних препаратів у більшості випадків обмежене інтестинальним типом РШ, шляхом метастазування якого є гематогенний [10].
В основу циторедуктивних втручань (при РШ з перитонеальними імплантами: гастректомія + лімфаденектомія D2+ парціальна перитонектомія) покладено принцип максимального видалення пухлинної маси з організму хворого з метою досягнення мінімального рівня інтраперитонеального пулу пухлинних клітин з розрахунку на наступну дію на резидуальні мікроскопічні пухлинні елементи хіміогіпертермічного впливу. Принциповою відмінністю циторедуктивних операцій від паліативних втручань є видалення не тільки локорегіонарного сегмента дисемінованої пухлини, а й віддалених метастазів. Після закінчення основного етапу хірургічного втручання для проведення процедури HIPEC за допомогою з’єднання магістральних катетерів, позиціонованих у черевну порожнину з автоматичним термостатуючим обладнанням, створюється замкнутий стерильний контур, який дозволяє проводити перфузію черевної порожнини розчином цитостатичних препаратів у гіпертермічному режимі з перманентним термомоніторингом організму хворого на різних рівнях.
Об’єктивним методом оцінки ступеня інтраперитонеального поширення метастатичного процесу є класифікація Японської асоціації з раку шлунка (Japanese Gastric Cancer Association — JGCA): Р0 — імпланти на очеревині відсутні; Р1 — поодинокі дисемінати у верхньому поверсі черевної порожнини (вище рівня поперечно-ободової кишки); Р2 — поодинокі дисемінати у всіх відділах черевної порожнини; Р3 — дифузний карциноматоз черевної порожнини, у тому числі наявність асциту, та CY1 — наявність злоякісних клітин у змивах з очеревини без макроскопічного карциноматозу [11].
Іншим об’єктивним критерієм стадіювання перитонеального карциноматозу є перитонеальний раковий індекс (peritoneal cancer index — PCI), який розраховують наступним чином: черевну порожнину розділяють на 13 умовних ділянок, у кожній з яких залежно від розмірів імплантів оцінюють ступінь карциноматозу (від 1 до 3 балів) з подальшим сумуванням балів усіх ділянок [12].
Важливим прогностичним критерієм ефективності циторедуктивного втручання є показник повноти циторедукції (completeness of cytoreduction score — CC): СС-0 — макроскопічні резидуальні пухлинні вогнища на очеревині після циторедуктивного втручання відсутні; СС-1 — резидуальні вогнища діаметром не більше 2,5 мм; СС-2 — розмір резидуальних вузликів від 2,5 мм до 2,5 см та СС-3 — розмір резидуальних пухлинних вузлів >2,5 см [12].
Метою нашого дослідження було вивчення клінічної ефективності застосування комбінованої терапії з використанням HIPEC у хворих на місцево-поширений та дисемінований РШ, а також визначення факторів прогнозу у пацієнтів з розповсюдженим РШ, які одержують комбіноване лікування.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
Проведено аналіз результатів лікування 98 хворих на розповсюджений РШ, які перебували на стаціонарному лікуванні в Клініці онкології та медичної радіології Львівського національного медичного університету ім. Данила Галицького, Львівському державному онкологічному регіональному лікувально-діагностичному центрі у 2008–2012 рр. (проспективне нерандомізоване клінічне дослідження). Чоловіки становили 66,3% (65 хворих), жінки — 33,7% (33 хворих). Вік хворих коливався від 22 до 74 років, середній вік — 56,6±0,2 року. У всіх хворих до початку лікування морфологічно верифіковано РШ, а також отримано інформовану згоду на участь у клінічному дослідженні. Стадіювання РШ проводили на основі критеріїв класифікації TNM 7-го видання (2009).
Досліджуваних хворих розподілено на 3 групи. Таким чином, у 1-шу групу увійшли 38 хворих на локалізований чи місцево-поширений РШ з інвазією серозної оболонки та, відповідно, високим ризиком інтраперитонеального прогресування. Пацієнтів 1-ї групи розділено на 2 підгрупи: дослідна підгрупа — у хворих проведено стандартні радикальні хірургічні втручання в обсязі гастректомії чи субтотальної резекції шлунка з D2-лімфаденектомією, після чого інтраопераційно виконували HIPEC з ад’ювантною метою; та підгрупа хірургічного контролю — хворі одержували лише хірургічне лікування без ад’ювантної терапії.
У 2-гу групу ввійшли 40 хворих на РШ з маніфестованою перитонеальною дисемінацією. Хворих даної групи розділено на 2 підгрупи: дослідна підгрупа — хворим проводили циторедуктивні хірургічні втручання в обсязі гастректомії чи субтотальної резекції шлунка з D2-лімфаденектомією та парціальною перитонектомією ділянок очеревини уражених імплантами, після чого інтраопераційно проводили HIPEC та в післяопераційний період — системну хіміотерапію; та контрольна підгрупа — хворі одержували лише системну паліативну хіміотерапію.
3-тя група — 20 хворих на інтраперитонеально дисемінований РШ з дифузним КО, перебіг якого ускладнювався розвитком напруженого асциту. Пацієнтів 3-ї групи розділено на 2 підгрупи: дослідна підгрупа — у хворих виконано симптоматичні хірургічні втручання в обсязі лапаротомії, евакуації асциту та HIPEC в симптоматичному режимі з метою ліквідації рецидивуючого асциту; та контрольна підгрупа — хворі отримали симптоматичну терапію. Циторедуктивний обсяг втручання у хворих даної групи не застосовували через масивний характер перитонеальної дисемінації та неможливість досягнення повного обсягу циторедукції (рис. 1).
| 98 хворих на РШ | Група 1 38 хворих з високим ризиком метахронного КО |
19 хворих —радикальна операція + HIPEC | Диспансеризація | |||
| 19 хворих —радикальна операція | ||||||
| Група 2
40 хворих з маніфестованим КО |
20 хворих — циторедуктивна операція + HIPEC + паліативна хіміотерапія | |||||
| 20 хворих —паліативна хіміотерапія | ||||||
| Група З
20 хворих з дифузним КО та рецидивуючим асцитом |
10 хворих —симптоматична операція + HIPEC | |||||
| 10 хворих —симптоматична терапія |
У хворих інтраопераційно застосовано бідирекційну хіміотерапію (НІРЕС + внутрішньовенно флуороурацил). Процедуру HIPEC проводили протягом 90 хв з середньою інтраабдомінальною температурою 42,3±1,3 °С (від 39 до 44) з використанням мітоміцину Ц в дозі 12,5 мг/м2 та цисплатину — 75 мг/м2.
Пацієнти 1-ї групи були зіставними за основними клініко-морфологічними параметрами (табл. 1).
У табл. 2 відображено основні клініко-морфологічні параметри хворих 2-ї групи.
Ступінь дисемінації в контрольній підгрупі визначали за результатами діагностичної лапароскопії чи експлоративної лапаротомії.
Характер повноти циторедукції серед 20 хворих 2-ї групи був наступним: СС-0 — у 15 (75%) пацієнтів, СС-1 — у 3 (15%) та СС-2 — у 2 (10%).
Таблиця 1. Характеристика хворих 1-ї групи за основними клініко-морфологічними параметрами
| Радикальна операція + HIPEC (n=19) | Радикальна операція (n=19) | |
|---|---|---|
| Чоловіки
Жінки |
15 (79%)
4 (21%) |
13 (68%)
6 (32%) |
| Локалізація пухлини в шлунку:
антральний відділ тіло антральний відділ + тіло субтотальне ураження |
4 (21%)
9 (47%) – 6 (32%) |
7 (37%)
5 (26%) 1 (5%) 6 (32%) |
| Гістологічна структура:
G2 G3 G4 перснеподібно-клітинна карцинома |
2 (11%)
9 (47%) 7 (37%) 1 (5%) |
1 (5%)
6 (32%) 10 (52%) 2 (11%) |
| рТ (TNM 7, 2010)
рТ4а рТ4b |
15 (79%)
4 (21%) |
18 (95%)
1 (5%) |
| Площа інфільтрації серозної оболонки шлунка
2 >20 см2 субтотальне ураження «серози» |
7 (36%)
6 (32%) 6 (32%) |
7 (36%)
6 (32%) 6 (32%) |
| Стадія (TNM 7, 2010)
ІІВ ІІІА ІІІВ ІІІС |
8 (43%)
1 (5%) 5 (26%) 5 (26%) |
11 (58%)
2 (10%) 3 (16%) 3 (16%) |
| Лімфодисекція
D1 D2 |
8 (42%)
11 (58%) |
10 (52%)
9 (48%) |
Таблиця 2. Характеристика хворих 2-ї групи за основними клініко-морфологічними параметрами
| Циторедуктивна операція + HIPEC + ХТ (n=20) | Паліативна ХТ (n=20) | |
|---|---|---|
| Чоловіки
Жінки |
10 (50%)
10 (50%) |
16 (80%)
4 (20%) |
| Локалізація пухлини в шлунку:
антральний відділ тіло антральний відділ + тіло субтотальне ураження |
2 (10%)
5 (25%) 6 (30%) 7 (35%) |
7 (35%)
4 (20%) 5 (25%) 4 (20%) |
| Гістологічна структура:
G2 G3 G4 перснеподібно-клітинна карцинома муцинозна карцинома |
1 (5%)
2 (10%) 14 (70%) 2 (10%) 1 (5%) |
1 (5%)
10 (50%) 6 (30%) 3 (15%)- |
| Ступінь дисемінації (JGCA*):
Р0 (CY1) Р1 Р2 Р3 |
2 (10%)
10 (50%) 7 (35%) 1 (5%) |
2 (10%)
11 (55%) 6 (30%) 1 (5%) |
| Середній показник перитонеального ракового індексу | 3,4 (0–14) | 4,2 (0–18) |
| Лімфодисекція
D1 D2 |
14 (70%)
6 (30%) |
— |
*Japanese Gastric Cancer Association; ХТ — хіміотерапія.
12 (60%) із 20 хворих 2-ї групи, у яких застосовували комбіноване лікування з використанням HIPEC, отримували в післяопераційний період системну паліативну хіміотерапію за наступними схемами: ECF — 4 (20%) пацієнтів, СF — 4 (20%), CAF — 2 (10%), 5-FU — 1 (5%) та тегафур — 1 (5%). У контрольній підгрупі 2-ї групи системну паліативну хіміотерапію одержували 17 (85%) хворих за наступними схемами: XELOX — 1 пацієнт (5%), CF — 6 (30%), CAF — 4 (20%), 5-FU — 4 (20%), тегафур — 2 (10%), у 3 (15%) пацієнтів застосовували симптоматичну терапію.
Середній об’єм асцитичної рідини в черевній порожнині у хворих 3-ї групи становив 5,5±1,4 л (від 3,5 до 8 л).
Статистичну обробку первинних даних проводили з використанням програми Statistica. Для дослідження кумулятивної виживаності хворих використовували цензурований метод Каплана — Мейєра. Визначення значущості в різниці рівнів виживаності в окремих групах здійснено за допомогою логарифмічного рангового коефіцієнта. Мультиваріаційний аналіз проведено шляхом дискримінантного дослідження.
РЕЗУЛЬТАТИ ДОСЛІДЖЕННЯ
Середній термін перебування у стаціонарі хворих, у яких застосовували HIPEC, становив 24,3±5,7 доби (від 16 до 48 діб).
Після проведеного хірургічного втручання з використанням HIPEC післяопераційні ускладнення розвинулися в 13 (26,5%) з 49 хворих 3 груп. Із них хірургічні — у 7 (14,3%) пацієнтів, ускладнення, специфічні для HIPEC, — у 6 (12,2%) та загальносоматичні — у 1 (2%). Серед хірургічних ускладнень відзначено: підпечінковий абсцес у 2 (4,1%) хворих, інфікований некротичний панкреатит з гнійно-септичними ускладненнями — у 2 (4,1%), анастомозит — у 1 (2%), мезентеріальний тромбоз — у 1 (2%) та неспроможність гостроентероанастомозу — у 1 (2%) пацієнта. Серед ускладнень, пов’язаних з HIPEC, констатовано: нефротоксичність ІІІ–ІV ступеня (згідно з критеріями Clinical Toxicity Criteria National Cancer Institut Canada — CTC NCIC) — у 1 (2,6%) пацієнта, лейкопенію ІІІ ступеня — у 1 (2,6%), тривалий парез кишечнику — у 1 (2,6%), тенденцію до підвищення системної температури тіла протягом HIPEC — у 1 (2,6%), виражений ентероколіт — у 1 (2,6%) та комбінацію нефротоксичності ІІІ ступеня з тривалим ентероколітом — у 1 (2,6%) хворого. Серед загальносоматичних ускладнень відзначено 1 (2,6%) випадок госпітальної пневмонії.
Побічні дії та явища легкого ступеня вираженості, пов’язані як з перебігом патології, обсягом і характером хірургічного втручання, так і застосуванням HIPEC, зафіксовано у 46 (93,9%) пацієнтів (табл. 3).
Післяопераційна летальність серед 49 хворих, у складі комбінованої терапії яких застосовували HIPEC, мала місце у 2 (4,1%) випадках: 1 — внаслідок тромбозу мезентеріальних судин на фоні генералізованого атеросклерозу та 1 — через некротичний панкреатит з гнійно-септичними ускладненнями.
Мінімальний термін спостереження за пацієнтами після лікування — 12 міс.
Таблиця 3. Характеристика явищ токсичності (CTC NCIC) комбінованого лікування з використанням HIPEC
| Побічні явища | Кількість хворих n (%) |
|---|---|
| Гіпопротеїнемія І–ІІІ ступеня | 41 (83,7%) |
| Анемія І–ІІІ ступеня | 33 (67,3%) |
| Лейкопенія І–ІІ ступеня | 3 (6,1%) |
| Тромбоцитопенія І ступеня | 1 (2%) |
| Гіперамілаземія І–ІІІ ступеня | 17 (34,7%) |
| Гіперамінотрансфераземія І–ІІ ступеня | 19 (38,8%) |
| Нефротоксичність І–ІІ ступеня | 14 (28,6%) |
| Мікрогематурія І ступеня | 8 (16,3%) |
| Протеїнурія І–ІІ ступеня | 14 (28,6%) |
| Підвищений рівень ексудації з дренажів | 7 (14,3%) |
Медіана та 1-річна виживаність 19 хворих 1-ї групи (з високим ризиком інтраперитонеального прогресування), у котрих в ад’ювантному режимі застосовували HIPEC, становлять 22,5±6,5 міс (95% ДІ 9,7–35,3) та 100% відповідно; у 19 пацієнтів підгрупи хірургічного контролю — 12±1,3 міс (95% ДІ 9,4–14,6) (р=0,002) та 52,6% (р=0,001) (рис. 2).
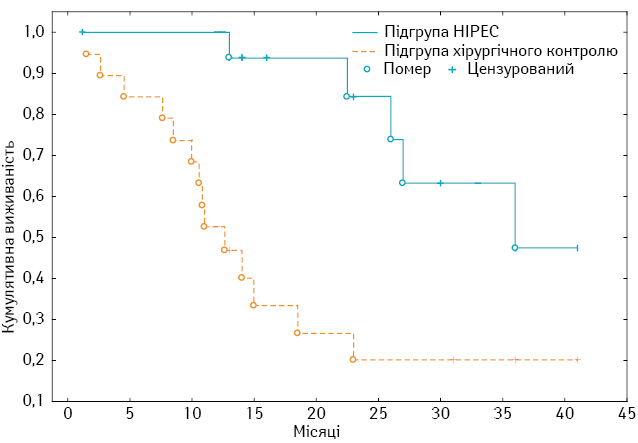
Рівень інтраперитонеального рецидиву у хворих 1-ї групи після проведення комбінованого лікування з використанням HIPEC становить 11,1%, у підгрупі хірургічного контролю — 73,7% (р
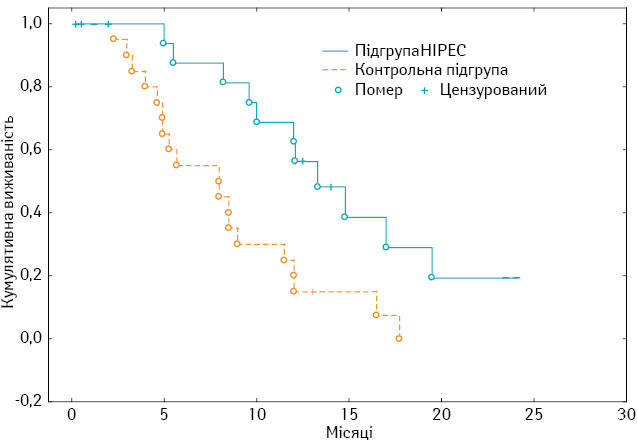
Медіана та 1-річна виживаність 20 хворих 2-ї групи (з маніфестованими імплантами), котрим у режимі комбінованої терапії застосовували HIPEC, становлять 12±1,6 міс (95% ДІ 8,9–15,1) та 68,8% відповідно; у 20 пацієнтів контрольної підгрупи (паліативна хіміотерапія) — 8±2,6 міс (95% ДІ 2,99–13) (р=0,004) та 25% (р=0,004) (рис. 3).
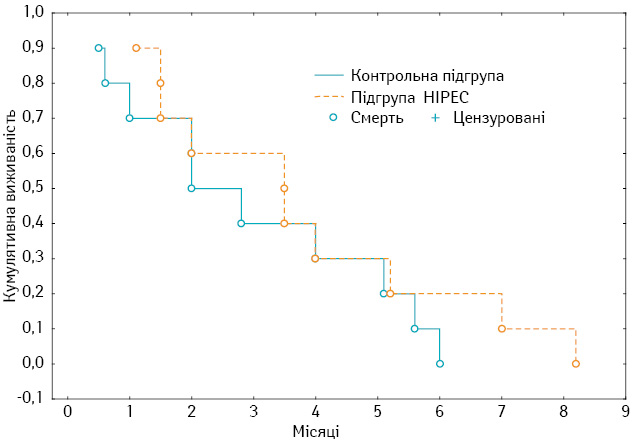
Медіана виживаності 10 хворих 3-ї групи (з напруженим злоякісним асцитом), котрим у комбінованій терапії застосовували HIPEC, становить 3,5 міс, у 10 пацієнтів контрольної підгрупи — 2,4 міс, різниця виживаності невірогідна (р=0,49) (рис. 4).
З метою підвищення якості життя усім пацієнтам контрольної підгрупи проводилися повторні (від 1 до 9) процедури лапароцентезу та евакуації асциту, середня кількість лапароцентезів — 3,6±2,1. У підгрупі HIPEC необхідність проведення лапароцентезу була у 2 (20%) пацієнтів у зв’язку з рецидивом асциту.
Шляхом багатофакторного аналізу встановлено незалежні фактори прогнозу виживаності хворих на інтраперитонеально дисемінований РШ при застосуванні агресивної комбінованої терапії з використанням циторедуктивних втручань та HIPEC: ступінь перитонеальної дисемінації згідно з класифікацією Японської асоціації з раку шлунка (p=0,004) та показник повноти циторедукції (p=0,031).
ОБГОВОРЕННЯ РЕЗУЛЬТАТІВ
РШ з інвазією серозної оболонки характеризується несприятливим прогнозом та високим ризиком метахронного КО, який розвивається внаслідок наявності мікроскопічного інтраперитонеального пулу злоякісних клітин на момент хірургічного втручання чи їх інтраопераційної дисемінації.
Тривалий час сподівання на ад’ювантну хіміотерапію резектабельного РШ не знаходили підтвердження в рандомізованих дослідженнях, проте застосування внутрішньочеревної хіміотерапії, потенційованої гіпертермією, дозволило вірогідно підвищити виживаність хворих на серозоінвазивний РШ. На сьогодні опубліковано 2 метааналізи результатів вивчення цієї проблеми з оптимістичними висновками, однак такий підхід до комбінованого лікування поки не увійшов у повсякденну практику хірургів-онкологів [13, 14]. Результати нашого дослідження засвідчують майже подвійне зростання виживаності хворих при застосуванні HIPEC в ад’ювантному режимі та зниження рівня інтраперитонеального рецидиву з 73,7 до 11,1%. У дослідній підгрупі відзначено 2 випадки інтраперитонеального прогресування, причому один із них — через 3 роки після хірургічного втручання, що свідчить про певні зміни процесів інтраперитонеального канцерогенезу під впливом внутрішньочеревної хіміогіпертермії.
Циторедуктивна операція передбачає максимальну редукцію пухлинних мас з організму, у тому числі метастатичних вогнищ, з метою зниження критичного рівня пулу пухлинних клітин з розрахунком на наступний вплив на резидуальні мікроскопічні активно проліферуючі пухлинні елементи цитостатичних препаратів. Ідея HIPEC полягає у знищенні резидуального інтраперитонеального мікроскопічного пулу клітин шляхом локорегіонарного застосування двох синергічних протипухлинних чинників — хіміопрепаратів і гіпертермії.
У 1996 р. Y. Yonemura та співавтори опублікували результати першого великого клінічного дослідження ефективності застосування HIPEC (мітоміцин 30 мг + цисплатин 300 мг + етопозид 150 мг, 60 хв при 42–43 °С) після проведення агресивного циторедуктивного втручання в обсязі гастректомії, широкої регіонарної лімфаденектомії та парціальної чи субтотальної перитонектомії у хворих на РШ з КО [15]. 1-річної виживаності досягнуто у 43% хворих, та вперше у пацієнтів цієї прогностично несприятливої категорії зафіксовано 5-річну виживаність 11%.
У 2010 р. О. Glehen та співавтори з університетської клініки в Ліоні опублікували узагальнені ретроспективні результати французького національного мультицентрового дослідження, що базується на аналізі віддалених результатів лікування 159 пацієнтів з 15 хірургічних центрів [16]. Медіану виживаності досягнуто на рівні 9,2 міс, а також 1-, 3- та 5-річну виживаність — 43; 18 та 13% відповідно. Єдиним незалежним фактором прогнозу, встановленим шляхом мультиваріантного аналізу, визнано показник повноти циторедукції. Для пацієнтів з показником циторедукції СС-0 виживаність була кращою: медіана становила 15,0 міс, 1-, 3- та 5-річна виживаність — 61; 30 та 23% відповідно.
Результати нашого дослідження також засвідчили вірогідне підвищення виживаності хворих на РШ з перитонеальними метастазами при застосуванні агресивної тактики лікування з використанням HIPEC з досягненням довготривалих термінів виживаності у відібраних пацієнтів. Двоє хворих нашого дослідження живі в терміни >2 років, один з яких без ознак прогресування захворювання.
У групі хворих з симптоматичним асцитом очікувано досягнути вірогідного підвищення виживаності не вдалося, проте застосування HIPEC у симптоматичному режимі дозволило ефективно проводити лікування рецидивуючого асциту.
ВИСНОВКИ
1. Застосування комбінованої терапії з використанням HIPEC у хворих на розповсюджений РШ є безпечним методом лікування з допустимими рівнями післяопераційних ускладнень та летальності.
2. Застосування HIPEC є ефективним методом ад’ювантного лікування хворих на РШ з високим ризиком інтраперитонеального прогресування, що дозволяє знижувати рівень імовірності розвитку метахронного КО з 73,7% в підгрупі хірургічного контролю до 11,1% (р
3. Застосування циторедуктивних втручань, HIPEC та системної паліативної хіміотерапії у хворих на РШ з обмеженим КО дозволяє досягнути медіани та 1-річної виживаності на рівні 12 міс та 68,8%, тоді як при системній паліативній хіміотерапії — 8 міс та 25% відповідно (р=0,004).
4. Застосування HIPEC в симптоматичному режимі у хворих на РШ з дифузним КО, ускладненим симптоматичним асцитом, не призводить до вірогідного підвищення виживаності, проте дозволяє ефективно усунути рецидивуючий асцит.
5. Незалежними факторами прогнозу у хворих на РШ з перитонеальними метастазами, які отримують комбіноване лікування з використанням HIPEC, є ступінь перитонеальної дисемінації, згідно з класифікацією Японської асоціації з раку шлунка, та показник повноти циторедукції.
Список використаної літератури
1. Elias D., Gilly F., Quenet F. et al. (2010) Pseudomyxoma peritonei: a French multicentric study of 301 patients treated with cytoreductive surgery and intraperitoneal chemotherapy. Eur. J. Surg. Oncol., 36(5): 456–462.
2. Baratti D., Scivales A., Balestra M.R. et al. (2010) Cost analysis of the combined procedure of cytoreductive surgery and hyperthermic intraperitoneal chemotherapy (HIPEC). Eur. J. Surg. Oncol., 36(5): 463–469.
3. Sommariva A., Pilati P., Rossi C.R. (2012) Cytoreductive surgery combined with hyperthermic intra-peritoneal chemotherapy for peritoneal surface malignancies: current treatment and results. Cancer Treat. Rev., 38(4): 258–268.
4. Sugarbaker P.H. (2010) Surgical responsibilities in the management of peritoneal carcinomatosis. J. Surg. Oncol., 101(8): 713–724.
5. Nissan A., Garofalo A., Esquivel J. (2010) Cytoreductive surgery and hyperthermic intra-peritoneal chemotherapy (HIPEC) for gastric adenocarcinoma: why haven’t we reached the promised land? J. Surg. Oncol., 102(5): 359–360.
6. Яценко Л.Д. (2007) Особливості метастазування при раку шлунка ІV стадії. Онкология, 9(2): 139–144.
7. Bando E., Yonemura Y., Takeshita Y. et al. (1999) Intraoperative lavage for cytological examination in 1297 patients with gastric carcinoma. Am. J. Surg., 178(3): 256–262.
8. Yoo C.H., Noh S.H., Shin D.W. et al. (2000) Recurrence following curative resection for gastric carcinoma. Br. J. Surg., 87(2): 236–242.
9. Macdonald J.S. (2007) Advances in the management of gastric cancer. New York: CMP Medica: 85 p.
10. Bang Y.J., van Cutsem E., Feyereislova A. et al. (2010) Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-esophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet., 376(9742): 687–697.
11. Japanese Gastric Cancer Association (1998) Japanese classification of gastric cancer, 2nd English ed. Gastric Cancer., 1(1): 10–24.
12. Sugarbaker P.H. (1999) Management of peritoneal-surface malignancy: the surgeon’s role. Langenbeck’s Arch. Surg., 384(6): 576–87.
13. Xu D.Z., Zhan Y.Q., Sun X.W. et al. (2004) Meta-analysis of intraperitoneal chemotherapy for gastric cancer. World J. Gastroenterol, 10(18): 2727–30.
14. Yan T.D., Black D., Sugarbaker P.H. et al. (2007) A systematic review and meta-analysis of the randomized controlled trials on adjuvant intraperitoneal chemotherapy for respectable gastric cancer. Ann. Surg. Oncol., 14(10): 2702–13.
15. Yonemura Y., Fujimura T., Nishimura G. et al. (1996) Effects of intraoperative chemohyperthermia in patients with gastric cancer with peritoneal dissemination. Surgery., 119(4): 437–444.
16. Glehen O., Gilly F.N., Arvieux C. et al. (2010) Peritoneal carcinomatosis from gastric cancer: a multi-institutional study of 159 patients treated by cytoreductive surgery combined with perioperative intraperitoneal chemotherapy. Ann. Surg. Oncol., 17(9): 2370–2377.
Интраоперационная гипертермическая внутрибрюшная химиоперфузия в комбинированном лечении пациентов с местно-распространенным и диссеминированным раком желудка
2Львовский государственный онкологический региональный лечебно-диагностический центр
Резюме. Проанализированы результаты применения интраоперационной гипертермической внутрибрюшной химиоперфузии (hyperthermic intraperitoneal chemoperfusion — HIPEC) в комбинированном лечении 49 больных с распространенным раком желудка. Послеоперационные осложнения зафиксированы у 26,5% больных, послеоперационная летальность составила 4,1%. Комбинированное лечение пациентов с серозоинвазивным раком желудка позволило снизить уровень метахронного карциноматоза брюшины с 73,7 до 11,1% (р
Ключевые слова: рак желудка, карциноматоз брюшины, циторедуктивная операция, интраоперационная гипертермическая внутрибрюшная химиоперфузия.
Intraoperative hyperthermic intraperitoneal chemoperfusion in combined treatment of local-advanced and disseminated gastric cancer
2Lviv regional cancer center, Lviv
Summary. Assesment of results use a novel strategy of combined treatment with hyperthermic intraperitoneal chemoperfusion (HIPEC) in patients with intraperitoneal disseminated gastric cancer was purpose of the study. The frequency of postoperative complications with the use of HIPEC was 26,5%, postoperative mortality — 4,1%. The use of HIPEC in adjuvant regime in patients with high risk of metachronous carcinomatosis permitted to obviously decrease the level of intraperitoneal relapse from 73,7 to 11,1% (р
Key words: gastric cancer, peritoneal carcinomatosis, cytoreductive surgery, hyperthermic intraperitoneal chemoperfusion.














Leave a comment