Інтраперитонеально дисемінований рак шлунка: фактори прогнозу та результати комбінованого лікування
Фецич Т.Г.1, Ярема Р.Р.1, Огорчак М.А.2, Зубарєв Г.П. 2, Олійник Ю.Ю. 1, Гиря П.І. 2, Ковальчук Ю.Я.2, Сафіян В.І. 2, Зубарєв М.Г1
- 1Львівський національний медичний університет імені Данила Галицького
- 2Львівський державний онкологічний регіональний лікувально-діагностичний центр, Львів
Резюме. Проаналізовано фактори перебігу та результати стандартних методів лікування 115 хворих на рак шлунка з карциноматозом очеревини. Встановлено виражений несприятливий прогноз для пацієнтів даної категорії — медіана тривалості життя та 1-річна виживаність становлять 3,7 міс та 9,6 % відповідно, — а також прогностичну цінність перитонеального ракового індексу для оцінки перебігу дисемінованого раку шлунка. Застосування паліативних хірургічних втручань в резекційному обсязі та системної паліативної хіміотерапії дозволяють вірогідно збільшувати виживаність хворих порівняно із застосуванням симптоматичної терапії.
 ВСТУП
ВСТУП
Найбільш поширеним шляхом метастазування раку шлунка (РШ) є перитонеальна дисемінація або карциноматоз очеревини (КО) [1], що виявляється при лапаротомії у 10–20% пацієнтів з потенційно резектабельним РШ та є наявний у 72% хворих на дисемінований РШ [2, 3]. Хворих даної категорії тривалий час відносили до інкурабельних, зважаючи на вкрай несприятливий прогноз, — медіана загальної тривалості життя (МеЗТЖ) становить 1,8–3,1 міс [4, 5].
Системна хіміотерапія у хворих на РШ з КО є малоефективною — з найнижчим рівнем об’єктивних відповідей на лікуванння з-поміж інших шляхів метастазування та незначним збільшенням медіани виживаності [6]. За твердженням деяких авторів, системна хіміотерапія не впливає на процеси інтраперитонеального канцерогенезу хворих на РШ [7].
Виявлення під час лапаротомії імплантаційних метастазів у хворого на РШ розцінюється більшістю хірургів як ознака вкрай несприятливого прогнозу та абсолютне протипоказання до резекційного обсягу втручання. Проте паліативні гастректомії та резекції шлунка сьогодні проводять все частіше з огляду на ефективність у хворих з початковими ступенями КО [8]. Відтак, дискусія щодо доцільності виконання паліативних втручань у резекційному обсязі хворим на інтраперитонеально дисемінований РШ до сьогодні залишається відкритою [9].
Об’єктивним методом оцінки ступеня інтраперитонеального поширення РШ є класифікація Японської Асоціації з раку шлунка (Japanese Gastric Cancer Association — JGCA) [10], згідно з якою вирізняють наступні градації КО: Р0 (CY1) — імпланти на очеревині відсутні, проте наявні злоякісні клітини в змивах з очеревини, Р1 — поодинокі дисемінати у верхньому поверсі черевної порожнини (вище рівня поперечно-ободової кишки), Р2 — поодинокі дисемінати у всіх відділах черевної порожнини, Р3 — дифузний карциноматоз черевної порожнини, у тому числі наявність асциту. В 7-й редакції перегляду TNM-класифікації (UICC) 2009 року вперше за багато років введено категорію перитонеальних змивів, позитивний характер котрих відтепер також розцінюють як ознаку віддаленого метастазування [11].
Іншим об’єктивним критерієм стадіювання перитонеального карциноматозу є запропонований P.H. Sugarbaker для колоректального раку перитонеальний раковий індекс (ПРІ) (peritoneal cancer index — PCI) [12], котрий обчислюється наступним чином: черевну порожнину розділено на 13 умовних ділянок, у кожній з яких залежно від розмірів імплантів оцінюють ступінь карциноматозу (від 1 до 3 балів) з подальшим сумуванням балів усіх ділянок; таким чином, максимальне значення ПРІ становить 39. Питання щодо можливості застосування ПРІ в якості прогностичного критерію перебігу дисемінованого РШ залишається невивченим [13].
Сьогодні все частіше в практиці онкологічних клінік застосовують нові активні методи комбінованого лікування хворих на РШ з КО [14, 15], що визначає актуальність вивчення результатів стандартних методів терапії таких хворих, публікації щодо яких на сьогодні в літературі є поодинокими [4, 5].
Метою нашого дослідження було вивчення факторів прогнозу перебігу інтраперитонеально дисемінованого РШ та результатів хірургічного, хіміотерапевтичного та симптоматичного лікування таких хворих.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
Проведено аналіз результатів лікування 115 хворих на РШ IV стадії з синхронним КО, що перебували на стаціонарному лікуванні у Львівському державному онкологічному регіональному лікувально-діагностичному центрі у 2007–2010 рр. (проспективнй аналіз). Чоловіки становили 57,4% (66 хворих), жінки — 42,6% (49 хворих). Вік хворих становив від 30 до 82 років, середній вік — 59,6±10,6 років. У всіх хворих за допомогою інструментальних методів чи під час хірургічного втручання виявлено ознаки перитонеальної дисемінації.
У хворих переважали низько- та недиференційовані аденокарциноми, які в сумі становили 74,8%, помірнодиференційована аденокарцинома зустрічалася у 4,4%, високодиференційована — у 3,4%, перснеподібноклітинна — у 14,8% та муцинозна — у 2,6%.
Розподіл хворих залежно від ступеня КО згідно з класифікацією JGCA представлено у табл. 1.
| Ступінь КО | Кількість хворих n (%) |
|---|---|
| Р0 (Cyt+) | 4 (3,5) |
| Р1 | 22 (19,1) |
| Р2 | 24 (20,9) |
| Р3 | 65 (56,5) |
| Всього | 115 |
ПРІ оцінено у 95 хворих, його показник становив від 1 до 26, середній показник — 10,8±7,1. Характеристику хворих згідно з ПРІ представлено у табл. 2.
| ПРІ | Кількість хворих n (%) |
|---|---|
| від 1 до 6 | 35 (36,9) |
| від 7 до 12 | 14 (14,7) |
| 13 та більше | 46 (48,4) |
| Всього | 95 |
У 58 (50,4%) хворих перебіг інтраперитонеально дисемінованого РШ супроводжувався розвитком асциту. У 28 (24,4%) хворих діагностовано також екстраперитонеальні метастази. Найчастіше КО у хворих на РШ супроводжувався метастазами у віддалені лімфатичні вузли, печінку та по плеврі у 12; 9 та 4 хворих відповідно.
Характеристику методів, застосованих у лікуванні хворих на РШ з КО, представлено у табл. 3.
| Методи лікування | Кількість хворих n (%) |
|---|---|
| Хірургічне втручання | 50 (43,5) |
| Паліативна хіміотерапія | 21 (18,3) |
| Хірургічне втручання + паліативна хіміотерапія | 16 (13,9) |
| Симптоматична терапія | 28 (24,3) |
| Всього | 115 |
Структура обсягу хірургічних втручань була наступною: 17 (25,8%) хворим виконано паліативні гастректомії чи субтотальні резекції шлунка, 20 (30,3%) хворим — пробну лапаротомію з біопсією, та 29 (43,9%) — симптоматичні втручання різного обсягу. У ході паліативних втручань D1 лімфаденектомію виконано 11 пацієнтам та D2–6. Комбінований обсяг паліативних операцій проведено 7 пацієнтам. Паліативні операції проводили в основному хворим з початковими ступенями КО, тоді як симптоматичні втручання та пробні лапаротомії хворим з дифузним КО.
Середня кількість циклів системної паліативної хіміотерапії становила 3,5±1,7 (від 1 до 7). Застосовували наступні схеми паліативної хіміотерапії: CF, ACF, 5-FU, ECF, Tegafur.
Статистичну обробку первинних даних проводили з використанням програми Statistica. Таблиці частот та зв’язків аналізували за допомогою точного критерію Фішера та критерію χ2. Для дослідження кумулятивної виживаності хворих використовували цензурований метод Каплана — Мейера. Визначення відмінностей різниці рівнів виживаності в окремих групах здійснено за допомогою логарифмічного рангового коефіцієнта.
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
Середній термін перебування хворих на РШ з КО у стаціонарі становив 17,6±7,9 діб (від 3 до 36 діб) та залежав від характеру проведеної терапії, наявності ускладнень.
Загальна кількість післяопераційних ускладнень у 66 хворих, у лікуванні котрих застосовували хірургічний метод, становила 5 (7,6%) випадків. У хворих виникали наступні хірургічні ускладнення: набряк анастомозу, евентрація, наднирковозалозна недостатність на ґрунті крововиливу в метастаз надниркової залози, сепсис на фоні панкреанекрозу та недостатність ентероентероанастомозу.
Зафіксовано 2 випадки післяопераційної летальності у групі хірургічного лікування, причиною яких стали панкреанекроз після паліативної гастректомії та наднирковозалозна недостатність внаслідок крововиливу в метастатично змінену надниркову залозу після сигмостомії у хворого зі стенозуючим метастазом Шніцлера. Випадків післяопераційної летальності після пробної лапаротомії не зафіксовано.
Серед 37 хворих, котрим проводили системну паліативну хіміотерапію, у 11 (29,7%) пацієнтів відзначено стабілізацію процесу та у 26 (70,3%) — прогресування. Загальна кількість ускладнень на фоні хіміотерапії становила 8 (21,6%) випадків: у всіх хворих спостерігали лейкопенію І–ІІ ступеня. Випадків летальності на фоні проведення системної хіміотерапії не зафіксовано.
За період спостереження прогресування пухлинного процесу після проведеного лікування стало причиною смерті 110 (95,7%) із 115 хворих. У перші 12 міс померли 104 (90,4%) хворі, відповідно, кумулятивна 1-річна виживаність становила 9,6%, МеЗТЖ — 3,7 міс (рис. 1).
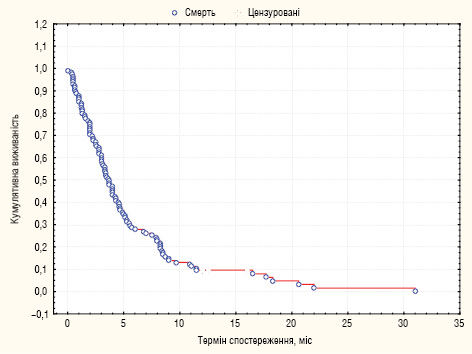
Шляхом монофакторного аналізу потенційних факторів перебігу інтраперитонеально дисемінованого РШ встановлено, що статистично вірогідно корелюють з виживаністю: локалізація пухлини, наявність асциту, екстраперитонеальних метастазів, ступінь КО згідно з JGCA, величина ПРІ, комбінований обсяг паліативного втручання, системна паліативна хіміотерапія, ефект її проведення, а також характер застосованих методів лікування хворих.
При локалізації пухлини в проксимальних відділах шлунка, у проксимальних відділах з переходом на тіло, а також при субтотальному та тотальному ураженні шлунка МеЗТЖ становила 2,7; 3 та 3,2 міс відповідно, тоді як при локалізації пухлини в антральному відділі шлунка — 8 міс (р=0,02).
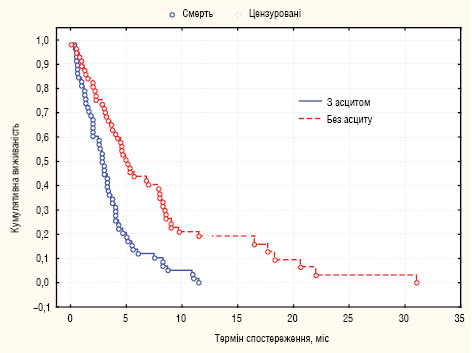
МеЗТЖ у 58 хворих з наявним асцитом становила 2,9 міс, у 57 хворих без асциту — 5,1 міс (р=0,0002) (рис. 2).
Виявлено залежність тривалості життя хворих на РШ з КО від наявності екстраперитонеальних метастазів гематогенного чи лімфогенного характеру: у хворих з наявними екстраперитонеальними метастазами МеЗТЖ становила 2,3 міс, без екстраперитонеальної дисемінації — 4 міс (лог-ранг критерій, р=0,007).
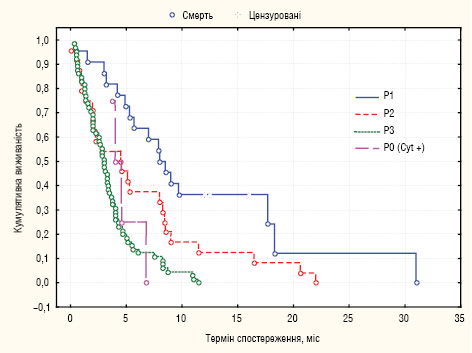
Виявлено залежність МеЗТЖ хворих від ступеня поширеності імплантаційних метастазів у черевній порожнині згідно з JGCA. Так, при Р1 дисемінації МеЗТЖ становила 8,3 міс, при Р2 КО — 4,6 міс, при Р3 — 3 міс та при Р0 (Cyt+) — 4,3 міс (лог-ранг критерій, р=0,0001) (рис. 3).
Виявлено статистично вірогідну зворотню кореляцію виживаності хворих і рівня ПРІ (r=-0,44, р<0,05). МеЗТЖ хворих з ПРІ в інтервалі 1–6 становила 8 міс, у хворих з ПРІ 7–12 — 1,8 міс та при ПРІ >13 — 3,4 міс (лог-ранг критерій, р=0,00). Різниця виживаності пацієнтів з ПРІ в інтервалах 7–12 та 13 і більше не була вірогідною (р=0,06).
Комбінований обсяг паліативного втручання, який виконується хворим з більшим об’ємом місцевого розповсюдження пухлини, є самостійним несприятливим чинником перебігу інтраперитонеально дисемінованого РШ (МеЗТЖ у хворих з резекцією суміжних органів та без неї становила 2,8 та 8,4 міс відповідно (р=0,01)).
МеЗТЖ у хворих після паліативних хірургічних втручань (без додаткової паліативної хіміотерапії) становила 4,7 міс, у хворих, яким проводили системну паліативну хіміотерапію, — 5,3 міс та у хворих на фоні симптоматичної терапії — 1,9 міс (р<0,05) (рис. 4).
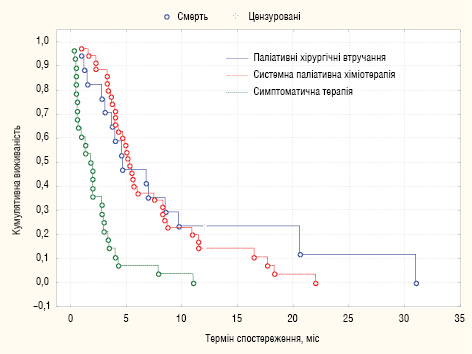
Беручи до уваги той факт, що різні методи лікування застосовували у неоднорідних за ступенем КО когортах пацієнтів, проведено стратифікацію пацієнтів відповідно до ступенів КО (JGCA) та аналіз ефективності методів лікування у порівнюваних підгрупах, котрий засвідчив збереження вірогідної різниці виживаності (χ2= 53,5, р<0,05).
Таким чином, хворі на РШ з КО характеризуються вкрай несприятливим прогнозом (МеЗТЖ та 1-річна виживаність становлять 3,7 міс та 9,6% відповідно). Отримані результати дослідження ефективності стандартних підходів до лікування інтраперитонеально дисемінованого РШ є важливими з точки зору критичного аналізу віддалених результатів нових активних способів комбінованого лікування таких хворих, що сьогодні щораз частіше застосовуються в клінічний практиці. Так, проведені клінічні дослідження циторедуктивних втручань та регіонарної внутрішньочеревної хіміотерапії в гіпертермічному режимі засвідчили достовірне зростання медіани виживаності хворих, та вперше у пацієнтів цієї складної категорії досягнуто 5-річної виживаності [14, 15].
У рандомізованих дослідженнях ІІІ фази доведено, що проведення системної паліативної хіміотерапії достовірно збільшує тривалість життя хворих на метастатичний РШ порівняно із застосуванням симптоматичної терапії [16], проте в групі пацієнтів з перитонеальними метастазами системна хіміотерапія, як правило, є найменш ефективною [17]. Результати нашого дослідження свідчать про достовірне зростання МеЗТЖ при застосуванні системної паліативної хіміотерапії; подібний ріст виживаності пацієнтів відзначено також іншими авторами [18]. Низька ефективність системної хіміотерапії у хворих з КО на думку R.L. Dedric [19] зумовлена незначним проникненням цитостатичних препаратів у черевну порожнину та перитонеальні метастази внаслідок існування перитонеально-плазматичного бар’єру.
Ставлення до паліативних гастректомій та резекцій шлунка при КО зазнає сьогодні певної еволюції — від абсолютного заперечення доцільності [20] до активного впровадження в клінічну практику [21]. Проведення паліативних втручань у резекційному обсязі дозволило збільшити медіану виживаності в рамках вибірки пацієнтів даного дослідження з 1,9 міс при застосуванні симптоматичної терапії до 4,7 міс, відтак, такі результати є співзвучними з деякими опублікованими даними інших авторів [22].
ПРІ в якості об’єктивного критерію стадіювання КО протягом останнього десятиліття застосовується у хворих на колоректальний рак. Результати даного дослідження засвідчили різке прогресивне погіршення прогнозу у хворих на РШ з показником ПРІ вище 7 балів. На останніх консенсусних конференціях з питань інтраперитонеально дисемінованих пухлин (Milan, 2006; Lyon, 2008; Uppsala, 2010) часто висували тезу про можливість застосування ПРІ як прогностичного фактору та критерію відбору пацієнтів для комбінованого лікування не лише колоректального раку, а й власне РШ.
ВИСНОВКИ
Інтраперитонеально дисемінований РШ характеризується виражено несприятливим прогнозом: МеЗТЖ та 1-річна виживаність становлять у таких хворих 3,7 міс та 9,6% відповідно.
Вірогідним впливом на виживаність хворих на РШ з КО характеризуються наступні фактори: локалізація пухлини, наявність асциту, екстраперитонеальних метастазів, ступінь КО згідно з JGCA, величина ПРІ, комбінований обсяг паліативного втручання, системна паліативна хіміотерапія, ефект її проведення, а також характер застосованих методів лікування хворих.
ПРІ може розглядатися в якості прогностичного фактору та критерію відбору до паліативного лікування хворих на РШ з КО — виживаність хворих з показником ПРІ в діапазоні 1–6 значно перевищує показники виживаності хворих із більшими значеннями ПРІ.
Застосування паліативних хірургічних втручань в резекційному обсязі та системної паліативної хіміотерапії дозволяє вірогідно збільшувати виживаність хворих на РШ з КО порівняно із симптоматичною терапією.
ЛІТЕРАТУРА
1. Скоропад В.Ю., Бердов Б.А. (2004) Хирургическое лечение распространенного рака желудка. Хирургия, 11: 30–35.
2. Okajima K., Yamada S. (1986) Surgical treatment of far-advanced gastric cancer. Jpn. J. Cancer Clin., 32: 1203–1209.
3. Яценко Л.Д. (2007) Особливості метастазування при раку шлунка ІV стадії. Онкология, 9(2): 39–144.
4. Chu D.Z., Lang N.P., Thompson C. et al. (1989) Peritoneal carcinomatosis in nongynecologic malignancy: a prospective study of prognostic factors. Cancer, 63: 364–367.
5. Sadeghi B., Arvieux C., Glehen O. et al. (2000) Peritoneal carcinomatosis from non-gynecologic malignancies: results of the EVOCAPE 1 multicentric prospective study. Cancer, 88: 358–363.
6. Preusser P., Wilke H., Achterrath W. et al. (1989) Phase II study with the combination etoposide, doxorubicin, and cisplatin in advanced measurable gastric cancer. J. Clin. Oncol., 7: 1310–1317.
7. Ajani J.A., Ota D.M., Jessup J.M. et al. (1991) Resectable gastric carcinoma. An evaluation of preoperative and postoperative chemotherapy. Cancer, 68(7): 1501–1506.
8. Давыдов М.И., Абдихакимов А.Н., Полоцкий Б.Е. и др. (2002) К вопросу о роли хирургии в лечении местно-распространенного и диссеминированного рака желудка. Анналы хирургии, 2: 33–44.
9. Чиссов В.И., Вашакмадзе Л.А., Бутенко А.В. и др. (2003) Возможности хирургического лечения резектабельного рака желудка IV стадии. Российский онкологический журнал, 6: 4–7.
10. Japanese Gastric Cancer Association (1998) Japanese classification of gastric cancer — 2nd English edition. Gastric Cancer, 1: 10–24.
11. TNM: Классификация злокачественных опухолей / Под ред. Л.Х. Собина и др.; пер. с англ. и научн. ред. А.И. Щеголев, Е.А. Дубова, К.А. Павлов. – М.: Логосфера, 2011. – 304 с. – Перевод изд. TNM Classification of Malignant Tumors, 7th ed. – ISBN 978-5-98657-025-9.
12. Sugarbaker P.H. (1999) Management of peritoneal-surface malignancy: the surgeon’s role. Langenbeck’s Archives of Surgery, 384(6): 576–587.
13. Bozzetti F., Yu W., Baratti D. et al. (2008) Locoregional treatment of peritoneal carcinomatosis from gastric cancer. J. Surg. Oncol., 98 (4 Special issue: dedicated to the 5th International consensus meeting on peritoneal surface malignancies treatment): 273–276.
14. Yonemura Y., Fujimura T., Nishimura G. et al. (1996) Effects of intraoperative chemohyperthermia in patients with gastric cancer with peritoneal dissemination. Surgery, 119(4): 437–444.
15. Glehen O., Gilly F.N., Arvieux C. et al. (2010) Peritoneal carcinomatosis from gastric cancer: a multi-institutional study of 159 patients treated by cytoreductive surgery combined with perioperative intraperitoneal chemotherapy. Ann. Surg. Oncol., 17(9): 2370–2377.
16. Ohtsu A. (2005) Current status and future prospects of chemotherapy for metastatic gastric cancer: a review. Gastric Cancer, 8: 95–102.
17. Ross P., Nicolson M., Cunningam D. et al. (2002) Prospective randomized trial comparing mitomycin, cisplatin and protracted venous-infusion fluorouracil (PVI 5-FU) with epirubicin, cisplatin and PVI 5-FU in advanced esophagogastric cancer. J. Clin. Oncol., 20(8): 1996–2004.
18. Kimura Y., Machida H., Fujitani K. et al. (2010) Combination of S-1 and paclitaxel for advanced/recurrent gastric cancer patients with peritoneal metastasis, feasibility study (OGSG0401). Gan To Kagaku Ryoho, 37(1): 151–155.
19. Dedrick R.L. (1985) Theoretical and experimental bases of intraperitoneal chemotherapy. Semin. Oncol., 12: 1–6.
20. Yoshikawa T., Kanari M., Tsuburaya A. et al. (2003) Should gastric cancer with peritoneal metastasis be treated surgically? Hepatogastroenterology, 50: 1712–1715.
21. Чиссов В.И., Вашакмадзе Л.А., Бутенко А.В. и др. (2001) Перитонеальная диссеминация при раке желудка: возможности лечения. Российский онкологический журнал, 3: 9–12.
22. Kikuchi S., Arai Y., Morise M. et al. (1998) Gastric cancer with metastases to the distant peritoneum: a 20-year surgical experience. Hepatogastroenterology, 45: 1183–1188.
Интраперитонеально диссеминированный рак желудка: факторы прогноза и результаты комбинированного лечения
1Львовский национальный медицинский университет им. Данила Галицкого, Львов
2Львовский государственный онкологический региональный лечебно-диагностический центр, Львов
Резюме. Проанализировано факторы течения и результаты стандартных методов лечения 115 больных раком желудка с карциноматозом брюшины. Установлено выраженный неблагоприятный прогноз для пациентов данной категории – медиана виживаемости и 1-летняя выживаемость составляют 3,7 мес и 9,6% соответственно, а также прогностическую ценность перитонеального ракового индекса для оценки протекания диссеминированного рака желудка. Использование паллиативных хирургических вмешательств в резекционном объеме и системной паллиативной химиотерапии позволяют достоверно увеличивать выживаемость больных сравнительно с использованием симптоматической терапии.
Ключевые слова: рак желудка, карциноматоз брюшины, факторы прогноза, перитонеальный индекс рака, комбинированное лечение.
Intraperitoneal disseminated gastric cancer: prognostic factors and results of combined treatmentn
1Lviv national medical university, Lviv
2Lviv regional cancer center, Lviv
Summary. Аnalised prognostic factors and the results of standard treatment 115 patients with gastric cancer and peritoneal carcinomatosis. Found poor forecast for patients this category— median survival and 1-year survival was 3.7 month and 9.6%, respectively, as well prognostic value peritoneal cancer index for disseminated gastric cancer. Perform palliative surgical interventions and systemic palliative chemotherapy allow significantly increase prognosis of patients relatively with using best supportive care.
Key words:gastric cancer, peritoneal carcinomatosis, forecast factors, peritoneal cancer index, combined treatment.














Leave a comment