Значение полиморфизма SNP309 гена MDM2 для оценки течения хронического лимфолейкоза в комплексе с другими маркерами прогноза
Белоус Н.И.1, Абраменко И.В.1, Крячок И.А.2, Мартина З.В.1, Чумак А.А.1, Дягиль И.С.1
- 1ДУ «Національний науковий центр радіаційної медицини Національної академії медичних наук України», Київ
- 2Національний інститут раку, Київ
Резюме. Цель исследования — определить значение полиморфизма SNP309 гена MDM2 для оценки клинических особенностей хронического лимфолейкоза (ХЛЛ) и прогноза течения заболевания. Полиморфизм SNP309 гена MDM2 изучен в группе 224 первичных больных ХЛЛ методом полимеразной цепной реакции с последующим анализом полиморфизма длины рестрикционных фрагментов в комплексе с другими факторами прогноза (возраст, инициальный лейкоцитоз, стадия заболевания, мутационный статус генов вариабельных участков тяжелых цепей иммуноглобулинов (IGHV), наличие мутаций в гене ТР53). При анализе всей когорты обследованных пациентов не отмечено влияния полиморфизма SNP309 гена MDM2 на клинико-гематологические данные на момент установления диагноза, развитие вторичных осложнений и выживаемость при учете других факторов прогноза. В то же время выявлена ассоциация генотипа SNP309 GG с более быстрым прогрессированием заболевания (р=0,013) и меньшей выживаемостью (р=0,014) в подгруппе больных с отсутствием мутаций в гене ТР53 и немутированным статусом IGHV генов. Исследование полиморфизма SNP309 гена MDM2 может быть использовано в качестве дополнительного прогностического маркера при ХЛЛ.

Хронический лимфолейкоз (ХЛЛ) характеризуется выраженной гетерогенностью клинического течения. Особенно неблагоприятный прогноз ассоциирован с инактивацией опухолевого супрессора p53 в результате делеции 17p13 (область локализации гена TP53) и/или точковых мутаций в нуклеотидной последовательности гена [1, 2]. Белок p53 функционирует как транскрипционный фактор и является главным регулятором клеточного ответа на действие генотоксических факторов, индуцируя апоптоз или остановку клеточного цикла и репарацию ДНК. Нормальное функционирование p53 критически важно для предотвращения накопления мутаций, способствующих злокачественной трансформации и прогрессированию трансформированных клонов, а также для опосредования действия химиотерапевтических препаратов [3].
Активность р53 в клетке регулируется на посттрансляционном уровне продуктами многих генов, при этом основным негативным регулятором является белок Mdm2 (Murine double minute-2) [4]. Mdm2 взаимодействует с р53 по принципу обратной негативной связи: p53 активирует экспрессию белка Mdm2, действуя как транскрипционный фактор для MDM2 гена. В свою очередь, Mdm2 обеспечивает снижение уровня р53, индуцируя его убиквитинзависимую деградацию. При этом Mdm2 функционирует как специфичная для p53 E3 убиквитин-лигаза — катализирует присоединение остатков убиквитина, что приводит к перемещению р53 в цитоплазму и последующей его деградации в протеасомах. Кроме того, Mdm2 подавляет транскрипционную активность белка р53 относительно генов-мишеней, связывая его N-терминальный трансактивационный домен и блокируя взаимодействие с другими факторами транскрипционного аппарата, в частности TFIIE и CBP/p300 [5]. Взаимная регуляция в паре р53 — Mdm2 позволяет ограничивать продолжительность и интенсивность p53-зависимого ответа на действие генотоксических факторов, а также обеспечивает низкий уровень p53 в нормальных клетках. Избыточная экспрессия белка Mdm2, как показали исследования, может приводить к существенной дисфункции p53 [6, 7].
Хорошо известен функционально значимый однонуклеотидный полиморфизм (SNP) в промоторной области гена MDM2, влияющий на уровень его экспрессии, — замена T на G в позиции 309 1-го интрона (SNP309 T>G, rs2279744). SNP309 G аллель характеризуется более высокой аффинностью к транскрипционному фактору Sp1 (stimulatory protein 1) по сравнению с Т вариантом, что определяет высший уровень экспрессии гена MDM2, соответствующего белка, а также сниженную активность p53 в клетке [8].
Первым исследованием ассоциаций полиморфизма SNP309 с течением ХЛЛ была работа I. Gryshchenko и соавторов [9]. Ученые выявили сокращение периода общей выживаемости (ОВ) больных с генотипом TG (р=0,02) и GG (р=0,001) по сравнению с носителями генотипа ТТ. Аналогичные данные были получены K. Willander и соавторами [10]. Продемонстрировано также, что данный полиморфизм является маркером эффективности ответа пациентов на применение специфического ингибитора Mdm2 — нутлина-3а [11]. Вместе с тем многие авторы не выявили существенного прогностического значения SNP309 генотипов для оценки течения ХЛЛ [12–14]. В этой связи прогностическое значение SNP309 нельзя считать окончательно установленным.
Целью настоящей работы являлось определение значения полиморфизма SNP309 гена MDM2 для оценки клинических особенностей ХЛЛ и прогноза течения заболевания.
Объект и методы исследования
Исследование проведено в группе 224 первичных больных ХЛЛ, которая включала 171 (76,3%) мужчину и 53 (23,7%) женщины в возрасте 29–80 лет (средний возраст 57,9±0,64 года, медиана 58 лет). Пациенты находились на лечении в отделении гематологии ГУ «Национальный научный центр радиационной медицины НАМН Украины». Проведение исследования было одобрено комитетом по медицинской этике центра.
Диагноз ХЛЛ устанавливали на основании клинико-гематологических критериев и иммунофенотипирования лимфоцитов периферической крови. Стадию ХЛЛ определяли согласно классификациям K.R. Rai и соавторов [15, 16], а также J.L. Binet и соавторов [17]. По классификации Binet 114 больных (50,9%) находились на ранней стадии заболевания А, 81 пациент (36,2%) — на стадии В (развернутая) и 29 больных (12,9%) — на стадии С. Согласно классификации Rai распределение больных по стадиям ХЛЛ было следующим: стадия 0 — 30 больных (13,4%), стадия І — 81 (36,2%), стадия ІІ — 82 (36,6%), стадия ІІІ — 19 (8,5%) и стадия IV — 12 (5,4%).
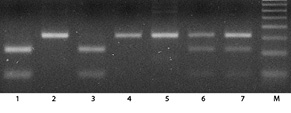
Геномную ДНК выделяли из мононуклеаров периферической крови с использованием наборов QIAamp Blood Mini Kit (Qiagen). Генотипирование полиморфизма SNP309 T>G гена MDM2 проводили методом полимеразной цепной реакции с последующим анализом полиморфизма длины рестрикционных фрагментов (ПЦР-ПДРФ), как было предложено H. Hirata и соавторами [18], с небольшими модификациями. ПЦР проводили с 50 нг ДНК в конечном объеме 20 мкл реакционной смеси, содержащей прямой (5′-CGCGGGAGTTCAGGGTAAAG-3′) и обратный (5′-CTGAGTCAACCTG CCCACTG-3′) праймеры (0,4 мкмоль каждого) и 10 мкл PCR Master Mix (2X) (Fermentas). Режим ПЦР был следующим: начальная денатурация — 95 °C, 3 мин, затем 35 циклов амплификации (95 °C — 30 с, 57 °C — 30 с, 72 °C — 30 с). Для рестрикционного анализа ПЦР продукты обрабатывали эндонуклеазой рестрикции MspA1I (Promega), следуя рекомендациям производителя. Продукты рестрикции/амплификации анализировали посредством электрофореза в 2% агарозном геле, содержащем 1 мкг/мл бромистого этидия (рис. 1). В случае наличия SNP309 G аллели ПЦР продукт (157 п.н.) имел сайт рестрикции для MspA1I (образование фрагментов 109 п.н. и 48 п.н.), при наличии SNP309 Т аллели данный сайт рестрикции отсутствовал.
В качестве прогностических маркеров у всех больных был определен мутационный статус генов вариабельных участков тяжелых цепей иммуноглобулинов (IGHV), как описано ранее [19], а также исследовали мутации гена ТР53 в области экзонов 3–10 методом прямого секвенирования. Использованные праймеры, а также детали проведения ПЦР для выявления мутаций гена ТР53 доступны по запросу. Анализ мутаций ТР53 проводили с помощью базы данных International Agency for Research on Cancer (IARC) TP53 Mutation Database (http://www.p53.iarc.fr).
В зависимости от генотипов SNP309 гена MDM2 оценивали следующие параметры: клинико-гематологические данные при установлении диагноза, развитие осложнений (аутоиммунной гемолитической анемии, вторичных опухолей, трансформации Рихтера), время до необходимости начала терапии, выживаемость без прогрессирования заболевания (ВБП) и ОВ пациентов. Для оценки времени до необходимости начала терапии, ВБП и ОВ применяли метод Каплана — Мейера, а также уни- и мультивариантный Кокс-регрессионный анализ. В число факторов, помимо генотипов SNP309 гена MDM2, включали: стадию заболевания по Binet, мутационный статус IGHV генов, инициальный лейкоцитоз (граничный уровень 70 Г/л), возраст пациента при установлении диагноза (граничный возраст 65 лет), наличие или отсутствие мутаций гена ТР53. Медиана наблюдения пациентов составила 53 мес.
Результаты исследования
В обследованной группе первичных больных ХЛЛ преобладали пациенты с немутированным статусом IGHV генов (64,3%) и отсутствием мутаций гена ТР53 (97,3%).
Частота генотипов SNP309 гена MDM2 в группе обследованных была следующей: ТТ — 110 (49,1%) пациентов, TG — 93 (41,5%) пациента, GG — 21 (9,4%) пациент. Распределение SNP309 генотипов соответствовало уравнению Харди — Вайнберга (χ2=0,04) и существенно не отличалось от распределения в других европейских когортах пациентов с ХЛЛ [14].
Клинико-гематологические данные при установлении диагноза ХЛЛ, а также частота вторичных осложнений достоверно не различались у носителей отдельных генотипов SNP309 гена MDM2 (табл. 1). В процессе наблюдения 168 (75,0%) больным назначена специфическая терапия (31 — на основе пуриновых аналогов, 137 — алкилирующими препаратами). Время до начала терапии статистически значимо не различалось у носителей отдельных генотипов, медиана составила 25 мес при генотипе ТТ, 22 мес — при ТG и 6 мес — при GG (р=0,109 при сравнении всех генотипов и р=0,064 при сравнении генотипа GG и генотипов ТТ + ТG).
Таблица 1. Клинико-гематологические данные больных ХЛЛ при установлении диагноза в зависимости от генотипов SNP309 гена MDM2
| Показатели | MDM2 генотип | р | ||
| TT, n (%) | TG, n (%) | GG, n (%) | ||
| Пол | 0,255 | |||
| мужчины, n=171 | 79 (46,2) | 76 (44,4) | 16 (9,4) | |
| женщины, n=53 | 31 (58,5) | 17 (32,1) | 5 (9,4) | |
| Средний возраст, лет | 57,9±0,91 | 57,42±1,03 | 60,04±2,08 | 0,537 |
| Стадия по Binet: | 0,301 | |||
| А, n=114 | 60 (52,6) | 45 (39,5) | 9 (7,9) | |
| В, n=81 | 35 (43,2) | 39 (48,1) | 7 (8,6) | |
| С, n=29 | 15 (51,7) | 9 (31,0) | 5 (17,2) | |
| Стадия по Rai | 0,122 | |||
| 0, n=30 | 17 (56,7) | 8 (26,7) | 5 (16,7) | |
| І, n=81 | 42 (51,9) | 34 (42,0) | 5 (6,2) | |
| ІІ, n=82 | 35 (42,7) | 41 (50,0) | 6 (7,3) | |
| ІІІ, n=19 | 12 (63,2) | 5 (26,3) | 2 (10,5) | |
| IV, n=12 | 4 (33,3) | 5 (41,7) | 3 (25,0) | |
| Лейкоцитоз | 0,226 | |||
| >100 Г/л, n=11 | 8 (72,7) | 3 (27,3) | 0 | |
| <100 Г/л, n=211 | 101 (47,8) | 89 (42,2) | 21 (10,0) | |
| Лейкоцитоз | 0,990 | |||
| >70 Г/л, n=42 | 21 (50,0) | 17 (40,5) | 4 (9,5) | |
| <70 Г/л, n=180 | 88 (48,9) | 75 (41,7) | 17 (9,4) | |
| Лейкоцитоз, Г/л, M±m | 46,30±5,53 | 45,59±5,85 | 60,33±18,90 | 0,585 |
| IGHV гены | 0,089 | |||
| мутированные, n=80 | 47 (58,8) | 26 (32,5) | 7 (8,8) | |
| немутированные, n=144 | 63 (43,8) | 67 (46,5) | 14 (9,7) | |
| Мутации в гене ТР53 | 0,681 | |||
| нет, n=218 | 108 (49,5) | 90 (41,3) | 20 (9,2) | |
| есть, n=6 | 2 (33,3) | 3 (50,0) | 1 (16,7) | |
| Аутоиммунная гемолитическая анемия | 0,256 | |||
| нет, n=195 | 94 (48,2) | 84 (43,1) | 17 (8,7) | |
| есть, n=25 | 14 (56,0) | 7 (28,0) | 4 (16,0) | |
| Вторичные опухоли | 0,917 | |||
| нет, n=193 | 94 (48,7) | 81 (42,0) | 18 (9,3) | |
| есть, n=29 | 15 (51,7) | 11 (37,9) | 3 (10,3) | |
| Синдром Рихтера | 0,310 | |||
| нет, n=205 | 101 (49,3) | 83 (40,5) | 21 (10,2) | |
| есть, n=17 | 8 (47,1) | 9 (52,9) | 0 | |
Скорость прогрессирования заболевания была выше у носителей генотипа GG. Медиана ВБП составила: 79 мес при генотипе ТТ, 56 мес — при ТG и 48 мес — при GG (р=0,028 при сравнении всех генотипов и р=0,037 при сравнении генотипа GG и генотипов ТТ + ТG). Однако при комплексном учете других маркеров прогноза вклад полиморфизма SNP309 гена MDM2 оказался незначимым (табл. 2). Только в подгруппе пациентов с отсутствием мутаций ТР53 и немутированным статусом IGHV генов вклад полиморфизма был значимым. Медиана ВБП составила: 49 мес при генотипе ТТ, 48 мес — при ТG и 24 мес — при GG (р=0,044 при сравнении всех генотипов и р=0,013 при сравнении генотипа GG и генотипов ТТ + ТG).
Таблица 2. Прогностическая значимость отдельных маркеров при анализе ОВ и ВБП обследованных больных ХЛЛ
| Показатель | ВБП | |||||
| Унивариантный анализ | Мультивариантный анализ | |||||
| ОР | 95% ДИ | P | ОР | 95% ДИ | P | |
| SNP309 GG генотип | 1,875 | 1,026–3,428 | 0,042 | 1,548 | 0,833–2,815 | 0,167 |
| Возраст | 1,383 | 0,9–2,12 | 0,143 | 1,769 | 1,119–2,797 | 0,015 |
| Стадия ХЛЛ | 2,408 | 1,892–3,065 | 0,0001 | 1,74 | 1,33–2,276 | 0,0001 |
| Инициальный лейкоцитоз | 4,138 | 2,706–6,328 | 0,0001 | 2,705 | 1,078–4,359 | 0,0001 |
| Статус IGHV генов | 3,185 | 2,037–4,979 | 0,0001 | 2,6 | 1,633–4,12 | 0,0001 |
| Мутации ТР53 | 6,595 | 1,313–9,842 | 0,013 | 5,807 | 2,069–10,301 | 0,001 |
| ОВ | ||||||
| SNP309 GG генотип | 2,226 | 1,236–4,012 | 0,008 | 1,523 | 0,827–2,807 | 0,177 |
| Возраст | 2,239 | 1,446–3,467 | 0,0001 | 2,514 | 1,562–4,046 | 0,0001 |
| Стадия ХЛЛ | 2,689 | 2,04–4,545 | 0,0001 | 1,981 | 1,467–2,675 | 0,0001 |
| Инициальный лейкоцитоз | 3,261 | 2,083–5,104 | 0,0001 | 2,182 | 1,319–3,609 | 0,0001 |
| Статус IGHV генов | 2,610 | 1,611–4,228 | 0,0001 | 2,329 | 1,408–3,853 | 0,001 |
| Мутации ТР53 | 4,491 | 1,398–14,433 | 0,04 | 6,188 | 1,837–20,852 | 0,003 |
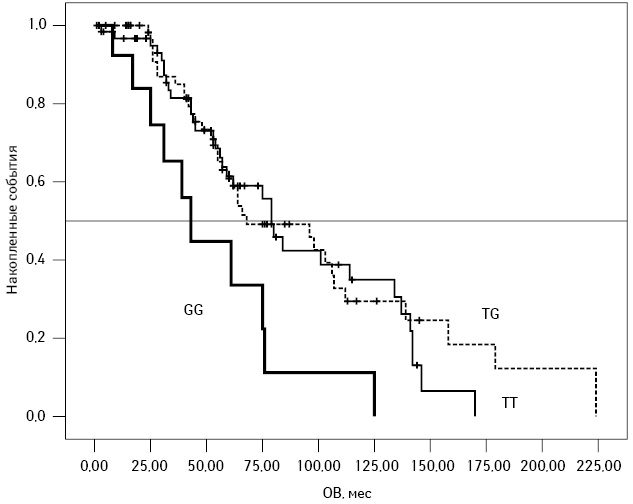
Аналогичную картину отмечали при анализе ОВ пациентов: несмотря на то, как изолированный фактор полиморфизм SNP309 гена MDM2 влиял на длительность ОВ (медиана ОВ составила 114 мес при генотипе ТТ, 98 мес — при ТG и 61 мес — при GG; р=0,018 при сравнении всех генотипов и р=0,008 при сравнении генотипа GG и генотипов ТТ + ТG), с учетом других факторов прогноза его значимость сохранялась лишь в подгруппе пациентов с отсутствием мутаций ТР53 и немутированным статусом IGHV генов. Для этих пациентов медиана ОВ составляла 79 мес при генотипе ТТ, 68 мес — при ТG и 43 мес — при генотипе GG; р=0,014 при сравнении всех генотипов и р=0,004 при сравнении генотипа GG и генотипов ТТ + ТG (рис. 2).
Обсуждение полученных результатов
При анализе всей когорты обследованных больных ХЛЛ мы не выявили влияния полиморфизма SNP309 гена MDM2 на клинико-гематологические данные при установлении диагноза, развитие вторичных осложнений и выживаемость в комплексе с другими факторами прогноза. В то же время полученные результаты свидетельствуют о наличии ассоциации генотипа SNP309 GG с неблагоприятным течением ХЛЛ в группе первичных пациентов с отсутствием мутаций гена ТР53 и немутированным статусом IGHV генов (62,5% от числа всех обследованных больных), что выражалось в более быстром прогрессировании заболевания и меньшей выживаемости таких больных. Это подтверждает мнение многих авторов о возможности использования полиморфизма SNP309 гена MDM2 в качестве маркера прогноза заболевания [10–12]. Объяснением подобного влияния, как принято считать, является более слабая активность p53, связанная с повышенным уровнем экспрессии белка Mdm2 у носителей SNP309 GG генотипа [9–11]. Следует отметить также снижение уровня экспрессии микроРНК miR-34a, которое ранее было выявлено у носителей генотипа SNP309 GG по сравнению с носителями генотипа SNP309 ТТ [20, 21]. miR-34a способна связываться с нуклеотидной последовательностью генов-мишеней и регулировать их экспрессию. В частности, экспрессия miR-34a негативно коррелирует с экспрессией антиапоптотического гена Bcl2 и позитивно — с более низкой пролиферативной активностью лейкемических клеток при ХЛЛ, более длительным периодом удвоения содержания лейкоцитов и более длительным периодом до необходимости начала терапии [20–22].
Нам представляется возможным еще один механизм реализации влияния полиморфизма SNP309 на течение ХЛЛ. Недавно продемонстрировано, что Mdm2 действует как кофактор для NF-κB — транскрипционного фактора, опосредующего пролиферативные и антиапоптотические сигналы в клетке [23]. Показано, что NF-κB аберрантно активирован при ХЛЛ, при этом высокий уровень активности ассоциирован с резистентностью к химиотерапии и неблагоприятным течением заболевания [24, 25]. Можно предположить, что избыточная экпрессия Mdm2 при SNP309 GG генотипе усиливает NF-κB активность, что приводит к повышению пролиферативных свойств лейкозных клеток и снижению их чувствительности к действию проапоптотических стимулов. Для подтверждения данного предположения необходимы дальнейшие исследования.
Благодарность
Мы выражаем благодарность г-ну Т. Хармсу, президенту благотворительной организации «KiHev — Kinderhilfe Kiew e.V.» за поддержку в обеспечении реактивами.
Список использованной литературы
1. Dohner H., Fischer K., Bentz M. et al. (1995) p53 gene deletion predicts for poor survival and non-response to therapy with purine analogs in chronic B-cell leukemias. Blood, 85(6): 1580–1589.
2. Rossi D., Cerri M., Deambrogi C. et al. (2009) The prognostic value of TP53 mutations in chronic lymphocytic leukemia is independent of del17p13: implications for overall survival and chemorefractoriness. Clin. Cancer Res., 15(3): 995–1004.
3. Haupt S., Haupt Y. (2006) Importance of p53 for cancer onset and therapy. Anticancer Drugs, 17(7): 725–732.
4. Momand J., Zambetti G.P., Olson D.C. et al. (1992) The mdm-2 oncogene product forms a complex with the p53 protein and inhibits p53-mediated transactivation. Cell, 69(7): 1237–1245.
5. Shi D., Gu W. (2012) Dual roles of MDM2 in the regulation of p53: ubiquitination dependent and ubiquitination independent mechanisms of MDM2 repression of p53 activity. Genes. Cancer, 3(3–4): 240–248.
6. Poyurovsky M.V., Prives C. (2006) Unleashing the power of p53: Lessons from mice and men. Genes Develop., 20(2): 125–131.
7. Grochola L.F., Zeron-Medina J., Meriaux S., Bond G.L. (2010) Single-nucleotide polymorphisms in the p53 signaling pathway. Cold Spring Harb. Perspect. Biol., 2(5): a001032: 1–18.
8. Bond G.L., Hu W., Bond E.E. et al. (2004) A single nucleotide polymorphism in the MDM2 promoter attenuates the p53 tumor suppressor pathway and accelerates tumor formation in humans. Cell, 119 (5): 591–602.
9. Gryshchenko I., Hofbauer S., Stoecher M. et al. (2008) MDM2 SNP309 is associated with poor outcome in B-cell chronic lymphocytic leukemia. J. Clin. Oncol., 26(14): 2252–2257.
10. Willander K., Ungerback J., Karlsson K. et al. (2010) MDM2 SNP309 promoter polymorphism, an independent prognostic factor in chronic lymphocytic leukemia. Eur. J. Haematol., 85(3): 251–256.
11. Seyfried I., Hofbauer S., Stoecher M. et al. (2008) SNP309 as predictor for sensitivity of CLL cells to the MDM2 inhibitor nutlin-3a. Blood, 112(5): 2168.
12. Kaderi M.A., Mansouri M., Zainuddin N. et al. (2010) Lack of association between the MDM2 promoter polymorphism SNP309 and clinical outcome in chronic lymphocytic leukemia. Leuk. Res., 34(3): 335–339.
13. Zenz T., Habe S., Benner A. et al. (2008) The MDM2 — 309 T/G promotor single nucleotide polymorphism does not alter disease characteristics in chronic lymphocytic leukemia. Haematologica, 93 (7): 1111–1113.
14. Benner A., Mansouri L., Rossi D. et al. (2014) MDM2 promotor polymorphism and disease characteristics in chronic lymphocytic leukemia: results of an individual patient data-based meta-analysis. Haematologica, 99(8): 1285–1291.
15. Rai K.R., Sawitzky A., Cronkite E.P. (1975) Clinical staging of chronic lymphocytic leukemia. Blood, 46(2): 219–234.
16. Rai K.R. (1987) A critical analysis of staging in CLL. Chronic lymphocytic leukemia. Recent progress and future direction. New York: Alan. R. Liss. 253 p.
17. Binet J.L., Auguier A., Dighiero G. et al. (1981) A new prognostic classification of chronic lymphocytic leukemia derived from a multivariante survival analysis. Cancer, 48(1): 198–205.
18. Hirata H., Hinoda Y., Kikuno N. et al. (2007) MDM2 SNP309 polymorphism as risk factor for susceptibility and poor prognosis in renal cell carcinoma. Clin. Cancer Res., 13(14): 4123–4129.
19. Abramenko I., Bilous N., Chumak A. et al. (2008) Chronic lymphocytic leukemia patients exposed to ionizing radiation due to the Chernobyl NPP accident — with focus on immunoglobulin heavy chain gene analysis. Leuk. Res., 32(4): 535–542.
20. Asslaber D., Pinon J.D., Seyfried I. et al. (2010) microRNA-34a expression correlates with MDM2 SNP309 polymorphism and treatment-free survival in chronic lymphocytic leukemia. Blood, 115(21): 4191–4297.
21. Merkel O., Asslaber D., Pinon J.D. et al. (2010) Interdependent regulation of p53 and miR-34a in chronic lymphocytic leukemia. Cell Cycle, 9(14): 2764–2768.
22. Zauh G., Voltan R., di Iasio M.G. et al. (2011) miR-34a induces the downregulation of both E2F1 and B-Myb oncogenes in leukemic cells. Clin. Cancer Res., 17(9): 2712–2724.
23. Mulay S.R., Thomasova D., Ryu M., Anders H.J. (2012) MDM2 (murine double minute-2) links inflammation and tubular cell healing during acute kidney injury in mice. Kidney Int., 81: 1199–1211.
24. Liu Z., Hazan-Halevy I., Harris D.M. et al. (2011) Signal transducer and activator of transcription (STAT)-3 activates nuclear factor (NF)-κB in chronic lymphocytic leukemia cells. Mol. Cancer Res., 9(4): 507–515.
25. Kanduri M., Tobin G.,Aleskog A. et al. (2011) The novel NF-jB inhibitor IMD-0354 induces apoptosis in chronic lymphocytic. Blood Cancer J., 1(3): e12: 1–6.
Значення поліморфізму SNP309 гена MDM2 для оцінки перебігу хронічного лімфолейкозу в комплексі з іншими маркерами прогнозу
1ДУ «Національний науковий центр радіаційно медицини НАМН України», Київ
2Національний інститут раку, Київ
Резюме. Мета дослідження — визначити значення поліморфізму SNP309 гена MDM2 для оцінки клінічних особливостей хронічного лімфолейкозу (ХЛЛ) і прогнозу перебігу захворювання. Поліморфізм SNP309 досліджено в групі 224 первинних хворих на ХЛЛ методом полімеразної ланцюгової реакції з подальшим аналізом поліморфізму довжини рестрикційних фрагментів у комплексі з іншими факторами прогнозу (вік, ініціальний лейкоцитоз, стадія захворювання, мутаційний статус генів варіабельних ділянок важких ланцюгів імуноглобулінів (IGHV), наявність мутацій у гені ТР53). При аналізі усієї когорти обстежених пацієнтів не виявлено впливу поліморфізму SNP309 гена MDM2 на клініко-гематологічні дані на момент встановлення діагнозу, розвиток вторинних ускладнень і виживаність при врахуванні інших факторів прогнозу. Разом з тим розкрито асоціацію генотипу SNP309 GG зі швидшим прогресуванням захворювання (р=0,013) та коротшою виживаністю (р=0,014) в підгрупі хворих із відсутністю мутацій у гені ТР53 і немутованим статусом IGHV генів. Дослідження поліморфізму SNP309 гена MDM2 можна використовувати як додатковий прогностичний маркер при ХЛЛ.
Ключові слова: хронічний лімфолейкоз, ген MDM2, однонуклеотидний поліморфізм (SNP).
SNP309 polymorphism in the MDM2 gene in evaluation of chronic lymphocytic leukemia outcome in combination with other prognostic markers
1SI «National Research Center for Radiation Medicine, NAS of Ukraine», Kyiv
2National Cancer Institute, Kyiv
Summary. To define the value of MDM2 SNP309 polymorphism for the assessment of clinical characteristics and outcome of chronic lymphocytic leukemia (CLL). MDM2 SNP309 polymorphism was studied in 224 CLL patients by polymerase chain reaction with restriction fragment length polymorphism analysis and correlated with other prognostic factors (age at diagnosis, initial leukocytosis, stage at diagnosis, mutational status of immunoglobulin heavy chain variable region (IGHV) genes, presence of mutations in the TP53 gene). Analysis of the entire group of patients showed no influence of SNP309 polymorphism on clinical data at diagnosis, the development of secondary complications and survival rates when other prognostic factors where considered. However, the association of the SNP309 GG genotype with faster progression (р=0,013) and shorter overall survival (р=0,014) was seen in the subgroup of patients with no mutations in the TP53 gene and unmutated IGHV genes. The assessment of MDM2 SNP309 polymorohism may be used as additional prognostic marker in CLL.
Key words: chronic lymphocytic leukemia, gene MDM2, single nucleotide polymorphism (SNP).
Адрес:
Белоус Надежда Ивановна
04050, Киев, просп. Победы, 119/121
ГУ «Национальный научный центр
радиационной медицины НАМН Украины»
Факс: (044) 483-06-37
E-mail: nbilous@yahoo.com














Leave a comment