Використання дифузійно-зважених зображень МРТ у діагностиці солідних ниркових новоутворень
Мицик Ю.О.1, Дутка І.Ю.2, Борис Ю.Б.1, Комнацька І.М.2, Шатинська-Мицик І.С.1, Лозинський Р.М.2
- 1Львівський національний медичний університет імені Данила Галицького
- 2Медичний центр «Євроклінік», Львів
Резюме. Нирково-клітинний рак (НКР) є найбільш розповсюдженою пухлиною нирки і трапляється в 85-90% випадків, що становить 3% від усіх вісцеральних новоутворень. Ступінь злоякісності світлоклітинного НКР (скНКР) визначають за різними гістологічними класифікаціями, найбільш широко вживаною з яких є градація за Fuhrman, яка ґрунтується на 4 морфоядерних критеріях. Останніми роками магнітно-резонансна томографія (МРТ) все частіше привертає увагу клініцистів як метод вибору для діагностики та стадіювання НКР, оскільки має низку переваг перед комп’ютерною томографією. Мета дослідження полягала в оцінці інформативності МРТ із використанням модальності дифузійно-зважених зображень МРТ у діагностиці солідних ниркових новоутворень. У дослідженні брали участь 62 хворих із патоморфологічно доведеними пухлинами нирки (37 хворих на скНКР, 12 хворих на онкоцитому, 13 пацієнтів з ангіоміоліпомою) та 15 здорових волонтерів. Усім пацієнтам проводили МРТ із використанням дифузійно-зважених зображень з подальшим визначенням вимірюваного коефіцієнта дифузії (ВКД). У результаті проведеного аналізу встановлено, що середнє значення ВКД злоякісних новоутворень було значно нижчим, ніж у нормальної ниркової паренхіми, і становило відповідно 2,11±0,25·10−−–3 мм2/с проти 3,36±0,41·10−–3 мм2/с (р<0,05). Також відзначали статистично достовірну різницю у показниках ВКД у хворих на скНКР високого та низького ступеня диференціації, ангіоміоліпому та онкоцитому.

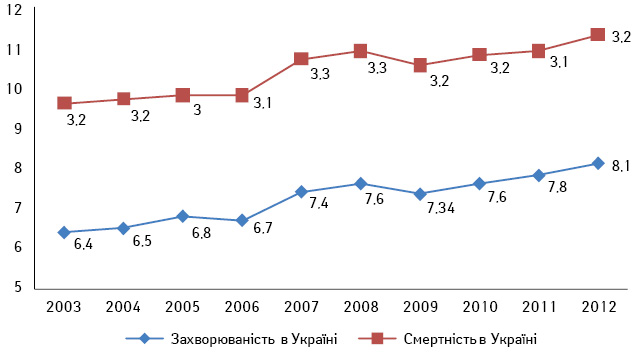
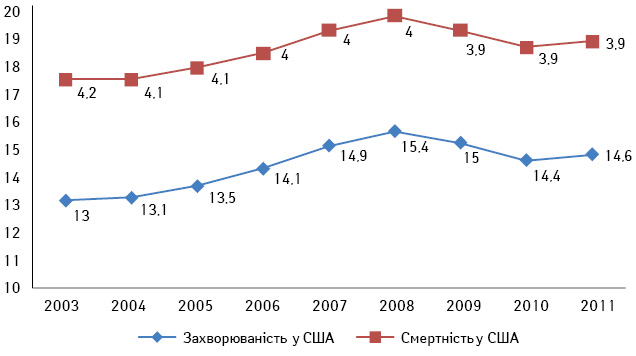
Нирково-клітинний рак (НКР) становить близько 3% усіх злоякісних пухлин дорослого населення. В онкоурології цей вид новоутворень займає 3-тє місце після раку передміхурової залози і сечового міхура. За даними Національного інституту раку (National Cancer Institute) США, за останні 20 років захворюваність на НКР в американській популяції невпинно зростає і становить 3,8% від усіх уперше виявлених злоякісних пухлин, а кількість нових випадків у 2014 р. становила майже 70 тис. Водночас рівень смертності від цього захворювання залишається незмінним і становить 3,9% [1]. Згідно з даними канцер-реєстру Національного інституту раку в Україні, в 2012 р. захворюваність на НКР (стандартизований показник, світовий стандарт) становила 8,1, а смертність — 3,2. Аналіз цих показників за останні роки свідчить на користь того, що захворюваність і смертність через НКР в Україні та США невпинно зростають, незважаючи на широке застосування сучасних методів діагностики та лікування (рис. 1, 2) [2].
Серед різних гістологічних субтипів НКР найбільш розповсюдженим є його світлоклітинна форма (скНКР), яку виявляють у 70–80% патоморфологічних висновків. Ступінь злоякісності скНКР визначають за різними гістологічними класифікаціями, найбільш вживаною з яких є градація за Fuhrman, яка ґрунтується на 4 морфоядерних критеріях. Разом зі значним поступом у розумінні механізмів розвитку НКР запропоновано варіант активного виживання у вибраних пацієнтів, ключову роль при такому виборі відіграє ступінь злоякісності пухлини [3, 4]. Найбільш поширеними доброякісними пухлинами нирки, що трапляються в клінічній практиці, є ангіоміоліпома (АМЛ) (10%) й онкоцитома (3–7%) [5].
На сьогодні комп’ютерна томографія (КТ) є рутинним променевим дослідженням при НКР, яке дозволяє з високою точністю проводити стадіювання новоутворення, визначати характер його росту та наявність некротичних ділянок. Дослідники отримали обнадійливі результати стосовно диференціації гістологічних субтипів НКР та пухлин із різним ступенем ядерної атипії [6]. Проте все більшу цікавість науковців і клініцистів викликає факт значного ризику КТ-індукованого онкогенезу, навіть при одноразовому проведенні цього дослідження. В останні роки магнітно-резонансна томографія (МРТ) все частіше привертає увагу клініцистів як метод вибору для діагностики та стадіювання НКР, оскільки має низку переваг над КТ: відмінна якість зображення, висока інформативність, відсутність будь-якого променевого навантаження на пацієнта та персонал, можливість отримання трьохвимірного зображення, оцінка функції нирок за допомогою контрастування тощо. За даними деяких досліджень, чутливість МРТ із контрастним підсиленням при диференційній діагностиці НКР була навіть вищою за таку при КТ і становила 100% проти 84% при тому, що специфічність обох методик була майже однаковою — 89 і 91% відповідно [7, 8].
Застосування дифузійно-зважених зображень (ДЗЗ), що являють собою МРТ модальність, яка використовує сильні біполярні градієнти для посилення чутливості до термічно індукованого броунівського руху молекул водню, дозволяє вимірювати молекулярну дифузію в тканинах in vivo. Вимірюваний коефіцієнт дифузії (ВКД) — це кількісний параметр, який вираховується із ДЗЗ і використовується для оцінки ступеня дифузії в здорових та уражених тканинах. Досі ДЗЗ в основному застосовували для диференційної діагностики пухлин центральної нервової системи, проте останніми роками були отримані обнадійливі дані щодо використання цієї методики у діагностиці захворювань інших органів, у тому числі нирок [9–12]. Наразі майже всі доступні клінічні системи МРТ (1,5 T і 3Т) мають можливість виконання модальності ДЗЗ на додаток до морфологічної та анатомічної візуалізації. Для обстеження сечостатевої системи більшість ДЗЗ виконують в осьовій площині при «вільному диханні» або з використанням «дихального тригера» для доповнення звичайних послідовностей МРТ, з додатковим часом приблизно 4–10 хв [13–15].
З урахуванням вищезазначеного зроблено припущення, що МРТ з модальністю ДЗЗ може бути застосована для диференційної діагностики злоякісних і доброякісних пухлин нирки та визначення ступеня їх диференціації за відсутності променевого навантаження на хворого.
Метою дослідження було вивчення інформативності МРТ із застосуванням модальності ДЗЗ у диференційній діагностиці солідних ниркових новоутворень.
Об’єкт і методи дослідження
У ретроспективному дослідженні брали участь 62 дорослих пацієнтів із пухлинами нирки (37 чоловіків і 25 жінок): 37 хворих на скНКР, 13 пацієнтів з онкоцитомою, 12 пацієнтів з АМЛ, а також 15 здорових волонтерів з нормальними результатами ультразвукового дослідження нирок. Усім учасникам проводили МРТ, яка включала ДЗЗ із подальшим обчисленням ВКД.
Хворим проводили часткове або радикальне видалення нирки з подальшою патоморфологічною верифікацією діагнозу. У дослідженні брали участь пацієнти лише зі світлоклітинним гістологічним підтипом НКР, онкоцитомою та АМЛ. Із дослідження були виключені особи з металевими деталями в тілі, пацієнти із мультифокальними або кістозними ураженнями нирок, хворі, у яких одержано зображення з низькою якістю, ДЗЗ із явними артефактами. До виконання МРТ та хірургічного лікування протипухлинну терапію у пацієнтів не проводили.
МРТ виконували за допомогою 1,5 T сканера (Signa HDxt, General Electric, США) з використанням восьмиканальної котушки. У всіх випадках використовували однаковий стандартизований протокол сканування, який включав такі послідовності:
- корональні T2-зважені одномоментні швидкі спінові ехо (coronal T2-weighted single shot fast spin echo — SSFSE), час повтору (TR) = 2625 мс, час ехо (TE) = 90 мс, кут повороту = 90°, поле зору = 40 см × 40 см, матриця = 200 × 192, із затримкою дихання;
- осьові 2D швидкі зображення з використанням жирового насичення (axial 2D fast imaging employing steady-state acquisition with fat saturation — FIESTAFATSAT), TR = 4,1 мс, TE = 1,8 мс, кут повороту = 90°, поле зору = 40 см × 40 см, матриця = 224 × 320;
- осьові ДЗЗ із такими параметрами: TR = 12 000 мс, TE = 90 мс, поле зору = 40 см × 40 см; матриця = 200 × 192; NEX = 3; пропускна здатність = 250 кГц, напрям дифузії = зріз, товщина зрізу = 6,0 мм, міжсканувальний розрив = 1,0 мм з b-показником = 600 мм/с, час дослідження = 17 с. ДЗЗ проводили до введення контрастних речовин, за допомогою одномоментної ехо-планарної послідовності зображень із технікою паралельної візуалізації та насичення жиру протягом однієї затримки дихання;
- осьові Т1-зважені швидкі градієнтні повторювані подвійні ехо (axial T1-weighted fast spoiled gradient-recalled echo dual-echo — FSPGR-DE), TR = 130 мс, TE = 2,1 мс і 4,3 мс, кут повороту = 70°, поле зору = 43 см × 43 см, матриця = 320 × 192, із затримкою дихання;
- осьові Т2-зважені швидковідновлювальні спінові ехо (axial T2-weighted fast recovery fast spin echo — FRFSE), TR = 8750 мс, TE = 78 мс і 132 мс, кут повороту = 90°, поле зору = 44 см × 44 см, матриця = 384 × 192;
- сагітальні T2-зважені одномоментні швидкі спінові ехо (sagital T2-weighted), TR = 1760 мс, TE = 87,4 мс, кут повороту = 90°, поле зору = 37 см × 37 см, матриця = 384 × 256;
- осьові 3D жиронасичувальні Т1-зважені градієнтні ехо (axial 3D fat-saturated T1-weighted spoiled gradient echo, liver acquisition with volume acquisition — LAVA), TR = 4,5 мс, TE = 2,2 мс, кут повороту = 15°, поле зору = 38 см × 38 см, матриця = 320 × 192; під час і після введення гадопентетату дімеглуміну у дозі 0,1 ммоль/кг маси тіла у вигляді болюсних ін’єкцій протягом 20 с між кожним подихом.
Середня тривалість МРТ-обстеження становила 35 хв.
ВКД обчислювали з ВКД-карт, що автоматично генерувалися на робочій станції на основі ДЗЗ, і використовували для вимірювання дифузії. ВКД розраховували з лінійною регресією аналізу функції:
S = S0 × ехр ( — b × ВКД),
де S — інтенсивність сигналу після застосування градієнту дифузії; S0 — інтенсивність сигналу на зображенні ДЗЗ, визначеного при b = 0 с/мм.
Для обчислення ВКД пухлини встановлювали зону зацікавлення на ВКД-карті над ділянкою новоутворення, ретельно повторюючи його контури, після чого проводили виміри. За наявності негомогенного сигналу від пухлини чи зон некрозу зону зацікавлення виявляли над ділянкою із найменшим значенням ВКД. Додатково проводили обчислення ВКД нормальної ниркової паренхіми, копіюючи зону зацікавлення пухлини на симетричну ділянку контралатеральної нирки.
Дослідження проводили на базі клінік урології та променевої діагностики і терапії Львівського національного медичного університету імені Данила Галицького та медичного центру «Євроклінік» протягом 2013–2014 років з дозволу етичної комісії. Для статистичної обробки отриманих даних використовували програму Microsoft Excel 2010.
Мета дослідження полягала в оцінці клінічної інформативності МРТ із використанням модальності ДЗЗ у диференційній діагностиці солідних новоутворень нирок.
Результати та їх обговорення
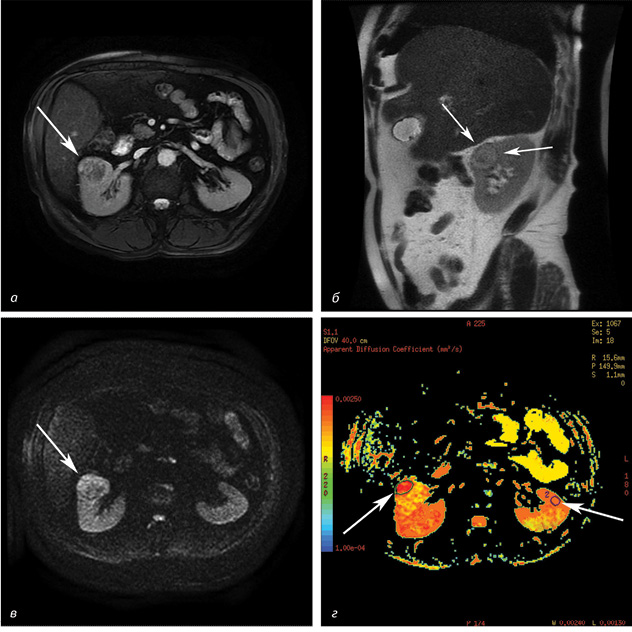
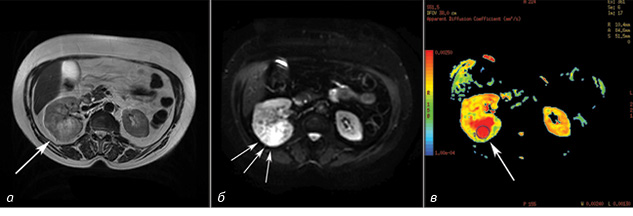
На МРТ-зображеннях пухлини мали круглу, овальну або неправильну форму (рис. 3, 4). Усі новоутворення були діаметром, що перевищував 3 см, із середнім розміром 5,6±2,2 см (діапазон від 3,0 до 13,5 см). У пацієнтів із НКР у 29 випадках спостерігали інтенсивний гомогенний сигнал; в інших 8 пацієнтів — гетерогенний через некротичні компоненти пухлини. Середнє значення ВКД злоякісних новоутворень було значно нижчим, ніж у нормальної ниркової паренхіми (2,11±0,25•10 мм/с проти 3,36±0,41•10 мм/с, р<0,05). Встановлено різницю у ВКД злоякісних та доброякісних пухлин нирки: у хворих на АМЛ значення ВКД становило 2,36±0,32•10 мм/с проти 2,11±0,25•10 мм/с (р<0,05); у пацієнтів з онкоцитомою ВКД досягав 2,75±0,27•10 мм/с проти 2,11±0,25•10 мм/с (р<0,05). Відзначали статистично достовірні відмінності в значеннях ВКД при різних ступенях диференціації НКР. Відмінності ВКД у хворих на НКР, АМЛ та онкоцитому наведено в таблиці.
Таблиця. Середні значення ВКД нормальної ниркової паренхіми, скНКР, АМЛ та онкоцитоми
|
Патологічний тип/стадія (кількість випадків) |
Середній розмір пухлини, см |
Середнє значення ВКД (•10мм/с) |
| Нормальна ниркова паренхіма (n=15) | − | 3,36±0,41* |
| СкНКР (n=37) Ступінь I (n=7) Ступінь II (n=10) Ступінь III (n=14) Ступінь IV (n=6) |
7,3 4,6 5,2 8,56,1 |
2,11±0,25* 2,26±0,42* 2,20±0,39* 2,15±0,52* 2,09±0,45* |
| АМЛ (n=12) | 4,3 | 2,36±0,32* |
| Онкоцитома (n=13) | 5,1 | 2,75±0,27* |
*p <0,05.
Висновки
1. Значення ВКД нормальної ниркової паренхіми було значно вищим, ніж у тканинах злоякісних пухлин нирки.
2. Середнє значення ВКД скНКР було найнижчим серед усіх новоутворень нирки: у хворих на НКР становило 2,11±0,25•10 мм/с проти 2,75±0,27•10 мм/с — для онкоцитоми і 2,36±0,32•10 мм/с — для АМЛ. Ми спостерігали розходження в значеннях ВКД у хворих із різними ступенями ядерної атипії НКР.
3. МРТ-модальність ДЗЗ із обчисленням ВКД дозволяє отримати цінну інформацію, необхідну для диференційної діагностики злоякісних і доброякісних пухлин нирки, що є вкрай важливим для вибору подальшої тактики лікування хворих із цими патологічними процесами.
Список використаної літератури
1. Howlader N., Noone A.M., Krapcho M. et al. (2014)SEER Cancer Statistics Review, 1975–2011, National Cancer Institute (http://seer.cancer.gov/csr/1975_2011/).
2. Федоренко З.П., Михайлович Ю.Й., Гулак Л.О. та ін. (2014) Рак в Україні, 2012–2013. Бюл. Нац. канцер-реєстру України, 15. 124 с.
3. Sun M.R., Ngo L., Genega E.M. et al. (2009) Renal cell carcinoma: dynamic contrast-enhanced MR imaging for differentiation of tumor subtypes — correlation with pathologic findings. Radiology, 250: 793–802.
4. Fuhrman S.A., Lasky L.C., Limas C. et al. (1982) Prognostic significance of morphologic parameters in renalcell carcinoma. Am. J. Surg. Pathol., 6(7): 655–663.
5. Kutikov A., Fossett L.K., Ramchandani P. et al. (2006) Incidence of benign pathologic findings at partial nephrectomy for solitary renal mass presumed to be renal cell carcinoma on preoperative imaging. Urology, 68: 737–740.
6. Kono K., Inoue Y., Nakayama K. et al. (2001) The role of diffusion-weighted imaging in patients with brain tumors. AJNR, 22: 1081–1088.
7. Zhang J., Tehrani Y.M., Wang L. et al. (2008) Renal masses: characterization with diffusion-weighted MR imaging — a preliminary experience. Radiology, 247: 458–464.
8. Taouli B., Thakur R.K., Mannelli L. et al. (2009) Renal lesions: characterization with diffusion-weighted imaging versus contrast-enhanced MR imaging. Radiology, 251: 398–407.
9. Kim S., Jain M., Harris A.B. et al. (2009) T1 hyperintense renal lesions: characterization with diffusion-weighted MR imaging versus contrast-enhanced MR imaging. Radiology, 251: 796–807.
10. Grobner T. (2006) Gadolinium: a specific trigger for the development of nephrogenicfibrosingdermopathy and nephrogenic systemic fibrosis. Nephrol. Dial. Transplant., 21: 1104–1108.
11. Razek A.A., Farouk A., Mousa A., Nabil N. (2011) Role of diffusion-weighted magnetic resonance imaging in characterization of renal tumors. J. Comput. Assist. Tomogr., 35: 332–336.
12. Rosenkrantz A.B., Niver B.E., Fitzgerald E.F. et al. (2010) Utility of the apparent diffusion coefficient for distinguishing clear cell renal cell carcinoma of low and high nuclear grade. AJR Am. J. Roentgenol., 195: W344–51.
13. Doganay S., Orhan I. (2011) Ability and utility of diffusion-weighted MRI with different b values in the evaluation of benign and malignant renal lesions. Clin. Radiol., 66: 420–425.
14. Cova M., Squillaci E., Stacul F. et al. (2004) Diffusion-weighted MRI in the evaluation of renal lesions: preliminary results. Br. J. Radiol., 77: 851–857.
15. Sandrasegaran K., Sundaram C.P., Ramaswamy R. et al. (2010) Usefulness of diffusion-weighted imaging in the evaluation of renal masses. AJR Am. J. Roentgenol., 194: 438–445.
Использование диффузионно-взвешенных изображений МРТ в диагностике солидных новообразований почки
Львовский национальный медицинский университет имени Данила Галицкого
Медицинский центр «Евроклиник», Львов
Резюме. Почечно-клеточный рак (ПКР) является наиболее часто встречающейся опухолью почки и выявляется в 85–90% случаев, что составляет 3% от всех злокачественных висцеральных новообразований. Степень злокачественности светлоклеточного НКР (скНКР) определяют по разным гистологическим классификациям, наиболее широко применяемой из которых является градация по Fuhrman, основанная на 4 морфоядерных критериях. В последние годы магнитно-резонансная томография (МРТ) все чаще привлекает внимание клиницистов как метод выбора для диагностики и стадирования НКР, так как имеет ряд преимуществ перед компьютерной томографией. Целью исследования была оценка клинической информативности МРТ с использованием модальности диффузионно-взвешенных изображений в диагностике солидных почечных новообразований. В исследовании принимали участие 62 взрослых пациентов с патоморфологически доказанными опухолями почки (37 больных скНКР, 12 больных онкоцитомой, 13 пациентов с ангиомиолипомой) и 15 здоровых волонтеров. Всем пациентам проводили магнитно-резонансную томографию с использованием диффузионно-взвешенных изображений с последующим определением измеряемого коэффициента диффузии (ИКД). В результате проведенного анализа установлено, что среднее значение ИКД злокачественных новообразований было значительно ниже, чем у нормальной почечной паренхимы, и составляло 2,11±0,25•10 мм/с против 3,36±0,41•10 мм/с соответственно (р<0,05). Также отмечена разница в показателях ИКД у больных скПКР высокой и низкой степени дифференциации, ангиомиолипомой и онкоцитомой.
почечно-клеточный рак, магнитно-резонансная томография, диффузионно-взвешенные изображения, измеряемый коэффициент диффузии.
Адреса:
Мицик Юліан Олегович
79010, Львів, вул. Пекарська, 69
Львівський національний медичний
університет імені Данила Галицького
E-mail: mytsyk.yulian@i.ua














Leave a comment