Вплив модуляторів рівня аргініну і поліамінів на метаболічну активність макрофагів, цитолітичну активність спленоцитів та їх електрокінетичні властивості у мишей з лейкозом L1210
Яніш Ю.В.1, Гончар М.В.2, Артамонова А.Б.1, Карнаушенко О.В.1
- 1Інститут експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького НАН України, Київ
- 2Інститут молекулярної біології і генетики НАН України, Київ
Резюме. Показано, що інгібітори рівня поліамінів значно підвищують метаболічну активність макрофагів і водночас знижують цитолітичну активність спленоцитів тварин з експериментальним лейкозом. Аргіназа пригнічує метаболічну активність клітин лейкозу L1210 in vitro. Між ζ-потенціалом і метаболічною активністю лейкозних клітин та макрофагів пухлиноносія існує зворотна кореляція.

Вступ
Відомо, що важливу роль у проліферації клітин, зокрема пухлинних, та пухлинному рості в цілому відіграють аргінін і поліаміни. Тому слушною видалася думка, що зовнішній вплив на рівень цих сполук в організмі надасть дослідникові нові важелі для підвищення ефективності протипухлинної терапії, принаймні в експерименті in vivo, з подальшою розробкою рекомендацій для впровадження їх у клінічну практику.
Предметом наших досліджень був вплив інгібіторів рівня поліамінів, а також інгібітору аргінази нораргініну (окремо та при сумісному їх застосуванні) на спонтанну метаболічну активність перитонеальних макрофагів (ПМФ) мишей з перещепленим асцитним лімфолейкозом L1210, оскільки саме макрофаги одними з перших зустрічаються зі злоякісно трансформованими клітинами, уособлюючи собою клітинну ланку неспецифічного захисту хворого організму.
Як модулятори метаболізму аргініну та поліамінів використано, зокрема, α-дифторметилорнітин (α-ДФМО) і рекомбінантну аргіназу, люб’язно надані нам доктором біологічних наук, професором М.В. Гончаром (Інститут біології клітини НАН України, Львів).
В експериментах in vivo досліджували дію згаданих чинників на спонтанну метаболічну активність клітин лейкозу L1210, а також на цитолітичну активність мононуклеарних лімфоцитів (МНЛ) селезінки тварин-пухлиноносіїв відносно гомологічних пухлинних клітин (ПК). Окремо проведено експерименти з вивчення впливу аргінази на спонтанну метаболічну активність ПК за generic viagra умови короткочасного культивування їх in vitro.
Також виконано дослідження впливу інгібіторів обміну поліамінів на електрокінетичні показники ПМФ і ПК для подальшого зіставлення з результатами, отриманими у МТТ- та НСТ-тестах.
Об’єкт і методи дослідження
У роботі використовували мишей-самців лінії СDF-1 розведення віварію Інституту експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького. Тваринам із масою тіла 22–25 г вводили в черевну порожнину 0,2 мл ізотонічного розчину NaCl, що містив 5•10 клітин лімфоцитарного лейкозу L1210.
В експериментах із визначення спонтанної метаболічної активності ПМФ у НСТ-тесті та цитолітичної активності МНЛ у МТТ-тесті досліджувані сполуки, розведені в 0,2 мл ізотонічного розчину, також вводили в черевну порожнину, починаючи з 1-ї доби після перещеплення пухлини. Загалом проведено 6 ін’єкцій кожній тварині, останню — за добу до забою, на 12-й день розвитку лейкозу.
Мишам груп «хворого контролю» паралельно з експериментальними тваринами вводили плацебо — по 0,2 мл чистого 0,14 М розчину NaCl.
Інгібітор ферменту аргінази нораргінін вводили по 40 мг на мишу, α-ДФМО — в дозі 800 мг/кг, метилгліоксаль-біс-гуанілгідразон (МГБГ) — по 40 мкг на мишу під час кожної ін’єкції.
В експериментах із визначення у НСТ-тесті метаболічної активності ПК і α-ДФМО, і МГБГ вводили по 5 мкМ на тварину у 3 прийоми: на 7; 8-му та 9-ту добу після перещеплення лейкозу; мишей виводили з експерименту на 10-ту добу росту пухлини. ПК отримували з асцитичної рідини і тричі відмивали центрифугуванням у 0,14 М NaCl (400 g, 10 хв).
В експериментах із визначення у МТТ-тесті цитолітичної активності спленоцитів мишей-носіїв лімфоцитарного лейкозу L1210 і α-ДФМО, і МГБГ вводили за попередньою схемою.
У випадку сумісного використання досліджувані речовини вводили одній і тій самій тварині у вигляді окремих ін’єкцій відповідного розчину в об’ємі 0,2 мл.
У кінці експериментів тварин забивали методом дисторсії шийних хребців з дотриманням правил біологічної етики.
ПМФ виділяли в складі загального пулу клітин перитонеального змиву, отриманих з черевної порожнини мишей, із подальшою їх адгезією на поверхні стандартних чашок Петрі з полістиролу.
У випадку приготування клітин-ефекторів (КЕ) для цитолітичного тесту вихідну суспензію спленоцитів отримували за нижчеописаною методикою. Вилучену селезінку мишей розтирали за допомогою гомогенізатора Поттера у живильному середовищі 199 («Sigma», США) з 10% сироватки великої рогатої худоби (СВР) (АТ «Конотопм’ясо», Україна). Суспензію клітин додатково обробляли протягом 6 хв 0,83% розчином NH4Cl для лізису еритроцитів, після чого тричі відмивали від NH4Cl у середовищі 199 (500 g, 15 хв). МНЛ селезінки виділяли шляхом центрифугування суспензії спленоцитів у градієнті щільності фікол-верографіну (ρ=1,077 г/см) при 400 g протягом 30 хв. Після дворазового відмивання у середовищі Ігла (НПВ «Біо-Тест-Лабораторія», Київ, Україна) виділені МНЛ суспендували у середовищі 199 («Sigma», США) з 10% СВР. Для звільнення отриманої фракції МНЛ від прилипаючих клітин використовували здатність останніх до адгезії на гладенькій поверхні (інкубація 10 клітин/мл у живильному середовищі 199 з 10% сироватки великої рогатої худоби у полістиролових чашках Петрі стандартного діаметру протягом 60 хв при 37 °C). Після інкубації клітини, що не адгезувалися на пластиковій поверхні, осаджували (400 g, 10 хв), ресуспендували у середовищі RPMI 1640 («Biowest», США) з 20% інактивованої нагріванням ембріональної телячої сироватки (ЕТС) у необхідній концентрації (НПВ «Біо-Тест-Лабораторія», Київ, Україна).
Кількість життєздатних клітин підраховували за допомогою рахункової камери Горяєва у тесті суправітального забарвлення трипановим синім («Sigma», США).
Визначення спонтанної метаболічної активності ПМФ у тесті відновлення нітросинього тетразолію (НСТ) проводили у круглодонних планшетах для імунологічних досліджень (Санкт-Петербурзький завод медполімерів, Росія) з використанням спектрофотометричної модифікації тесту відновлення нітросинього тетразолію (НСТ-тесту) [1]. Для цього в лунки вносили по 0,2 мл суспензії ПМФ у концентрації 1×10 клітин/мл і додавали по 0,02 мл 0,2% розчину НСТ («Sigma», США). Інкубацію здійснювали протягом 60 хв у термостаті при температурі 37 ˚C у вологій атмосфері 5,0% CO2. Після завершення інкубації вміст лунок двічі відмивали від залишків барвника за допомогою фізіологічного розчину хлориду натрію, здійснюючи центрифугування при 400 g протягом 15 хв. Потім у кожну лунку вносили по 0,06 мл KOH (1,0 М) і 0,07 мл 50% розчину диметилсульфоксиду (ДМСО). Проби ретельно піпетували до повного розчинення диформазану.
Цитолітичну активність спленоцитів визначали у МТТ-тесті [1]. Для цього у ролі КЕ використовували МНЛ селезінки, які суспендували в кількості 3,0•10 клітин/мл у середовищі RPMI 1640 з додаванням 20% ЕТС, 40 од./мл пеніциліну і 40 мкг/мл стрептоміцину (ПАТ «Київмедпрепарат», Україна).
Як клітини-мішені (КМ) використовували клітини експериментального асцитного лімфолейкозу L1210, виділені з перитонеальної порожнини хворих мишей-самців лінії CDF-1. ПК суспендували у концентрації 1,0•10 клітин/мл у живильному середовищі аналогічного складу. Життєздатність ПК, визначена у мікроскопічному суправітальному тесті з трипановим синім, становила не менше 98%. Цитолітичний тест проводили у таких самих круглодонних планшетах для імунологічних досліджень.
Для цього у дослідні лунки вносили по 0,1 мл суспензії КМ (1,0•10) і 0,1 мл суспензії КЕ (3,0•10). Таким чином, співвідношення КМ до КЕ становило 1 : 3. У контрольні лунки вносили по 0,1 мл суспензії КМ чи КЕ та по 0,1 мл живильного середовища. Інкубацію здійснювали протягом 18 год у термостаті при температурі 37 ˚C у вологій атмосфері 5,0% CO2. Після закінчення інкубації додавали 0,02 мл розчину 3-(4,5-диметилдіазол-2-їл)-2,5-дифенілтетразолію броміду (МТТ) у концентрації 5,0 мг/мл та
інкубували ще 4 год за аналогічних умов. Потім вміст лунок двічі відмивали від залишків барвника з використанням 0,14 М NaCl (500 g, 15 хв). До отриманого осаду клітин додавали 0,12 мл 2,0 М КОН і 0,14 мл generic cialis online 50% розчину ДМСО.
Облік реакції як у НСТ-, так і у МТТ-тестах здійснювали за допомогою автоматичного мікропланшетного фотометра «MicroELISA reader» (США), вимірюючи оптичну густину вмісту лунок у першому випадку при довжині хвилі 630 нм, а в другому — при 540 нм. Результати вимірювань виражали в умовних оптичних одиницях (о.о.). Усі проби були взяті тричі. Цитолітичну активність (ЦЛА) МНЛ зазвичай виражають цитолітичним індексом (ЦІ) у відсотках, який розраховують за формулою:
ЦІ = (А + В — С) : (А + В) • 100%,
де А, В, С — значення оптичної густини в лунках з КЕ, КМ та КЕ + КМ відповідно. Проте ми вважали за доцільне оцінювати отримані в цих тестах ефекти через обчислення так званого індексу модуляції (ІМ) за формулою:
ІМ = (Д — К) : К • 100%,
де К і Д — оптична густина контрольних або дослідних зразків відповідно [1].
В експериментах із вивчення дії аргінази на метаболічну активність клітин лейкозу L1210 короткочасне культивування ПК проводили безпосередньо в круглодонних лунках стандартного планшета для імунологічних досліджень, використовуючи живильне середовище RPMI 1640 («Biowest», США), з додаванням 10% ЕТС, у вологій атмосфері 5,0% СО2. Загальний об’єм проби дорівнював 0,2 мл на лунку.
Електрокінетичний, або ζ-потенціал, обчислювали, виходячи з рівняння М. Смолуховського. У нього підставляли значення лінійної швидкості руху клітин в електричному полі. Цю швидкість вимірювали за допомогою приладу, в якому клітини, суспендовані у спеціальному K/Na-фосфатному буфері (його pH у цьому випадку становив 7,0), рухалися всередині плоскостінного кварцового капіляра. Завдяки цьому усувалися сторонні механічні впливи на характер руху клітин та ставало можливим використання мікрооб’ємів досліджуваного матеріалу [2–4].
Відстань між платиновими електродами приладу становила 5 см, градієнт напруженості електричного поля Е досягав 20 В/см, оскільки до електродів прикладали напругу 100 В. Рівняння М. Смолуховського, адаптоване до біологічних об’єктів та автоматично — до фізіологічних значень фізико-хімічних параметрів, має вигляд:
ζ = 14U,
де U — так звана електрофоретична рухомість, виражена у позасистемних одиницях як відношення лінійної швидкості руху клітин V в електричному полі, визначеної експериментально (мкм/с), до градієнту напруженості поля (В/см) [2–4].
Напрямок руху клітин під дією зовнішнього електричного поля з певними параметрами в бік катода чи анода давав можливість визначити знак сумарного заряду клітин; його поверхневу щільність (q) обчислювали згідно з рівнянням Квінке — Гельмгольца:
qδ = ζεа,
де δ — товщина подвійного електричного шару, а εа — абсолютна діелектрична проникність [2, 3]. Клітинний електрофорез виконували в K-Na-фосфатному буфері при pH 7,0.
Результати та їх обговорення
Як свідчать результати, відтворені на рис. 1, інгібітори рівня поліамінів в організмі, як-от α-ДФМО і МГБГ, викликали потужну стимуляцію метаболічної активності ПМФ мишей із перещепленим лімфолейкозом L1210 (на 181,5 та 120,4% відповідно).
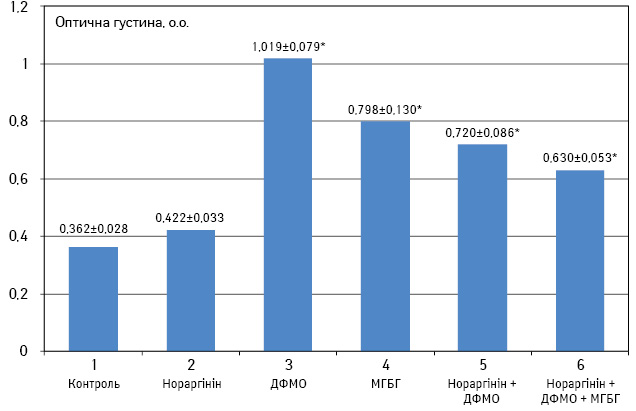
Інгібітор ферменту аргінази — нораргінін — практично не вплинув на метаболічну активність макрофагів пухлиноносіїв, що саме собою дуже цікаво і заслуговує на поглиблене вивчення.
Сумісна дія нораргініну і α-ДФМО стимулювала метаболізм ПМФ на 98,9%, а дія нораргініну, α-ДФМО і МГБГ — на 59,4%.
На рис. 2 наведено результати дослідження впливу інгібіторів рівня поліамінів на здатність МНЛ селезінки мишей з перещепленим лімфолейкозом лізувати ПК. Ми бачимо статистично вірогідне зниження цитолітичної активності відносно контролю у варіантах, коли тварини дослідних груп отримували ін’єкції α-ДФМО або МГБГ (дані позначено зірочками). Це доволі цікавий факт, тому що він певним чином корелює з результатами, представленими на рис. 1, демонструючи зворотний зв’язок із ними. Так, α-ДФМО підвищує метаболічну, а власне, — функціональну активність ПМФ мишей-пухлиноносіїв майже втричі (на 181,5%), тоді як цитолітичну активність МНЛ селезінки тих самих тварин-пухлиноносіїв він знижує на 67%. І, відповідно, МГБГ стимулює метаболічну активність ПМФ дещо меншою мірою (на 120,4%), проте ще менше він інгібує цитолітичну активність МНЛ (індекс модуляції — 38%). Чи не може це свідчити про те, що штучне зниження рівня поліамінів в ураженому лейкозом організмі зміщує акцент імунної відповіді на клітинному рівні саме на користь фагоцитозу, однак за рахунок функціональних можливостей принаймні деяких пулів клітин лімфоцитарного ряду? Це, у свою чергу, може означати, що інгібітори рівня поліамінів виявляться корисними при терапії експериментальних лейкозів тільки на початкових стадіях розвитку пухлинної патології, в той час як на більш пізніх етапах можуть навіть завадити лікуванню.
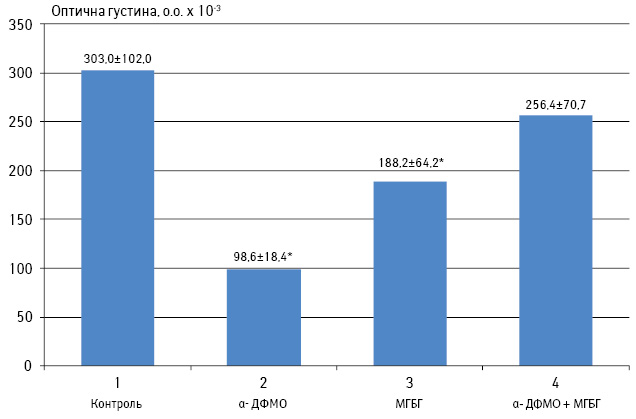
Частковим підтвердженням такої думки можуть стати дані табл. 1. Тут ми також бачимо зниження метаболічної активності під впливом α-ДФМО та МГБГ, проте уже безпосередньо в клітинах лейкозу L1210. Залишається припустити, що на тлі штучного зниження рівня поліамінів більш ефективними захисниками організму виявляться саме макрофаги. Але ще цікавішим є той факт, що спільна інгібуюча дія α-ДФМО та МГБГ є ефективнішою стосовно метаболічної активності ПК, аніж цитолітичної активності МНЛ селезінки мишей з пухлиною. Це може дати надію на успішність експериментальної терапії лейкозу саме комбінацією цих сполук на пізніх етапах розвитку пухлинної хвороби.
Таблиця 1. Вплив інгібіторів обміну поліамінів, застосованих окремо чи в комбінації в експериментах in vivo, на спонтанну метаболічну активність клітин лімфоцитарного лейкозу L1210 (10 діб росту), визначену в НСТ-тесті
| Варіант | Показання рідера, о.о. ×10 | Індекс модуляції, % |
| Контроль | 864,0±0,72 | 0 |
| ДФМО | 398,0±0,24* | −54,0 |
| МГБГ | 476,0±0,38* | −45,0 |
| α-ДФМО + МГБГ | 303,0±0,19* | −65,0 |
*р≤0,05 порівняно з контролем.
Табл. 2 демонструє результати вивчення ефекту штучного зниження рівня аргініну в первинній культурі ПК експериментального лейкозу L1210. До експериментальних проб додавали по 2; 4 та 6 мкл розчину ферменту, що, з огляду на концентрацію вихідного розчину, дало значення активності аргінази (Arg), наведені у табл. 2. Внесена безпосередньо до лунок планшета, де протягом доби культивувалися лейкозні клітини, аргіназа (Arg) у всіх застосованих концентраціях вірогідно знизила здатність ПК відновлювати нітросиній тетразолій. При цьому визначено оптимальну in vitro концентрацію Arg — 3,0 од./мл.
Таблиця 2. Вплив аргінази на спонтанну метаболічну активність клітин лімфоцитарного лейкозу L1210 in vitro, визначену в НСТ-тесті
| Варіант | Показання рідера, о.о. ×10 | Індекс модуляції, % |
| Контроль | 758,0±0,76 | 0 |
| Arg 1,5 од./мл | 265,3±0,27* | −65,0 |
| Arg 3,0 од./мл | 250,1±0,25* | −67,0 |
| Arg 4,5 од./мл | 246,4±0,18* | −67,5 |
*р≤0,05 порівняно з контролем.
Ефект виявляється доволі потужним, тому інтерпретувати його результати треба досить обережно — до виконання додаткових досліджень. Зараз можемо відмітити, що вибір впливу саме на рівень аргініну при проведенні експериментальної терапії лейкозу виявився слушним і стратегічно обґрунтованим.
Усі досліджувані клітини у всіх варіантах впливу інгібіторів обміну поліамінів продемонстрували в наших експериментах позитивний сумарний поверхневий заряд, характерний для багатьох живих клітин саме при значеннях pH 7,0. Розподіл ПК за значенням ζ-потенціалу подано на рис. 3, ПМФ — на рис. 4. Частотний розподіл має практично одномодальний характер, притаманний живим неушкодженим клітинам [2, 3].
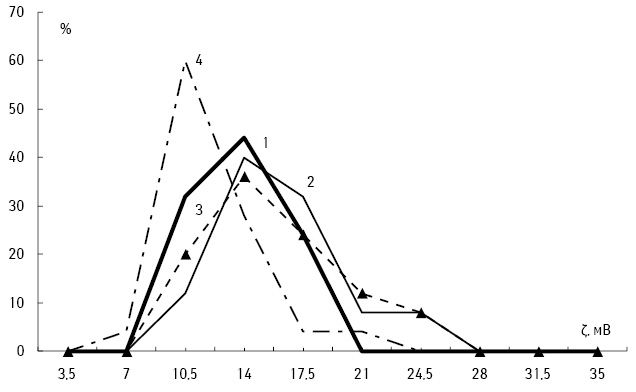
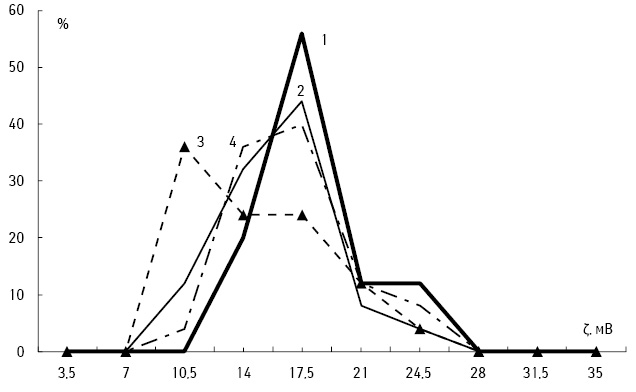
Показано вірогідну відмінність, з якою реагували на серію ін’єкцій α-ДФМО, МГБГ та їх комбінації (ДФМО + МГБГ) тестовані клітини піддослідних тварин. Так, ПК, отримані у тварин, 6-разово ін’єктованих ДФМО протягом 10 діб після перещеплення пухлин, продемонстрували підвищення ζ-потенціалу на 17,9%. Значення його досягло 14,11±0,92 мВ порівняно з 11,97±0,72 мВ у контрольних мишей з лейкозом, яким вводили плацебо — фізіологічний розчин (табл. 3). Водночас вплив ін’єкцій ДФМО викликав вірогідне зниження ζ-потенціалу ПМФ тварин-пухлиноносіїв на 12,7%: він зменшився до 14,01±0,97 мВ проти 16,05±0,94 мВ у контролі (табл. 4).
Таблиця 3. Вплив інгібіторів синтезу поліамінів, застосованих окремо чи в комбінації в експериментах in vivo, на електрокінетичні характеристики клітин лімфоцитарного лейкозу L1210
| Параметри | Контроль | Ін’єкції | ||
| ДФМО | МГБГ | ДФМО + МГБГ | ||
| ζ-потенціал, мВ | 11,97±0,72 | 14,11±0,92* | 13,88±1,48 | 10,70±1,06 |
| q, ×10 Кл/м | 8,58±0,52 | 10,12±0,66* | 9,95±0,95 | 7,67±0,76 |
*р≤0,05 порівняно з контролем.
Таблиця 4. Вплив інгібіторів синтезу поліамінів, застосованих окремо чи в комбінації в експериментах in vivo, на електрокінетичні характеристики ПМФ мишей з лімфоцитарним лейкозом L1210
| Параметри | Контроль | Ін’єкції | ||
| ДФМО | МГБГ | ДФМО + МГБГ | ||
| ζ-потенціал, мВ | 16,05±0,94 | 14,01±0,97* | 12,98±1,18* | 15,23±1,35 |
| q, ×10 Кл/м | 11,51±0,68 | 10,05±0,70* | 9,31±0,85* | 10,92±0,97 |
*р≤0,05 порівняно з контролем.
На особливу увагу заслуговує і сам факт кількісних відмінностей як у щільності сумарного поверхневого заряду (q), так і у прямо пов’язаному з нею ζ-потенціалі ПК і ПМФ; обидва типи об’єктів мали за наших умов інкубування позитивний заряд, проте у ПК ці показники були на 25,4% нижчими, ніж у макрофагів. Це вказує на принципову можливість електрофоретичного відокремлення клітин асцитного лейкозу від ПМФ.
Введення тваринам МГБГ протягом росту перещепленої пухлини викликало аналогічну дію: значення як ζ, так і q у ПК зростали, а у ПМФ — знижувалися, демонструючи протилежну спрямованість впливу на них інгібіторів обміну поліамінів. Але комбінація цих інгібіторів (ДФМО + МГБГ) нівелювала досягнутий ефект, повертаючи досліджувані параметри на контрольний рівень (див. табл. 3, 4). Зазначену обставину треба брати до уваги при плануванні експериментів, оскільки не можна виключити конкурентні механізми дії ДФМО і МГБГ.
Висновки
З наших даних випливає, що штучне зниження рівня поліамінів в generic cialis united states організмі мишей, уражених асцитним лімфоцитарним лейкозом L1210, стимулює макрофагальні клітини, зокрема їх метаболічну, а отже, і функціональну активність. Водночас дія інгібітору аргінази нораргініну перешкоджає вказаній стимуляції.
Для пояснення цього можна припустити, що в організмі з пригніченою активністю аргінази накопичується надлишок аргініну, достатній для того, щоб певним чином компенсувати дефіцит поліамінів, викликаний дією α-ДФМО та МГБГ, оскільки саме аргінін є попередником утворення орнітину та надалі — власне поліамінів. Також не виключено, що нораргінін прямо конкурує з інгібіторами рівня поліамінів за специфічні рецептори зв’язування на поверхневій мембрані макрофагів.
Дія власне нораргініну ніяк не позначається на метаболічній активності ПМФ тварин, уражених лімфолейкозом. Це вельми цікавий факт, тому що нораргінін, блокуючи утворення орнітину з аргініну, також має викликати зниження загального рівня поліамінів. Як наслідок, він мав би стимулювати метаболічну активність макрофагів, подібно до α-ДФМО та МГБГ, проте таких фактів не зафіксовано.
Продемонстровано, що інгібітори рівня поліамінів діють у протифазі відносно метаболічної активності макрофагів, значно її підвищуючи,
та цитолітичної активності МНЛ селезінки лейкозних тварин, відповідно знижуючи її.
Цей вельми цікавий феномен треба враховувати, розробляючи тактику лікування при лейкозах в експерименті. Перспективним, безумовно, є застосування комбінації α-ДФМО та МГБГ, принаймні — з огляду на вірогідне зниження метаболічної активності ПК внаслідок дії цієї комбінації.
Нами встановлено, що застосування аргінази в тест-системі in vitro викликає значне зниження метаболічної активності короткочасно культивованих клітин лімфоцитарного лейкозу мишей L1210.
Зазначене явище можна пояснити дефіцитом аргініну, який виникає при дії аргінази в обмеженому об’ємі живильної суміші, що міститься в лунках використаного в цих експериментах планшета.
Зареєстрована в експериментах кількісна різниця в значеннях ζ-потенціалу і щільності сумарного поверхневого заряду власне лейкозних клітин і ПМФ мишей з асцитною лімфоцитарною лейкемією L1210 дає теоретичне підґрунтя для розробки методу їх електрофоретичного розділення.
Встановлено, що інгібітори синтезу поліамінів — α-ДФМО та МГБГ, застосовані окремо у вигляді ін’єкцій тваринам протягом росту у них перещепленого асцитного лейкозу, вірогідно збільшують ζ-потенціал і щільність сумарного поверхневого заряду ПК у дисперсійному середовищі зі значенням pH 7,0. За аналогічних умов і α-ДФМО, і МГБГ вірогідно знижують вказані електрокінетичні параметри ПМФ мишей з асцитним лейкозом L1210, демонструючи протилежну спрямованість дії інгібіторів рівня поліамінів, принаймні в цьому сенсі, на злоякісно трансформовані лімфоцити та макрофаги хворих тварин.
Таким чином, показана зворотна кореляція між ζ-потенціалом, щільністю сумарного поверхневого заряду та метаболічною активністю як клітин лейкозу, так і клітин макрофагального ряду ураженого лейкозом організму. Пошук чинників, що зможуть викликати інверсію знака сумарного поверхневого заряду макрофагів, або умов застосування таких факторів можна вважати одним із перспективних напрямів подальших досліджень.
Комбінований вплив ДФМО та МГБГ повертає щільність сумарного поверхневого заряду і лейкозних клітин, і ПМФ тварин-пухлиноносіїв до контрольних значень, що не виключає наявності конкурентних механізмів дії даних інгібіторів обміну поліамінів.
Список використаної літератури
1. Гриневич Ю.А., Храновская Н.Н. (2007) Вакцины на основе антигенпрезентирующих дендритных клеток в иммунотерапии больных со злокачественными опухолями. Онкология, 9 (4): 365–370.
2. Garmanchouk L.V., Pyascovskaya O.N., Yanish Yu. et al. (2005) Influence of aconitin-containing herbal extract BC 1 on proliferative and electrocinetic characteristics of endothelial cells. Exp. Oncol., 27 (4): 262–266.
3. Lukianova N.Yu., Naleskina L.A., Bezdenezhnykh N.O. et al. (2013) Reactive changes of cytophysiological properties, molecular-biological profile and functional metabolic status of cells in vitro with different sensitivity to cytostatic agents under the influence of magnetic fluid. Cancer Res. J., 1(1): 7–14.
4. Yanish Yu.V., Artamonova A.B., Shlyakhovenko V.A. (2013) Glycopeptide vaccine on DNA-histone carrier and its impact on ζ-potential of effector cells during experimental treatment of lymphoblastic leukemia. Exp. Oncol., 35(3): 198–201.
Влияние модуляторов уровня аргинина и полиаминов на метаболическую активность макрофагов, цитолитическую активность спленоцитов и их электрокинетические свойства у мышей с лейкозом L1210
Институт экспериментальной патологии, онкологии и радиобиологии им. Р.Е. Кавецкого НАН Украины, Киев
Институт биологии клетки НАН Украины, Львов
Резюме. Показано, что ингибиторы уровня полиаминов значительно повышают метаболическую активность макрофагов и одновременно снижают цитолитическую активность спленоцитов животных с экспериментальным лейкозом. Аргиназа угнетает метаболическую активность клеток лейкоза L1210 in vitro. Между ζ-потенциалом и метаболической активностью лейкозных клеток и макрофагов опухоленосителя существует обратная корреляция.
лейкоз, полиамины, макрофаги, спленоциты, ζ-потенциал.
Адреса:
Яніш Юрій Вадимович
03022, Київ, вул. Васильківська, 45
Інститут експериментальної патології, онкології і радіобіології
ім. Р.Є. Кавецького НАН України
Тел.: (044) 259-91-95














Leave a comment