Оцінка асоціації клініко-патологічних особливостей пухлинного процесу з результатами клініко-генеалогічного обстеження хворих на рак яєчника та грудної залози — носіїв мутації 5382insC у гені BRCA1
Палійчук О.В. 1, Россоха З.І. 2, Галкін Ф.М.3, Поліщук Л.З. 1
- 1Інститут експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького НАН України, Київ
- 2ДУ «Референс-центр з молекулярної діагностики МОЗ України», Київ
- 3КЗ «Черкаський обласний онкологічний диспансер» Черкаської обласної ради
Резюме. Проведено комплексні клініко-патологічні, клініко-генеалогічні, патоморфологічні, молекулярно-генетичні дослідження у 23 хворих на рак яєчника (РЯ) І–ІV стадії (за FIGO) і 21 пацієнтки з раком грудної залози (РГЗ) І–ІІ стадії (за TNM). Здійснено аналіз геномної ДНК периферичної крові (до початку лікування) для визначення мутацій 185delAG та 5382insC у гені BRCA1, мутації 6174delT у гені BRCA2. Контролем слугували результати клінічного та молекулярно-генетичного дослідження ДНК периферичної крові 55 здорових жінок без пухлинної патології в анамнезі. Видалені пухлини проаналізовано за гістологічним типом, ступенем диференціювання. У хворих на РГЗ визначали молекулярний підтип утворення шляхом імуногістохімічного дослідження експресії гормональних рецепторів до естрогену (ER) і прогестерону (PR) та епідермального фактора росту пухлин II типу (HER2/neu). Результати показали, що у пацієнток із РЯ та РГЗ із родин з агрегацією пухлинної патології достовірних відмінностей репродуктивно-менструальної функції не виявлено. У геномній ДНК периферичної крові відзначено лише мутацію 5382insC у гені BRCA1. На підставі одержаних результатів проаналізовано клінічні, клініко-патоморфологічні характеристики пухлин та їхній зв’язок із результатами клініко-генеалогічного та молекулярно-генетичного досліджень індивідуально у кожної хворої, в якої визначено мутації в гені BRCA1. Ця мутація виявлена у 3 (13%) із 23 пацієнток із серозним РЯ і 4 (19%) хворих на інфільтративний протоковий РГЗ люмінального молекулярного підтипу. В обох групах обстежених було більше хворих на рак родичів по материнській, ніж по батьківській лінії. У жінок контрольної групи мутацій у генах BRCA1 та BRCA2 не визначено. Підтверджено асоціацію мутації 5382insC у гені BRCA1 з розвитком спадкового синдрому РЯ/РГЗ і первинно-множинних пухлин органів жіночої репродуктивної системи.
Вступ
Питання щодо клініко-патологічних і молекулярних особливостей раку яєчника (РЯ) і раку грудної залози (РГЗ) та їхнє значення для встановлення клініко-патологічних ознак пухлин та оцінки прогнозу перебігу онкологічної хвороби не втрачають актуальності. Це зумовлено високою захворюваністю на РЯ та РГЗ, остаточно невизначеними патогенетичними механізмами і труднощами ранньої діагностики РЯ, неточною оцінкою індивідуального прогнозу РЯ та РГЗ попри активні пошуки нових цитостатичних препаратів і впровадження у клінічну практику нових схем лікування хворих [1–6]. Однак завдяки розвитку молекулярно-біологічних технологій та їх застосуванню в онкологічній практиці доведено, що особливості пухлинних процесів асоційовані з молекулярно-генетичними змінами пухлинних клітин, які у свою чергу визначають індивідуальну біологічну гетерогенність новоутворень. У цьому контексті привертають до себе увагу мутації в генах-супресорах BRCA1 та BRCA2. Встановлено, що вони належать до генів схильності виникнення раку [7–9], хоча у нормі ці гени відіграють важливу роль у репарації порушень ДНК і підтримці стабільності геному, виконуючи роль супресорів пухлинного росту у багатьох біологічних тканинах. Проте мутації в цих генах сприяють втраті супресорної функції, що призводить до порушень мітотичного циклу і транскрипційних механізмів клітин [10]. Завдяки розвитку молекулярно-генетичних досліджень та їхньому впровадженню у клінічну практику визначено роль мутацій у генах BRCA1 та BRCA2 щодо схильності до розвитку раку органів жіночої репродуктивної системи (ОЖРС), кишечнику та інших органів. Гермінальні мутації у високопенетрантних генах, до яких належать гени BRCA1 та BRCA2, можуть викликати спадкові форми неоплазій, у тому числі первинно-множинну патологію у декількох поколіннях. Найбільш часто виявляють мажорні, тобто домінантні за частотою, мутації 185delАG і 5382insC у гені BRCA1 та мутацію 6174delТ у гені BRCA2 [11–15]. Однак даних про зв’язок вказаних мутацій у генах BRCA1 та BRCA2 із клініко-патологічними особливостями пухлинного процесу та результатами клініко-генеалогічного обстеження хворих із первинно-множинною пухлинною патологією недостатньо.
Мета дослідження: визначити мутації в генах BRCA1 та BRCA2 у хворих на РЯ та РГЗ і провести аналіз їх асоціації з клініко-патологічними особливостями раку ОЖРС.
Об’єкт і методи дослідження
У дослідження залучено 23 хворих на РЯ І–IV стадії та 21 пацієнтку з РГЗ І–ІІ стадії, у родоводах яких були хворі в основному на рак ОЖРС. Аналізували результати клінічного і клініко-генеалогічного обстеження хворих і жінок контрольної групи (55 практично здорових жінок без онкологічної патології та без хворих на рак родичів у родоводах) за клініко-генеалогічними картами, в яких відображали родовід, кількість хворих на рак родичів, перенесені хвороби, стан здоров’я. Розповсюдженість пухлинного процесу визначали за класифікацією FIGO у пацієнток із РЯ та класифікацією TNM — у хворих на РГЗ. Проведено хірургічне, комплексне і комбіноване лікування у Черкаському обласному онкологічному диспансері за стандартами лікування, прийнятими в Україні, відповідно до стадії та гістологічної структури пухлин. Видалені утворення аналізували за гістологічним типом, ступенем диференціювання. У хворих на РГЗ визначали молекулярний підтип пухлин шляхом імуногістохімічного дослідження експресії гормональних рецепторів до естрогену (estrogen receptor — ER) та прогестерону (progesterone receptor — PR) і епідермального фактора росту пухлин II типу (human epidermal growth factor receptor-2 — HER2/neu) із застосуванням моноклональних антитіл фірми «DakoCytomation», Данія (відповідно клони 1D5, PgR636, c-erbB2). У хворих і жінок контрольної групи проведено молекулярно-генетичне дослідження геномної ДНК периферичної крові на наявність мутацій 185delAG та 5382insC у гені BRCA1, мутації 6174delT у гені BRCA2. Зразки крові для молекулярно-генетичного дослідження брали до початку лікування.
Молекулярно-генетичні дослідження периферичної крові проводили з дотриманням алгоритму: виділення ДНК із лейкоцитів периферичної крові, ампліфікація досліджуваних фрагментів ДНК, електрофоретичний розподіл ампліфікаційних фрагментів або аналіз рестрикційних фрагментів у агарозному гелі. На першому етапі такого дослідження проводили виділення сумарної чи загальної геномної ДНК із лейкоцитів периферичної крові зі 100 мкл крові. Для цього використовували стандартний комерційний набір із сорбентом, принцип дії якого полягає в тому, що після попереднього лізису клітин крові вивільнена ДНК фіксується на сорбенті. Це полегшує процес виділення та зменшує її втрати при подальшому очищенні. Після фіксації на сорбенті ДНК відмивали спеціальними розчинами для отримання очищеної ДНК із мінімальними домішками.
На другому етапі молекулярно-генетичного дослідження збільшували кількість копій досліджуваних фрагментів генів для того, щоб зробити можливим подальше визначення делеційного варіанта чи однонуклеотидної заміни. Для збільшення кількості копій фрагмента досліджуваної ДНК використовували полімеразну ланцюгову реакцію (ПЛР). При проведенні ПЛР відбувається синтез комплементарних ланцюгів досліджуваного фрагмента ДНК у штучних умовах, що досягається завдяки оптимальним температурним умовам та оптимальному співвідношенню реагентів у пробірці.
Для дослідження поліморфізму генів BRCA1 та BRCA2 використовували мультиплексну ПЛР (ампліфікацію). У генах BRCA1 та BRCA2 проводили ідентифікацію трьох мутацій (185delAG і 5382insC — у BRCA1 та 6174delT — у BRCA2). При аналізі мутацій у цих генах, на відміну від інших генів, наприклад GSTT1 та GSTM1, відбувається ампліфікація як мутантного алеля, так і алеля «дикого» типу. Отримані амплікони мають різну молекулярну масу, тому можуть бути розділені методом горизонтального електрофорезу в агарозному гелі. На третьому етапі молекулярно-генетичного дослідження проводили рестрикційний аналіз продуктів ПЛР та аналіз розподілу досліджуваних фрагментів у 1,5% агарозному гелі шляхом горизонтального електрофорезу.
Після лікування хворі на РЯ та РГЗ підлягали диспансерному спостереженню. Усі пацієнтки і жінки контрольної групи є українками і тривалий період проживали у Черкаській області.
Результати та їх обговорення
Загальні відомості стосовно віку, стану менструальної функції, операцій (за даними анамнезу) у хворих на РЯ та РГЗ, а також у жінок групи контролю представлено у табл. 1. Як видно, вік хворих на РЯ і РГЗ коливався в однаковому діапазоні (29–62 і 27–63 роки відповідно). Слід відзначити, що у 30,4% пацієнток із РЯ вік менархе перевищував 15 років, тоді як у хворих на РГЗ (81,0%) і жінок контрольної групи (63,6%) менструації найчастіше починалися в період 12–15 років. За репродуктивним статусом хворих і кількістю операцій на ОЖРС за даними анамнезу достовірних змін не встановлено (р>0,05).
Таблиця 1. Загальні відомості про вікові особливості та стан оваріально-менструальної функції у хворих на РЯ та РГЗ
| Показники | РЯ, n (%) (N=23) | РГЗ, n (%) (N=21) |
Контрольна група, n (%) (N=55) |
||||
| Коливання віку, років | 29–62 | 27–63 | 19–65 | ||||
| Вік | до 35 років | 23 | 5 (21,7) | 21 | 5 (23,8) | 55 | 20 (36,4) |
| 36–49 років | 5 (21,7) | 5 (23,8) | 20 (36,4) | ||||
| старше 50 років | 13 (56,6) | 11 (52,4) | 15 (27,2) | ||||
| Менархе | до 12 років | 23 | 6 (26,1) | 21 | 4 (19,0) | 55 | 20 (36,4) |
| 12–15 років | 10 (43,5) | 17 (81,0) | 35 (63,6) | ||||
| старше 15 років | 7 (30,4) | 0 | 0 | ||||
| Кількість пологів | 0 | 23 | 0 | 21 | 0 | 55 | 20 (36,4) |
| 1–2 | 3 (13,0) | 2 (9,5) | 20 (36,4) | ||||
| ≥3 | 20 (87,0) | 19 (90,5) | 15 (27,2) | ||||
| Кількість абортів | 0 | 23 | 18 (78,3) | 21 | 16 (76,2) | 55 | 0 |
| 1–3 | 5 (21,7) | 5 (23,8) | 0 | ||||
| Кількість викиднів | не було | 23 | 22 (95,7) | 21 | 21 (100,0) | 55 | 0 |
| 1–2 | 1 (4,3) | 0 | 0 | ||||
| ≥3 | 0 | 0 | 0 | ||||
| Кількість днів менструації | до 3 | 23 | 0 | 21 | 9 (42,9) | 55 | 0 |
| 4–6 | 20 (87,0) | 12 (57,1) | 55 (100,0) | ||||
| ≥7 | 3 (13,0) | 0 | 0 | ||||
| Регулярність менструального циклу | регулярний(24–32 дні) | 23 | 20 (87,0) | 21 | 19 (90,5) | 55 | 55 (100,0) |
| нерегулярний | 3 (13,0) | 2 (9,5) | 0 | ||||
| Mенопаузa (n=32) | до 5 років | 8 | 4 (50,0) | 9 | 4 (44,4) | 15 | 5 (33,3) |
| 5–10 років | 4 (50,0) | 3 (33,3) | 5 (33,3) | ||||
| більше 10 років | 0 | 2 (22,2) | 5 (33,3) | ||||
| Операції на ОЖРС в анамнезі | не було (n=38) | 23 | 20 (87,0) | 21 | 18 (85,6) | 55 | 0 |
| На придатках матки (n=4) | 3 (13,0) | 1 (4,8) | 0 | ||||
| на грудній залозі (n=2) | 0 | 2 (9,6) | 0 | ||||
Розподіл хворих за стадіями подано на рис. 1, згідно з яким у пацієнток переважав РЯ І і ІІІ стадії та РГЗ І–ІІ стадії. Відповідно до розповсюдженості пухлинного процесу і результатів морфологічного дослідження видалених пухлин проводили терапію згідно зі стандартами лікування онкологічних хворих, прийнятими в Україні. Не конкретизуючи показання до лікування, наводимо загальні дані про методи терапії обстежених хворих — хірургічний, комбінований і комплексний (табл. 2). Як свідчать наведені дані, у більшості хворих на РЯ та РГЗ проводили комплексне лікування.
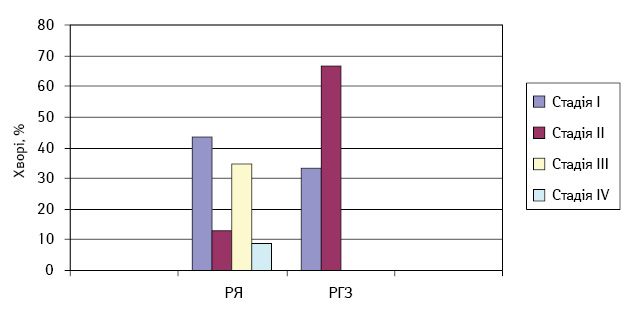
Рис. 1. Розподіл хворих на РЯ та РГЗ за розповсюдженістю пухлинного процесу (відповідно до FIGO та TNM класифікації)
Таблиця 2. Загальна характеристика методів лікування обстежених хворих на РЯ та РГЗ
| Методи лікування | РЯ І–ІV стадії, n (%) (N=23) | РМЗ І–ІІ стадії, n (%) (N=21) | |
| Хірургічний метод | 1 (4,3) | 3 (14,3) | |
| Комбінований | Хірургічний + променева терапія в ад’ювантному режимі | 0 | 5 (23,8) |
| Хірургічний + ПХТ в ад’ювантному режимі | 20 (87,0) | 10 (47,6) | |
| Комплексний | Хірургічний + променева терапія та ПХТ в ад’ювантному режимі | 2 (8,7) | 3 (14,3) |
ПХТ — поліхіміотерапія.
Аналіз клініко-генеалогічних даних показав, що у родоводах жінок контрольної групи злоякісні пухлини не діагностовано. Натомість у родоводах пацієнток із РЯ і РГЗ було 80 родичів І та ІІ ступеня спорідненості, які хворіли на рак. Як свідчать дані табл. 3, кількість хворих на рак родичів І ступеня спорідненості становила 33 (41,2%), ІІ ступеня спорідненості — 47 (58,8%). В обох групах обстежених нами пацієнток більше було хворих на рак родичів по материнській, ніж по батьківській лінії.
Таблиця 3. Розподіл хворих на рак родичів у родоводах пацієнток із РЯ і РГЗ
| Клініко-генеалогічні дані родоводів |
Кількість пацієнток із РЯ і РГЗ залежно від ступеня спорідненості родичів, які хворіли на рак |
||
|
РЯ, n (%) (N=23) |
РГЗ, n (%) (N=21) |
||
| Кількість хворих на рак родичів І ступеня спорідненості, n=33 (100%) | Материнська лінія, n=22 (64,5%) | 12 (47,8) | 10 (42,8) |
| Батьківська лінія n=11 (35,5%) | 6 (26,1) | 5 (23,8) | |
| Кількість хворих на рак родичів ІI ступеня спорідненості, n=47 (100%) | Материнська лінія n=35 (74,5%) | 21 (91,3) | 14 (66,7) |
| Батьківська лінія n=12 (25,5%) | 6 (21,7) | 6 (23,8) | |
Гістологічну структуру пухлин і ступінь диференціювання раку подано в табл. 4, з якої видно, що у хворих на РЯ переважав серозний папілярний рак (56,5%), хоча і кількість пухлин залозистої структури була велика (43,5%). У пацієнток із РГЗ 90,5% становив інфільтративний протоковий рак. У хворих на РЯ та РГЗ переважав високий ступінь диференціювання пухлин — 47,8 та 47,6%.
Таблиця 4. Гістологічні особливості пухлинного процесу у хворих на РЯ та РГЗ
| Гістологічні особливості пухлин |
РЯ, n (%) (N=23) |
РГЗ, n (%) (N=21) |
| Морфологія пухлин | ||
| Серозний папілярний рак | 13 (56,5) | − |
| Аденокарцинома | 10 (43,5) | 2 (9,5) |
| Інфільтративний протоковий рак | − | 19 (90,5) |
| Ступінь диференціювання пухлин | ||
| G1 (високий) | 11 (47,8) | 10 (47,6) |
| G2 (помірний) | 4 (17,4) | 4 (19,1) |
| G3 (низький) | 8 (34,8) | 7 (33,3) |
Проведене імуногістохімічне дослідження пухлин у хворих на РГЗ дозволило визначити експресію ER, PR і HER2/neu та встановити молекулярний підтип раку. Як видно з табл. 5, 42,9% пухлин мали люмінальний А підтип, 33,3% — люмінальний В підтип, 23,8% — базальний підтип (тричі рецептор-негативний). HER2/neu-позитивний молекулярний підтип у нашому дослідженні не детектовано. Кількісний розподіл молекулярних підтипів РГЗ відповідає даним літератури.
Таблиця 5. Молекулярні підтипи РГЗ (за даними імуногістохімічного дослідження пухлин)
| Молекулярні підтипи | Рецептори | Кількість хворих (N=21) | |||
| ER | PR | HER2/neu | n | % | |
| Люмінальний А | + | + | – | 9 | 42,9 |
| Люмінальний В | + | + | + | 7 | 33,3 |
| Базальний (тричі рецептор-негативний) | – | – | – | 5 | 23,8 |
| HER2/neu-позитивний | – | – | – | 0 | 0 |
Примітка: «+» — позитивна експресія рецепторів, «–» — відсутність експресії рецепторів.
На підставі одержаних результатів нами проаналізовано клінічні, клініко-патоморфологічні характеристики пухлин та їх зв’язок із результатами клініко-генеалогічного та молекулярно-генетичного досліджень індивідуально у кожної хворої, в якої визначено мутації в гені BRCA1 (табл. 6). Вік пацієнток із РЯ був у діапазоні 48–51 років. Розповсюдженість пухлинного процесу у хворих на РЯ відповідала стадії рT3СN0M0. Морфологічне дослідження встановило, що пухлини яєчника мали гістологічну будову серозного папілярного раку і серозної аденокарциноми з низьким ступенем диференціювання (G3). Вік пацієнток із РГЗ коливався від 31 до 46 років, а розповсюдженість пухлинного процесу характеризувалася як pT1N0M0 (n=3) і pT2bN0M0 стадії (n=1). Гістологічна будова пухлин відповідала інфільтративному протоковому РГЗ різного ступеня диференціювання (G1, G2, G3), люмінальному А і В молекулярним підтипам.
Враховуючи дані літератури про значення мутацій у генах BRCA1 (5382insC, 185delAG)
та BRCA2 (6174delT) у схильності до розвитку РЯ та РГЗ, нами проведено молекулярно-генетичні дослідження у хворих на РГЗ і РЯ та у 55 практично здорових жінок (контрольна група), зіставних за віком і менструальним статусом із пацієнтками з пухлинною хворобою. Результати такого дослідження показали, що у хворих на РЯ і РГЗ ідентифіковано 7 мутацій 5382insC у гені BRCA1. Такі мутації були у 3 (13,0%) із 23 пацієнток із РЯ, у 4 (19,0%) з 21 хворої на РГЗ. Мутацій 6174delT у гені BRCA2 та 185delAG у гені BRCA1 не виявлено в жодної хворої. У жінок контрольної групи мутацій у генах BRCA1 та BRCA2 не визначено. Індивідуальний порівняльний аналіз результатів комплексного клінічного, клініко-генеалогічного, патоморфологічного та молекулярно-генетичного досліджень проведено у 7 носіїв мутації 5382insC у гені BRCA1 (табл. 6).
Таблиця 6. Індивідуальний порівняльний аналіз результатів комплексного обстеження хворих на РЯ та РГЗ — носіїв мутації 5382insC у гені BRCA1
| Ген BRCA1 | ||||
| Мутація 5382insC | ||||
| Клінічний діагноз, вік виявлення раку | Стадія | Гістологічний діагноз | G | Клініко-генеалогічні дані родоводів |
| № 1. РЯ, 48 років | pT3СN0M0 | Серозний папілярний рак | G3 | Рак товстої кишки у матері та бабусі (по материнській лінії) Рак легені у діда та дядька по батьківській лінії |
| № 2. РЯ, 51 рік | pT3СN0M0 | Серозний папілярний рак | G3 | Рак щитоподібної залози у матері РГЗ у тітки по материнській лінії |
| № 3. РЯ, 48 років РГЗ, 50 років | pT3СN0M0 рT1N0M0 |
Серозна аденокарцинома яєчника Інфільтративний протоковий рак |
G3G2 | РЯ у матері |
| № 4. РГЗ, 46 років | pT1N0M0 | Інфільтративний протоковий РГЗ, люмінальний В молекулярний підтип | G2 | РГЗ у матері |
| № 5. РГЗ, 40 років | pT1N0M0 | Інфільтративний протоковий рак, люмінальний А молекулярний підтип | G3 | Рак підшлункової залози у матері РГЗ у 2 тіток по материнській лінії |
| № 6. РГЗ, 31 рік | T1N0M0 | Інфільтративний протоковий рак, люмінальний В молекулярний підтип | G3 | Рак ендометрія у бабусі по батьківській лінії |
|
№ 7. РГЗ (права грудна залоза), 37 років РГЗ (ліва грудна залоза), 41 рік РЯ, 50 років |
pT2N0M0 pT2N1M0pT2bN0M0 |
Інфільтративний протоковий рак правої грудної залози, люмінальний B молекулярний підтип Інфільтративний протоковий рак лівої грудної залози, люмінальний B молекулярний підтипСерозна аденокарцинома яєчника |
G1G1G3 | РЯ у матері |
G — ступінь диференціювання пухлин.
Як свідчать наведені дані, досить цікавими виявилися результати клініко-генеалогічного аналізу родоводів. Родичі обстежених нами пацієнток — носіїв мутації 5382insC у гені BRCA1 — хворіли на РЯ (2 матері), РГЗ (мати і 3 тітки по материнській лінії), рак щитоподібної залози (мати), рак ендометрія (бабуся по батьківській лінії), рак товстої кишки (мати та бабуся по материнській лінії), рак підшлункової залози (мати). Тобто серед родичів найчастіше на рак хворіла мати, при цьому переважали пухлини, у патогенезі яких мають значення гормональні фактори (РГЗ, РЯ, рак ендометрія, щитоподібної залози, товстої кишки).
Привертають увагу такі факти: у 6 із 7 пробандів вік не перевищував 50 років; у 2 пробандів (№ 3 та 7 за табл. 6) були первинно-множинні пухлини, серед яких діагностували РЯ та РГЗ. Матері цих хворих лікувалися з приводу РЯ.
Значний інтерес викликає розвиток первинно-множинних пухлин у жінки — носія мутації 5382insC у гені BRCA (№ 7 за табл. 6): у 37 років діагностовано рак правої грудної залози ІІА стадії, у віці 41 року — рак лівої грудної залози ІІВ стадії, у 50 років — РЯ 2В стадії (серозна аденокарцинома низького ступеня диференціювання). При цьому гістологічна будова пухлин грудної залози була однаковою — інфільтративний протоковий рак високого ступеня диференціювання (G1). Наведене вказує на асоціацію мутації 5382insC у гені BRCA з розвитком первинно-множинних пухлин — РГЗ обох грудних залоз і РЯ.
Другий випадок первинно-множинної патології ОЖРС у носія мутації 5382insC у гені BRCA: пробанд — хвора на РЯ (№ 3 за табл. 6), у 48 років діагностовано рак правого яєчника, у 50 років — рак лівої грудної залози. Гістологічна будова РЯ відповідала серозній аденокарциномі низького ступеня диференціювання (G3), а РГЗ — інфільтративному протоковому раку помірного ступеня диференціювання (G2). Серед родичів пробанда хворою на рак була мати — вона лікувалася з приводу РЯ. У пробанда двоє здорових дітей (рис. 2). Але при молекулярно-генетичному обстеженні дочки пробанда виявилося, що вона є носієм мутації 5382insC у гені BRCA1 і, безумовно, має підвищений ризик виникнення раку ОЖРС.
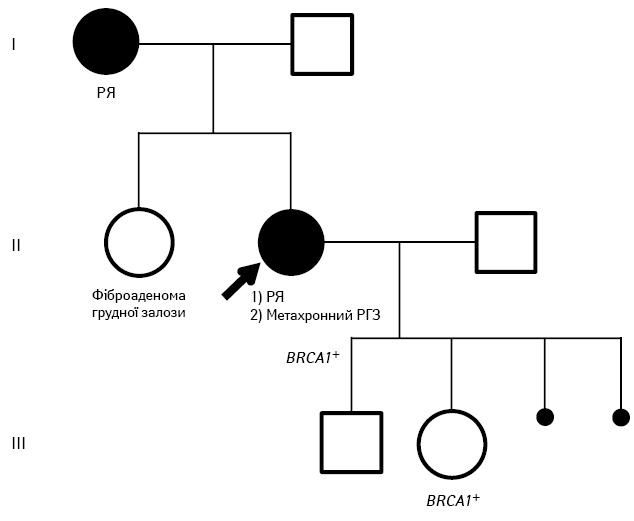
Рис. 2. Родовід хворої на первинно-множинний рак: первинна пухлина — РЯ у віці 48 років, метахронна пухлина у 50 років — РГЗ (пробанда вказано стрілкою). Молекулярно-генетичне дослідження ДНК периферичної крові встановило мутацію 5382insC у гені BRCA1. З анамнезу пробанда — мати захворіла на РЯ у віці 57 років. У сестри пробанда діагностовано фіброаденому грудної залози. У пробанда син і дочка, яка є носієм мутації 5382insC у гені BRCA1
У цій статті ми детально не зупиняємося на особливостях клінічного перебігу і прогнозі обстежених нами хворих — носіїв мутації 5382insC у гені BRCA1, тому що це початковий етап фундаментального дослідження, присвяченого генним змінам у пухлинах ОЖРС. Але вже з огляду на одержані результати можемо констатувати, що мутація 5382insC у гені асоційована зі спадковим синдромом РЯ і РГЗ й аутосомно-домінантною передачею цієї мутації. Такий синдром характеризується підвищеним ризиком розвитку не тільки РЯ та РГЗ, але й раку передміхурової та підшлункової залоз, що диктує необхідність проведення молекулярно-генетичних досліджень у чоловіків із родини з асоціацією пухлинних процесів гормонального генезу та мутаціями у генах BRCA1/2. Ризик розвитку зазначених форм раку протягом життя за наявності патогенних варіантів генів BRCA1 або BRCA2 становить 40–80% для РГЗ, 11–40% — для РЯ, 1–10% — для РГЗ у чоловіків, до 39% — для раку передміхурової залози і 1–7% — для раку підшлункової залози [16].
Тепер мутації у генах BRCA1/2 широко вивчаються (особливо у хворих на РГЗ люмінального підтипу, який найбільш розповсюджений, і базального підтипу, що характеризується агресивним перебігом пухлинного процесу) для визначенням їхніх клінічних особливостей, зв’язку з такими біологічними маркерами, як ER, PgR, HER2/neu, p53 та Ki-67 у первинній пухлині та метастатичних ураженнях [17–19]. Варто зауважити, що визначення мутацій у генах BRCA1/2 має предиктивний характер, і за умови знання про наявність у них таких мутацій жінки будуть більш уважними до своїх симптомів і частіше консультуватимуться в онкогінеколога, мамолога та інших спеціалістів.
Необхідність проведення комплексних досліджень, які включають клінічні, гістологічні, генеалогічні та молекулярно-генетичні методи, ґрунтується на суттєвому клінічному значенні одержаних результатів — можливості визначити, перш за все, генетичну схильність до розвитку спадкової патології, а також розробці заходів, які йому запобігають. Не менш важливо знати про характер пухлинного процесу — спадковий або спорадичний, варіабельність генетичних особливостей пухлин одного генезу та зв’язок мутаційних змін зі злоякісним потенціалом захворювання. Ці дослідження надзвичайно важливі для вирішення такої складної проблеми онкології, як резистентність злоякісних пухлин до цитостатичної терапії. Клінічне значення цього напряму досліджень ґрунтується на окремих спостереженнях і даних літератури, які свідчать, що при агрегації пухлинної патології у родоводах змінюється медикаментозна резистентність пухлин. Так, у роботі [20] показано, що у хворих на рак ендометрія з обтяженим сімейним анамнезом виявлено природну медикаментозну резистентність, яка характеризується достовірно вищим рівнем експресії білка MDR-1/P-gp у пухлинних клітинах порівняно з таким у пацієнтів без агрегації онкопатології у родоводах. Крім того, вторинні мутації у клітинах із BRCA1/2-мутаціями також є ще одним важливим механізмом змін резистентності до цитостатиків і виживання пухлинних клітин із мутаціями [21]. Такі дослідження є обґрунтованою підставою для розробки лікарських препаратів з метою диференційної терапії пацієнтів онкологічного профілю, зокрема хворих на РЯ та РГЗ із мутаціями у генах BRCA1 або BRCA2 [22, 23].
Висновки
У результаті комплексного клінічного, клініко-генеалогічного обстеження хворих на РЯ і РГЗ, патоморфологічного дослідження пухлин і молекулярно-генетичного дослідження ДНК периферичної крові, зокрема аналізу геномної ДНК периферичної крові (до початку лікування) для визначення мутацій 185delAG та 5382insC у гені BRCA1, мутації 6174delT у гені BRCA2 встановлено таке. У хворих на РЯ та РГЗ із родин з агрегацією пухлинної патології достовірних відмінностей стану менструальної функції не виявлено. У жінок контрольної групи мутацій у генах BRCA1 та BRCA2 не визначено. У геномній ДНК периферичної крові виявлено лише мутацію 5382insC у гені BRCA1 у 3 (13,0%) із 23 хворих на РЯ і у 4 (19,0%) із 21 пацієнтки із РГЗ. Кількість хворих на рак родичів І ступеня спорідненості становила 33 (41,2%), ІІ ступеня спорідненості — 47 (58,8%). В обох групах обстежених було більше хворих на рак родичів по материнській, ніж по батьківській лінії. Підтверджено асоціацію мутації 5382insC у гені BRCA1 з розвитком спадкового синдрому РЯ/РГЗ та первинно-множинних пухлин ОЖРС. Встановлено асоціацію люмінального молекулярного підтипу А і В РГЗ із мутацією 5382insC у гені BRCA1.
Список використаної літератури
1. Свінціцький В.С., Воробйова Л.І., Неспрядько С.В. (2009) Актуальні проблеми хіміотерапії хворих на злоякісні пухлини яєчника. Вісник наукових досліджень, 4(57): 87–89.
2. Свінціцький В.С. (2010) Комплексне лікування хворих на злоякісні пухлини яєчника. Автореф. дис.. … доктора мед. наук, Київ: 40 с.
3. Головко Т.С., Смоланка И.И., Скляр С.Ю. и др. (2012) Лучевая диагностика редких заболеваний грудной железы с клиническим синдромом узловых мастопатий. Променева діагностика, променева терапія, 1: 19–31.
4. Іванкова В.С., Барановська Л.М., Іванкова О.М. та ін. (2012) Підходи до хіміопроменевого лікування хворих на рецидивні та метастатичні форми раку грудної залози. Укр. радіол. журн., 20(2): 153–155.
5. Смоланка І.І., Солодяннікова О.І., Скляр С.Ю., Костриба О.І. (2013) Вибір обсягу лімфодисекції при операціях з приводу раку грудної залози. Метод. рекомен. Національний інститут раку, Київ.
6. Смоланка І.І., Югрінов О.Г., Досенко І.В. та ін. (2013) Безпосередні результати комплексного лікування хворих на місцево-поширений рак грудної залози із застосуванням системно-селективної неоад’ювантної поліхіміотерапії. Клин. онкол., 1(9): 44–47.
7. Hall J.M., Lee M.K., Newman B. et al. (1990) Linkage of early-onset familial breast cancer to chromosome 17q21. Science, 250(4988): 1684–1689.
8. Wooster R., Neuhausen S.L., Mangion J. et al. (1994) Localization of a breast cancer susceptibility gene, BRCA2, to chromosome 13q12-13. Science, 265(5181): 2088–2090.
9. Mavaddat N., Peock S., Frost D. et al. (2013) Cancer risks for BRCA1 and BRCA2 mutation carriers: results from prospective analysis of EMBRACE. J. Natl. Cancer Inst., 105(1): 812–822.
10. Wang Q., Zhang H., Fishel R., Greene M.I. (2000) BRCA1 and cell signaling. Oncogene,19: 6152–6158.
11. Horsman D., Wilson B.J., Avard D. et al. (2007) Clinical management recommendations for surveillance and risk-reduction strategies for hereditary breast and ovarian cancer among individuals carrying a deleterious BRCA1 or BRCA2 mutation. J. Obstet. Gynaecol. Can., 29(1): 45–60.
12. Fattahi M.J., Mojtahedi Z., Karimaghaee N. et al. (2009) Analysis of BRCA1 and BRCA2 mutations in Southern Iranian breast cancer patients. Arch. Iranian Med., 12(6): 584–587.
13. Konecny M., Milly M., Zavodna K. (2011) Comprehensive genetic characterization of hereditary breast/ovarian cancer families from Slovakia. Breast Cancer Res. Treat., 126(1): 119–30.
14. Cherbal F., Salhi N., Bakour R. et al. (2012) BRCA1 and BRCA2 unclassified variants and missense polymorphisms in Algerian breast/ovarian cancer families. Dis. Markers., 32(6): 343–353.
15. Silva F.C., Lisboa B.C., Figueiredo M.C. et al. (2014) Hereditary breast and ovarian cancer: assessment of point mutations and copy number variations in Brazilian patients. BMC Med. Genet., 15: 55. doi: 10.1186/1471-2350-15-55.
16. Petrucelli N., Daly M.B., Feldman G.L. (2013) BRCA1 and BRCA2 hereditary breast and ovarian cancer (http://www.ncbi.nlm.nih.gov/books/NBK1247).
17. Ricks-Santi L.J., Nie J., Marian C. et al. (2013) BRCA1 polymorphisms and breast cancer epidemiology in the Western New York exposures and breast cancer (WEB) study. Genet. Epidemiol., 37(5): 504–511.
18. Santarosa M., Maestro R. (2012) BRACking news on triple-negative/basal-like breast cancers: how BRCA1 deficiency may result in the development of a selective tumor subtype. Cancer Metastasis Rev., 31(1–2): 131–142.
19. Nishimura R., Osako T., Okumura Y. et al. (2011) Changes in the ER, PgR, HER2, p53 and Ki-67 biological markers between primary and recurrent breast cancer: discordance rates and prognosis. World J. Surg. Oncol., 17(9): 131/
20. Бучинська Л.Г., Воробйова Л.І., Несіна І.П. (2005) Дослідження медикаментозної резистентності злоякісних новоутворень ендометрія залежно від агрегації пухлинної патології у родоводах хворих. Онкология, 7(3): 201–204.
21. Dhillon K.K., Swisher E.M., Taniguchi T. (2011) Secondary mutations of BRCA1/2 and drug resistance. Cancer Sci. 102(4): 663–669.
22. Audeh M.W., Carmichael J. et al. (2010) Oral poly(ADP-ribose) polymerase inhibitor olaparib in patients with BRCA1 or BRCA2 mutations and recurrent ovarian cancer: a proof-of-concept trial. Lancet, 376(9737): 245–251.
23. Mercier-Vogel L., Bodmer A., Castiglione M. (2011) PARP inhibitors: new therapeutic agents in breast and ovarian cancer, 25(7): 1137–1140.
Оценка ассоциации клинико-патологических особенностей опухолевого процесса с результатами клинико-генеалогического обследования больных раком яичника и грудной железы — носителей мутации 5382insC в гене BRCA1
Институт экспериментальной патологии, онкологии и радиобиологии им. Р.Е. Кавецкого НАН Украины, КиевКУ «Черкасский областной онкологический диспансер» Черкасского областного советаГУ «Референс-центр молекулярной диагностики МОЗ Украины», Киев
Резюме. Проведены комплексные клинико-патологические, клинико-генеалогические, патоморфологические, молекулярно-генетические исследования у 23 больных раком яичника (РЯ) І–ІV стадии (по FIGO) и 21 пациентки с раком грудной железы (РГЖ) І–ІІ стадии (по TNM). Выполнен анализ геномной ДНК периферической крови (до начала лечения) для определения мутаций 185delAG и 5382insC в гене BRCA1, мутации 6174delT в гене BRCA2. В качестве контроля использованы результаты клинического и молекулярно-генетического исследования ДНК периферической крови 55 здоровых женщин без опухолевой патологии в анамнезе. Удаленные опухоли проанализированы по гистологическому типу, степени дифференцировки. У больных РГЖ определяли молекулярный подтип образования путем иммуногистохимического исследования экспрессии гормональных рецепторов к эстрогену (ER) и прогестерону (PR), а также эпидермального фактора роста опухоли II типа (HER2/neu). Результаты показали, что у пациенток с РЯ и РГЖ из семей с агрегацией опухолевой патологии достоверные изменения репродуктивно-менструальной функции не выявлены. В геномной ДНК периферической крови определена только мутация 5382insC в гене BRCA1. На основании полученных результатов проанализирована клиническая, клинико-патоморфологическая характеристика опухолей и их связь с результатами клинико-генеалогических и молекулярно-генетических исследований индивидуально у каждой больной, у которой выявлены мутации в гене BRCA1. Данная мутация отмечена у 3 (13%) из 23 пациенток с серозным РЯ и у 4 (19%) больных с инфильтративным протоковым РГЖ люминального молекулярного подтипа. В обеих группах обследованных было больше больных раком родственников по материнской, чем по отцовской линии. У женщин контрольной группы мутации в генах BRCA1 и BRCA2 не определялись. Подтверджена ассоциация мутации 5382insC в гене BRCA1 с развитием наследственного синдрома РЯ/РГЖ и первично-множественных опухолей органов женской репродуктивной системы.
рак яичника, рак грудной железы, клиническая и генеалогическая характеристика, гены BRCA1/2, мутации 5382insC BRCA1.
Адреса:
Палійчук Ольга Володимирівна
03022, Київ, вул. Василькiвська, 45
Інститут експериментальної патології,
онкології і радіобіології
ім. Р.Є. Кавецького НАН України
E-mail: oncology@2upost.com















Leave a comment