Роль генетичних факторів у схильності до розвитку первинно-множинних пухлин органів жіночої репродуктивної системи
Палийчук О.В. 1, Полищук Л.З. 1, Горовенко Н.Г. 2, Россоха З.И. 3, Галкин Ф.М.4, Парамонов В.В. 4
- 1Інститут експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького НАН України, Київ
- 2Національна медична академія післядипломної освіти ім. П.Л. Шупика, Київ
- 3Референс-центр з молекулярної діагностики МОЗ України, Київ
- 4Черкаський обласний онкологічний диспансер, Черкаси
Резюме. Проведено клінічні, клініко-генеалогічні та молекулярно-генетичні дослідження у 47 хворих (віком від 23 до 83 років) із первинно-множинними злоякісними пухлинами (ПМЗП) органів жіночої репродуктивної системи (ОЖРС), у родинах яких хворіли на рак родичі І та ІІ ступеня спорідненості. Представлено характеристику синхронних та метахронних ПМЗП, останні у 75% випадків виникали у віці понад 50 років. Серед метахронних пухлин у хворих на рак ОЖРС найчастіше діагностували рак тіла матки (39,6%), рак яєчника (20,8%), рак грудної залози (14,6%), що може свідчити про спільні механізми патогенезу первинних і вторинних пухлин. Результати клініко-генеалогічного дослідження свідчать про спадковий характер хвороби у пробандів: сімейний раковий синдром встановлено у 12,8% родоводів з агрегацією у родоводах пухлин різного генезу, у 6% — спадковий рак яєчника, матки, грудної залози. За результатами молекулярно-генетичних досліджень пухлин у 8 (18,2%) із 44 обстежених пацієнток виявлено мутації 5382insC в гені BRCA1 та 6174del в гені BRCA2, що є свідченням ролі генетичних факторів у розвитку ПМЗП ОЖРС. Клініко-генеалогічний аналіз родоводів та виявлення мутацій у генах-супресорах BRCA1 і BRCA2потрібно розцінювати як невід’ємну частину комплексного обстеження хворих на рак ОЖРС для визначення генетичного ризику розвитку вторинних пухлин та розробки принципів генетичної профілактики раку у їх родичів.

Вступ
Відсутність тенденції до зниження захворюваності жінок на рак органів репродуктивної системи обґрунтовує підвищену увагу до цієї проблеми. Для її розв’язання необхідні нові програми, спрямовані на профілактику й ранню діагностику злоякісних новоутворень, у тому числі первинно-множинної онкологічної патології. Первинно-множинні злоякісні пухлини (ПМЗП) належать до мало вивчених онкологічних захворювань, хоча інтерес до них з’явився у 70-ті роки минулого століття. Наукові розробки щодо особливостей клінічної картини і перебігу ПМЗП висвітлено в ряді монографій і статей [1, 2, 8, 12, 14–18].
Проте, незважаючи на багаторічні дослідження, досі відсутня класифікація цих пухлин, їх комплексна клінічна характеристика у зв’язку з різноманітністю гістологічних типів ПМЗП, не розроблено принципів їх профілактики, не визначено тактики моніторингу хворих, не виділено груп ризику щодо розвитку вторинних пухлин після лікування пацієнтів онкологічного профілю [11, 13].
Результати клінічних досліджень свідчать про підвищення частоти ПМЗП в останні роки, що можна пояснити низкою обставин. Перш за все, це може бути пов’язано з оптимізацією діагностики пухлин шляхом упровадження нових методів обстеження хворих (ендоскопія і ультразвукова діагностика, комп’ютерна та магнітно-резонансна томографія, імуноферментні, імуноморфологічні та молекулярно-генетичні методи дослідження операційного матеріалу). Крім того, розвиток вторинних пухлин можливий після лікування пацієнтів онкологічного профілю, особливо молодого віку, із застосуванням хіміо- та променевої терапії, яким притаманний мутагенний вплив на клітини організму. Шкідливі фактори довкілля, умови праці, імунодефіцит, спосіб життя також є передумовою для розвитку онкологічної патології, особливо в людей похилого віку, тривалість життя яких збільшується.
Слід вказати й на суттєве значення спадкових факторів у виникненні декількох пухлин різного генезу, що можна пояснити плейотропною дією мутантного гена, який передається з покоління в покоління [3, 22, 26]. ПМЗП виникають за умов генетичної схильності до розвитку злоякісних пухлин, яка характерна для ряду синдромів (синдроми Гарднера, Лінча, Лі-Фраумені, множинні ендокринні неоплазії, підвищена спонтанна та індукована ламкість хромосом та ін.) [4, 6]. Відомі випадки розвитку вторинних пухлин у хворих на хронічний лімфолейкоз або лімфогранулематоз, при яких відзначають виражений імунодефіцит [5]. На думку деяких авторів, розвиток ПМЗП органів жіночої репродуктивної системи (ОЖРС) також не є казуїстикою [7, 19, 23, 25, 28, 30], проте патогенез і закономірності їх розвитку залишаються невизначеними.
ПМЗП за строками виникнення поділяють на синхронні та метахронні. Синхронні ПМЗП розвиваються одночасно з первинною пухлиною або протягом півроку після її діагностування, а метахронні ПМЗП виявляють через різні проміжки часу після 6-місячного терміну верифікації первинної локалізації злоякісного процесу.
При діагностуванні первинної множинності пухлин дослідники керуються критеріями, які були сформульовані ще в 30-ті роки минулого століття. Основними параметрами, які широко використовують у клінічних дослідженнях, є наступні:
- кожна з первинно-множинних пухлин має характеризуватися чіткою гістологічною картиною злоякісності;
- кожна пухлина має розташовуватися на відстані одна від одної;
- вторинна пухлина не має бути метастатичним ураженням первинної пухлини.
Вивчення клінічних особливостей ПМЗП дозволило деталізувати дані критерії: первинно-множинні пухлини — це 2 або більше пухлин, які розвинулися в одному організмі; мають різний або однаковий гістогенез, різний біологічний потенціал (доброякісні, злоякісні або їх комбінації), різну або однакову гістологічну будову; локалізуються в одному органі (або парних органах) однієї системи, у різних органах однієї системи або різних органах різних систем і проявляються одночасно (синхронно), послідовно (метахронно) або комбіновано (синхронно-метахронно, метахронно-синхронно), а також відповідають правилам, які виключають можливість розцінювати вторинну пухлину як рецидив або метастаз.
В останні роки наша увага прикута до ролі генетичних факторів у виникненні спадкових форм раку ОЖРС [9]. Аналізуючи клініко-генеалогічні дані хворих на рак ОЖРС, ми звернули увагу на наявність у родоводах пацієнток з раком тіла матки (РТМ), грудної залози (РГЗ), яєчника (РЯ) ПМЗП, що дозволило виділяти спадкові, сімейні й спорадичні форми раку.
Мета дослідження: представити клініко-морфологічну оцінку пухлинних процесів та клініко-генеалогічну характеристику хворих із ПМЗП ОЖРС.
Матеріали та методи дослідження
У число обстежених включено 47 хворих із ПМЗП ОЖРС, у родинах яких хворіли на рак родичі I та II ступеня спорідненості. Із 47 пацієнток із ПМЗП у 14 первинною пухлиною був РГЗ, у 13 — РТМ, у 7 — РЯ. У загальну кількість досліджених включено також 13 випадків колоректального раку, у цих хворих пухлини ОЖРС були вторинними. З усіх новоутворень виключали доброякісні пухлини й такі, що мали однакову морфологію і локалізувалися в одному органі жіночої репродуктивної системи. Усіх хворих обстежено та проліковано (хірургічне лікування, променеве, хіміотерапія в рамках комплексного та/або комбінованого спеціального лікування) згідно з діючими стандартами, прийнятими в Україні, у комунальному закладі «Черкаський обласний онкологічний диспансер» Черкаської обласної ради (далі — КЗ «ЧООД» ЧОР) в 2005–2009 рр. Пацієнтки дали інформовану згоду на використання клінічних даних для дослідницьких цілей.
У всіх хворих проаналізовано результати клінічних, лабораторних, інструментальних досліджень, а також клініко-генеалогічні дані про кількість родичів, хворих на рак, та ступінь їх спорідненості з пробандом (пробанди — пацієнтки з первинно-множинними пухлинами), одержаними за спеціально розробленою анкетою, заповнюваною під час бесіди з жінками.
У діагностиці первинної множинності пухлин ми керувалися клінічними і патоморфологічними критеріями, на які посилалися у вступі даної публікації. Клінічний діагноз верифікували за допомогою морфологічного дослідження видалених пухлин. Операційний матеріал піддавали класичній гістологічній обробці з наступним фарбуванням гістологічних зрізів гематоксиліном та еозином та оцінкою морфології пухлин за допомогою мікроскопа «Axiostarplus» («Сarl Zeiss», Німеччина) при збільшенні 100–400.
Із Черкаського обласного патологоанатомічного архіву відібрано блоки операційного матеріалу 44 (93,6%) із 47 хворих із ПМЗП ОЖРС, на яких проведено молекулярно-генетичне дослідження на наявність найбільш поширених у слов’янській популяції мутацій у генах BRCA1 та BRCA2 (ДУ «Референс-центр з молекулярної діагностики» МОЗ України, Київ). Дослідження включало виділення ДНК з гістологічних зрізів пухлин, ампліфікацію досліджених фрагментів ДНК (алельспецифічна та класична), електрофоретичний розподіл ампліфікаційних фрагментів або аналіз рестрикційних фрагментів у 1,5% агарозному гелі.
Результати дослідження та їх обговорення
За даними канцер-реєстру КЗ «ЧООД» ЧОР, протягом 2010–2012 рр. на диспансерний облік взято 1012 хворих різної статі з ПМЗП, з яких жінок було 580 (57,3%). Із загальної кількості жінок (7103 особи), які перебували на диспансерному обліку з приводу онкологічного захворювання у вказаний період, було 580 (8,2%) хворих із ПМЗП різного генезу. Із цієї кількості пацієнток у 193 (33,3%) діагностовано ПМЗП ОЖРС (табл. 1). Із наведеної таблиці видно, що частота ПМЗП ОЖРС за вказані роки достовірно не змінювалася і коливалася в межах 32,1 і 34,7%, що можна пояснити щорічними коливаннями онкологічної захворюваності жінок.
Таблиця 1. Частота захворюваності на ПМЗП за 2010–1012 рр. (за даними КЗ «ЧООД» ЧОР)
| Показники | Кількість хворих, n/% | |||
|---|---|---|---|---|
| 2010 р. | 2011 р. | 2012 р. | Усього | |
| Загальна кількість жінок, взятих на диспансерний облік | 2322/32,7 | 2375/33,4 | 2406/33,9 | 7103/100 |
| Загальна кількість жінок з ПМЗП, взятих на диспансерний облік | 181/31,2 | 204/35,2 | 195/33,6 | 580/100 |
| Загальна кількість жінок з ПМЗП ОЖРС, взятих на диспансерний облік | 67/34,7 | 64/33,2 | 62/32,1 | 193/100 |
Cеред ПМЗП найбільш частою патологією був РГЗ (53,9%), тоді як частота РТМ і РЯ виявилася нижчою — 33,2 і 12,9% відповідно. Відзначено варіабельність кількості пухлин у різні роки, яка становила 4,0% — для РГЗ, 7,7% — для РТМ і 4,3% — для РЯ (табл. 2).
Таблиця 2. Частота захворюваності на ПМЗП ОЖРС за 2010–1012 рр. (за даними КЗ «ЧООД» ЧОР)
| Показники | Кількість хворих, n/% | |||
|---|---|---|---|---|
| 2010 р. | 2011 р. | 2011 р. | Усього | |
| Загальна кількість взятих на диспансерний облік хворих на РМЗ (первинна пухлина) | 35/52,2 | 36/56,2 | 33/53,2 | 104/53,9 |
| Загальна кількість взятих на диспансерний облік хворих на РТМ (первинна пухлина) | 24/35,8 | 18/28,1 | 22/35,5 | 64/33,2 |
| Загальна кількість взятих на диспансерний облік хворих на РЯ (первинна пухлина) | 8/11,9 | 10/15,6 | 7/11,3 | 25/12,9 |
| Усього | 67/100 | 64/100 | 62/100 | 193/100 |
Аналіз клінічних даних показав, що в 7 (14,9%) із 47 хворих ПМЗП були синхронними, у 40 (85,1%) — метахронними. Загалом вік жінок при діагностуванні первинної пухлини коливався від 23 до 83 років, середній вік становив 49,9±4,4 року, медіана віку — 50 років. Одержані результати збігаються з даними літератури. Так, за одними даними, середній вік хворих на синхронний РЯ і РТМ становив 49 років, за іншими — 47,3 року [18, 22]. Більш детальний розподіл пацієнток за віком (рис. 1) свідчить, що найбільша кількість хворих (78,7%) з первинною пухлиною була у віковому інтервалі 31–60 років, з метахронною пухлиною (60%) — 51–70 років.
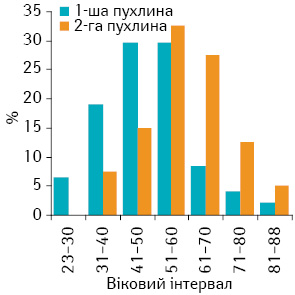
Обчислення продемонстрували, що вік хворих із синхронними ПМЗП коливався від 39 до 74 років, становлячи в середньому 57,6±5,6 року, медіана віку — 57 років. Мінімальний вік пацієнток із метахронними ПМЗП був меншим (23 роки), максимальний — більшим (83 роки), при цьому середній вік (48,6±6,1 року) і медіана (50 років) мали тенденцію до зменшення (р>0,05), порівняно з такими у групі хворих на синхронний рак.
Тривалість періоду між діагностуванням первинної та метахронної пухлин була різною й коливалася від 3 до 27 років. Найбільший термін (27 років) відзначено у хворої на РТМ (первинна пухлина у віці 50 років), у якої в подальшому виникли 3 метахронні пухлини (рак прямої кишки, шкіри, лімфома Ходжкіна).
Залежно від часу виникнення вторинних пухлин (синхронні чи метахронні) й морфологічного діагнозу первинних пухлин усіх хворих розподілено на 4 групи: група І — пацієнтки з РГЗ (14), група ІІ — РТМ (13), група ІІІ — РЯ (7), група IV — з раком товстої кишки — РТК (13). Основні клініко-морфологічні особливості характеризували окремо, відповідно до цих груп. Клінічні характеристики, результати клініко-генеалогічного дослідження й морфологічні особливості синхронних пухлин подано в табл. 3.
Таблиця 3. Результати клінічних, морфологічних та клініко-генеалогічних досліджень у хворих на первинно-множинний синхронний рак (n=7)
| Групи хворих і характеристика первинних пухлин | ||||
|---|---|---|---|---|
| Характеристика | Група I | Група II | Група III | Група IV |
| Первинні пухлини | РМЗ | РТМ | РЯ | РТК |
| Кількість хворих | 2 | 3 | 1 | 1 |
| Вік хворих | 39; 54 | 53; 68; 74 | 58 | 57 |
| Cтадія | І | Іа, Ів, Ів | IIIс | І |
| Патоморфологічний діагноз | Протоковий інфільтруючий, скір | Аденокарцинома | Серозна аденокарцинома | Муцинозний рак |
| Ступінь диференціювання пухлин | G2, G1 | G0, G1, G1 | G3 | G2 |
| Вторинні пухлини у групах хворих на синхронний рак | ||||
| Вторинні пухлини | РТМ | РЯ (2), РТК (1) | РТМ | РЯ |
| Кількість хворих | 2 | 3 | 1 | 1 |
| Cтадія | Іа | Іс–IIв | Ів | IIс |
| Ступінь диференціювання | G0, G2 | G2, G2, G2 | G1 | G3 |
| Патоморфологічний діагноз | Аденокарцинома | Ендометріоїдний, серозний папілярний рак, аденокарцинома | Аденокарцинома | Серозна аденокарцинома |
| Злоякісні пухлини у родичів пробандів | РГЗ у сестри, бабусі | РТМ у дочки і матері, РГЗ у сестри, рак товстої кишки у брата, рак легені (2) у дідусів | РГЗ у матері | Рак шийки матки у сестри |
Як видно (див. табл. 3), синхронною пухлиною у хворих на РГЗ був РТМ, у пацієнток з РТМ — РЯ і РТК, у хворої на РЯ — РТМ, у хворої на РТМ — РЯ, при цьому, за клінічними даними, у всіх діагностовано первинний злоякісний процес у I стадії. Синхронні пухлини мали іншу гістологічну структуру, ніж первинна пухлина, й у більшості хворих, за винятком випадків раку прямої кишки і РЯ, також встановлено I стадію процесу. Слід зауважити, що в пацієнток із РГЗ і РТМ виявлено злоякісні пухлини того самого або іншого генезу, що й у їх родичок І та ІІ ступеня спорідненості, що вкладається в поняття сімейний раковий синдром (синдром Лінча ІІ) [19, 23].
Результати клінічних, морфологічних та клініко-генеалогічних досліджень у хворих на метахронний рак представлені в табл. 4. Вік пацієнток з ПМЗП коливався від 23 до 83 років, при цьому середній вік і його медіана були меншими у хворих на РЯ. У цій групі була однакова кількість обстежених у віці до і понад 50 років, тоді як у групах І та ІІ було більше у віці <50 років, а у групі IV — хворих віком >50 років. У пацієнток усіх груп при первинному зверненні до онколога діагностовано І–ІІІ стадію пухлинного процесу. За даними морфологічного дослідження пухлин встановлено, що у хворих на РГЗ наявний протоковий рак і скір (G1 та G2 ступінь диференціювання), у пацієнток з РТМ — аденокарцинома (G0 та G1), з РЯ — в основному серозні форми раку (G3), у хворих на РТК — найчастіше аденокарцинома (G2).
Таблиця 4. Результати клінічних, морфологічних та клініко-генеалогічних досліджень у хворих на первинно-множинний метахронний рак (n=40)
| Групи хворих і первинні пухлини | ||||
|---|---|---|---|---|
| Групи хворих | І група | ІІ група | ІІІ група | ІV група |
| Пухлини | РМЗ | РТМ | РЯ | РТК |
| Кількість хворих | 12 | 10 | 6 | 12 |
| Вік хворих (коливання), середній вік/медіана віку (Ме) | 33–8349,2/45 | 33–7848,3/46 | 23–6743/40,5 | 26–6850/52 |
| Кількість хворих до 50/після 50 років | 8/4 | 6/4 | 3/3 | 3/9 |
| Cтадія | Iа–IIIс | Iа–IIIв | Iа–IIIс | I—IIIс |
| Патоморфологічний діагноз | Протоковий інфільтруючий рак, скір | Аденокарцинома | Серозний папілярний рак (3), серозна аденокарцинома (2), дизгермінома (1) | Аденокарцинома (8), муцинозний (2), карциноїд (1), базально-клітинний рак (1) |
| Метахронні пухлини | ||||
| Інтервал до діагностування метахронних пухлин | 2–22 роки | 4–27 років | 3–31 рік | 3–19 років |
| Метахронні пухлини | РТМ (6), РЯ (6), білатеральний РГЗ (1), саркома (1), рак щитоподібної залози (1) | РПК (6), РГЗ (3), РЯ (2), рак шлунка (1), рак шкіри (1), лімфома Ходжкіна (1) | РТМ (3), РГЗ(3), рак шлунка (1) | РТМ (10)РЯ (2) |
| Кількість пухлин/кількість хворих у групі | 15/12 | 14/10 | 7/6 | 12/12 |
| Кількість хворих до 50 років/після 50 років | 4/8 | 2/8 | 3/3 | 1/11 |
| Cтадія | Iа–IIIс | І–IIв | Іа–IIв | Iа–IIа |
| Ступінь диференціювання | РТМ (G0–G2)РЯ (G2–G3)РГЗ білатеральний (G2)Саркома (G3)Рак щитоподібної залози (G1) | РПК 6 (G1–G2)РГЗ (G1–G3)РЯ (G2)Рак шлунка (G3)Рак шкіри (G1)Лімфома Ходжкіна | РТМ (G0–G1)РГЗ (G1–G2)Рак шлунка (G1) | РТМ (G0–3)РЯ (G1–G2) |
| Патоморфологічний діагноз | Аденокарцинома, протоковий інфільтруючий рак, серозна аденокарцинома лейоміосаркома | Аденокарцинома, протоковий інфільтруючий рак, базально-клітинний рак, плоскоклітинний рак, хронічний лімфолейкоз | Аденокарцинома, медулярний рак, протоковий рак | Аденокарцинома, серозний папілярний, гранульозо-клітинний рак |
| Загальна кількість злоякісних пухлин у родоводах/у родичів І ступеня спорідненості | 24/14* | 18/9 | 8/5 | 26/12* |
*Первинно-множинний рак у матері пробанда; РПК — тут і далі — рак прямої кишки.
Інтервал до діагностування метахронних пухлин коливався від 2 до 31 року. На відміну від синхронних пухлин, більшість метахронних діагностували у хворих у віці >50 років (30/75%) і лише в 10 (25%) вторинні пухлини виникали у віці <50 років.
Метахронні пухлини були різними за гістологією, при цьому у деяких хворих на РГЗ, РТМ, РЯ виявляли по 2 пухлини. Вторинні пухлини діагностовано на І–ІІІ стадії неопластичного процесу. Враховуючи, що РЯ, РГЗ, РТМ (первинні пухлини) є гормонозумовленими, можна припустити, що розвиток метахронних пухлин у цих хворих також пов’язаний з гіперестрогенією, яка задіяна в механізмах патогенезу гормонозумовлених пухлин. Останні серед 47 пухлин загалом становили 36 (75%), з яких РТМ — 19 (39,6%), РГЗ — 7 (14,6%), РЯ — 10 (20,8%).
Досить важливими з погляду ролі спадкових факторів у розвитку пухлин і сімейного ракового синдрому виявилися клініко-генеалогічні дані, згідно з якими у 40 родоводах хворих із метахронними злоякісними новоутвореннями виявлено 74 родичів різного ступеня спорідненості, які хворіли на рак різного генезу. Із 74 родичів злоякісні пухлини були у 38 (51,3%) родичів І ступеня (16 матерів і 14 батьків, 3 дочки, 2 братів і 5 сестер) і 36 (48,7%) родичів ІІ ступеня спорідненості (17 тіток і 4 дядьків, 12 бабусь і 3 дідів). Загалом, за клініко-генеалогічними даними, у 6 (12,8%) з 47 родин встановлено сімейний раковий синдром з агрегацією пухлин яєчника, грудної залози, тіла матки і шлунково-кишкового тракту та пухлин іншого генезу, у 3 хворих — спадковий рак (РЯ, РГЗ, РТМ). За даними літератури [19], сімейну історію раку у хворих на РТМ і РЯ відзначають у більшості хворих (28%).
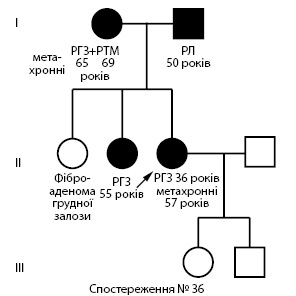
У 5 хворих із загальної кількості обстежених було декілька метахронних пухлин (табл. 5). Це були пацієнтки з РГЗ (2), РТМ (2) і РЯ (1). Характерно, що в усіх спостереженнях, крім № 42, за клініко-генеалогічними даними можна констатувати синдром Лінча ІІ.
Таблиця 5. Індивідуальні характеристики хворих з декількома метахронними пухлинами
| № спостереження і діагноз | Вік хворих, стадія і морфологічні особливості пухлинного процесу | Клініко-генеалогічні дані | |||
|---|---|---|---|---|---|
| Первинна пухлина | Перша метахронна пухлина | Друга метахронна пухлина | Третя метахронна пухлина | ||
| № 27 | 33 роки | 40 років | 61 рік | – | РГЗ у матері, РГЗ і РЯ у тіток, рак товстої кишки у дядька |
| Клінічний діагноз | РГЗ (IIа) | Рак щитоподібної залози (I) | РЯ (IIIс) | ||
| Патоморфологічний діагноз | Протоковий інфільтруючий рак | Папілярний | Ендометріоїдна аденокарцинома | ||
| № 36 | 36 років | 57 років | 57,5 року | – | РГЗ і рак шийки матки у матері, РГЗ у сестри, рак легені у батька |
| Клінічний діагноз | РГЗ (II) | РЯ (IIIс) | РГЗ (IIв) | ||
| Патоморфологічний діагноз | Солідний рак | Серозна аденокарцинома | Білатеральний протоковий інфільтруючий рак | ||
| № 16 | 23 роки | 50 років | 54 роки | РПК у матері, рак легені у дядька | |
| Клінічний діагноз | РЯ (Iс) | РТМ (Iв) | РГЗ (I) | ||
| Патоморфологічний діагноз | Серозна цистаденокарцинома | Аденокарцинома | Протоковий інфільтруючий рак | ||
| № 19 | 47 років | 59 років | 69 років | – | |
| Клінічний діагноз | РТМ (III) | РПК (I) | Хвороба Ходжкіна (III) | ||
| Патоморфологічний діагноз | Аденокарцинома | Базально-клітинний рак | Хронічний лімфолейкоз | Рак шлунка у 2 братів | |
| № 42 | 50 років | 75 років | 77 років | 77 років | Рак нирки у діда |
| Клінічний діагноз | РТМ (IIа) | РПК (II) | Рак шкіри гомілки ст. I | Лімфома (IVа) | |
| Патоморфологічний діагноз | Папілярна аденокарцинома | Базально-клітинний рак | Плоскоклітинний не роговіючий рак | Лімфома Ходжкіна | |
Як видно з наведених результатів дослідження, у багатьох хворих з первинною гормонозалежною пухлиною синхронна або метахронна пухлини також є гормонозалежними, що може свідчити про спільність їхнього патоморфозу. Слід відзначити, що у розвитку злоякісного росту, крім гормональних порушень і генетичної схильності, мають значення інші ендо- та екзогенні фактори, які також можуть впливати на ОЖРС, викликаючи в них патологічні зміни. За даними, порушення не тільки гормонального гомеостазу, але й наявність метаболічних змін в організмі призводять до розвитку полінеоплазій [24, 25]. Враховуючи це, активний пошук змін в органах-мішенях гормонального впливу, особливо у хворих на рак, є абсолютно необхідним етапом після лікування пацієнток із РГЗ, РЯ, РТМ для оцінки ризику розвитку в них вторинних пухлин.
Безумовно, найбільший інтерес викликають хворі, у родоводах яких злоякісні пухлини (синхронні та метахронні) були в матерів і батьків, що є суттєвим для визначення спадкових форм раку. Як видно з рис. 2, найчастішою патологією у батьків пробандів був рак шлунково-кишкового тракту і рак легені, у матерів — рак шлунково-кишкового тракту і РГЗ.
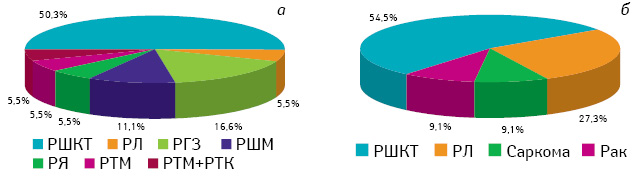
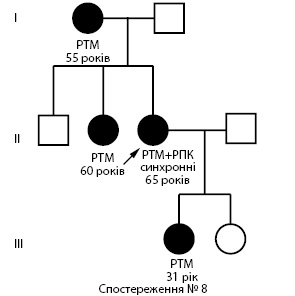
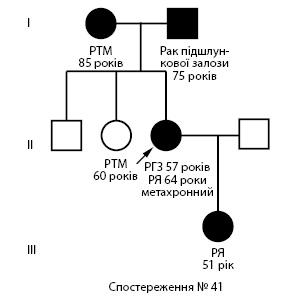
За наведеними результатами ми не можемо визначити фактори, які впливали на виникнення злоякісного росту у членів даних родин, проте можна констатувати, що клінічний і морфологічний діагнози та дані клініко-генеалогічного дослідження ПМЗП свідчать про спадковий характер хвороби — у 6% хворих спадковий РТМ, РЯ, РГЗ (рис. 3, 4), у 12,8% — сімейний раковий синдром (рис. 5),
За даними молекулярно-біологічних і клінічних досліджень раку, спадковий характер пухлинної хвороби ґрунтується на дослідженнях генетичної схильності онкологічної патології, яка полягає у вивченні генів схильності до розвитку раку ОЖРС [20, 21, 27, 29]. При молекулярних дослідженнях виявлено мутації в генах-супресорах пухлинного росту — 185delAG (ген BRCA1), 5382insC (ген BRCA1), 2080delA (ген BRCA1), 4154delA (ген BRCA1) та 6174delT (ген BRCA2), а також мутації в генах репарації ДНК hMLH1 і hMLH2. Відзначено також тенденцію до виникнення первинно-множинних уражень грудної залози або яєчника у осіб з аномальним метилуванням генів RASSF1A, RARβ2 [4]. Тому необхідність подальших молекулярно-генетичних обстежень хворих на рак ОЖРС, особливо з первинно-множинними пухлинами, та їх родичів на наявність мутацій в генах-супресорах пухлинного росту BRCA1/2 або однонуклеотидного поліморфізму (SNP — single nucleotide polymorphism) генів не викликає сумнівів (рис. 6). Такі дослідження будуть сприяти уточненню генетичних змін та їх асоціації з розвитком полінеоплазій.
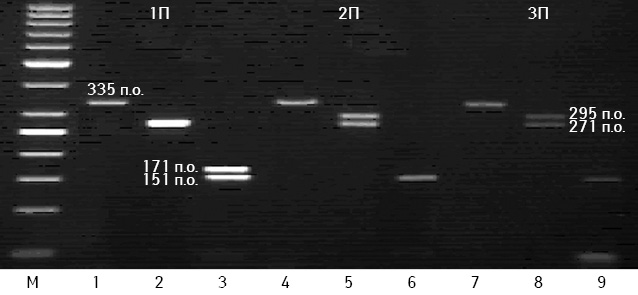
З метою ідентифікації найбільш поширених у слов’янській популяції мутацій у генах BRCA1 (185delAG і 5382insC) та BRCA2 (6174delT) нами проведено молекулярно-генетичне дослідження пухлин, видалених у хворих із ПМЗП ОЖРС. За результатами молекулярно-генетичних досліджень у пухлинах 8 (18,2%) із 44 пацієнток виявлено мутації в гені BRCA1 — 5382insC у 4 хворих із ПМЗП ОЖРС, в гені BRCA2 — 6472delT у 4 із ПМЗП ОЖРС + рак шлунково-кишкового тракту. Натомість мутацію 185delAC в гені BRCA1 не виявлено в жодному з випадків (табл. 6). При зіставленні мутаційних змін у пухлинних клітинах з клінічними особливостями неопластичного процесу у хворих із ПМЗП відзначено, що за наявності мутацій в генах BRCA1 (5382insC) та BRCA2 (6472delT) у 5 з 8 пацієнток реєстрували синхронне виникнення злоякісних пухлин ОЖРС.
Таблиця 6. Частота і характеристика мутацій в генах BRCA1/2 у хворих із ПМЗП ОЖРС (n=44)
| Мутації в генах | BRCA1 (185delAС) | BRCA1 (5382insC) | BRCA2 (6174delT) |
|---|---|---|---|
| Кількість і характеристика мутацій (у дужках асоціація пухлин у пробанда та кількість пацієнток) | 0 | 4 (РГЗ+РЯ — 3) (РГЗ+РТМ — 1) |
4 (РТМ+РЯ — 1) (РГЗ+РЯ — 1) (РЯ+рак шлунка — 1) (РТМ+РПК — 1) |
| Загальна кількість пацієнток з мутаціями, n (%) | 8 (18,2%) | ||
| Загальна кількість обстежених пацієнток, n (%) | 44 (100%) | ||
Виходячи з вищенаведеного, можна зробити висновок, що за наявності в родині хворих на рак ОЖРС та генетичних змін у родичів пробанда абсолютно необхідним заходом є формування груп генетичного ризику розвитку раку в таких родинах та розробка тактики їх моніторингу. На користь моніторингу осіб з сімей, у яких є хворі з ПМЗП, свідчать дослідження [7], які показали, що в жінок з РТМ відносний ризик РГЗ становить на 1-му році спостереження 13,6, на 5-му — 5,3, на 10-му — 3,9, на 15-му — 3,0. У хворих на РГЗ відносний ризик розвитку РТМ також великий, особливо на 1-му році спостереження — 9,0, на 5–10-му — 2,0–2,2, на 15-му — 3,6. Встановлено, що синхронний РГЗ, асоційований з мутаціями в генах BRCA1/2, виявляють у 50% хворих, а за умови первинно-множинної патології (РГЗ і РЯ) у 100% діагностують гермінальні мутації в генах репарації ДНК, що дозволяє виділяти спадковий онкологічний синдром, у склад якого входять РГЗ та/або РЯ [10].
Ці приклади свідчать про патогенетичну спільність і схильність до розвитку синхронних або метахронних РГЗ, РТМ, РЯ та нагальну необхідність проведення клініко-генеалогічного аналізу сімей з визначенням частоти агрегації злоякісних пухлин у родині, особливо І ступеня спорідненості. Такий підхід є важливим кроком для визначення ризику розвитку ПМЗП у пробандів, а також для скринінгу пухлинної патології, особливо РГЗ, РТМ, РЯ.
Таким чином, одержані нами результати вказують на актуальність і перспективність подальшого вивчення такої малодослідженої проблеми, як ПМЗП ОЖРС, при цьому суттєве значення в майбутніх дослідженнях належить не лише клінічним, морфологічним і клініко-генеалогічним, але й молекулярно-генетичним дослідженням, від яких залежать біологічні прояви пухлинного процесу.
Висновки
1. ПМЗП ОЖРС (синхронні та метахронні) характеризуються індивідуальною варіабельністю за строками проявів неопластичного росту. У 75% хворих із ПМЗП органів репродуктивної системи метахронні пухлини виникли у віці після 50 років.
2. Серед метахронних пухлин у хворих із ПМЗП ОЖРС найчастіше діагностуються РТМ (39,6%), РЯ (20,8%), РГЗ (14,6%), що може свідчити про спільні механізми гормонального патогенезу.
3. Більшість (89,4%) синхронних і метахронних пухлин мали епітеліальний генез, їх гістологічна будова відповідала аденокарциномам різного ступеня диференціювання і плоскоклітинному раку.
4. За даними клініко-генеалогічного обстеження пробандів (хворі з ПМЗП) злоякісні пухлини різного генезу діагностували у 51,3% родичів І ступеня спорідненості і 48,7% ІІ ступеня спорідненості. У 12,8% хворих із ПМЗП визначено синдром Лінча з агрегацією пухлин яєчника, грудної залози, тіла матки і шлунково-кишкового тракту, у 6% хворих — спадковий РЯ, РТМ або РГЗ.
5. У 18,2% хворих з синхронними ПМЗП виявлено мутації в генах BRCA1 і BRCA2, що може свідчити про роль генетичних факторів у розвитку первинно-множинних пухлин ОЖРС.
6. Клініко-генеалогічний аналіз родоводів має розцінюватися як невід’ємна частина комплексного обстеження родин, у яких є хворі на РГЗ, РТМ, РЯ для визначення ризику розвитку метахронних пухлин у пробандів та як захід для розробки принципів генетичного моніторингу родичів пробандів і профілактики раку у членів їх родин.
Список використаної літератури
1. Бохман Я.В., Рыбин Е.Л. (1987) Патогенетические аспекты первично-множественных опухолей толстой кишки, тела матки и молочной железы. Первично-множественные злокачественные опухоли, Ленинград: 47–56.
2. Бохман Я.В. (1985) Лекции по онкогинекологии. Медицина, Ташкент, 304 с.
3. Гарькавцева Р.Ф., Казубская Т.П., Сельчук В.Ю. (1992) Анализ генетической предрасположенности к раку в семьях больных первично-множественными злокачественными новообразованиями. Цитология и генетика, 26(2): 32–6.
4. Казубская Т.П., Ходырев Д.С., Пронина И.В. и др. (2012) Метилирование генов-супрессоров в эпителиальных опухолях молочной железы и яичников, включая первично-множественные. Рос. биотерапевт. журн., 1: 69–74.
5. Капланская И.Б., Гайдамака Н.В., Королев А.В., Франк Г.А. (2008) Синхронные и метахронные опухоли у онкогематологических больных. Архив. патол., 70(1): 23–25.
6. Любченко Л.Н., Семьянихина А.В., Фу Р.Г. и др. (2012) Синдром Ли-Фраумени: ТP-53-ассоциированные первично-множественные злокачественные опухоли. Вестник РОНЦ им. Н.Н. Блохина РАМН, (2): 52–58.
7. Максимов С.Я., Хаджимба А.В., Катамадзе И.Г. (2001) Рак яичников в синдроме полинеоплазий органов репродуктивной системы. Мат. науч. конф. «Новые подходы к скринингу, диагностике и лечению опухолей яичников». Великий Новгород, 17–18 мая 2001, Санкт Петербург: 85.
8. Максимов С.Я. (2009) Первично-множественные опухоли органов репродуктивной системы. Практическая онкология, 10(2): 117–123.
9. Палійчук О.В., Поліщук Л.З., Чехун В.Ф. (2012)Впровадження і перші результати онкогенетичного консультування жінок у програмах ранньої діагностики і профілактики передраку і раку органів жіночої репродуктивної системи. Онкологія, 3: 1–6.
10. Пароконная А.А., Поспехова Н.И., Любченко Л.Н. и др. (2009) Рак молочной железы или яичников в составе наследственного онкологического синдрома. Опухоли женской репродуктивной системы, 1: 59–63.
11. Паяниди Ю.Г., Сельчук В. Ю., Жорданиа К. И. и др. (2006) Полинеоплазии женского генитального тракта: первично-множественные новообразования или метастазы? Архив. патол., 68(4): 16–20.
12. Поліщук Л.З. (2010) Основи клінічної онкогенетики. Онкологія. Вибрані лекції: 475–495.
13. Попова Т.Н., Селезнева Т.Д., Барсуков В.Ю., Федоров В.Э. (2011) Особенности течения и трудности диагностики множественных злокачественных новообразований. Мед. альманах, (2): 157–160.
14. Скоропад В.Ю., Бердов Б.А., Рухадзе Г.О. (2012) Полинеоплазии у больных раком желудка. Закономерности развития. Результаты лечения. Вопр. онкол., 6: 754–61.
15. Чиссов В.И., Трахтенберг А.Х. (2000) Первично-множественные злокачественные опухоли.// Под ред. В.И. Чиссова, А.Х. Трахтенберга. Руководство для врачей. Медицина, Москва: 7–39.
16. Щепотін І.Б., Зотов О.С., Енгел О.Т. (2009) Первинно-множинні злоякісні пухлини органів жіночої репродуктивної системи. Онкология, 11(4): 249–53.
17. Buyukasik O., Hasdemir A.O., Gulnerman Y., et al. (2010) Second primary cancers in patients with gastric cancer. Radiol. Oncol., 444): 239–43.
18. Caldarella A., Crocetti E., Taddei G.L., Paci E. (2008) Coexisting endometrial and ovarian carcinomas: a retrospective clinicopathological study. Pathol. Res. Pract., 204: 643–8.
19. Chiang Y.C., Chen C.A., Huang C.Y. et al. (2008) Synchronous primary cancers of the endometrium and ovary. Int. J. Gynecol. Cancer, 18: 159–164.
20. Friedenson B. (2005) BRCA1 and BRCA2 pathways and the risk of cancers other than breast or ovarian. Med. Gen., 7(2): 60.
21. Jakubowska A., Scott R., Menkiszak J. et al. (2003) High frequency of BRCA2 gene mutations in Polish families with ovarian and stomach cancer. Eur. J. Hum. Genet., 11(12): 955–958.
22. Kaneki E., Oda Y., Ohishi Y. et al. (2004) Frіquent microsatellite instability in synchronous ovarian and endometrial adenocarcinoma and its usefulness for differential diagnosis. Hum. Pathol., 35: 1484–93.
23. Kim M.K., Song S.Y., Do I.G. et al. (2011) Synchronous gynecologic malignancy and preliminary results of Lynch syndrome. J. Gynecol. Oncol., 22: 233–8.
24. Lim Y.K., Padma R., Foo L. et al. (2011) Survival outcome of women with synchronous cancers of endometrium and ovary: a 10 year retrospective cohort study. J. Gynecol. Oncol., 22: 239–243.
25. Ma S.K., Zhang H.T., Sun Y.C., Wu L.Y. (2008) Synchronous primary cancers of the endometrium and ovary: review of 43 cases. Zhonghua Zhong Liu Za Zhi, 30(9): 690–4.
26. Meindl A., Ditsch N., Kast K. et al. (2011) Hereditary breast and ovarian cancer: new genes, new treatments, new concepts. Dtsch .Arztebl. Int., 108(19): 323–30.
27. Mendes A., Chiquelho R., Santos T.A., Sousa L. (2010) Family matters: examining a multi-family group intervention for women with BRCA mutations in the scope of genetic counseling. J. Community Genet., 1(4):161–8.
28. Soliman P.T., Broaddus R.R., Schmeler K.M. et al. (2005) Women with synchronous primary cancers of the endometrium and ovary: do they have Lynch syndrome? J. Clin. Oncol., 23: 9344–50.
29. Sowter H.M., Ashworth A. (2005) BRCA1 and BRCA2 as ovarian cancer susceptibility genes. Carcinogenesis, 26(10): 1651–6.
30. Yoo H.J., Park S.Y., Lim M.C. et al. (2012) Hereditary portion as an initial genetic approach in gynecologic cancer: synchronous tumor of ovary and endometrium J. Gynecol. Oncol., 23(1): 72–73.
Роль генетических факторов в предрасположенности к развитию первично-множественных опухолей женской репродуктивной системы
Резюме. Проведены клинические, клинико-генеалогические и молекулярно-генетические исследования у 47 больных (возраст от 23 до 83 лет) с первично-множественными злокачественными опухолями (ПМЗО) органов женской репродуктивной системы (ОЖРС), в семьях которых болели раком родственники І и ІІ степени родства. Представлена характеристика синхронных и метахронных ПМЗО, последние у 75% больных возникали в возрасте старше 50 лет. Среди метахронных опухолей у больных раком ОЖРС чаще всего диагностировали рак тела матки (39,6%), рак яичника (20,8%), рак грудной железы (14,6%), что может свидетельствовать об общих механизмах патогенеза первичных и вторичных опухолей. Результаты клинико-генеалогического исследования свидетельствуют о наследственном характере заболевания у пробандов: семейный раковый синдром установлен в 12,8% родословных с агрегацией опухолей разного генеза, в 6% — наследственный рак яичника, матки, грудной железы. По результатам молекулярно-генетических исследований в опухолях 8 (18,2%) из 44 обследованных пациенток выявлены мутации 5382insC в гене BRCA1 и 6174delT в BRCA2, что является свидетельством роли генетических факторов в развитии ПМЗО ОЖРС. Клинико-генеалогический анализ родословных и выявление мутаций в генах BRCA1, BRCA2 следует расценивать как неотъемлемую часть комплексного обследования больных раком ОЖРС для определения генетического риска развития вторичных опухолей и разработки принципов генетической профилактики рака у их родственников.
Ключевые слова: рак органов женской репродуктивной системы, первично-множественные злокачественные опухоли, семейный раковый синдром, наследственный рак, гены BRCA1 і BRCA2, мутации.
Genetic factors and their role in the predispozitioned to formation of multiple primary malignancies of the female reproductive system
Summary. There were conducted the clinical-genealogic and molecular-genetic studies of tumor processes in 47 patients (aged 23 to 83 years) with multiple primary malignancies of the female reproductive system from the families whose relatives (first and second genetic relationship) had cancer. The clinical-genealogic data have proved about hereditary cancer diseases — 12,8% in patients with cancer family syndrome, 6% in patients with cancer of ovarian, cervix or breast. The results of molecular-genetic studies in 8 tumors (18,2%) of 44 examined patients were identified 5382insC in BRCA1 gene and 26472delT in BRCA2 gene mutations. The clinical-genealogic pedigree analysis should be viewed as part of a comprehensive survey in the families with malignant tumor pathology aggregation for determining the genetic risk of cancer in healthy relatives of probands and its prevention in the members of such families.
Key words: cancer of female reproductive system, multiple primary malignancies, cancer family syndrome, family cancer, genes BRCA1/2, mutations.














Leave a comment