Фактори, асоційовані з розвитком прогностично несприятливих мутацій генів TP53 і SF3B1 у хворих на хронічний лімфолейкоз
Абраменко И.В.1, Билоус Н.И.1, Крячок И.А.2, Мартина З.В.1, Дягиль И.С.1, Чумак А.А.1
- 1ДУ «Національний науковий центр радіаційної медицини Національної академії медичних наук України», Київ
- 2Національний інститут раку, Київ
Резюме. Мета дослідження — ідентифікація факторів, асоційованих з наявністю прогностично несприятливих мутацій генів TP53 і SF3B1 у хворих на хронічний лімфолейкоз (ХЛЛ). Мутації гена ТР53 досліджено у 261 пацієнта з ХЛЛ, у 244 — в поєднанні з визначенням мутацій гена SF3B1 методом прямого ДНК-секвенування у комплексі з іншими факторами прогнозу (клініко-гематологічні, мутаційний статус генів варіабельних ділянок важких ланцюгів імуноглобулінів (IGHV), поліморфізм генів CD38, регуляції апоптозу та репарації ДНК). Із проаналізованих чинників на частоту мутацій генів TP53 і SF3B1 вплив мали мутаційний статус IGHV генів і поліморфізм rs1042522 TP53. При генотипах Arg/Arg і Arg/Pro та експресії немутованих (UM) IGHV генів ризик розвитку мутацій TP53 і SF3B1 був підвищений порівняно з хворими з експресією мутованих (М) IGHV генів (відношення шансів (ВШ) 1,182; 95% довірчий інтервал (ДІ) 1,083–1,290; р=0,003). У пацієнтів із М IGHV генами та за генотипів Arg/Arg і Arg/Pro ризик розвитку мутацій підвищувався при експресії генів IGHV4-59, IGHV3-30 та IGHV3-21 порівняно з хворими з експресією інших М IGHV генів (ВШ 1,430; 95% ДІ 1,026–1,993; р=0,001). Пацієнти з генотипом Pro/Pro є групою ризику за розвитком мутацій ТР53 і SF3B1 незалежно від мутаційного статусу та експресії окремих IGHV генів. Вивчення мутаційного статусу, експресії окремих IGHV генів і генотипу за поліморфізмом rs1042522 гена ТР53 може бути використано як фактор ризику розвитку мутацій TP53 і SF3B1 у хворих на ХЛЛ.
Резюме. Цель исследования — идентификация факторов, ассоциированных с наличием прогностически неблагоприятных мутаций генов TP53 и SF3B1 у больных хроническим лимфолейкозом (ХЛЛ). Мутации гена TP53 исследованы у 261 пациента с ХЛЛ, у 244 — в сочетании с определением мутаций гена SF3B1 методом прямого ДНК-секвенирования в комплексе с другими факторами прогноза (клинико-гематологические, мутационный статус генов вариабельных участков тяжелых цепей иммуноглобулинов (IGHV), полиморфизм генов CD38, регуляции апоптоза и репарации ДНК). Из проанализированных факторов на частоту мутаций генов ТР53 и SF3B1 влияли мутационный статус IGHV генов и полиморфизм rs1042522 TP53. При генотипах Arg/Arg и Arg/Pro и экспрессии немутированных (UM) IGHV генов риск развития мутаций TP53 и SF3B1 повышен по сравнению с больными с экспрессией мутированных (М) IGHV генов (отношение шансов (ОШ) 1,182; 95% доверительный интервал (ДИ) 1,083–1,290; р=0,003). У пациентов с М IGHV генами и генотипами Arg/Arg и Arg/Pro риск развития мутаций повышен при экспрессии генов IGHV4-59, IGHV3-30 и IGHV3-21 по сравнению с больными с экспрессией других М IGHV генов (ОШ 1,430; (95% ДИ 1,026–1,993; р=0,001). Пациенты с генотипом Pro/Pro являются группой риска по развитию мутаций TP53 и SF3B1 независимо от мутационного статуса и экспрессии отдельных IGHV генов. Изучение мутационного статуса, экспрессии отдельных IGHV генов и генотипа по полиморфизму rs1042522 гена TP53 может быть использовано в качестве фактора риска развития мутаций TP53 и SF3B1 у больных ХЛЛ.

Введение
Широкое внедрение методов молекулярной биологии позволило идентифицировать мутации ряда генов, имеющие негативное прогностическое значение при хроническом лимфолейкозе В-клеточной природы (В-ХЛЛ).
Прежде всего, это мутации гена ТР53. Делеции хромосомы 17p13 в области локализации ТР53 известны давно. Частота их выявления составляет 3–8% у пациентов с впервые диагностированной болезнью и возрастает до 30% в группе больных с резистентностью к терапии, а наличие мутаций приводит к значительному сокращению продолжительности общей (overall survival) и безрецидивной (progression-free survival) выживаемости [1, 2]. Установлено, что делеция одного аллеля гена ТР53 в 75–80% случаев сочетается с появлением мутаций гена ТР53 второго аллеля. В отсутствие делеции 17р13 мутации гена ТР53 выявляют в 5–10% случаев [3, 4]. Наличие изолированных мутаций ТР53 имеет такое же негативное прогностическое значение, как и делеция 17р13 [5].
В 2011 г. выявлены новые прогностически неблагоприятные мутации, а именно мутации гена SF3B1, который кодирует рибонуклеопротеин, в комплексе с другими белками участвующий в образовании зрелой мРНК посредством удаления интронов из предшественников мРНК [6].
Частота выявления указанных мутаций ТР53 и SF3B1 возрастает по мере прогрессирования заболевания [7]. Более того, для больных с нарушениями ТР53 показано, что наибольшую опасность представляют не делеции 17р, которые определяют при диагностике ХЛЛ, а приобретенные в процессе эволюции клона. Так, медиана общей выживаемости пациентов с делением 17р de novo составляет 4–5 лет и только 1–1,5 года — больных с приобретенной делецией (после ее появления) [8]. Поэтому цель нашей работы заключалась в идентификации факторов, ассоциирующихся с появлением прогностически неблагоприятных мутаций генов ТР53 и SF3B1, что позволит выделить группу больных повышенного риска относительно их развития.
Объект и методы исследования
Исследования проведены у больных В-ХЛЛ, находящихся на лечении в ГУ «Национальный научный центр радиационной медицины НАМН Украины» (ННЦРМ), согласно протоколу, утвержденному комитетом по медицинской этике ННЦРМ. Заболевание диагностировали на основании клинико-гематологических данных и иммунофенотипирования лимфоцитов периферической крови. Стадию заболевания устанавливали по классификациям Rai и Binet.
Определение мутаций обоих генов (ТР53 и SF3B1) проведено у 244 больных В-ХЛЛ. Кроме этого, у 17 пациентов исследованы только мутации гена ТР53.
Генетические исследования проводили с использованием венозной крови, собранной в пробирки с антикоагулянтом. ДНК получали с помощью наборов QIAamp Blood Mini Kit (Qiagen, Великобритания) согласно инструкциям производителя.
Мутации ТР53 (экзоны 3–10) и SF3B1 (экзоны 14–16) определяли методом прямого ДНК-секвенирования на автоматическом секвенаторе ABI Prism 3100 (Applied Biosystems). Выбор участков генов для исследования был обусловлен сведениями о более частом развитии мутаций в указанных экзонах.
Мутационный статус генов вариабельных участков тяжелых цепей иммуноглобулинов (immunoglobulin heavy-chain variable — IGHV) изучали методом полимеразной цепной реакции, как описано ранее [9].
В качестве возможных факторов, влияющих на частоту появления прогностически неблагоприятных мутаций, исследовали полиморфизмы замены одного нуклеотида (single nucleotide polymorphisms — SNP), для которых ранее была показана функциональная значимость и ассоциация с клиническими параметрами больных ХЛЛ.
Изучали следующие полиморфизмы генов:
- участвующих в процессах репарации ДНК (XRCC1, rs25487; XPD, rs13181; XRCC3, rs861539) [10];
- ассоциированных с развитием апоптоза (rs1042522 TP53, rs1801270 p21, rs2279744 (SNP309) MDM2) [11];
- полиморфизм rs6449182 гена CD38, влияющий на эффективность передачи сигналов пролиферации в лейкемических клетках [12].
Статистическую обработку полученных данных проводили в программе SPSS 17.0 software package (SPSS, США). Частоту мутаций анализировали в зависимости от клинико-гематологических параметров пациентов и фазы заболевания на момент исследования мутаций (первичные пациенты, в динамике развития заболевания), мутационного статуса IGHV генов, полиморфных вариантов отдельных генов. Критическим значением вероятности различий считали p<0,05.
Результаты исследования
Частота мутаций генов ТР53 и SF3B1 у обследованных больных ХЛЛ и их прогностическое значение. Мутации гена ТР53 были выявлены у 28 (10,7%) из 261 пациента. Частота мутаций была минимальной при диагностике заболевания (5 (3,9%) из 129 пациентов) и возрастала у больных, обследованных в динамике опухолевого процесса (23 (21,1%) из 109; р=0,001).
Мутации гена SF3B1 присутствовали у 23 (9,4%) из 244 обследованных больных, достоверных различий в частоте при диагностике заболевания (у 8 (6,6%) из 122) и в динамике процесса (у 15 (12,3%) из 122) не выявлено (р=0,125).
У пациентов с впервые выявленным заболеванием мутации ТР53 и SF3B1 встречались изолированно, но у 5 больных, обследованных позднее, мутации обоих генов были определены одновременно.
Наличие мутаций генов ТР53 и SF3B1 имело негативное влияние на продолжительность общей и безрецидивной выживаемости больных (рис. 1, 2).
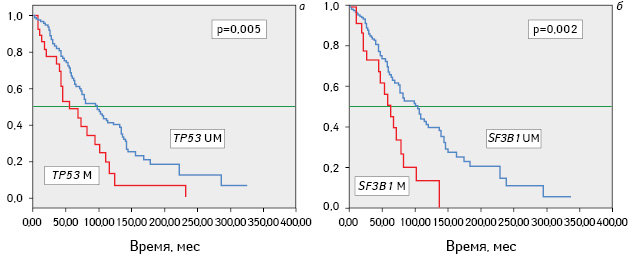
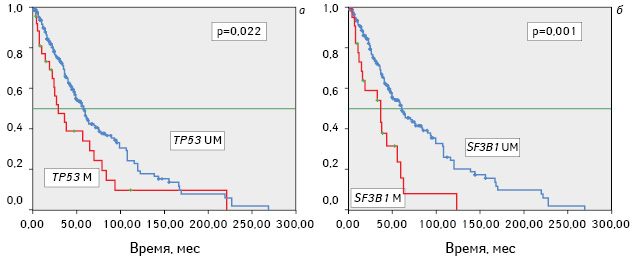
Частота мутаций генов ТР53 и SF3B1 у обследованных больных ХЛЛ в зависимости от клинико-гематологических данных. Частота мутаций ТР53 и SF3B1, выявленных при диагностике ХЛЛ и позднее в динамике процесса (анализ проведен отдельно), была одинаковой у мужчин и женщин, не зависела от возраста, в котором возникло заболевание, и показателей инициального лейкоцитоза (табл. 1). Большинство пациентов с впервые выявленным заболеванием, у которых присутствовали мутации ТР53 и SF3B1, имели ранние стадии опухолевого процесса и не отличались по этому показателю от больных, у которых мутации развились позже или не развились на протяжении времени наблюдения.
Таблица 1. Характеристика обследованных пациентов с наличием/отсутствием мутации генов TP53 и SF3B1
| Показатель | Наличие мутаций генов ТР53 и SF3B1 | |||
| Пациенты, обследованные при диагностике, n (%) | Пациенты, обследованные в динамике заболевания, n (%) | |||
| есть (n=13) | нет (n=109) | есть (n=33) | нет (n=89) | |
| Мужчины | 9 (69,2) | 75 (68,8) | 28 (84,8) | 70 (78,7) |
| Женщины | 4 (30,8) | 34 (31,2) | 5 (15,2) | 19 (21,3) |
| Вероятность | 0,975 | 0,44 | ||
| Возраст, лет | 61,84±2,27 | 59,16±0,94 | 57,63±1,66 | 55,73±0,98 |
| Вероятность | 0,347 | 0,322 | ||
| Стадия по Binet | ||||
| A | 11 (84,6) | 80 (73,4) | 10 (30,3) | 26 (29,2) |
| B | 2 (15,4) | 25 (22,9) | 19 (57,6) | 40 (44,9) |
| C | 0 | 4 (3,7) | 4 (12,1) | 23 (25,9) |
| Вероятность | 0,615 | 0,240 | ||
| Лейкоциты, Г/л | 28,54±7,82 | 28,88±2,83 | 71,61±13,62 | 61,74±8,18 |
| Вероятность | 0,968 | 0,534 | ||
| M IGHV гены | 3 (25,0) | 59 (54,6) | 7 (22,2) | 19 (21,6) |
| UM IGHV гены | 9 (75,0) | 49 (45,4) | 24 (77,4) | 69 (78,4) |
| Вероятность | 0,051 | 0,909 | ||
Так, из 5 первичных пациентов с мутациями ТР53 у 4 опухолевый процесс выявлен в стадии А, у 1 — в стадии В; из 8 первичных больных с мутациями SF3B1 у 7 установлена стадия А, 1 — стадия В. Таким образом, по клиническим параметрам при обследовании (стадия, возраст, пол, инициальный лейкоцитоз) невозможно было прогнозировать, какие пациенты имеют прогностически неблагоприятные мутации.
Мутационный статус IGHV генов был определен у 239 (97,9%) из 244 больных, у которых исследовались мутации двух генов (ТР53 и SF3B1). У пациентов с немутированным статусом (UM) IGHV генов по сравнению с экспрессией мутированных (М) IGHV генов несколько чаще развивались мутации ТР53 и/или SF3B1: 21,9 и 11,4% соответственно; р=0,042 (отдельно частота мутации гена ТР53 — 12,3% против 6,5%; р=0,138; частота мутаций гена SF3B1 — 11,3% против 5,7%; р=0,149). Однако это касалось исключительно частоты мутаций SF3B1 у первичных пациентов, которые были выявлены в этой подгруппе только при UM IGHV генах в 12,1% случаев и отсутствовали при экспрессии М IGHV генов (р=0,005). Частота мутаций гена ТР53 у больных с впервые выявленным патологическим процессом при M и UM IGHV генах не различалась: 4,5 и 3,3% соответственно (р=0,714).
У пациентов, обследованных в динамике заболевания, различий в частоте мутаций генов ТР53 (11,1 и 17,6%; р=0,413) и SF3B1 (19,2 и 10,8%; р=0,250) при M и UM IGHV генах не выявлено.
Частота мутаций генов ТР53 и SF3B1 у обследованных больных ХЛЛ в зависимости от изученных полиморфизмов генов репарации ДНК, CD38 и регуляторов процессов апоптоза. Из всех проанализированных полиморфизмов влияние на частоту мутаций генов ТР53 и SF3B1 имел только полиморфизм rs1042522 гена ТР53 (табл. 2).
Таблица 2. Частота мутаций генов ТР53 и SF3B1 у носителей различных генотипов по исследованным полиморфизмам
| Мутации генов при разных генотипах | Количество пациентов с генотипами, n (%) | р | ||
| Генотип rs1042522 TP53 | Arg/Arg | Arg/Pro | Pro/Pro | |
| TP53 | 9 (7,3) из 124 | 11 (10,2) из 108 | 8 (28,6) из 28 | 0,002 |
| SF3B1 | 12 (10,1) из 119 | 4 (4,1) из 97 | 7 (25,0) из 28 | 0,004 |
| TP53 и SF3B1 | 19 (16,0) из 119 | 15 (15,5) из 97 | 12 (42,9) из 28 | 0,003 |
| Генотип rs1801270 р21 | Arg/Arg | Arg/Ser | Ser/Ser | |
| TP53 | 1 (50,0) из 2 | 2 (5,6) из 36 | 23 (11,6) из 199 | 0,211 |
| SF3B1 | 0 из 2 | 1 (3,3) из 30 | 21 (11,1) из 190 | 0,438 |
| TP53 и SF3B1 | 1 (50,0) из 2 | 3 (10,0) из 30 | 33 (20,5) из 190 | 0,315 |
| Генотип MDM2 SNP309 | TT | TG | GG | |
| TP53 | 7 (6,2) из 113 | 12 (12,2) из 98 | 4 (17,4) из 23 | 0,342 |
| SF3B1 | 9 (8,7) из 103 | 10 (10,8) из 93 | 3 (14,3) из 21 | 0,601 |
| TP53 и SF3B1 | 14 (13,6) из 103 | 20 (21,5) из 93 | 6 (28,6) из 21 | 0,285 |
| Генотип rs6449182 CD38 | СС | СG | GG | |
| TP53 | 15 (12,0) из 125 | 10 (10,6) из 94 | 2 (7,7) из 26 | 0,856 |
| SF3B1 | 8 (6,9) из 116 | 10 (11,4) из 88 | 4 (16,7) из 24 | 0,404 |
| TP53 и SF3B1 | 21 (18,1) из 116 | 18 (20,5) из 88 | 5 (20,8) из 24 | 0,879 |
| Генотип rs25487 XRCC1 | Arg/Arg | Arg/Gln | Gln/Gln | |
| TP53 | 6 (10,9) из 55 | 9 (13,2) из 68 | 3 (13,0) из 23 | 0,784 |
| SF3B1 | 4 (7,4) из 54 | 6 (10,0) из 60 | 3 (13,0) из 23 | 0,889 |
| TP53 и SF3B1 | 7 (13,0) из 54 | 14 (23,3) из 60 | 5 (21,7) из 23 | 0,544 |
| Генотип rs13188 XPD | Lys/Lys | Lys/Gln | Gln/Gln | |
| TP53 | 7 (14,9) из 47 | 7 (9,5) из 74 | 2 (10,0) из 20 | 0,788 |
| SF3B1 | 4 (9,3) из 43 | 7 (9,9) из 71 | 1 (5,6) из 18 | 0,950 |
| TP53 и SF3B1 | 10 (23,3) из 43 | 12 (16,9) из 71 | 2 (11,1) из 18 | 0,689 |
| Генотип rs861539 XRCC3 | Thr/Thr | Thr/Met | Met/Met | |
| TP53 | 7 (11,3) из 62 | 9 (15,8) из 57 | 1 (5,0) из 20 | 0,457 |
| SF3B1 | 5 (8,5) из 59 | 7 (13,5) из 52 | 1 (5,3) из 18 | 0,683 |
| TP53 и SF3B1 | 11 (18,6) из 59 | 13 (25,0) из 52 | 1 (5,3) из 18 | 0,309 |
При генотипе Pro/Pro при сравнении с носителями других генотипов частота развития неблагоприятных мутаций возрастала как у пациентов с впервые диагностированным опухолевым процессом (р=0,007), так и у больных, обследованных в динамике заболевания (р=0,027) (рис. 3).
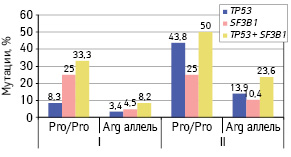
При этом у первичных больных при генотипе Pro/Pro по сравнению с другими генотипами была выше частота мутаций гена SF3B1 (25 и 4,5%; р=0,007), но не гена ТР53 (8,3 и 3,4%; р=0,401). У больных с генотипом Pro/Pro, обследованных в динамике ХЛЛ, преимущественно повышалась частота мутаций гена ТР53 (43,8 и 13,9%; р=0,003) и в меньшей степени — частота мутаций гена SF3B1 (25,0 и 10,3%; р=0,097).
При совместном анализе влияния мутационного статуса IGHV генов и генотипов пациентов по полиморфизму rs1042522 установлено, что повышение частоты мутаций генов ТР53 и SF3B1 у носителей генотипа Pro/Pro выражалось независимо от экспрессии М или UM IGHV генов (р=0,637 — при анализе мутаций ТР53; р=0,535 — при анализе мутаций SF3B1; р=0,484 — при анализе мутаций обоих генов одновременно). Не выявлено также влияния экспрессии отдельных IGHV генов на частоту появления прогностически неблагоприятных мутаций у носителей генотипа Pro/Pro (р=0,543).
Напротив, у носителей аллеля Arg (генотипы Arg/Arg и Arg/Pro) частота прогностически неблагоприятных мутаций была повышена при UM IGHV генах (р=0,029 — при анализе мутаций обоих генов совместно; р=0,081 — при анализе мутаций ТР53; р=0,138 — при анализе мутаций SF3B1) (рис. 4).
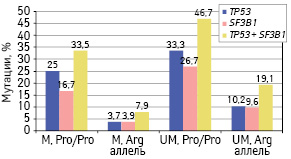
Кроме того, у носителей Arg аллеля при М IGHV генах (группа составила 76 пациентов) мутации генов ТР53 и SF3B1 были выявлены преимущественно при экспрессии генов IGHV3-21, IGHV3-30 и IGHV4-59: 5 (31,3%) больных с мутациями из 16 пациентов с экспрессией указанных генов по сравнению с 1 (1,7%) пациентом из 60 с экспрессией других М IGHV генов (χ=15,203; р=0,001). Эти различия проявлялись как у первичных пациентов (20 и 0%; р=0,002), так и у больных, обследованных в динамике опухолевого процесса (50 и 6,7%; р=0,022). При UM IGHV генах отличий в частоте прогностически неблагоприятных мутаций у носителей Arg аллеля в зависимости от экспрессии отдельных IGHV генов не выявлено (р=0,446).
У больных — носителей генотипов Arg/Arg и Arg/Pro при отсутствии экспрессии генов IGHV3-21, IGHV3-30 и IGHV4-59 частота прогностически неблагоприятных мутаций зависела от мутационного статуса IGHV генов и была выше при UM, чем при М IGHV генах (р=0,043 — при выявлении мутаций ТР53; р=0,021 — при выявлении мутаций SF3B1 и р=0,003 — при выявлении мутаций обоих генов). У пациентов с экспрессией IGHV3-21, IGHV3-30 и IGHV4-59 генов, носителей указанных генотипов, частота развития мутаций ТР53 и SF3B1 не зависела от мутационного статуса IGHV генов (р=0,723 — при выявлении мутаций ТР53; р=0,935 — при выявлении мутаций SF3B1 и р=0,805 — при выявлении мутаций обоих генов) (рис. 5).
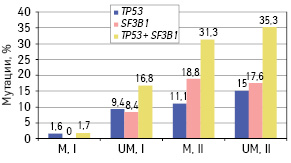
Комплексное влияние генотипов по полиморфизму rs1042522 TP53, мутационного статуса и экспрессии отдельных IGHV генов обобщено в табл. 3.
Таблица 3. Частота мутаций генов ТР53 и SF3B1 у больных ХЛЛ — носителей отдельных генотипов гена ТР53 по полиморфизму rs1042522 с учетом мутационного статуса и экспрессии отдельных IGHV генов
|
Генотипы ТР53 по полиморфизму rs1042522 |
Частота мутаций генов ТР53 и SF3B1 | ||
| Без учета мутационного статуса IGHV генов | Мутационный статус IGHV генов | ||
|
мутированные (M) |
немутированные (UM) |
||
| Pro/Pro (n=28) | 42,9% | 33,3% против 7,9% при других генотипах; р=0,010 | 46,7% против 19,1% при других генотипах; р=0,014 |
| Влияния экспрессии отдельных IGHV генов не выявлено | |||
| Arg/Arg и Arg/Pro (n=216) | 15,7% (достоверно ниже по сравнению с генотипом Pro/Pro; р=0,001) | 7,9%. Риск повышен при экспрессии IGHV4-59, IGHV3-30 и IGHV3-21 по сравнению с экспрессией других IGHV генов (31,3 и 1,7%; р=0,001) | 19,1% (достоверно выше по сравнению с М IGHV генами; р=0,029). Влияния экспрессии отдельных IGHV генов не выявлено |
Обсуждение полученных результатов
Полученные нами данные в отношении повышения частоты мутаций гена ТР53 у носителей генотипа Pro/Pro совпадают с результатами, представленными ранее V. Grossmann и соавторами [13] и H. Dong и соавторами [14]. Повышение частоты мутаций гена SF3B1 у носителей этого генотипа выявлено нами впервые.
Полиморфизм rs1042522 TP53 является функционально значимым и приводит к экспрессии белка р53 с позитивно заряженной боковой цепью (генотип Arg/Arg, экспрессия аргинина) или же с неполярной — алифатической боковой цепью (генотип Pro/Pro, экспрессия пролина). Предполагают, что замещение одной аминокислоты изменяет биохимические характеристики белка и влияет на эффективность связывания с компонентами транскрипционных комплексов [15]. По-видимому, с этим ассоциировано и влияние генотипов rs1042522 TP53 на частоту появления мутаций генов ТР53 и SF3B1.
На основании полученных результатов представляется возможным предложить следующий алгоритм определения риска развития прогностически неблагоприятных мутаций генов:
- при обследовании больных ХЛЛ целесообразно проводить определение мутационного статуса IGHV генов, экспрессии отдельных IGHV генов и генотипа по полиморфизму rs1042522 гена ТР53;
- при генотипах Arg/Arg и Arg/Pro пациенты с экспрессией UM IGHV генов по сравнению с больными с экспрессией М IGHV генов являются группой риска по развитию мутаций ТР53 и SF3B1 генов (отношение шансов (ОШ) 1,182; 95% доверительный интервал (ДИ) 1,083–1,290; р=0,003);
- при генотипах Arg/Arg и Arg/Pro риск развития мутаций ТР53 и SF3B1 генов для больных с М IGHV генами повышен только при экспрессии генов IGHV4-59, IGHV3-30 и IGHV3-21 по сравнению с пациентами с экспрессией других М IGHV генов (ОШ 1,430; 95% ДИ 1,026–1,993; р=0,001);
- больные с генотипом Pro/Pro по полиморфизму rs1042522 гена ТР53 являются группой риска по развитию мутаций ТР53 и SF3B1 генов независимо от мутационного статуса IGHV генов и экспрессии отдельных IGHV генов.
Список использованной литературы
1. Wawrzyniak E., Kotkowska A., Blonski J.Z. et al. (2014) Clonal evolution in CLL patients as detected by FISH versus chromosome banding analysis, and its clinical significance. Eur. J. Haemat., 92(2): 91–101.
2. Rossi D., Rasi S., Spina V. et al. (2013) Integrated mutational and cytogenetic analysis identifies new prognostic subgroups in chronic lymphocytic leukemia. Blood, 121(8): 1403–1412.
3. Dicker F., Herholz H., Schnittger S. et al. (2009) The detection of TP53 mutations in chronic lymphocytic leukemia independently predicts rapid disease progression and is highly correlated with a complex aberrant karyotype. Leukemia, 23(1): 117–124.
4. Gonzalez D., Martinez P., Wade R. et al. (2011) Mutational status of the TP53 gene as a predictor of response and survival in patients with chronic lymphocytic leukemia: results from the LRF CLL4 trial. J. Clin. Oncol., 29(10): 2223–2229.
5. Malcikova J., Pavlova S., Rozubik K.S. et al. (2014) TP53 mutation analysis in clinical practice: lessons from chronic lymphocytic leukemia. Hum. Mutat., 35(6): 663–671.
6. Wang L., Lawrence M.S., Wan Y. et al. (2011) SF3B1 and other novel cancer genes in chronic lymphocytic leukemia. N. Engl. J. Med., 365: 2497–2506.
7. Rossi D., Fangazio M., Gaidano G. (2012) The spectrum of genetic defects in chronic lymphocytic leukemia. Mediterr. J. Hematol. Infect. Dis., 4(1): e2012076.
8. Tam C.S., Shanafelt T.D., Wierda W.G. et al. (2009) De novo deletion 17p13.1 chronic lymphocytic leukemia shows significant clinical heterogeneity: the M.D. Anderson and Мayo Clinic experience. Blood, 114(5): 957–964.
9. Kryachok I., Abramenko I., Bilous N. et al. (2012) IGHV gene rearrangements as outcome predictors for CLL patients: experience of Ukrainian group. Med. Oncol., 29(2): 1093–1101.
10. Abramenko I., Bilous N., Chumak A. et al. (2012) DNA repair polymorphisms in B-cell chronic lymphocytic leukemia in sufferers of Chernobyl nuclear power plant accident. J. Rad. Res., 53(3): 497–503.
11. Abramenko I.V., Bilous N.I, Chumak A.A. et al. (2014) Gene polymorphisms of p53-mediated apoptosis in chronic lymphocytic leukemia patients: features of distribution depending on radiation factor in anamnesis. Probl. Radiac. Med. Radiobiol., 19: 223–230.
12. Abramenko I.V., Bilous N.I., Pleskach G.V. et al. (2012) CD38 gene polymorphism and risk of chronic lymphocytic leukemia. Leuk. Res., 36(10): 1237–1240.
13. Grossmann V., Artusi V., Schnittger S. et al. (2011) The TP53 codon72 polymorphism is associated with TP53 mutations in chronic lymphocytic leukemia. ASH-2011, 641: 1178.
14. Dong H., Fang C., Wang L. et al. (2014) TP53 Pro72 allele potentially increases the poor prognostic significance of TP53 mutation in chronic lymphocytic leukemia. Med. Oncol., 31: 908–911.
15. Grochola L.F., Zeron-Medina J., Meriaux S., Bond G.L. (2010) Single-nucleotide polymorphisms in the p53 signaling pathway. Cold Spring Harb. Perspect. Biol., 13(5): a001032.
Адрес:
Абраменко Ирина Викторовна
04050, Киев, ул. Мельникова, 53
ГУ «Национальный научный центр радиационной медицины НАМН Украины»
Тел.: (044) 452-00-24
E-mail: nbilous@yahoo.com














Leave a comment