Інтерпретація результатів визначення мутаційного статусу генів варіабельних дільниць важких ланцюгів імуноглобулінів у хворих на хронічну лімфоцитарну лейкемію
Абраменко И.В.1, Белоус Н.И.1, Мартина З.В.1, Чумак А.А.1, Крячок И.А.2
- 1ДУ «Національний науковий центр радіаційної медицини Національної академії медичних наук України», Київ
- 2Національний інститут раку, Київ
Резюме. Стаття узагальнює результати власних досліджень та дані літератури стосовно прогностичного значення перебудови генів важких ланцюгів імуноглобулінів (IGHV) та інтерпретацію результатів дослідження мутаційного статусу IGHV-генів.
В статье обобщены результаты собственных исследований и данных литературы относительно прогностического значения реарранжировки генов тяжелых цепей иммуноглобулинов (IGHV) и интерпретация результатов исследования мутационного статуса IGHV-генов.
Хронический лимфолейкоз (ХЛЛ) В-клеточного происхождения — одна из наиболее распространенных форм лимфоидных новообразований в Украине, США и странах Западной Европы [1, 2]. Широко известны гетерогенность клинического течения ХЛЛ и многообразие факторов, предложенных для оценки его прогноза: характеристики пациентов (возраст, пол, наличие сопуствующей патологии) [3, 4], клинико-гематологические (стадия заболевания согласно классификаций К. Rai и J. Binet) [5–7] показатели, маркеры, ассоциированные с пролиферативной активностью опухолевых клеток (концентрация лактатдегидрогеназы, β2-микроглобулина, тимидинкиназы, антигена CD23 в сыворотке крови, период удвоения лимфоцитов) [8–12]. Одним из наиболее важных молекулярно-генетических параметров для определения патогенетических и прогностических подгрупп больных ХЛЛ является мутационный статус IGHV-генов [13, 14].
Понятие «мутационный статус IGHV-генов» тесно связано с онтогенезом В-лимфоцитов и перестройкой (реаранжировкой) генов иммуноглобулинов. В процессе первой перестройки, которая проходит в костном мозге на стадии перехода про-В-лимфоцита в пре-В-лимфоцит, один IGHD-ген (D-diversity) объединяется с одним IGHJ-геном (J-joining) и затем — с одним IGHV-геном. Это приводит к формированию VDJ комплекса, а все остальные гены иммуноглобулинового кластера подлежат делеции. На этом этапе формируется многообразие антигенной специфичности иммуноглобулинов [15]. Второй важный этап, определяющий антигенную специфичность молекулы иммуноглобулина, происходит в зачаточном центре лимфатических узлов после взаимодействия В-лимфоцита с антигеном при костимуляторном участии хелперных Т-лимфоцитов. Он получил название «реакция зародышевого центра» [16]. Его суть заключается в появлении (под влиянием антигена) так называемых соматических гипермутаций (SHM) в нуклеотидной последовательности комплекса перестроенных генов тяжелой цепи иммуноглобулинов — точечных мутаций, вставок и делеций. Частота SHM составляет 10-5–10-3 мутаций на одну пару нуклеотидов за один раунд мутаций, что в миллион раз выше частоты спонтанных мутаций [17].
Случаи заболевания ХЛЛ, в опухолевых клетках которых последовательность оснований IGHV-генов не отличается от последовательностей в зародышевых клетках, считаются немутированными (UM). Наоборот, если последовательность IGHV-генов имеет 2% мутаций и больше, случай расценивается как мутированный (M).
Цель данной работы – показать место определения мутационного статуса IGHV-генов в комплексном прогнозе ХЛЛ.
Основные положения:
1. Мутационный статус IGHV-генов является неизменной характеристикой на протяжении всего заболевания. Известно, что в ряде случаев происходит трансформация ХЛЛ в более агрессивные формы заболевания (синдром Рихтера). По данным большинства исследователей, опухолевые клетки в этом случае сохраняют неизменным мутационный статус IGHV и другие параметры, с ним ассоциированные [18, 19].
2. Мутационный статус IGHV-генов не определяет время начала терапии и на сегодня нет убедительных данных о преимуществах какого-либо вида терапии в зависимости от того, экспрессируют опухолевые клетки М или UM IGHV-гены [20].
3. Мутационный статус IGHV-генов относится к маркерам долговременного прогноза – с его помощью можно достаточно точно спрогнозировать время общей выживаемости (OS) пациента, время прогрессии заболевания (PFS), время до начала терапии (TTT), длительность достигнутой ремиссии, развитие осложнений ХЛЛ. Наиболее информативным является определение мутационного статуса у больных на ранних стадиях ХЛЛ: А0-АI, частично – на стадии ВII [13, 21, 22].
Процесс определения мутационного статуса IGHV-генов достаточно трудоемок и включает следующие этапы: выделение нуклеиновых кислот, обратная транскрипция, амплификация кДНК (реже – геномной ДНК) с помощью смеси 7 праймеров, секвенирование продуктов реакции (реакция повторяется дважды – с вырожденным праймером к IGHJ-гену и затем – с праймером к IGHV-гену конкретного семейства), сопоставление последовательностей и их анализ в доступных базах данных.
В результатах определения мутационного статуса обычно отражено 3 параметра: собственно мутационный статус IGHV-гена и число мутаций в вариабельном фрагменте гена; определение конкретного IGHV-гена, включенного в реарранжировку, стереотипия В-клеточного рецептора. Рассмотрим интрепретацию этих показателей.
1. UM vs M IGHV-ген. Такое заключение устанавливается, если число мутаций в амплифицированной нуклеотидной последовательности IGHV-гена <2% (>2%) и, соответственно, совпадение с герминативной последовательностью ≥98% (<98%). Граничное значение 2% выбрано в связи с тем, что ранее установлено существование полиморфизмов отдельных аллелей IGHV-генов, с которыми может быть связано незначительное отличие анализируемого гена от герминативной последовательности [23].
Прогноз течения заболевания для больных ХЛЛ с UM и M IGHV-генами существенно различается по показателям общей и безрецидивной выживаемости, времени необходимости начала терапии, длительности достигнутых ремиссий заболевания (таблица). Дополнительное значение имеет число мутаций. Т. Hamblin и соавторы показали достоверную разницу в выживаемости больных ХЛЛ при гомологии IGHV-генов ≤97% (хороший прогноз), ≥98% (неблагоприятный прогноз) и 97–98% (промежуточный прогноз) [24]. Наши исследования также подтверждают эти данные: медиана OS больных с М IGHV-генами и числом мутаций >3% (97% совпадения с герминативной последовательностью) составила 274 мес, тогда как при количестве мутаций 2–3% — только 106 мес (рисунок). Дальнейшая стратификация пациентов с М IGHV-генами по числу мутаций (3–5%, ≥5%) не показала достоверных различий в прогностических индексах.
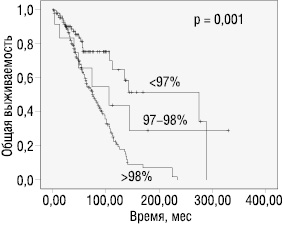
Таблица. Особенности течения больных ХЛЛ в зависимости от мутационного статуса IGHV-генов (на основании собственных исследований, проведенных у 319 больных ХЛЛ)
| Параметры | Мутационный статус IGHV-генов |
Достоверность различий | |
|---|---|---|---|
| М | UM | ||
| OS, медиана, мес | 143 | 75 | 0,0001 |
| PFS, медиана, мес | 88 | 42 | 0,0001 |
| TTT, медиана, мес | 33 | 9 | 0,0001 |
| Ответ на терапию 1-й линии, доля полных и частичных ремиссий (хлорамбуцил), % | 25,0 | 17,7 | >0,05 |
| Ответ на терапию 1-й линии, доля полных и частичных ремиссий (пуриновые аналоги), % | 90,0 | 78,6 | >0,05 |
| Длительность ответа на терапию 1-й линии, мес | 31 | 20 | 0,018 |
| Ответ на терапию 2-й линии, доля полных и частичных ремиссий, % | 64,7 | 44,8 | 0,04 |
| Длительность ответа на терапию 2-й линии, мес | 32 | 14 | 0,003 |
Кроме этого, прогноз пациентов целесообразно определять с учетом клинических данных на момент установления диагноза. Наш анализ свидетельствует о том, что наиболее важными клиническими параметрами являются: СIII–CIV стадия и/или наличие аутоиммунных осложнений и вторичной опухоли (кроме базальноклеточного рака) на момент диагноза ХЛЛ.
У пациентов с такими клиническими признаками вне зависимости от мутационного статуса IGHV-генов отмечают низкие показатели общей выживаемости (медиана 35 мес) и периода до прогрессии (медиана 22 мес).
При отсутствии указанных клинических признаков для больных с UM IGHV-генами, M IGHV и 2–3% мутаций, М IGHV-генами и >3% мутаций медиана общей выживаемости составила 90; 143 и 274 мес соответственно (р=0,0001); медиана беспрогрессивной выживаемости — 48; 88 и 148 мес соответственно (р=0,0001), медиана длительности ответа на терапию 1-й линии – 20; 29 и 36 мес соответственно (р=0,012), медиана длительности ответа на терапию 2-й линии – 14; 9 и 33 мес соответственно (р=0,008).
2. IGHV-ген, включенный в реарранжировку, и стереотипия В-клеточного рецептора.
Как было отмечено выше, в процессе реарранжировки генов иммуноглобулинов принимают участие также гены IGHD и IGHJ. Их объединение создает уникальную структуру 3-го комплементарного региона (HCRD3) – важной части молекулы иммуноглобулина, определяющей авидность к антигену. Учитывая количество функциональных IGHV- (50), IGHD- (около 30), IGHJ-генов (6), вероятность получения одинаковых HCRD3 последовательностей ничтожно мала [25], однако более чем у 20% больных ХЛЛ, проживающих в разных странах, отмечено совпадение HCRD3 областей, что расценивают как доказательство антигенной селекции опухолевого клона [26]. Такие случаи ХЛЛ со стереотипными (или гомологичными) HCRD3 последовательностями объединены в кластеры, количество которых неуклонно возрастает [26–29].
На сегодня только в отношении отдельных кластеров и использованных в реарранжировке IGHV-генов имеются данные об их прогностическом значении. Прежде всего, это касается экспрессии IGHV3-21, принадлежащего к кластеру 2 с аминокислотной последовательностью HCRD3 DANGMDV. По данным большинства исследователей, это независимый негативный маркер прогноза [30, 31]. По нашим данным, кластер 2 выявляют относительно редко, а течение заболевания у таких больных гетерогенное. Нами выявлено 5 таких случаев (1,5% среди всех обследованных больных). Одному пациенту в течение 101 мес с момента установления диагноза не требовалось назначение терапии (находится под наблюдением); у двоих длительный период заболевание было стабильным, хотя в дальнейшем в одном случае развилась трансформация Рихтера (OS 143 мес) и тяжелые инфекционные осложнения — в другом (OS 273 мес); течение заболевания у двоих пациентов было исходно неблагоприятным в связи с наличием аутоиммунной гемолитической анемии (OS 19 и 4 мес соответственно).
С. Chu и соавторы показали, что лейкемические клетки, относящиеся к кластеру 6 (UM IGHV1-69/IGDH3-16/IGJH3), распознают апоптотические клетки с экспрессией тяжелой цепи IIA немышечного миозина, что коррелирует с низкой выживаемостью больных [32]. Аналогичные результаты получены и в нашей когорте больных: медиана OS больных кластера 6 (n=6) составила 53 мес по сравнению с медианой OS 84 мес у больных, экспрессирующих другие UM IGHV1–69 гены (р=0,169).
Напротив, медиана OS больных кластера 7 (n=13; UM IGHV1-2, 1-69, 3-9, 3-15, 3-30, 4-39, 4-59/IGDH3-3/IGJH6) была максимальной (224 мес; р=0,015 по сравнению с OS больных, экспрессирующих такие же UM IGHV-гены) и сравнима с таковой для больных с М IGHV-генами.
Больные с экспрессией UM IGHV1-69, IGHV3-11 и IGHV4-59 и стереотипными рецепторами (вне зависимости от принадлежности к какому-либо кластеру) в нашем исследовании составили группу риска развития аутоиммунной гемолитической анемии (odds ratio — 3,671; 95% доверительный интервал 1,575–8,561; p=0,002). У больных с экспрессией IGHV3-21-гена (независимо от его мутационного статуса и стереотипии В-клеточного рецептора) достоверно чаще развивались вторичные солидные опухоли (35,3% по сравнению с 12,9% в целом по группе больных ХЛЛ; р=0,005).
Исследования прогностического значения экспрессии отдельных IGHV-генов и стереотипии HCDR3 региона в настоящее время интенсивно продолжаются.
Таким образом, исследование мутационного статуса IGHV-генов и ассоциированных с ним параметров может представлять интерес для практикующих врачей-гематологов для оценки прогноза течения заболевания у больных ХЛЛ.
Литература
1. Волкова М.А. (2001) Клиническая онкогематология. М., Медицина: 576.
2. Brunning R.D., McKenna R.W. (1993) Tumors of the bone marrow. Washington, DC: Armed Forces Inst. Pathol.: 406.
3. Caligaris-Cappio F., Scielzo C., Camporeale A. et al. (2005) Biology of chronic lymphocytic leukemia: new perspectives. Hematology., 1: 192–195.
4. Oscier D.G., Gardiner A.C., Mould S.J. et al. (2002) Multivariate analysis of prognostic factors in CLL: clinical stage, IGVH gene mutational status, and loss or mutation of the p53 gene are independent prognostic factors. Blood, 100: 1177–1184.
5. Rai K.R., Sawitzky A., Cronkite E.P. et al. (1975) Clinical staging of chronic lymphocytic leukemia. Blood, 46(2): 219–224.
6. Rai K.R. (1987) A critical analysis of staging in CLL. Chronic lymphocytic leukemia. Recent progress and future direction. New York: Alan R. Liss.: 253.
7. Binet J.L., Auguier A., Dighiero G. et al. (1981) A new prognostic classification of chronic lymphocytic leukemia derived from a multivariante survival analysis. Cancer, 48(1): 198–205.
8. Krober A., Seiler T., Benner A. et al. (2002) V(H) mutation status, CD38 expression level, genomic aberrations, and survival in chronic lymphocytic leukemia. Blood, 100: 1410–1416.
9. Rozman C., Monserral E. (1995) Chronic lymphocytic leukemia. N. Eng l. J. Med., 133: 1054–1057.
10. Montserrat E., Sanchez-Bisono J., Vinolas N. et al. (1986) Lymphocyte doubling time in chronic lymphocytic leukemia: analysis of its prognostic significance. Br. J. Hematol., 62: 567–575.
11. Hallek M., Langenmayer I., Nerl C. et al. (1999) Elevated serum thymidine kinase levels identify a subgroup at high risk of disease progression in early, nonsmoldering chronic lymphocytic leukemia. Blood, 93: 1732–1737.
12. Keating M.J. (1998) Chronic lymphocytic leukemia in the next decade: where do we go from here? Semin. Hematol., 35: 27–33.
13. Hamblin T.J., Davis Z., Garddiner A. et al. (1999) Unmutated Ig V(H) genes are associated with a more aggressive form of chronic lymphocytic leukemia. Blood, 94: 1848–1854.
14. Damle R.N., Wasil T., Fais F. et al. (1999) Ig V gene mutation status and CD38 expression as novel prognostic indicators in chronic lymphocytic leukemia. Blood, 94: 1840–1847.
15. Jung D., Alt F.W. (2004) Unraveling V(D)J recombination; insights into gene regulation. Cell., 116(2): 299–304.
16. Kelsoe G. (1996) The germinal center: a crucible for lymphocyte selection. Seminars Immunology, 6: 179–197.
17. Papavasiliou F.N., Schatz D.G. (2002) Somatic hypermutation of immunoglobulin genes: merging mechanisms for genetic diversity. Cell., 109 (Suppl. 1. S.): 35–39.
18. Smit L.A., van Maldegem F., Lahgerak A.W. et al. (2006) Antigen receptors and somatic hypermutation in B-cell chronic lymphocytic leukemia with Richter‘s transformation. Haematologica, 91( 7): 903–911.
19. Timar B., Fulop Z., Csernus B. et al. (2004) Relationship between the mutational status of VH genes and pathogenesis of diffuse large B-cell lymphoma in Richter’s syndrome. Leukemia, 18(2): 326–330.
20. van Bockstaele F., Verhasselt B., Philippe J. (2009) Prognostic markers in chronic lymphocytic leukemia: a comprehensive review. Blood Rev., 23(1): 25–47.
21. Ghia E.M., Jain S., Widhopf GF et al. (2008) Use of IGHV3-21 in chronic lymphocytic leukemia is associated with high-risk disease and reflects antigen-driven, post-germinal center leukemogenic selection. Blood, 111(10): 5101–5108.
22. Kryachok I., Abramenko I., Chumak A. et al. (2011) IGHV gene rearrangements as outcome predictors for CLL patients: experience of Ukrainian group. Med. Oncology, in press.
23. Matsuda F., Shin E.K., Nagaoka H. et al. (1993) Structure and physical map of 64 variable segments in the 3’0.8-megabase region of the human immunoglobulin heavy-chain locus. Nat. Genet., 3(1): 88–94.
24. Hamblim T.J., Davis Z.A., Oscier D.C. (2008) Determination of how many immunoglobulin variable region heavy chain mutations are allowable in unmutated chronic lymphocytic leukemia – long-term follow up of patients with different percentages of mutations. Br. J. Haematolol., 140(3): 320–323.
25. Kolar G.R., Capra J.D. (2004) Ig V region restrictions in human chronic lymphocytic leukemia suggest some cases have a common origin. J. Clin. Invest., 113( 7): 953–954.
26. Stamatopoulos K., Belessi C., Moreno C. et al. (2007) Over 20% of patients with chronic lymphocytic leukemia carry stereotyped receptors: pathogenetic implications and clinical correlations. Blood, 109: 259–270.
27. Murray F., Darzentas N., Hadzidimitriou A. et al. (2008) Stereotyped patterns of somatic hypermutation in subsets of patients with chronic lymphocytic leukemia: implications for the role of antigen selection in leukemogenesis. Blood, 111: 1524–1533.
28. Bomben R., Dal Bo M., Capello D. et al. (2009) Molecular and clinical features of chronic lymphocytic leukaemia with stereotyped B cell receptors: results from an Italian multicentre study. Br. J. Haematol., 144: 492–506.
29. Bilous N., Bomben R., Dal Bo M. et al. (2010) Molecular and clinical features of chronic lymphocytic leukemia with stereotyped B-cell receptors in a Ukrainian cohort. Leuk. Lymphoma, 51( 5): 822–838.
30. Tobin G., Thunberg U., Johnson A. et al. (2002) Somatically mutated Ig V(H)3-21 genes characterize a new subset of chronic lymphocytic leukemia. Blood, 99: 2262–2264, http:// bloodjournal. hematologylibrary. org/cgi/ ijlink?linkType= ABST&journalCode=bloodjournal&resid=99/6/2262
31. Oscier D., Wade R., Daviz Z. et al. (2010) Prognostic factors identify 3 risk groups in the LRF CLL4 trial, independent of treatment allocation. Haematologica, 95(10): 1705–1712.
32. Chu C.C., Catera R., Zhang L. et al. (2010) Many chronic lymphocytic leukemia antibodies recognize apoptotic cells with exposed nonmuscle myosin heavy chain IIA: implications for patient outcome and cell of origin. Blood. javascript: AL_get (this, ‘jour’, ‘Blood.’). 115(19): 3907–3915.














Leave a comment