Роль сульфгідрильних груп у формуванні резистентності серозного раку яєчника до препаратів платини
Резюме. За результатами досліджень 189 жінок віком 45–63 років із серозним раком яєчника встановлено, що їхня чутливість до дії препаратів платини пов’язана зі вмістом сульфгідрильних груп у тканині пухлини. Показано, що зниження вмісту сульфгідрильних груп в тканині новоутворення і збільшення серед них частки груп, пов’язаних з ліпідами, супроводжується зростанням резистентності до дії платинових препаратів і посиленням перебігу патологічного процесу. Автори вважають, що зниження вмісту сульфгідрильних груп зменшує можливість утворення тіонеїнових сполук платини, які є основним токсичним агентом хіміотерапії.
Резюме. По результатам исследований 189 женщин в возрасте 45–63 лет с диагнозом рак яичника установлено, что их чувствительность к действию препаратов платины связана с содержанием сульфгидрильных групп в ткани опухоли. Установлено, что снижение содержания сульфгидрильных групп в ткани новообразования и увеличение среди них доли групп, связанных с липидами, сопровождается повышением резистентности к действию платиновых препаратов и усугублением течения патологического процесса. Авторы полагают, что снижение содержания сульфгидрильных групп уменьшает возможность образования тионеиновых соединений платины, являющихся основным токсическим агентом химиотерапии.

Рак яичника (РЯ) — один из самых агрессивных видов онкологической патологии. Во всем мире данное заболевание диагностируют в 70–75% случаев на поздних стадиях, когда прогноз уже неблагоприятный. Именно в этих случаях основные надежды после выполненных циторедуктивных операций возлагаются на адъювантную полихимиотерапию. По мнению ряда авторов, прогноз у больных распространенным РЯ во многом определяется эффективностью 1-го этапа комбинированного лечения [2, 6, 15]. Чувствительность к препаратам платины в 1-й линии химиотерапии РЯ достоверно влияет на прогноз заболевания. Следовательно, поиск патогенетически обоснованного маркера чувствительности опухоли к препаратам платины является одним из компонентов разработки персонализированного лечения пациентов с РЯ. В зависимости от сроков прогрессирования болезни различают следующие типы опухолей: платинорефрактерные (опухоли, которые прогрессируют во время 1-й линии химиотерапии с включением препарата платины); платинорезистентные (опухоли, которые прогрессируют на протяжении 6 мес после окончания химиотерапии 1-й линии с включением препарата платины); и платиночувствительные (опухоли, которые прогрессируют более чем через 6 мес после окончания химиотерапии). Летальность больных РЯ на 1-м году после установления диагноза составляет 35% [1, 2, 6, 13, 14]. Согласно данным отечественных и зарубежных авторов, общая 5-летняя выживаемость больных РЯ не превышает 40% на ранних стадиях заболевания, это приводит к поздней диагностике, когда радикальное оперативное вмешательство уже не обеспечивает благоприятного исхода. Поэтому на сегодня золотым стандартом лечения пациентов с РЯ в IIIA–IIIC стадии принято считать сочетание радикального оперативного вмешательства и химиотерапии препаратами платины. Сегодня доказано, что платина, вступая в соединения с белками организма, формирует токсические комплексы, подавляющие репликации ДНК в опухолевых клетках, что блокирует процессы пролиферации [4, 6, 8–10].
Среди аминокислот, являющихся основой существования организма, выделяют группу серосодержащих аминокислот (цистины — цистин, метионин). Эти аминокислоты входят в состав многих белков и, кроме обеспечения вторичной и третичной структуры белка (за счет образования S-S мостиков), отвечают за протекание реакций трансметилирования, протеолиза, участвуют в формировании мембран, осуществлении реакций окислительно-восстановительных циклов. У серосодержащих аминокислот есть еще одно свойство, имеющее прямое отношение к химиотерапии онкопроцессов, это — способность связывать металлы за счет их взаимодействия с SH-группами; возникающие тиосоединения в значительной степени обусловливают токсическое действие металлов [5, 7, 12].
Вместе с тем в около 30% случаев РЯ является первично-резистентным к платиновой химиотерапии. Однако в доступной литературе мы не нашли данных о зависимости устойчивости к химиотерапии и содержанием SS-SH-групп у больных РЯ.
Целью работы была оценка состояния реакций трансаминирования и активности выделительных механизмов у больных РЯ с разной чувствительностью к препаратам платины. А также выявление корреляции между особенностями реакции пациентов с РЯ на применение платиновых препаратов и содержанием SS-SH-групп в опухолевой ткани.
Объект и методы исследований
Материалом настоящего исследования послужили данные, полученные при обследовании 189 женщин в возрасте от 45 до 63 лет с серозным РЯ IIIA–IIIC стадии. Всем больным была выполнена оптимальная либо субоптимальная циторедуктивная операция с последующими курсами платиновой полихимиотерапии (6 курсов). Ретроспективно через 1 год наблюдения все пациентки были ранжированы на 3 группы: I группа — 86 женщин, которые показали высокую чувствительность к препаратам платины (отсутствие рецидива в течение 1 года наблюдения); II группа — 59 больных, у которых выявили резистентность к платине (рецидив через 6 мес и позднее после лечения); III группа — 44 пациентки, у которых при проведении пробы была выявлена рефрактерность к платине (прогрессирование в течение 6 мес после проведенного лечения).
В ходе оперативного вмешательства у больных изымали кусочки опухоли (до 1 см), замораживали жидким азотом, из полученных блоков получали криостатные срезы, на которых щелочной тетразолиевой реакцией [6, 11] определяли содержание SS-SH-групп. Оценку результатов реакции производили по цветовой шкале. Синий цвет оценивали как наличие исследуемых групп, не связанных с липидами. Оттенки синего цвета позволяли судить об изменении количества SS-SH-групп. Появление красноватого оттенка — наличие SS-SH-групп, связанных с липопротеидами, а густота красной окраски свидетельствовала об уровне содержания этих групп.
Результаты и их обсуждение
Больные, ретроспективно включенные в каждую из групп, достоверно не демонстрировали различия в клинико-анамнестических характеристиках и клиническом течении заболевания. Средний возраст пациенток также достоверно не различался между группами.
В I группе (платиночувствительный РЯ) гистохимическое определение SS-SH-групп в ткани опухоли показало следующее. В стенке единичных сосудов, встречающихся в опухоли, определялись мелкие синие или сине-фиолетовые гранулы. Фоновая окраска неравномерная, участки сине-фиолетового или синего цвета чередовались с участками бледно-фиолетовой окраски. В телах фибробластов отмечали фиолетово-синюю зернистость (рис. 1). Поскольку щелочная тетразолиевая реакция на SS-SH-группы дает в случае присутствия нелипидных SS-SH-групп синюю окраску, а в случае наличия липидных групп — красную, можно полагать, что для больных I группы характерно высокое содержание нелипидных SS-SH-групп. Поскольку серосодержащие аминокислоты участвуют в образовании сульфид-металипидных комплексов, являющихся наиболее токсичными формами соединений металлов, можно полагать, что чувствительность к препаратам платины у больных данной группы обусловлена высоким содержанием SH-групп. Высокая же чувствительность к платине создает благоприятный прогноз для лечения таких больных.
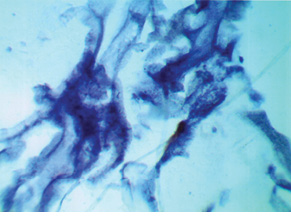
Во второй исследуемой группе (платинорезистентный РЯ) гистохимическое определение SS-SH-групп в ткани опухоли выявило следующее (рис. 2). В стенке сосудов определялись серо-синеватые мелкие гранулы. Эритроциты, расположенные в просвете сосудов, — красно-фиолетового цвета. Фоновая окраска ткани опухоли — серо-лиловая и красновато-лиловая. Окраска ткани неравномерная, участки одной окраски чередуются с участками другой. В фибробластах определяются мелкие красноватые или лиловые гранулы. Поскольку цветовая гамма в препаратах опухоли больных данной группы смещена к красной части спектра, можно полагать, что у них присутствуют SS-SH-группы, связанные с липопротеидами. Окраска эритроцитов позволяет предположить, что преимущество SS-SH-групп, связанных с липопротеидами, носит системный характер. Кроме того, бледность окраски позволяет считать, что возможность связывания платины в комплексы у них ослаблена, что, очевидно, и обусловливает резистентность к ее препаратам и, соответственно, ухудшает прогноз лечения.
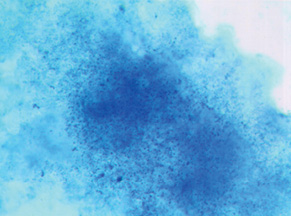
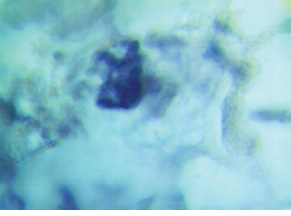
В III группе (платинорефрактерный РЯ) выявление гистохимическим методом SS-SH-групп показало, что фоновая окраска ткани опухоли неравномерна (в отличие от больных других групп) и меняется от красно-лиловой до лиловой. В волокнах опухолевой ткани определяли средних размеров багряные и красно-лиловые гранулы. Об окраске сосудов мы не могли судить, так как в препаратах их не отмечали. Цветовая гамма реакции на SS-SH-группы у больных III группы позволяет полагать, что они имеются только в липопротеидных соединениях и в небольшом количестве. Очевидно, это является основанием рефрактерности к платине, так как формирование сульфид-платиновых комплексов у этих больных затруднено (рис. 3). Это, по-видимому, обусловливает неблагоприятный прогноз развития болезни.
Таким образом, полученные нами данные свидетельствуют о корреляции тяжести течения и прогноза РЯ с содержанием SS-SH-групп в ткани опухоли. Кроме того, особенности течения заболевания и устойчивость к платиновым препаратам зависят от того, связаны ли SS-SH-группы с липидными соединениями. В тех случаях, когда содержание SS-SH-групп снижено, а по окраске препарата можно предполагать, что выявляемые сульфгидрильные группы связаны с липопротеидами, у больных отмечали рефрактерность к препаратам платины. Выявленное обстоятельство следует рассматривать как один из возможных механизмов реализации мутаций генов-супрессоров опухолевого роста BRCA1/2, при нарушении функций которых клетки не способны восстанавливать разрывы двойной цепи ДНК и демонстрируют высокую чувствительность к препаратам платины. На сегодня доказан факт участия генов BRCA1 и BRCA2 в регуляции пролиферации клеток, стабильности хромосом и репарации молекулы ДНК посредством механизмов гомологичной рекомбинации. Мутации указанных генов провоцируют развитие РЯ. Однако механизмы реализации таких мутаций не известны. Дальнейшее исследование подобных биологических факторов поможет понять не только их роль в патогенезе развития РЯ, но и может способствовать выявлению маркера прогноза течения заболевания и ответа на проведение химиотерапии препаратами платины.
Список использованной литературы
1. Винокуров В.Л. (2009) Рак яичников: закономерности метастазирования и выбор адекватного лечения больных. Фолиант, СПб., 333 с.
2. Дубинина В.Г., Рыбин А.И., Кузнецова О.В., Морозюк О.Н. (2015) Активность белка р53 у больных раком яичников в зависимости от чувствительности к препаратам платины. Клин. онкол., 4(20): 91–94.
3. Дубініна В.Г., Рибін А.І., Тюєва Н.В., Лукянчук О.В. (2013) Онкогінекологія. Навч. посібник. ОНМедУ, Одеса, 200 с.
4. Заридзе Д.Г. (2004) Канцерогенез. Медицина, Москва, 576 с.
5. Корман Д.Б. (2006) Основы противоопухолевой химиотерапии. Практическая медицина, Москва, 503 с.
6. Корочанская С.П., Абрамов Ю.Т. (2004) Роль SH-групп в механизме действия сульфидных вод при бальнеотерапии. Успехи современного естествознания, 8 (прилож.): 71–73.
7. Свинцицкий В.С. (2015) Серозный рак яичников: тестирование мутаций генов BRCA1 и BRCA2 в Украине. Евразийский онкологический журнал (прилож.): 79–82.
8. Урманчеева А.Ф., Тюляндина С.А., Моисеенко В.М. (2008) Практическая онкогинекология: избранные лекции. ТОММ, СПб., 400 с.
9. BoltonK.L., Ganda C., Berchuck A. et al. (2012) Role of common genetic variants in ovarian cancer susceptibility and outcome: progress to date from the ovarian cancer association consortium(OCAC). J. Internal. Med., 271: 366–378.
10. Braem M.G., Schouten L.J., Peeters P.H. et al. (2011) Genetic susceptibility to sporadic ovarian cancer: a systematic review. Biochim. Biophis. Acta., 1816: 132–146.
11. Geogakilas A.G., Tsantoulis P., Kotsinas et al. (2014) Are common fragile sites melely structural domains or highly organized «functional» units susceptible to oncogenic stress? Cell Mol. Life Sci., 71: 4519–4544.
12. Ha C., Tian S., Sun K. et al. (2015) Hydrogen sulfide att ennates J 1-ßL induced inflammory signaling and dysfunction of osteoarthritic chonrocytes. Jnf. J. Mol. Med., 35(6): 1657–1666.
13. Osterberg L., Levan K., Partheen K. et al. (2009) Predictive markers of chemotherapy resistance in stage III ovariav serous carcinomas. BMC Cancer, 9(368): 2407–2409.
14. Ozeri-Galai E., Tur-Sinai M., Bester A.S. et al. (2014) Interplay between genetic and epigenetic factors governs common fragile site instability in cancer. Cell Mol. Life Sci., 71: 4495–4506.
15. Sharon Stack M., Fishman D.A. (2009) Ovarian Cancer. Sprunger Science + Business Media: 408 p.
Адрес
Рыбин Андрей Игоревич
65023, Одесса, Валиховский проул., 2
Одесский национальный медицинский университет
Тел.: (048) 720-26-17
E-mail: Andriy.Rybin@gmail.com














Leave a comment