Особливості гормонального рецепторного статусу, експресії VEGF, HER2/neu в серозному раку і функціональних кістах яєчника. Гормональний гомеостаз у хворих із рецидивом серозного раку яєчника
Ткаля Ю.Г.1, Воробьева Л.И.1, Свинцицкий В.С.1, Неспрядько С.В.1, Лук’янова Н.Ю.2, Чехун В.Ф.2, Коротич А.П.3, Красиленко Д.Н.4, Балашова О.И.5, Шляхова Е.В.5, Царенкова О.А.6
- 1Національний інститут раку, Київ
- 2Інститут експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького НАН України, Київ
- 3Референс-центр з молекулярної діагностики МОЗ України, Київ
- 4Киевская областная больница
- 5КУ«Клинический онкологический диспансер Днепропетровского областного совета»
- 6Лаборатория «Synevo», Киев
Резюме. Досліджено та зіставлено гормональний гомеостаз хворих із рецидивом серозного раку яєчника і пацієнток із хірургічною менопаузою, прооперованих з приводу доброякісної патології матки; вивчено і зіставлено гормональний рецепторний статус, експресію HER-2/neu і VEGF у клітинах серозного раку і функціональних кістах яєчника.
Резюме. Исследован и сопоставлен гормональный гомеостаз больных с рецидивом серозного рака яичника и пациенток с хирургической менопаузой, прооперированных по поводу доброкачественной патологии матки; изучен и сопоставлен гормональный рецепторный статус, экспрессия HER-2/neu и VEGF в клетках серозного рака и функциональных кистах яичника.

Основная причина неэффективного лечения больных раком яичника (РЯ) кроется в поздней его диагностике из-за отсутствия патогномоничных симптомов. Главная трудность заключается в том, что до настоящего времени нет окончательного представления о патогенезе РЯ, знание которого разрешило бы проблему ранней диагностики и проведения наиболее эффективного патогенетического лечения. Тем не менее к настоящему времени накоплено значительное количество экспериментальных, эпидемиологических и клинических фактов, которые демонстрируют, что ведущая роль в общей гипотезе патогенеза РЯ принадлежит взаимодействию сложных механизмов эндокринно-обменных и молекулярно-генетических нарушений [1–5]. К факторам риска данного заболевания относят непрекращающуюся овуляцию вследствие сокращения числа беременностей и родов у женщин, бесплодие различного генеза, применение препаратов, стимулирующих овуляцию, а по данным последних исследований — ожирение, особенно у женщин перименопаузального периода [6–9]. РЯ характеризуется выраженной гетерогенностью молекулярно-биологических маркеров опухолевых клеток и их сложными взаимодействиями с факторами микроокружения, что в совокупности формирует опухолевый фенотип со значительной вариабельностью [10–13]. Гормонозависимость РЯ на сегодня остается до конца не изученной. О ней свидетельствуют результаты многих исследований, в которых установлено, что яичники не только продуцируют половые стероидные гормоны, но и выступают тканью-мишенью для гонадотропных, классических и неклассических стероидных гормонов, а также для гонадотропин-рилизинг гормона [14, 15]. Однако данные о клиническом, прогностическом и терапевтическом значении гормонального рецепторного статуса РЯ достаточно противоречивы. Кроме того, не получено полного представления о механизмах реализации гормонально-рецепторного сигнала в опухолевых клетках яичника, запускающих процессы пролиферации, инвазии и метастазирования. Результатами наших предыдущих работ показана высокая частота позитивной экспрессии всех рецепторов стероидных гормонов (РСГ) в клетках РЯ, что явилось неблагоприятным фактором течения опухолевого процесса [16]. И напротив, по данным других исследований, в доброкачественных кистах и морфологически не измененных яичниках отмечена низкая частота или отсутствие экспрессии РСГ [17]. Однако существуют и противоречивые научные сведения [18–19]. Рецептор эпидермального фактора роста 2 (epidermal growth factor receptor, EGFR-2 — HER-2/neu) и фактор роста эндотелия сосудов (vascular endothelial growth factor —VEGF) играют особую роль в механизмах ауто- и паракринной регуляции репродуктивной системы, прежде всего — овариальной функции. Ангиогенез в менструальном цикле находится под контролем многих ростовых факторов, в том числе и HER-2/neu [20, 21]. Многие ученые в своих работах отметили, что высокая экспрессия HER-2/neu и VEGF в опухолевых клетках яичника являются факторами агрессивного течения и неблагоприятного прогноза заболевания [22–25]. Более того, на сегодня доказано, что эстрадиол индуцирует через эстроген-рецепторные сигнальные пути экспрессию VEGF и его рецепторов в клетках органов репродуктивной системы при физиологическом и опухолевом ангиогенезе [26].
Некоторые исследователи отмечали у больных РЯ нарушение гормонального гомеостаза — гиперэстрогенемию и гиперандрогенемию на фоне абсолютной
гипопрогестеронемии — по сравнению с таковыми у практически здоровых женщин того же возраста [27]. Однако существуют и противоречивые научные данные [28, 29].
Вопрос о применении гормональной терапии у данного контингента больных и сегодня остается дискутабельным. Гормональное лечение на протяжении многих лет назначали эмпирически как «терапию отчаяния» больным с химиорезистентным и рецидивирующим РЯ, когда остальные терапевтические методы себя исчерпали, имея низкий показатель эффективности [3, 14].
Поскольку до настоящего времени не получено полного представления о нарушениях гормонального гомеостаза у больных с рецидивом РЯ и достоверных различиях гормонального рецепторного статуса, экспрессии HER-2/neu, VEGF в клетках серозного РЯ и яичниках при доброкачественной гормонозависимой патологии репродуктивной системы, решение этих вопросов позволит уточнить патогенез РЯ и будет иметь значение для обоснования показаний к проведению гормональной терапии в качестве компонента комплексного лечения больных.
Цель работы — исследовать и сопоставить гормональный гомеостаз больных с рецидивом РЯ (исследуемая группа) и пациенток с хирургической менопаузой, прооперированных по поводу доброкачественной патологии матки (контрольная группа); изучить и сопоставить гормональный рецепторный статус, экспрессию HER-2/neu и VEGF в клетках серозного РЯ и яичниках пациенток контрольной группы.
Объект и методы исследования
Пациенты. В исследовании приняла участие 41 больная с рецидивом серозного РЯ III стадии, которой в Национальном институте рака, Киевской областной клинической больнице и Клиническом онкологическом диспансере Днепропетровского областного совета проведено комбинированное лечение в 2011–2012 гг. (согласно стандартам диагностики и лечения онкологических больных, утвержденным приказом МЗ Украины от 17.09.2007 г. № 554). Комбинированное лечение заключалось в проведении циторедуктивной операции с последующей химиотерапией в адъювантном режиме или в комбинации с неоадъювантной химиотерапией. Всем больным проведена химиотерапия комбинацией препаратов платины и таксаносодержащих или платины и циклофосфамида. Рецидив заболевания установлен спустя 12–18 мес после завершения комбинированного лечения. Кроме того, в исследовании принимали участие 35 женщин с хирургической менопаузой, которым проведено хирургическое лечение в объеме экстирпации матки с придатками по поводу лейомиомы матки в центральной городской больнице Новомосковска Днепропетровской области в 2011–2012 гг. (контрольная группа).
Диагноз серозного РЯ и доброкачественных кистозных опухолевидных образований яичника был верифицирован с помощью морфологического исследования операционного материала больных двух групп согласно гистологической классификации опухолей яичника ВОЗ (2002), клиническое стадирование РЯ — по международной классификации FIGO (2009). Диагноз лейомиомы матки верифицирован с помощью морфологического исследования операционного материала пациенток контрольной группы согласно гистологической классификации мезенхимальных опухолей тела матки ВОЗ (2003). У всех пациенток получено информированное согласие на использование операционного материала с диагностической целью.
Результаты исследований оценивали в зависимости от возрастных периодов женщин двух групп согласно классификации ВОЗ (1980): репродуктивный (до 45 лет), перименопауза (46–55 лет), ранняя постменопауза (56–60 лет) и поздняя постменопауза (61 год и старше). Поскольку в исследовании принимала участие небольшая выборка пациенток, женщин постменопаузального периода не разделяли на больных ранней и поздней постменопаузы.
Результаты наших предыдущих исследований показали, что неоадъювантная химиотерапия не влияет на экспрессию РСГ и отсутствует корреляция последней со степенью дифференциации опухолей яичника разного гистогенеза, поэтому мы не распределяли больных РЯ в зависимости от проведения химиотерапии в неоадъювантном или адъювантном режиме и по степени дифференциации серозного РЯ [16].
Иммуногистохимический анализ. Уровни экспрессии РСГ, VEGF и HER-2/neu в опухолевых клетках яичников больных с рецидивом РЯ (РРЯ) и яичников пациенток контрольной группы оценивались в возрастной период на момент проведения хирургического лечения. Иммуногистохимическое исследование рецепторов эстрогенов (РЭ), прогестерона (РП), тестостерона (РТ), VEGF и HER-2/neu в клетках яичника проводили на парафиновых срезах толщиной 4–5 микрон, которые помещали на стекла, обработанные поли-L-лизином. В качестве первичных антител использовали моноклональные антитела, специфичные к РЭ (anti-Human Estrogen Receptor alfa Clone 1D5, DakoCytomation, Дания), РП (anti-Human Progesterone Receptor Clone PgR 636, DakoCytomation, Дания), РТ (testosterone antibody Clone GTX72779, Gene Tex, США), VEGF (anti-VEGF RB-9031-P1, Thermo Scientific, США) и HER-2/neu (anti-c-erbB2 Clone SP3, Thermo Scientific, США). Для визуализации результатов реакции использовали набор реактивов En Vision system (Dako LSAB2 system, Дания) в соответствии с рекомендациями производителя, срезы докрашивали гематоксилином Майера. Для оценки иммуногистохимической экспрессии РЭ, РП, РТ, VEGF и HER-2/neu применяли полуколичественный метод. При наличии специфического ядерного окрашивания для стероидных рецепторов, мембранно-цитоплазменного окрашивания для VEGF и HER-2/neu определяли количество иммуноположительных и иммуноотрицательных клеток в процентах. В каждом гистологическом препарате анализировали экспрессию стероидных рецепторов, VEGF и HER-2/neu в 1000 клеток. Для суммарной оценки экспрессии РСГ, VEGF и HER-2/neu в клетках яичника использовали методы, применяемые нами ранее [16, 25, 30]. Степень экспрессии РСГ выражали в баллах: 0 — отсутствует окрашивание ядер клеток яичника; 1 — слабое окрашивание ядер клеток яичника — ≤10% клеток; 2 — умеренная степень — 11–50%; 3 — высокая степень — 51–80%; 4 — гиперэкспрессия — >80% окрашенных клеток яичника. Положительной экспрессию стероидных рецепторов считали, если количество окрашенных ядер клеток яичника было >10% с умеренной и высокой степенью окрашивания. Степень экспрессии VEGF оценивали также в баллах: 0 — отсутствует окрашивание цитоплазмы и мембраны клеток яичника; 1 — слабое окрашивание — 1–25% клеток яичника (VEGF+); 2 — умеренная степень равномерного мембранно-цитоплазменного окрашивания — 26–50% клеток (VEGF++); 3 — высокая степень окрашивания или гиперэкспрессия — >50% клеток яичника (VEGF+++). Положительной экспрессией VEGF (VEGF+) считали >25% клеток с умеренной и высокой степенью экспрессии. Степень экспрессии рецептора HER-2/neu оценивали в баллах: 0/1+ — отсутствие или слабое окрашивание цитоплазмы и мембраны клеток яичника; 2+ — умеренная степень равномерного окрашивания цитоплазмы и мембраны клеток яичника; 3+ — высокая степень и 4+ — гиперэкспрессия клеток яичника с интенсивно окрашенной цитоплазмой и мембраной. Положительной экспрессию HER-2/neu считали при наличии >10% клеток с умеренной и высокой степенью мембранно-цитоплазменного окрашивания. В качестве положительного контроля применяли моноклональные антитела против пан-цитокератинов, в качестве отрицательного контроля — забуференный физиологический раствор, который вместо моноклональных антител наносили на гистологические срезы.
Иммунохимический анализ гормонального гомеостаза больных с РРЯ и пациенток контрольной группы проводился в лаборатории «Synevo». Уровень сывороточных гормонов фолликулостимулирующего (ФСГ), лютеинизирующего (ЛГ), эстрадиола (Э2), прогестерона и тестостерона (свободного) у пациенток двух групп оценивали в возрастной период на момент проведения этого исследования. Анализ сывороточных гормонов у больных с РРЯ осуществлялся при диагностировании рецидива заболевания (спустя 12–18 мес после завершения первичного лечения) до проведения лекарственной терапии, у женщин контрольной группы — спустя 12–18 мес после хирургического лечения. У пациенток двух групп получено информированное согласие на исследование их гормонального гомеостаза.
Уровни ФСГ, ЛГ, Э2 и прогестерона в сыворотке крови определяли иммунохимическим методом с электрохемилюминесцентной детекцией (ECLIA) при помощи тест-системы Roche Diagnostics (Switzerland), анализатора Cobas 6000 и набора реактивов: Elecsys ФСГ (1775863), Elecsys ЛГ (1732234), Elecsys Эстрадиол II (03000079), Elecsys Прогестерон II (2145383). Принцип метода (принцип «сэндвича») заключался в формировании специфического иммунокомплекса, меченного рутением, генерирующего электрохимическое свечение. Уровень тестостерона (свободного) определяли твердофазным иммуноферментным методом при помощи тест-системы и анализатора EUROIMMUN (Германия) и набора реактивов Free Testosterone ELISA (AAE-1400). Для положительной и отрицательной пробы применяли готовые контрольные сыворотки с заданными параметрами, которые предоставляет сам производитель каждой тест-системы. Результаты оценивали согласно диапазону измерений, представленному в каждой тест-системе. Концентрацию каждого гормона в образцах (сыворотка крови пациентов) рассчитывали автоматически в следующих единицах: для ФСГ и ЛГ в мМЕ/мл, Э2 и тестостерона свободного — в пг/мл, прогестерона — нг/мл.
Статистический анализ полученных данных заключался в использовании непараметрической и параметрической статистики, включая метод t-критерия Стьюдента. Достоверность межгрупповых различий оценивали по U-критерию Манна — Уитни. Статистически достоверными считали данные при р<0,05. Обработку результатов исследования проводили с использованием пакета программы Statistica 6.0.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Возраст больных РЯ на момент проведения хирургического лечения колебался от 34 до 68 лет, составляя в среднем 50,3±1,3 года, пациенток контрольной группы — 47,1±1,3 лет (38–62 года). Различия по возрасту пациенток двух групп статистически не достоверны (р=0,25).
Анализ морфологической структуры яичника у женщин контрольной группы представлен в табл. 1. Из данных табл. 1 следует, что большинство пациенток имели функциональные кисты яичника (17/48,6%): фолликулярные кисты (4/11,4%) и кисты желтого тела (13/37,2%). И только у 8,6% женщин контрольной группы выявили серозные кисты яичника без эпителиальной выстилки, которые, как известно, являются конечным этапом развития некоторых фолликулярных кист и кист желтого тела. Потеря эпителиальной выстилки в результате шелушения или атрофии и частого склерозирования подлежащих слоев не дает возможности при морфологическом исследовании точно указать гистогенез этих кист [31]. Функциональные кисты яичника возникают из его физиологических структур. К формированию фолликулярных кист ведет персистенция непроовулировавшего фолликула, в полости которого накапливается фолликулярная жидкость. Стенки кисты содержат гранулезные и тека-клетки. Фолликулярные кисты являются результатом многофакторных причин, среди которых ключевая роль отводится нарушению в системе гипоталамус — гипофиз — яичники, что приводит к десинхронизации активности биохимических факторов, участвующих в интрафолликулярном механизме овуляции, включая простагландины, протеолитические ферменты, окситоцин и релаксин [20, 32]. Образование кист желтого тела вызвано также гормональным дисбалансом и нарушением кровообращения и лимфооттока в тканях яичника [21]. Лютеинизированные гранулезные и тека-клетки располагаются в стенке кисты в виде пластов или отдельных групп. В норме желтое тело обладает самым высоким уровнем васкуляризации в организме человека, этот процесс непосредственно регулируется высокой экспрессией VEGF. Ангиогенная активность находится под контролем многих ростовых факторов, в том числе и HER-2/neu [20, 21].
Таблица 1. Экспрессия РСГ, HER-2/neu, VEGF в клетках серозного РЯ больных исследуемой группы и яичниках пациенток контрольной группы
| Серозный РЯ, n=41 (100%) | Больные исследуемой группы (n=41) | |||||||||
| РЭ+ | РП+ | РТ+ | HER-2/neu | VEGF | ||||||
| n | % | n | % | n | % | n | % | n | % | |
| 27 | 65,9 | 26 | 63,4 | 23 | 56,1 | 27 | 65,9 | 20 | 48,8 | |
| Морфологическая структура яичника | Пациентки контрольной группы (n=35) | |||||||||
| РЭ+ | РП+ | РТ+ | HER-2/neu | VEGF | ||||||
| n | % | n | % | n | % | n | % | n | % | |
| Нормальная структура яичника,n=4 (11,4%/100%) | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 |
| Инволютивные изменения, n=11 (31,4%/100%) | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 |
| Серозные кисты, n=3 (8,6%/100%) | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 |
| Фолликулярные кисты, n=4 (11,4%/100%) | 3 | 75,0 | 2 | 50,0 | 1 | 25,0 | 3 | 75,0 | 2 | 50,0 |
| Кисты желтого тела, n=13 (37,2%/100%) | 8 | 61,5 | 10 | 76,9 | 8 | 61,5 | 12 | 92,3 | 9 | 69,2 |
Результаты иммуногистохимического исследования экспрессии РСГ, HER-2/neu и VEGF в серозном РЯ свидетельствуют, что в клетках серозного РЯ отмечена высокая частота положительной экспрессии РЭ, РП, РТ, HER-2/neu и VEGF (65,9; 63,4; 56,1; 65,9 и 48,8% соответственно) (см. табл. 1; рис. 1, 2). При анализе результатов экспрессии РСГ, HER-2/neu и VEGF в яичниках пациенток контрольной группы установлено полное отсутствие экспрессии перечисленных маркеров в эпителиальных, стромальных, гранулезных и тека-клетках морфологически не измененного яичника, яичника с инволютивными изменениями, а также яичника с серозными кистами. Однако выявлена высокая частота положительной экспрессии РСГ, HER-2/neu и VEGF в гранулезных, тека- и лютеиновых клетках функциональных кист яичника: фолликулярных — 75,0; 50,0; 25,0; 75,0 и 50,0% соответственно, кист желтого тела — 65,1; 76,9; 65,1; 92,3 и 69,2% соответственно. Различия в частоте экспрессии РСГ, HER-2/neu, VEGF в серозном РЯ и функциональных кистах не имели достоверности (р>0,05). Исключением являлась достоверно более низкая частота экспрессии РТ в клетках кист желтого тела по сравнению с таковой в фолликулярных кистах и серозном РЯ (р=0,03). Как установлено нами ранее, выраженная экспрессия РТ в серозном РЯ является фактором неблагоприятного течения опухолевого процесса [16, 30].
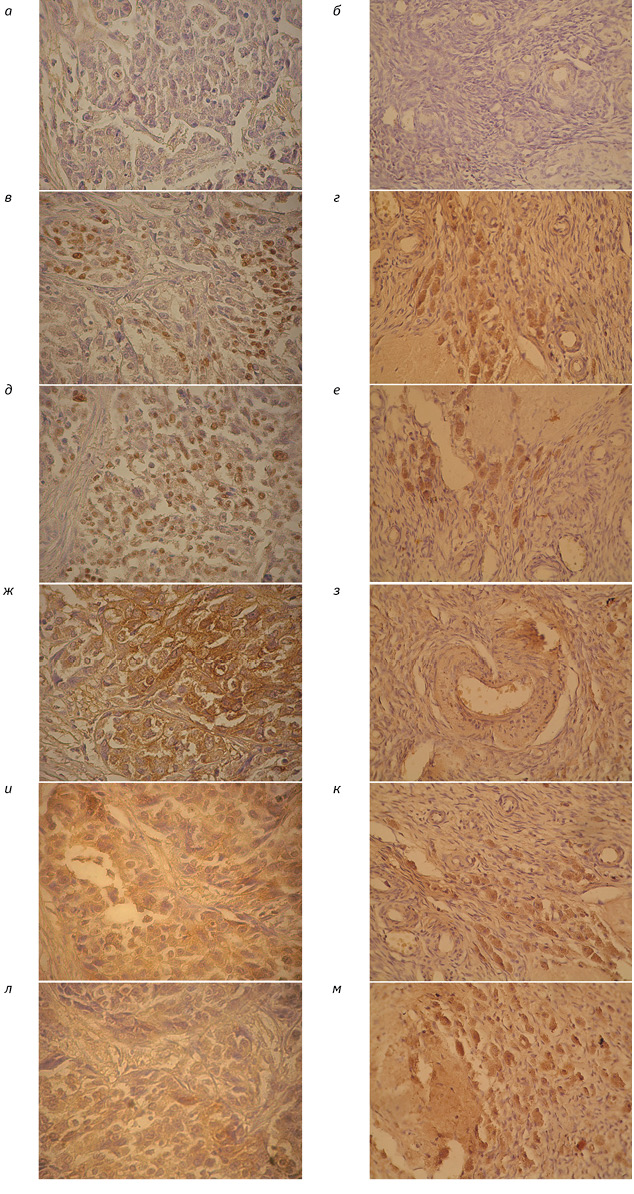
Примечание: КЖТЯ — киста желтого тела яичника; ФКЯ — фолликулярная киста яичника; РЯ — рак яичника
Таким образом, высокая частота экспрессии РСГ, HER-2/neu, VEGF в клетках серозного РЯ и функциональных кист яичника позволяет предположить о наличии общих факторов риска и механизмов развития РЯ и доброкачественных гормонозависимых заболеваний матки и яичника.
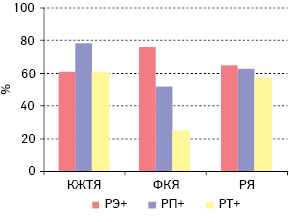
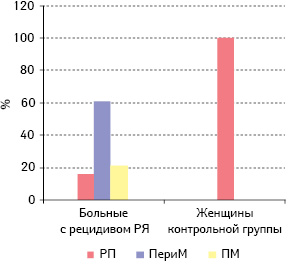
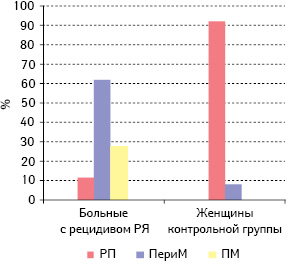
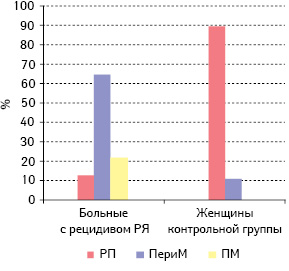
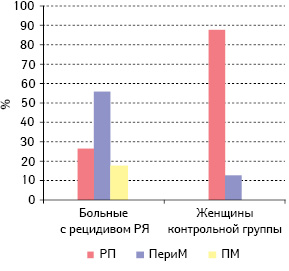
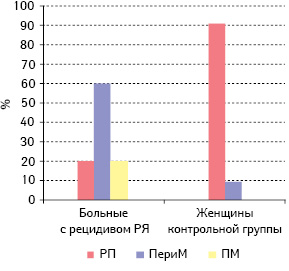
Далее мы проанализировали и сопоставили частоту экспрессии РСГ, HER-2/neu, VEGF в серозном РЯ и функциональных кистах яичника пациенток исследуемой и контрольной групп в зависимости от возрастного периода (табл. 2, рис. 3–7). Как свидетельствуют данные табл. 2 и рис. 3–7, наибольшее количество эстроген-, прогестерон- и тестостерон-рецепторположительных опухолей было у больных с РРЯ перименопаузального возраста — 63,0; 61,5 и 65,2% соответственно. При этом наибольшее количество VEGF и HER-2/neu-положительных опухолей тоже выявлено у больных этого возрастного периода (60,0 и 55,6% соответственно). Однако следует отметить, что большую часть больных с РРЯ составили женщины перименопаузального возраста (56,1%). Второе место по частоте эстроген-, прогестерон-, тестостерон-рецепторположительных опухолей отводится больным постменопаузального периода (22,2; 26,9 и 21,7% соответственно). Наименьшая частота рецепторположительного серозного РЯ отмечена у пациенток репродуктивного возраста: по РЭ — 14,8%, РП — 11,6% и РТ — 13,1%. Различия между частотой экспрессии РСГ в серозном РЯ больных разных возрастных периодов достоверно значимы (репродуктивный период и перименопауза — р=0,01, перименопауза и постменопауза — р=0,03, постменопауза и репродуктивный период — р=0,04). Результаты ранее проведенных нами и другими авторами исследований продемонстрировали, что у больных РЯ пери- и постменопаузального возрастного периода наиболее агрессивное течение и неблагоприятный прогноз заболевания. Более того, у больных серозным РЯ постменопаузального возраста отмечена наивысшая частота опухолей с положительным гормонально-рецепторным статусом, и выживаемость этих пациенток была достоверно ниже, чем больных с рецепторотрицательным серозным РЯ [1, 3, 4, 16].
Таблица 2. Частота экспрессии РСГ, HER-2/neu, VEGF в клетках серозного РЯ больных с РРЯ и функциональных кист яичника пациенток контрольной группы в зависимости от возрастного периода
| Возрастной период, n=41 (100%) | Пациентки с рецепторположительным серозным РЯ(исследуемая группа, n=41) | |||||||||
| РЭ+ | РП+ | РТ+ | HER-2/neu | VEGF | ||||||
| n | % | n | % | n | % | n | % | n | % | |
| Репродуктивный период, n=8 (19,5%) | 4 | 14,8 | 3 | 11,6 | 3 | 13,1 | 7 | 25,9 | 4 | 20,0 |
| Перименопауза, n=23 (56,1%) | 17 | 63,0 | 16 | 61,5 | 15 | 65,2 | 15 | 55,6 | 12 | 60,0 |
| Постменопауза, n=10 (24,4%) | 6 | 22,2 | 7 | 26,9 | 5 | 21,7 | 5 | 18,5 | 4 | 20,0 |
| Всего | 27 | 65,9/100 | 26 | 63,4/100 | 23 | 56,1/100 | 27 | 65,9/100 | 20 | 48,8/100 |
| Возрастной период, n=35 (100%) | Пациентки с рецепторположительными функциональнымикистами яичника (контрольная группа, n=35) | |||||||||
| РЭ+ | РП+ | РТ+ | HER-2/neu | VEGF | ||||||
| n | % | n | % | n | % | n | % | n | % | |
| Репродуктивный период, n=18 (51,4%) | 11 | 100,0 | 11 | 91,7 | 8 | 88,9 | 13 | 86,7 | 10 | 90,9 |
| Перименопауза, n=12 (34,3%) | 0 | 0,0 | 1 | 8,3 | 1 | 11,1 | 2 | 13,3 | 1 | 9,1 |
| Постменопауза, n=5 (14,3%) | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 |
| Всего | 11 | 31,4/100 | 12 | 34,3/100 | 9 | 25,7/100 | 15 | 42,9/100 | 11 | 31,4/100 |
Примечание: РП — репродуктивный период; ПериМ — перименопауза; ПМ — постменопауза
Примечание: РП — репродуктивный период; ПериМ — перименопауза; ПМ — постменопауза
Примечание: РП — репродуктивный период; ПериМ — перименопауза; ПМ — постменопауза
Примечание: РП — репродуктивный период; ПериМ — перименопауза; ПМ — постменопауза
Примечание: РП — репродуктивный период; ПериМ — перименопауза; ПМ — постменопауза
При анализе зависимости экспрессии РСГ в клетках серозного РЯ между собой (табл. 3) отмечена прямая корреляционная связь между частотой экспрессии РЭ и РП (р=0,001), РЭ и РТ (р=0,003), РП и РТ (р=0,002), особенно значимая между РЭ и РП (r=0,823). Кроме того, установлена достоверная корреляция между частотой экспрессии РЭ, РП и возрастным периодом больных с РРЯ (r=0,354, р=0,001 и r=0,342, р=0,031 соответственно) и отсутствие таковой для РТ (r=−0,117, р=0,6). Полученные данные согласуются с результатами ранее проведенных нами исследований [16].
Таблица 3. Ранговые корреляции Гамма, значимые на уровне р<0,05, между экспрессией РСГ, HER-2/neu, VEGF, возрастным периодом больных с рецидивом серозного РЯ (n=41)
| Показатель | Коэффициент корреляции | p |
| РЭ и возрастной период | 0,354 | 0,001 |
| РЭ и РП | 0,823 | 0,001 |
| РЭ и РТ | 0,426 | 0,003 |
| РЭ и VEGF | 0,254 | 0,151 |
| РЭ и HER-2/neu | −0,112 | 0,462 |
| РП и возрастной период | 0,342 | 0,031 |
| РП и РЭ | 0,823 | 0,001 |
| РП и РТ | 0,397 | 0,002 |
| РП и HER-2/neu | 0,125 | 0,317 |
| РП и VEGF | 0,027 | 0,763 |
| РТ и возрастной период | −0,117 | 0,591 |
| РТ и РЭ | 0,426 | 0,003 |
| РТ и РП | 0,397 | 0,002 |
| РТ и HER-2/neu | 0,012 | 0,879 |
| РТ и VEGF | 0,059 | 0,692 |
| HER-2/neu и возрастной период | −0,014 | 0,851 |
| HER-2/neu и РЭ | −0,112 | 0,462 |
| HER-2/neu и РП | 0,125 | 0,317 |
| HER-2/neu и РТ | 0,012 | 0,879 |
| HER-2/neu и VEGF | 0,925 | 0,001 |
| VEGF и возрастной период | −0,036 | 0,727 |
| VEGF и РЭ | 0,254 | 0,151 |
| VEGF и РП | 0,027 | 0,763 |
| VEGF и РТ | 0,059 | 0,692 |
| VEGF и HER-2/neu | 0,925 | 0,001 |
Частота экспрессии VEGF в опухолевых клетках яичника больных с РРЯ репродуктивного и постменопаузального возраста была одинаковой — 20,0% (см. табл. 2). Различия в частоте экспрессии HER-2/neu в серозном РЯ больных этих возрастных категорий (25,9 и 18,5% соответственно) не имели достоверности (р>0,05). Более того, статистический анализ показал отсутствие корреляционной связи между частотой экспрессии HER-2/neu, VEGF в серозном РЯ и возрастом больных (r=−0,014, р=0,85 и r=−0,036, р=0,73 соответственно). При этом установлена значимая корреляция экспрессии HER-2/neu с экспрессией VEGF в клетках серозного РЯ (r=0,925, р=0,001) (см. табл. 3). Таким образом, представленные данные подтверждают полученные результаты ранее проведенных нами исследований [25, 30].
При оценке связи между экспрессией HER-2/neu, VEGF и экспрессией РСГ в опухоли яичника отмечено отсутствие достоверной корреляции между ними (см. табл. 3). Полученные данные также согласуются с результатами ранее проведенных исследований, в которых установлено, что экспрессия HER-2/neu и VEGF в серозном РЯ являются независимыми факторами агрессивного и неблагоприятного течения опухолевого процесса [25, 30].
При анализе частоты экспрессии РЭ, РП, РТ, HER-2/neu и VEGF в клетках функциональных кист яичника больных контрольной группы отмечены самые высокие показатели среди женщин репродуктивного периода — 100; 91,7; 88,9; 86,7 и 90,9% соответственно. И только в единичных случаях фиксировали экспрессию этих маркеров в функциональных кистах яичника женщин перименопаузального возраста (см. табл. 2; рис. 2–6). Полученные данные объяснимы возрастным физиологическим состоянием пациенток контрольной группы, поскольку наличие функциональных кист яичника характерно только для менструирующих женщин [31, 32].
В дальнейшем проведена оценка ранговых корреляций между экспрессией РСГ, HER-2/neu, VEGF в функциональных кистах яичника и возрастом пациенток контрольной группы (табл. 4). Как свидетельствуют данные табл. 4, установлены достоверные корреляционные связи между всеми показателями, исключением являлось отсутствие корреляции между экспрессией РТ и VEGF (r=0,173, р=0,46), экспрессией HER-2/neu, VEGF и возрастным периодом женщин (r=−0,073, р=0,7 и r=−0,026, р=0,91 соответственно). Полученные данные подтверждают непосредственное участие экспрессии РСГ, HER-2/neu и VEGF в гранулезных, тека- и лютеиновых клетках яичника в регуляции нормального овариально-менструального цикла у женщин [20, 21, 32].
Таблица 4. Ранговые корреляции Гамма, значимые на уровне р<0,05, между экспрессией РСГ, HER-2/neu, VEGF, возрастным периодом пациенток с функциональными кистами яичника (n=35)
| Показатель | Коэффициент корреляции | p |
| РЭ и возрастной период | −0,658 | 0,001 |
| РЭ и РП | 0,871 | 0,001 |
| РЭ и РТ | −0,726 | 0,001 |
| РЭ и VEGF | 0,554 | 0,005 |
| РЭ и HER-2/neu | 0,627 | 0,002 |
| РП и возрастной период | −0,497 | 0,032 |
| РП и РЭ | 0,871 | 0,001 |
| РП и РТ | −0,645 | 0,002 |
| РП и HER-2/neu | −0,425 | 0,031 |
| РП и VEGF | 0,627 | 0,002 |
| РТ и возрастной период | 0,526 | 0,017 |
| РТ и РЭ | −0,526 | 0,016 |
| РТ и РП | −0,645 | 0,002 |
| РТ и HER-2/neu | 0,523 | 0,012 |
| РТ и VEGF | 0,173 | 0,456 |
| HER-2/neu и возрастной период | −0,073 | 0,701 |
| HER-2/neu и РЭ | 0,627 | 0,002 |
| HER-2/neu и РП | −0,425 | 0,031 |
| HER-2/neu и РТ | 0,523 | 0,012 |
| HER-2/neu и VEGF | 0,658 | 0,001 |
| VEGF и возрастной период | −0,026 | 0,912 |
| VEGF и РЭ | 0,554 | 0,005 |
| VEGF и РП | 0,627 | 0,002 |
| VEGF и РТ | 0,173 | 0,456 |
| VEGF и HER-2/neu | 0,658 | 0,001 |
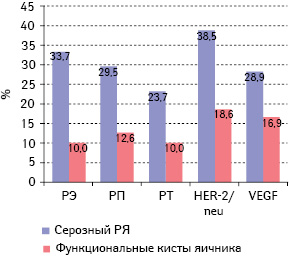
Проведен анализ средних уровней экспрессии РСГ, HER-2/neu, VEGF в клетках серозного РЯ и функциональных кист яичника, результаты представлены в табл. 5 и рис. 8. Из данных табл. 5 следует, что в функциональных кистах яичника отмечена достоверно низкая степень экспрессии РЭ, РП и РТ (10,0±3,3; 12,6±4,1 и 10,0±3,8% соответственно), при этом средний уровень экспрессии РЭ и РТ можно расценить как отрицательный. И напротив, в серозном РЯ зарегистрирована умеренная степень экспрессии РСГ, при этом самая высокая — для РЭ (33,7±4,9%). Таким образом, средний уровень экспрессии РСГ в серозном РЯ достоверно выше по сравнению с таковым в функциональных кистах яичника (для РЭ — р=0,0002, РП — р=0,009, РТ — р=0,02). Подобная тенденция отмечена и при оценке среднего уровня экспрессии HER-2/neu в клетках РЯ и функциональных кист яичника (38,5±5,6 против 18,6±4,6%, р=0,008). Средний уровень экспрессии VEGF в серозном РЯ был также выше (28,9±4,7%) по сравнению с таковым в функциональных кистах яичника (16,9±4,7%), однако статистический анализ не установил достоверных различий между показателями (р=0,08).
Таблица 5. Средние уровни экспрессии РСГ, HER-2/neu, VEGF в клетках серозного РЯ и функциональных кист яичника
| Показатель, % | Серозный РЯ, n=41 | Функциональные кисты яичника, n=35 | р |
| РЭ | 33,7±4,9 | 10,0±3,3 | 0,0002 |
| РП | 29,5±4,8 | 12,6±4,1 | 0,009 |
| РТ | 23,7±4,1 | 10,0±3,8 | 0,02 |
| HER-2/neu | 38,5±5,6 | 18,6±4,6 | 0,008 |
| VEGF | 28,9±4,7 | 16,9±4,7 | 0,08 |
Далее проведено исследование гормонального гомеостаза у больных с рецидивом серозного РЯ и пациенток контрольной группы, результаты представлены в табл. 6. Следует отметить, что период хирургической менопаузы у больных исследуемой и контрольной групп был одинаков (≈18 мес). Как свидетельствуют данные табл. 6, средний возраст больных с РРЯ и пациенток контрольной группы статистически не различался (51,8±1,3 и 48,7±1,3 лет соответственно; р=0,25). При анализе средних уровней гонадотропных и периферических стероидных половых гормонов в сыворотке крови больных исследуемой и контрольной групп отмечено отсутствие достоверных различий в показателях гормонального гомеостаза пациенток двух групп: для ФСГ — р=0,15, ЛГ — р=0,23, Э2 — р=0,29, прогестерона — р=0,07, тестостерона — р=0,19. Показатели гормонального гомеостаза пациенток этих групп соответствовали референтным значениям сывороточных уровней половых гормонов постменопаузального периода. Это доказывает тот факт, что оценка уровней гормонов в сыворотке крови у женщин постменопаузального возраста не дает полной информации о возможных вариантах развития патологических процессов, так как для реализации гормонального эффекта необходим достаточный уровень стероидных рецепторов в клетках тканей-мишеней. Более того, эстрогенизация у женщин постменопаузального периода определяется большей частью не уровнем гормонов в сыворотке крови, а локальной концентрацией их в тканях [2, 33].
Таблица 6. Средние уровни гонадотропных и периферических стероидных гормонов в сыворотке крови у больных с РРЯ и пациенток контрольной группы
| Показатель | Референтныезначения | Больные с РРЯ,n=41 | Пациентки контрольной группы, n=35 | р |
| Возраст на момент проведения анализа, годы | Постменопауза | 51,8±1,3 | 48,7±1,3 | 0,25 |
| ФСГ, мМЕ/мл | 25,2–134,8 | 83,0±5,3 | 76,3±6,1 | 0,15 |
| ЛГ, мМЕ/мл | 7,7–58,5 | 40,7±2,3 | 36,5±2,5 | 0,23 |
| Э2, пг/мл | до 54,7 | 18,3±1,0 | 21,5±6,6 | 0,29 |
| Прогестерон, нг/мл | 0,1–0,8 | 0,3±0,03 | 0,4±0,1 | 0,07 |
| Тестостерон, пг/мл | 0,1–1,7 | 1,2±0,1 | 1,4±0,2 | 0,19 |
Представленные результаты показали, что у больных с рецидивом серозного РЯ выявлена высокая частота экспрессии РСГ, HER-2/neu и VEGF в клетках первичной опухоли. У пациенток контрольной группы экспрессия РСГ, HER-2/neu и VEGF отмечена только в клетках фолликулярных кист и кист желтого тела яичника, при этом частота экспрессии этих маркеров была также высокой. Это указывает на наличие общих факторов риска, гормонального патогенеза РЯ и гормонозависимых доброкачественных заболеваний матки и яичника.
Наибольшее количество эстроген-, прогестерон- и тестостерон-рецепторположительных опухолей с достоверной значимостью выявлено у больных с РРЯ перименопаузального периода, тогда как наименьшая частота рецепторположительного серозного РЯ отмечена у пациенток репродуктивного возраста. Подтверждено наличие корреляционной связи между всеми РСГ, а также между экспрессией РЭ, РП и возрастным периодом больных с РРЯ, что установлено нами ранее [16]. Отмечено отсутствие корреляции между экспрессией HER-2/neu, VEGF и возрастом больных с РРЯ, что также установлено результатами предыдущих наших исследований. Это еще раз указывает на то, что экспрессия HER-2/neu и VEGF в серозном РЯ являются независимыми факторами агрессивного и неблагоприятного течения опухолевого процесса.
Самая высокая частота экспрессии РСГ, HER-2/neu и VEGF в гранулезных, тека- и лютеиновых клетках функциональных кист яичника отмечена у пациенток репродуктивного периода. При этом установлены достоверно значимые корреляции между всеми РСГ в клетках функциональных кист яичника; между возрастным периодом женщин и экспрессией всех стероидных рецепторов; экспрессии РЭ, РП с экспрессией HER-2/neu и VEGF. Эти данные подтверждают непосредственное участие экспрессии РСГ, HER-2/neu, VEGF в гранулезных, тека- и лютеиновых клетках яичника в регуляции овариально-менструального цикла у женщин [20, 21].
Отмечена достоверно более высокая степень экспрессии РСГ и HER-2/neu в клетках серозного РЯ по сравнению с таковой в функциональных кистах яичника. По результатам ранее проведенных исследований нами установлено, что положительный гормональный рецепторный статус у больных серозным РЯ является фактором неблагоприятного течения опухолевого процесса. Это позволяет заключить, что степень экспрессии РСГ имеет определенное значение в клиническом течении РЯ.
Еще A. Kauppila и A. Bergqvist (цит. по: [17]) показали, что образцы морфологически не измененного яичника, с доброкачественной и злокачественной опухолью экспрессировали все РСГ. При этом частота экспрессии РЭ была достоверно выше в клетках РЯ по сравнению с таковой в доброкачественной опухоли и морфологически не измененных яичниках, а для РП и РТ зафиксировано обратное соотношение. D. Willcocks и соавторы (цит. по: [17]) в морфологически не измененных яичниках наблюдали низкую степень экспрессии РЭ (22%) и высокую степень экспрессии РП (75%). M. Galli и соавторы (цит. по: [17]) установили фенотип опухоли РЭ+РП+РТ+ у 44% больных РЯ и не выявили такового фенотипа у пациенток с доброкачественной опухолью. При этом позитивное окрашивание образцов морфологически не измененных яичников для РЭ отмечено у 46% больных, для РП — у 54% и для РТ — у 85%. Л.С. Бассалык [17] в собственных исследованиях установил одинаковую частоту экспрессии РЭ и РП в клетках РЯ и доброкачественных опухолях яичника, тогда как рецепторы к андрогенам в последних встречались в 15 раз чаще, чем в клетках РЯ. По данным исследования В.К. Кондратюк [34], установлено отсутствие экспрессии РЭ и РП в клетках фолликулярных и параовариальных кист яичника, а также низкий рецепторный статус в клетках эндометриоидных кист и кист желтого тела. Q. Meng и соавторы [35] показали достоверно высокую частоту и уровень экспрессии РЭ-ɑ, рецепторов к андрогенам, VEGF и СОХ-2 в клетках РЯ по сравнению с таковыми в клетках эндометриоидных кист яичника.
Результатами исследований В.П. Козаченко и Е.Е. Маховой [36] показано, что средние уровни экспрессии РЭ, РП, рецепторов к андрогенам в опухолевых клетках достоверно не различались у менструирующих женщин и находящихся в постменопаузе, однако частота РП-положительного РЯ у менструирующих больных была выше и составила 83%. С.М. Карташов [37], анализируя гормонально-рецепторный статус в опухолях яичника, отметил, что фенотип опухоли РЭ+РП+ регистрировали достоверно чаще в серозном РЯ, чем в серозных цистаденомах яичника. При этом средние уровни экспрессии РЭ и РП были также достоверно выше в клетках серозного РЯ. Оценивая зависимость экспрессии РЭ и РП в опухолях яичника от возраста больных, исследователь показал, что положительный гормональный рецепторный статус серозного РЯ у больных менопаузального периода выявляли чаще (52,2%), чем у больных репродуктивного возраста (37,5%). Подобная тенденция отмечена и у пациенток с серозной цистаденомой яичника.
Нами установлено отсутствие достоверных различий гормонального гомеостаза у больных с РРЯ и пациенток контрольной группы, показатели которого соответствовали референтным значениям уровней половых гормонов постменопаузального периода, что позволяет предположить определенное значение локальной концентрации гонадных гормонов в опухолях яичника. Наши данные противоречат результатам исследований J. Wang и соавторов [38], которые наблюдали индукцию экспрессии VEGF в серозном РЯ, in vitro и in vivo, под воздействием повышенных уровней ФСГ и ЛГ, предположив, что высокие менопаузальные уровни гонадотропных гормонов у больных РЯ после операции могут ускорить прогрессирование и рецидив заболевания. Однако результаты нашего исследования согласуются с данными многих других работ. S. Rinaldi [39], анализируя результаты большого европейского исследования (192 больных РЯ и 346 здоровых женщин), и A. Lukanova [40], по данным собственных наблюдений, не установили статистически значимых различий в уровнях тестостерона, андростендиона, дегидроэпиандростендиона, эстрона, секс-связывающего глобулина в сыворотке крови больных РЯ и здоровых женщин. Кроме того, A. Akhmedkhanov [29] и A.A. Arslan [28] также не выявили связи между сывороточными уровнями ФСГ, ЛГ и риском развития РЯ. S. Kramer [41] и A. Chudecka-Glaz [42] при сравнении пациентов с доброкачественными кистами яичников и больных серозным РЯ не отметили различий в сывороточных уровнях ФСГ и ЛГ, однако в аспирате из серозного РЯ наблюдали достоверно высокие уровни ФСГ и ЛГ по сравнению с таковыми из доброкачественных кист яичников. Более того, результатами многих исследований показано, что ФСГ- и ЛГ-рецепторные комплексы способны вызывать гиперэкспрессию EGFR, в частности HER-2/neu, и через ERK½–PI3K/Akt путь стимулировать пролиферативную активность клеток РЯ [43–45]. Активация сигнального тирозинкиназного пути приводит к стимуляции СОХ-1 и -2, увеличивая миграционный потенциал и инвазивную способность опухолевых клеток яичника [44].
Как известно, эстрогенизация у женщин постменопаузального периода определяется не уровнем циркулирующих в крови гормонов, а локальной их концентрацией во всех тканях организма, большей частью в жировой. Более того, в постменопаузе возрастает роль неклассических фенолстероидов и эстрона, которые являются мощными агонистами эстрадиола, активность этих метаболитов превышает активность последнего в несколько раз, образуя стойкие связи со специфическими рецепторами различных тканей. Важность этого феномена заключается в том, что для возникновения и роста опухолевых клеток у постменопаузальных женщин имеет определенное значение локальная концентрация классических и неклассических половых стероидов в опухолевых тканях, что более полно изучено при раке грудной железы [2, 33, 46, 47]. При этом заболевании на сегодня также изучены механизмы взаимодействия стероидных гормонов и многих других молекулярных маркеров, в том числе HER-2/neu и VEGF, с рецепторным аппаратом опухолевой клетки и реализация рецепторных сигналов в клеточном ядре [48–50].
На сегодня доказана митогенная роль эстрогенов в клетках РЯ in vivo и in vitro. Однако каскадный сигнальный механизм пролиферации в результате действия эстроген-рецепторного комплекса в клетках РЯ включает в себя множество путей, которые еще не полностью изучены [14]. G.N. Armaiz-Pena и соавторы [51] продемонстрировали, что 17-β эстрадиол повышает экспрессию VEGF в РЯ, адгезию, миграционный и митогенный потенциал РЭ-положительных опухолевых и эндотелиальных клеток через МАРК. Роль прогестерона и его рецепторов на сегодня однозначно не определена [14]. Эстрадиол способен регулировать уровень экспрессии рецепторов андрогенов, в частности повышать ее [33]. Ныне доказано, что андроген-регулируемые гены стимулируют экспрессию EGFR, VEGF и циклинзависимых киназ 2 и 4. При этом оказывают репрессирующее действие на экспрессию ТФР-β и Bcl-2 [52], а дигидротестостерон в клеточных линиях РЯ и рака грудной железы вызывает репрессию р27 [53]. Кроме того, M. Nourbakhsh и соавторы [54] наблюдали активацию теломеразы тестостероном и андростендионом в клеточных линиях РЯ, увеличивая жизнеспособность опухолевых клеток. Результатами многих исследований показано, что выраженная экспрессия рецепторов андрогенов отмечена как в клеточных линиях (OVCAR3, OSEC2), так и в инвазивном РЯ, а гиперандрогения может быть риском возникновения и прогрессирования этого заболевания [55, 56].
Таким образом, представленные результаты свидетельствуют о наличии общих факторов риска, единого патогенетического механизма развития РЯ и гормонозависимых доброкачественных заболеваний матки и яичника, что аргументирует гормонообусловленность РЯ. Однако сложные механизмы реализации гормонально-рецепторного сигнала в опухолевых клетках яичника, запускающие процессы трансформации, пролиферации, инвазии и метастазирования остаются до конца не изученными, что требует продолжения исследований для обоснования целесообразности применения гормональной терапии не при рецидивах заболевания, а в первой линии комплексного лечения больных.
ВЫВОДЫ
Установлено, что у женщин контрольной группы экспрессия РСГ, HER-2/neu и VEGF выявлена только в клетках функциональных кист яичника. Отмечена высокая частота экспрессии указанных маркеров как в клетках серозного РЯ, так и в клетках функциональных кист яичника, однако степень экспрессии этих маркеров была достоверно выше в серозном РЯ.
Наибольшее количество эстроген-, прогестерон- и тестостерон-рецепторположительных опухолей с достоверной значимостью отмечено у больных с РРЯ перименопаузального периода, тогда как наименьшая частота рецепторположительного серозного РЯ зарегистрирована у пациенток репродуктивного возраста.
Отмечено отсутствие корреляционной связи между экспрессией HER-2/neu, VEGF и возрастом больных с РРЯ. При этом наблюдали значимую корреляцию между экспрессией HER-2/neu и VEGF в клетках серозного РЯ.
Самая высокая частота экспрессии РЭ, РП, РТ, HER-2/neu и VEGF в гранулезных, тека- и лютеиновых клетках функциональных кист яичника отмечена у пациенток репродуктивного периода. Установлены достоверно значимые корреляции между всеми РСГ в клетках функциональных кист яичника; между возрастом женщин и экспрессией всех стероидных рецепторов; экспрессией РЭ, РП с экспрессией HER-2/neu и VEGF.
Показатели гормонального гомеостаза больных с рецидивом серозного РЯ не имели достоверных различий с таковыми у пациенток с хирургической менопаузой, прооперированных по поводу доброкачественной патологии матки, и соответствовали референтным значениям уровней половых гормонов постменопаузального периода.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Disaia P.J., Creasman W.T. (2012) Clinical Oncologic Gynecology (перевод с англ. под ред. Новиковой Е.Г.). М.: РидЭлсивер, 346 c.
2. Воробьева Л.И., Свинцицкий В.С., Ткаля Ю.Г. (2013) Гормональный канцерогенез и обоснование применения гормональной терапии в лечении больных раком яичника. Клин. онкология, 1(9): 56–64.
3. Урманчеева А.Ф., Кутушева Г.Ф., Ульрих Е.А. (2012) Опухоли яичника (клиника, диагностика и лечение). СПб.: Н-Л, 68 с.
4. Воробьева Л.И., Ткаля Ю.Г. (2013) Киническое значение сопутствующих гиперпластических процессов эндометрия у больных со злокачественными опухолями яичников. Онкология, 4 (58): 286–293.
5. Горбунова В.А. (2011) Диагностика и лечение рака яичников. М.: МИА, 248 с.
6. Landen J.C.N., Birrer M.J., Sood A.K. (2008) Early stages of the pathogenesis of ovarian cancer. J Clin. Oncol., 26 (6): 149–160.
7. Whittemore A.S., Balise R.R., Pharoah P.D. et al. (2004) Oral contraceptive use and ovarian cancer risk among carriers of BRCA1 or BRCA2 mutations. Br. J. Cancer, 91 (11): 1911–1915.
8. Olsen C.M., Nagle C.M., Whiterman D.C. et al. (2013) Obesity and risk of ovarian cancer subtypes. Endocr. Relat. Cancer, 20 (2): 251–262.
9. Schouten L.J., Rivera C., Hunter D.J. et al. (2008) Height, body mass index, and ovarian cancer. Cancer Epidemiol. Biomark and Prevent., 17(4): 902–912.
10. Осинский С.П., Ваупель П. (2009) Микрофизиология опухолей. К.: Наукова думка, 256 с.
11. Осинский С.П., Глузман Д.Ф., Клифф Й. и др. (2007) Молекулярная диагностика опухолей: фундаментальные основы и практическое применение. Монография. К.: ДИА, 248 с.
12. Осинский С.П. (2013) Микроокружение опухолевых клеток и опухолевая прогрессия. Факторы стромального микроокружения. Здоров’я України, 3(28): 36–39.
13. Чехун В.Ф., Шербан С.Д., Савцова З.Л. (2012) Гетерогенность опухоли — динамическое состояние. Онкология, 1(14): 4–12.
14. King E.R., Wong K.K. (2011) Steroid hormones and ovarian cancer. Steroids — Clinical Aspect edited by Prof. Hassan Abduljabbar. 166 p. (http://www.intechopen.com/books/ steroids-clinical-aspect/steroid-hormones-and-ovarian-cancer).
15. Cunat S., Hoffmann P., Pujol P. (2004) Estrogens and epithelial ovarian cancer. Gynecol. Oncol., 94(1): 25–32.
16. Tkalia I.G., Vorobyova L.I., Svintsitsky V.S. et al. (2014) Clinical significance of hormonal receptor status of malignant ovarian tumors. Exp. Oncol., 36(2): 125–133.
17. Бассалык Л.С. (1987) Рецепторы стероидных гормонов в опухоли человека. М.: Медицина, 224 с.
18. Aust S., Horak P., Pils D. et al. (2013) The prognostic value of estrogen receptor beta and proline-, glutamic acid- and leucine-rich protein 1 (PELP1) expression in ovarian cancer. BMC Cancer, 13: 115.
19. Halon A., Materna V., Drag-Zalesinska M. et al. (2011) Estrogen receptor alpha expression in ovarian cancer predicts longer overall survival. Pathol. Oncol. Res., 17(3): 511–518.
20. Татарчук Т.Ф., Сольский Я.П. (2003) Эндокринная гинекология (клинические очерки). К.: Заповит, 300 с.
21. Манухин И.Б., Тумилович Л.Г., Геворкян М.А. (2003) Клинические лекции по гинекологической эндокринологии. М.: МИА, 247 с.
22. Sylvia M.T., Kumar S., Dasari P. (2012) The expression of immunohistochemical markers estrogen receptor, progesterone receptor, Her-2-neu, p53 and Ki-67 in epithelial ovarian tumors and its correlation with clinicopathologic variables. Pathology & Microbiology, 55 (1): 33–37.
23. Pils D., Pinter A., Reibenwein J. et al. (2007) In ovarian cancer the prognostic influence of HER2/neu is not dependent on the CXCR4/SDF-1 signalling pathway. Br. J. Cancer, 96: 485–491.
24. Moghaddam S.M., Amini A., Morris D.L. et al. (2012) Significance of vascular endothelial growth factor in growthand peritoneal dissemination of ovarian cancer. Cancer Metastasis Rev., 31: 143–62.
25. Ткаля Ю.Г., Воробьева Л.И., Свинцицкий В.С. и др. (2014) Клиническое значение экспрессии VEGF у больных серозным раком яичника в зависимости от гормонального рецепторного статуса опухоли. Здоровье женщины, 6(92): 169–177.
26. Ferrara N. (2005) The role of VEGF in the regulation of physiological and pathological angiogenesis. EXS; 94: 209–231.
27. Маевская Л.П., Тарутинов В.И., Свинцицкий В.С. (1993) Нарушение гормонального гомеостаза у больных раком яичника, 15(1): 79–80.
28. Arslan A.A., Zeleniuch-Jacquotte A., Lundin E. et al. (2003) Serum follicle-stimulating hormone and risk of epithelial ovarian cancer in postmenopausal women. Cancer Epidemiol Biomarkers Prev., 12(12): 1531–1535.
29. Akhmedkhanov A., Toniolo P., Zeleniuch-Jacquotte A. et al. (2001) Luteinizing hormone, its beta-subunit variant, and epithelial ovarian cancer: the gonadotropin hypothesis revisited. Am. J. Epidemiol., 154(1): 43–49.
30. Ткаля Ю.Г., Воробьева Л.И., Свинцицкий В.С. и др. (2014) Клиническое значение экспрессии HER-2/neu у больных серозным раком яичника в зависимости от статуса гормональных рецепторов опухоли. Онкология, 16(3): 181–190.
31. Вихляева Е.М. (2002) Руководство по эндокринной гинекологии. М.: МИА, 768 с.
32. Yen S.S.C., Jaffe R.B. (1998) Reproductive endocrinology (пер. с англ. под. ред. Дедова И.И.). М.: Медицина, 704 c.
33. Корман Д.Б. (2010) Эндокринная терапия злокачественных опухолей. М.: Практическая медицина, 400 с.
34. Кондратюк В.К. (2008) Імуногістохімічні особливості рецепторного апарата та регуляторів апоптоза пухлиноподібних уражень яєчників. Здоровье женщины, 2: 183–185.
35. Meng Q., Sun W., Jiang J. et al. (2011) Identification of common mechanisms between endometriosis and ovarian cancer. J. Assist. Reprod. Genet., 28: 917–923.
36. Козаченко В.П., Махова Е.Е. (2007) Гормоны в онкогинекологии (http://medinfa.ru/article/12/118816).
37. Карташов С.М. (2003) Рак яєчника: гормонально-метаболічні фактори патогенезу та шляхи підвищення ефективності лікування: автореф. дис…. д-ра мед. наук: 14.01.01.К., 35 с.
38. Wang J., Luo F., Lu J.J. et al.V (2002) EGF Expression and enhanced production by gonadotropins ovarian epithelial tumors. Int. J. Cancer, 97: 163–167.
39. Rinaldi S., Dossus L., Lukanova A. et al. (2007) Endogenous androgens and risk of epithelial ovarian cancer: results from the European Prospective Investigation into Cancer and Nutrition (EPIC). Cancer Epidemiol. Biomarkers Prev., 16(1): 23–29.
40. Lukanova A., Lundin E., Akhmedkhanov A. et al. (2003) Circulating levels of sex steroid hormones and risk of ovarian cancer. Int. J. Cancer, 104(5): 636–642.
41. Kramer S., Leeker M., Jager W. (1998) Gonadotropin levels in ovarian cyst fluids: a predictor of malignancy? Int. J. Biol. Markers, 13(3): 165–168.
42. Chudecka-Glaz A., Rzepka-Gorska I., Kosmowska B. (2004) Gonadotropin (LH, FSH) levels in serum and cyst fluid in epithelial tumors of the ovary. Arch. Gynecol. Obstet., 270(3): 151–156.
43. Choi K.C., Kang S.K., Tai C.J. et al. (2002) Follicle-stimulating hormone activates mitogen-activated protein kinase in preneoplastic and neoplastic ovarian surface epithelial cells. J. Clin. Endocrinol. Metab., 87: 2245–2253.
44. Choi J.H., Choi K.C., Auersperg N. et al. (2004) Overexpression of follicle-stimulating hormone receptor activates oncogenic pathways in preneoplastic ovarian surface epithelial cells. J. Clin. Endocrinol. Metab., 89: 5508–5516.
45. Choi J.H., Choi K.C., Auersperg N. et al. (2005) Gonadotropins upregulate the epidermal growth factor receptor through activation of mitogen-activated protein kinases and phosphatidyl-inositol-3-kinase in human ovarian surface epithelial cells. Endocrine-Related Cancer, 12: 407–421.
46. Simpson E.R., Misso M., Hewitt N. et al. (2005) Estrogen — the gold, the bad and the unexpected. Endocr. Rev., 26: 322–330.
47. Берштейн Л.М. (2010) Колчан и стрелы — проканцерогенная роль маммарного жира. Природа, 12: 13–19.
48. Ayadi L., Khabir A., Amouri H. et al. (2008) Correlation of HER2 overexpression with clinicopathological parameters in Tunisian breast carcinoma. World J. Surgical Oncol., 6: 112.
49. Ahmed H.G., Al-Adhraei M.A., Al-Thobhani A.K. (2011) Correlations of Hormone Receptors (ER and PR), Her2/neu and p53 Expression in Breast Ductal Carcinoma Among Yemeni Women. The Open Cancer Immunol J., 4: 1–9.
50. Faheem M., Mahmood H., Khurram M. et al. (2012) Estrogen receptor, progesterone receptor, and Her 2 Neu positivity and its association with tumour characteristics and menopausal status in a breast cancer cohort from northern Pakistan. Cancer, 6 (283): 1–8.
51. Armaiz-Pena G.N., Mangala L.S., Spannuth W.A. et al. (2009) Estrous cycle modulates ovarian carcinoma growth. Clin. Cancer Res., 15: 2971–2978.
52. Evangelou A., Jindal S.K., Brown T.J. et al. (2000) Down-regulation of transforming growth factor beta receptors by androgen in ovarian cancer cells. Cancer Res., 60(4): 929–935.
53. Shi P., Zhang Y., Tong X. et al. (2011) Dihydrotestosterone induces p27 degradation via direct binding with SKP2 in ovarian and breast cancer. Int. J. Mol. Med., 28(1): 109–114.
54. Nourbakhsh M., Golestani A., Zahrai M. et al. (2010) Androgens stimulate telomerase expression, activity and phosphorylation in ovarian adenocarcinoma cells. Mol. Cell. Endocrinol., 330(1–2): 10–16.
55. Wang P.H., Chang C. (2004) Androgens and ovarian cancers. Eur. J. Gynaec. Oncol., 25 (2): 157–163.
56. Sheach L.A., Adeney E.M., Kucukmetin A. et al. (2009) Androgen-related expression of G-proteins in ovarian cancer. Br. J. Cancer, 101(3): 498–503.














Leave a comment