Роль та місце хірургічного лікування в комплексній терапії первинно-метастатичного раку грудної залози
Щепотин И.Б.1, Чешук В.Е.2, Аникусько Н.Ф.3, Любота И.И.3, Любота Р.В.2
- 1Національний інститут раку, Київ
- 2Національний медичний університет ім. О.О. Богомольца, Київ
- 3Київський міський клінічний онкологічний центр, Київ
Резюме. В роботі проведено порівняльний аналіз результатів комплексного лікування хворих на первинно-розповсюджений рак грудної залози з та без оперативного втручання. У двох групах хворих проводили комплексне паліативне лікування, яке включало променеву терапію, хіміотерапію, гормональну терапію (1-ша група — 79 хворих), в контрольній групі (2-га група — 42 пацієнти) лікування ще включало операцію — видалення первинного вогнища. Дослідження виживаності хворих за методом Каплана — Мейєра продемонструвало більшу виживаність хворих в групі з хірургічним лікуванням. 3- та 5-річна виживаність була на 29 и 26% більша відповідно, медіана виживаності – на 11 міс. У групі з хірургічним лікуванням проведення передопераційного спеціального лікування покращило 3- та 5-річну виживаність на 20 та 10% відповідно, а також медіану виживаності – на 14 міс.
Резюме. В работе проведен сравнительный анализ результатов комплексного лечения пациентов с первично-распространенным раком грудной железы с и без оперативного вмешательства. В двух группах больных проводили комплексное паллиативное лечение, которое включало лучевую терапию, химиотерапию, гормональную терапию (1-я группа — 79 больных), в контрольной группе (2-я группа — 42 пациента) лечение еще включало операцию — удаление первичного очага. Исследование выживаемости больных по методу Каплана — Мейера продемонстрировало большую выживаемость больных в группе с хирургическим лечением. 3- и 5-летняя выживаемость была на 29 и 26% больше соответственно, медиана выживаемости — на 11 мес больше. В группе с хирургическим лечением проведение предоперационного специального лечения улучшило 3- и 5-летнюю выживаемость на 20 и 10% соответственно, а также медиану выживаемости — на 14 мес.

Введение
Заболеваемость женского населения раком грудной железы (РГЖ) в течение нескольких десятилетий остается на 1-м месте в мире, и рост заболеваемости отмечен не только в странах Европы и Америки, но и среди стран Азии и Африки. В последние годы достигнуты значительные успехи в диагностике и лечении РГЖ благодаря эффективной работе скрининга и индивидуализированного подхода в лечении [31]. Доказательство этому — снижение смертности от РГЖ во многих развитых странах мира.
Как и при многих других онкологических заболеваниях, успех в лечении РГЖ зависит от ранней диагностики и своевременного лечения. Лечение IV стадии носит паллиативный характер, а иногда симптоматический [5, 19]. Тем не менее, в последние годы обращают внимание на разработку относительно эффективных методик для лечения этой категории больных. В разных странах, в зависимости от уровня диагностики, количество пациенток с первично-метастатическим (первично-распостраненным) РГЖ составляет 5–20%. По данным Национального канцер-регистра Украины, в 2009 г. 7,5% больных РГЖ впервые обратились за медицинской помощью с первично-распространенным РГЖ [1]. Медиана выживаемости пациентов с IV стадией РГЖ составляет 18–24 мес [21, 30].
Существует мнение, что хирургическое вмешательство при первично-распостраненном РГЖ не только не повышает общую выживаемость больных РГЖ с наличием отдаленных метастазов, но и может стимулировать прогрессирование заболевания [4, 9]. Поэтому хирургическое лечение у этой группы больных применяют только для предотвращения и/или устранения местных осложнений [8, 23, 24]. Однако не были доказаны в рандомизированных исследованиях как провоцирующее метастазирование влияние биопсии при верификации диагноза, так и вред оперативного лечения у пациенток с первичным метастатическим РГЖ. Напротив, результаты многих ретроспективных популяционных исследований свидетельствуют, что хирургическое удаление первичного очага увеличивает 5-летнюю выживаемость больных с первично-распространенным РГЖ [2, 3, 6, 7, 13, 15, 18, 20, 22, 25, 26. 28, 29] в составе паллиативного лечения.
Целью данного популяционного исследования было определить влияние паллиативного оперативного вмешательства на результаты комплексного лечения больных с первично-метастатическим РГЖ.
В ходе исследования было предусмотрено решение следующих задач:
- оценить выживаемость больных с первично-метастатическим РГЖ с и без хирургического лечения в составе паллиативной терапии;
- определить показания к оперативному лечению у этой категории пациенток.
Материалы и методы
Использовали данные амбулаторных карт Киевского городского клинического онкологического центра и Национального института рака, в которых представлены состав и результаты лечения пациенток с первично-метастатическим РГЖ.
В исследование включены женщины в возрасте 23–81 (55±11) лет, проживающие в Киеве на момент установления диагноза первично-метастатического РГЖ в 2004–2006 гг. В исследование включили 121 пациентку. Диагноз устанавливали согласно Международной TNM-классификации (6-е издание 2002 г.): любое Т, любое N, и М1 — наличие отдаленных метастазов [16].
Для расчета 3- и 5-летней выживаемости больных с первично-метастатическим РГЖ использовали метод Каплана – Мейера. Учитывали прошедшее время в месяцах с момента установления диагноза (начало наблюдения) до наступления смерти (критическое событие) в результате прогрессирования РГЖ. Пациенты, которые погибли от других причин, были цензурированы в момент смерти. Данные анализировали с помощью программы MS Exсel.
Результаты
В результате проведенного исследования больных разделили на 2 группы. Обе группы отличались только наличием или отсутствием оперативного вмешательства в составе комплексной паллиативной терапии. В 1-ю группу (n=79) включили больных, которым проводили консервативную паллиативную (химио-, гормональная и лучевая терапия) терапию, а во 2-ю группу (n=42) — больных, которым проводили оперативное вмешательство в составе паллиативного лечения. Для определения важности времени выполнения операции — до проведения специальных методов лечения, то есть в начале лечения, или после неоадъювантного лечения 2-ю группу разделили на подгруппу А (n=21) — пациентки, которым на первом этапе лечения проводили операцию, и подгруппу Б (n=21) — пациентки, которым проводили неоадъювантную полихимиотерапию и/или лучевую терапию. Распределение больных в зависимости от возраста на момент установления диагноза представлено в табл. 1.
| ГруппаБольных | Возраст | Всего | ||||||
|---|---|---|---|---|---|---|---|---|
| До 50 лет | 51–70 лет | Более 70 лет | ||||||
| n | % | n | % | n | % | n | % | |
| 1-я группа | 22 | 28 | 50 | 63 | 7 | 9 | 79 | 100 |
| 2-я (А) группа | 8 | 38 | 12 | 57 | 1 | 5 | 21 | 100 |
| 2-я (Б) группа | 8 | 38 | 11 | 52 | 2 | 10 | 21 | 100 |
| Всего | 38 | 31,5 | 73 | 60,5 | 10 | 8 | 121 | 100 |
Во 2-й группе больных в возрасте до 50 лет было на 10% больше. Следовательно, операции были подвергнуты пациентки более молодого возраста, что вполне естественно, так как возраст старше 70 лет значительно повышает риск операции, особенно когда польза от нее сомнительна. Тем не менее, количество пациенток в возрасте старше 70 лет в исследованных группах существенно не отличалось.
Объем выполненного оперативного вмешательства больным 2-й группы представлен в табл. 2.
| Группа больныхОбъем оперативного вмешательства |
2-я (А) группа | 2-я (Б) группа | Всего |
|---|---|---|---|
| Секторальная резекция | 2 | 1 | 3 |
| Квадрантэктомия грудной железы | 2 | 3 | 5 |
| Простая мастэктомия | 12 | 5 | 17 |
| Мастэктомия по Маддену | 3 | 7 | 10 |
| Мастэктомия по Пейти | 1 | 5 | 6 |
| Мастэктомия по Холстеду | 1 | 0 | 1 |
| Всего | 21 | 21 | 42 |
Во 2-й (А) группе было больше пациенток, которым выполняли простые мастэктомии в связи с угрозой кровотечения, зачастую по вынужденным показаниям. Конечно, у больных этой группы отмечали определенные отягощающие факторы, связанные с интоксикацией, анемией и др.
3- и 5-летняя выживаемость у больных 1-й группы составила 15 и 7%, тогда как у больных 2-й группы — 44 и 33% (рис. 1). Медиана выживаемости для больных, которым не проводили хирургическое вмешательство, составляла 19 мес против 30 мес у пациентов, перенесших паллиативную операцию.
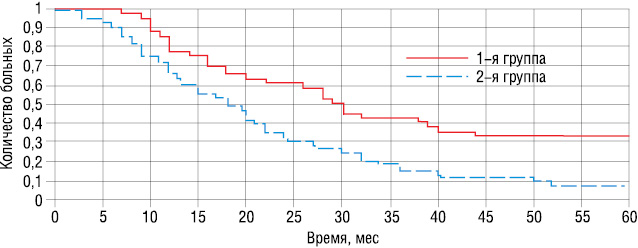
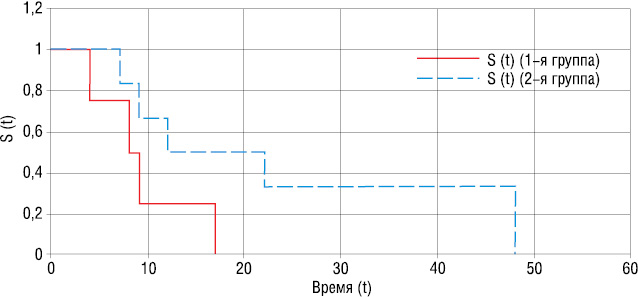
На рис. 2 представлены кривые выживаемости больных 2-й группы. У пациентов, получавших неоадъювантное лечение, 3- и 5-летняя выживаемость составила 53 и 38% соответственно, медиана выживаемости — 38 мес. Среди пациенток, которым на первом этапе проводили паллиативную операцию, 3- и 5-летняя выживаемость составляла 33 и 28%, медиана выживаемости — 24 мес. Неоадъювантное лечение включало проведение паллиативных курсов химиотерапии, которое не планировалось в качестве подготовки к операции. Однако впоследствии возникала необходимость в операции в связи с развитием местных осложнений – распада и кровотечения первичной опухоли, а также положительная динамика лечения (частичная регрессия опухолевого процесса) приводила к повышению резектабельности опухоли, что подталкивало нас к выполнению операции с целью дополнительной редукции опухолевого процесса в организме пациентки.

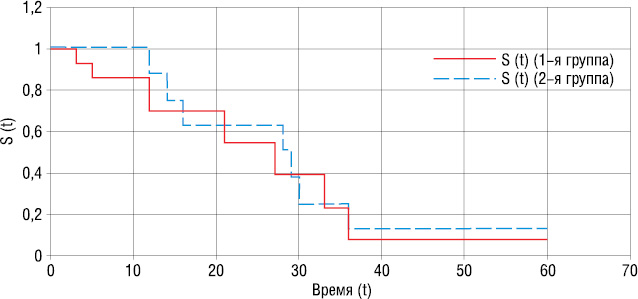
Чтобы определить эффективность хирургического вмешательства при первично-распространенном РГЖ в зависимости от локализации метастастазов, провели анализ выживаемости больных 1-й и 2-й группы. На рис. 3 представлены кривые выживаемости больных с наличием метастазов в костях. При метастатическом поражении костей 3- и 5-летняя выживаемость в 1-й группе составила 0%, а во 2-й группе 33 и 0% соответственно, медиана выживаемости — 8 мес среди больных без хирургического лечения против 12 мес среди пациентов, которым была проведена паллиативная операция.
На рис. 4 представлены кривые выживаемости больных с наличием метастазов в легких и/или плевре. У больных обеих групп 3- и 5-летняя выживаемость была сравнима и составила для больных 1-й группы 8%, а для 2-й группы — 13%, при медиане выживаемости 21 и 29 мес для 1-й и 2-й группы соответственно.
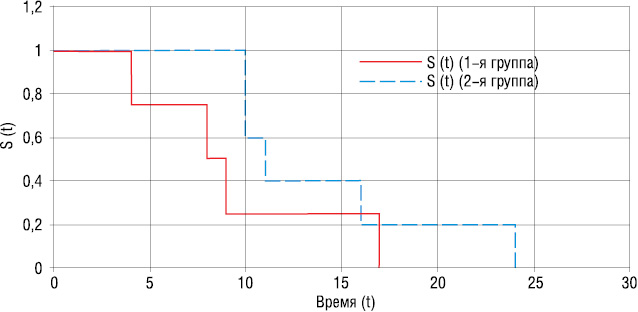
На рис. 5 представлены кривые выживаемости больных 1-й и 2-й групп при наличии у них метастатического поражения печени. Так, 3- и 5-летняя выживаемость больных обеих групп равна 0%, а медиана выживаемости — 8 и 11 мес для больных 1-й и 2-й групп соответственно.
Обсуждение
Данное исследование показывает, что хирургическое удаление первичного очага в грудной железе значительно улучшает прогноз течения первично-метастатического РГЖ. У женщин, которым проведена паллиативная операция, 3- и 5-летняя выживаемость увеличилась на 29 и 26%, а медиана выживаемости – на 11 мес. Локализация метастазов существенно не влияет на эффект оперативного вмешательства у пациенток с первично-распространенным РГЖ. Тем не менее, согласно литературным данным, лучший эффект от паллиативной операции отмечают среди больных с изолированным метастатическим поражением костей [26].
В настоящее время оперативное лечение при наличии отдаленных метастазов РГЖ показано лишь при развитии осложнений, таких как изъязвление, инфицирование, угроза распада или кровотечения, как правило, в объеме простой мастэктомии. Исторически сложилось мнение о неэффективности хирургического лечения у больных с первично-распространенным РГЖ. Длительное время существовало мнение, основанное на личном опыте врачей, что хирургическое вмешательство у больных РГЖ с наличием отдаленных метастазов может стимулировать прогрессирование заболевания. Поэтому хирургическое лечение пациентов с первично-распространенным РГЖ применяется для предотвращения местных осложнений [4, 8, 9, 23, 24]. В данном исследовании установлено, что паллиативная операция не только не снижает общую выживаемость больных с первично-распространенным РГЖ, но и достоверно улучшает 3- и 5-летнюю выживаемость, а также медиану выживаемости. Полученные результаты коррелируют с результатами других исследований, направленных на определение влияния паллиативной операции при различных локализациях злокачественных новообразований при РГЖ [2, 3, 6, 7, 13, 15, 18, 20, 22, 25, 26, 28, 29], почечно-клеточном раке [14], колоректальном раке [27], раке желудка [17] и меланоме [12]. Полученный эффект от оперативного вмешательства, возможно, обусловлен уменьшением опухолевой массы в организме и количества циркулирующих опухолевых клеток, снижением вероятности возникновения новых метастатических очагов и, как следствие, улучшение прогноза течения первично-распространенного РГЖ [10, 11]. Возможно, удаление опухолевого очага с участками некроза и распада, источника кровотечения и развития анемии, приводит к снижению интоксикации и способствует адекватному проведению специального лечения.
Результаты этого исследования свидетельствуют, что 3- и 5-летняя выживаемость (на 20 и 10%), а также медиана выживаемости на 14 мес больше у пациенток, которым перед операцией проводили химио-, гормоно- или лучевую терапию или их комбинацию.
Наибольшую выгоду от хирургического лечения первичного очага в грудной железе при первично-распространенном РГЖ, по полученным в данном исследовании результатам, получают больные с метастатическим поражением легких и/или плевры и костей.
Результаты данного исследования свидетельствуют о положительном влиянии оперативного вмешательства на прогноз течения первично-метастатического РГЖ. Однако, дальнейшие исследования должны быть направлены на установление критериев отбора пациентов с первично-распространенным РГЖ для проведения им оперативного вмешательства.
Литература
- 1. Бюллетень Национального канцер-регистра № 11. «Рак в Украине, 2008–2009», Киев – 2010.
- 2. Babiera G.V., Rao R., Feng L. et al. (2006) Effect of primary tumor extirpation in breast cancer patients who present with stage IV disease and an intact primary tumor. Ann Surg Oncol., 13: 776–782.
- 3. Bafford A.C., Burstein H.J., Barkley C.R. et al. (2009) Breast surgery in stage IV breast cancer: impact of staging and patient selection on overall survival. Breast Cancer Res Treat., 115: 7–12.
- 4. Baum M., Demicheli R., Hrushesky W. et al. (2005) Does surgery unfavourably perturb the «natural history» of early breast cancer by accelerating the appearance of distant metastases? Eur. J. Cancer., 41: 508–515.
- 5. Bernard-Marty C., Cardoso F., Piccart M.J. (2004) Facts and controversies in systemic treatment of metastatic breast cancer. Oncologist., 9: 617–632.
- 6. Blanchard D.K., Shetty P.B., Hilsenbeck S.G. et al. (2008) Association of surgery with improved survival in stage IV breast cancer patients. Ann. Surg., 247(5): 732–738.
- 7. Cady B., Nathan N.R., Michaelson J.S. et al. (2008) Matched pair analyses of stage IV breast cancer with or without resection of primary breast site. Ann. Surg. Oncol., 15(3): 3384–3395.
- 8. Canadian Cancer Society: Canadian Cancer Encyclopedia. Breast cancer. Treatment by stage. Stage IV breast cancer—treatment. Stage IV (any T, any N, M1) (http://info.cancer.ca /E/CCE/ cceexplorer.ascp?tocid=10).
- 9. Coffey J.C., Wang J.H., Smith M.J. et al. (2003) Excisional surgery for cancer cure: Therapy at a cost. Lancet Oncol., 4(12): 760–768.
- 10. Cristofanilli M., Budd G.T., Ellis M.J. et al. (2004) Circulating tumor cells, disease progression, and survival in metastatic breast cancer. N. Engl. J. Med., 351(6): 781–791.
- 11. Cristofanilli M., Hayes D.F., Budd G.T. et al. (2005) Circulating tumor cells: A novel prognostic factor for newly diagnosed metastatic breast cancer. J. Clin. Oncol., 23(21): 1420–1430.
- 12. Essner R., Lee J.H., Wanek L.A. et al. (2004) Contemporary surgical treatment of advanced-stage melanoma. Arch. Surg., 139(9): 961–966.
- 13. Fields R.C., Jeffe D.B., Trinkaus K. et al. (2007) Surgical resection of the primary tumor is associated with increased long-term survival in patients with stage IV breast cancer after controlling for site of metastasis. Ann. Surg. Oncol., 14(12): 3345–3351.
- 14. Flanigan R.C., Salmon S.E., Blumenstein B.A. et al. (2001) Nephrectomy followed by interferon alfa-2b compared with interferon alfa-2b alone for metastatic renal-cell cancer. N. Engl. J. Med., 345(23): 1655–1659.
- 15. Gnerlich J., Jeffe D.B., Deshpande A.D. et al. (2007) Surgical removal of the primary tumor increases overall survival in patients with metastatic breast cancer: analysis of the 1988–2003 SEER data. Ann. Surg. Oncol., 14(8): 2187–2194.
- 16. Greene F.L., Page D.S., Fleming I.D. et al. (2002) AJCC (American Joint Committee on Cancer) Cancer Staging Manual, 6th ed. New York: Springer-Verlag, 421.
- 17. Hallissey M.T., Allum W.H., Roginski C. et al. (1988) Palliative surgery for gastric cancer. Cancer., 62(2): 440–444.
- 18. Hazard H.W., Gorla S.R., Kim J. et al. (2007) Surgical resection of the primary tumor in stage IV breast cancer and survival. Presented at the Society of Surgical Oncology (SSO) 60th Annual Cancer Symposium. V. 14 (Suppl.), p. 84, abstract р. 174.
- 19. Hortobagyi G.N. (1998) Treatment of breast cancer. N. Engl. J. Med., 339(14): 974–984.
- 20. Khan S.A., Stewart A.K., Morrow M. (2002) Does aggressive local therapy improve survival in metastatic breast cancer? Surgery, 132(4): 620–626.
- 21. Lee C.G., McCormick B., Mazumdar M. et al. (1992) Infiltrating breast carcinoma in patients age 30 years and younger: long term outcome for life, relapse, and second primary tumors. Int. J. Radiat. Oncol. Biol. Phys., 23(5): 969–975.
- 22. Leung A.M., Vu H.N., Nguyen K.A. et al. (2010) Effects of surgical excision on survival of patients with stage IV breast cancer. J. Surg. Res., 161(1): 83–88.
- 23. National Cancer Institute: Breast Cancer (PDQ): Treatment. Stage IIIB, inoperable IIIC, IV, recurrent, and metastatic breast cancer (http://www.cancer. gov/ cancertopics/ pdq/ treatment /breast /Health Professional/page8).
- 24. National Health and Medical Research Council: Clinical practice guidelines for the management of advanced breast cancer. Prepared by the iSource National Breast Cancer Centre Advanced Breast Cancer Working Group. Endorsed January 2001 (http://www.nhmrc. gov.au/publications/synopses/cp76syn.htm).
- 25. Rao R., Feng L., Kuerer H.M. et al. (2008) Timing of surgical intervention for the intact primary in stage IV breast cancer patients. Ann. Surg. Oncol., 15(6): 1696–1702.
- 26. Rapiti E., Verkooijen H.M., Vlastos G. et al. (2006) Complete excision of primary breast tumor improves survival of patients with metastatic breast cancer at diagnosis. J. Clin. Oncol., 24(18): 2743–2749.
- 27. Rosen S.A., Buell J.F., Yoshida A. et al. (2000) Initial presentation with stage IV colorectal cancer: How aggressive should we be? Arch. Surg., 135(5): 530–534.
- 28. Ruiterkamp J., Ernst M.F., van de Poll-Franse L.V. et al. (2009) Surgical resection of the primary tumour is associated with improved survival in patients with distant metastatic breast cancer at diagnosis. Eur. J. Surg. Oncol., 35(1): 1146–1151.
- 29. Shien T., Kinoshita T., Shimizu C. et al. (2009) Primary tumor resection improves the survival of younger patients with metastatic breast cancer. Oncol. Rep., 21(3): 827–832.
- 30. Vogel C.L., Azevedo S., Hilsenbeck S. et al. (1992) Survival after first recurrence of breast cancer. The Miami experience. Cancer, 70(1): 129–135.
- 31. Wood W.C., Muss H.B., Solin L.J. et al. (2005) Cancer of the breast, in DeVita V.T. Jr, Hellman S., Rosenberg S.A. (eds). Cancer Principles & Practice of Oncology. Philadelphia: PA, Lippincott Williams & Wilkins, 1453–1462.














Leave a comment