Набрякові форми раку грудної залози: особливості хірургічної тактики
Смоланка І.І., Ляшенко А.О., Лобода А.Д., Досенко І.В., Супруненко О.А., Лигирда О.Ф., Іванкова О.М., Молід С.О., Сидорчук О.І.
Резюме. Хірургічна тактика при набряковому раку грудної залози має базуватися на принципах онкологічного радикалізму та естетичної доцільності. Методом вибору оперативної техніки є радикальна мастектомія. Краї рани мають бути досліджені на чистоту. Органозберігаючі втручання та підшкірні ендопротезування при цій формі не виправдані. Реконструктивно-відновні операції мають бути відтерміновані і проведені після закінчення ад’ювантного лікування та повного загоєння післяопераційної рани.
 Покращення результатів лікування раку грудної залози (РГЗ) лишається актуальною проблемою сучасної онкології. Попри втілення наукових досягнень у медичну практику, розробку нових методик лікування хворих на РГЗ, говорити про перемогу або, бодай, значний прогрес у цьому напрямку передчасно. Захворюваність на РГЗ зростає, що є характерним для більшості європейських країн. Так, у 2012 р. скоригований за віком показник захворюваності на РГЗ становив 94,2 на 100 000 населення, а показник смертності — 23,1 на 100 000. Щодо України захворюваність становить 62,5 на 100 000 населення, але смертність перевищує аналогічний загальноєвропейський показник і дорівнює 31,1 на 100 000 населення. Особливе занепокоєння викликають випадки пізно діагностованих, занедбаних форм РГЗ, а також таких, що мають агресивний перебіг, як-от набряковий РГЗ (НРГЗ).
Покращення результатів лікування раку грудної залози (РГЗ) лишається актуальною проблемою сучасної онкології. Попри втілення наукових досягнень у медичну практику, розробку нових методик лікування хворих на РГЗ, говорити про перемогу або, бодай, значний прогрес у цьому напрямку передчасно. Захворюваність на РГЗ зростає, що є характерним для більшості європейських країн. Так, у 2012 р. скоригований за віком показник захворюваності на РГЗ становив 94,2 на 100 000 населення, а показник смертності — 23,1 на 100 000. Щодо України захворюваність становить 62,5 на 100 000 населення, але смертність перевищує аналогічний загальноєвропейський показник і дорівнює 31,1 на 100 000 населення. Особливе занепокоєння викликають випадки пізно діагностованих, занедбаних форм РГЗ, а також таких, що мають агресивний перебіг, як-от набряковий РГЗ (НРГЗ).
НРГЗ — одна з найбільш несприятливих форм місцево-поширеного РГЗ. Хоча кількість випадків НРГЗ у загальній структурі РГЗ не перевищує 1–5% [1, 2], прогноз цієї форми — невтішний, а лікування — проблематичне. Картина перебігу НРГЗ нагадує запальний процес. Відзначається потовщення і гіперемія шкіри, збільшення розмірів ураженої залози, місцеве підвищення температури тіла, дифузне ущільнення тканини залози. Специфічною ознакою є виникнення набряку, що уражує більше ніж третину грудної залози. Характерним є ураження регіонарних лімфатичних колекторів. Вважається [2], що регіонарні лімфатичні вузли уражені у 95% випадків, а надключичні лімфовузли — у 40%. Прийнято розрізняти дифузну (істинно набрякову) та вузлову форму НРГЗ. Перша пов’язана з набряком без солідної пухлини, друга означає наявність пухлинного вузла з набряком навколишніх тканин.
Діагностика НРГЗ базується на загальноприйнятих методах клініко-інструментальних досліджень і гістологічної верифікації. Обов’язковим є виконання мамографії, а при необхідності — мамосцинтиграфії. Для уточнення діагнозу використовують допплерівське сканування, комп’ютерну томографію, магнітно-резонансну томографію, позитронно-емісійну томографію. Гістологічна верифікація діагнозу передбачає проведення трепан-біопсії з наступним мікроскопічним дослідженням пунктату. За відсутності пухлинного вузла (істинний НРГЗ) виконують пункційну біопсію регіонарних лімфатичних колекторів або досліджують зразки тканини грудної залози в зоні набряку.
Загальна виживаність при НРГЗ знаходиться в межах 18–35%, лікування обов’язково має бути комплексним, із залученням хіміотерапії, радіотерапії, при необхідності — гормонотерапії [3–6].
Доречність хірургічного етапу лікування при НРГЗ до недавнього часу викликала сумніви і багато запитань. В історичному аспекті хірургічне лікування виникло як перший і єдиний метод терапії хворих на НРГЗ. Пацієнткам виконували радикальну мастектомію в модифікації Холстеда. Результати оперативного лікування при цій патології були невтішні: 5-річна загальна виживаність не перевищувала 4%. Використання комбінованого лікування у вигляді поєднання радикальної мастектомії з радіотерапією не зумовило жодних істотних зрушень у загальній виживаності, яка залишалася практично на тому самому рівні (5%). Надії на збільшення терміну життя для цієї категорії хворих з’явилися при включенні в комплекс лікувальних заходів хіміотерапії, що було пов’язане з підвищенням показника загальної виживаності до 31%. Розуміння системності природи НРГЗ породжувало у деяких дослідників певний скепсис щодо доречності хірургічного лікування як етапу взагалі. Багато авторів [7, 8] висловлювалися на користь обмеження лікувальних заходів при НРГЗ комбінацією хіміопроменевого лікування, наводячи дані про практично ідентичні показники загальної та безрецидивної виживаності у групі пацієнтів з використанням неоад’ювантної хіміотерапії і подальшим хірургічним лікуванням порівняно з неоад’ювантною хіміотерапією та подальшою радіотерапією. Так, R.H. DeBoer і співавтори [7] наводили результати лікування 59 пацієнток, де 1-й групі (35 хворих) після курсу поліхіміотерапії (ПХТ) виконували радіотерапію, тоді як пацієнткам 2-ї групи (24 хворих) проводили хірургічне лікування в поєднанні з радіотерапією. Медіана загальної виживаності була ідентична для обох груп і становила 35 міс. Ознаки повернення хвороби у вигляді метастазування відзначено у 69% пацієнток, які отримали радіотерапію, і у 79%, які лікувалися поєднанням променевого та хірургічного методів. Локорегіонарний рецидив спостерігали в 34 і 42% випадків відповідно. Автори дійшли висновку, що відсутні будь-які переваги при введенні в схему комплексного лікування хірургічного етапу. Однак дослідження R.Y. Fleming і співавторів, M. Panades і співавторів, B. Chevallier і співавторів [9–11] показали переваги комплексного підходу, при якому неоад’ювантна (ад’ювантна) хіміотерапія поєднувалася з радикальним хірургічним лікуванням та променевою терапією (ПТ). При цьому загальна виживаність сягала 41%.
Однак ця перевага актуальна тільки для пацієнтів, у яких досягнута повна або часткова регресія у відповідь на неоад’ювантну ПХТ. M. Pandes і співавтори [10] повідомили про результативність включення мастектомії в схему лікування хворих на НРГЗ: 10-річна виживаність без ознак регіонарного рецидиву становила 62,8% проти 34,4%, а 10-річна виживаність без ознак хвороби — 36,9% проти 22,5% відповідно в групах пацієнток, яким проводили оперативне лікування водночас з хіміопроменевою терапією, на відміну від тих, що отримали комбіноване хіміопроменеве лікування. За даними B. Chevallier і співавторів [11], медіана безрецидивної та загальної виживаності пацієнток, прооперованих з приводу НРГЗ після завершення неоад’ювантної ПХТ, становила 38,3 і 60,1 міс відповідно, тоді як тих, що отримали після неоад’ювантної ПХТ радіотерапію, — 19,0 і 38,3 міс відповідно.
У порівняльному аспекті наводили результати досліджень лікування хворих на НРГЗ [12] із залученням як двох методів лікування (хіміопроменевого), так і трьох (хіміопроменевого та хірургічного). Попри невелику кількість пацієнток, задіяних у дослідженнях, і певний розкид результатів, можна помітити тенденцію до зростання безрецидивної та загальної виживаності пацієнтів, які лікувалися за використання усіх трьох методів (табл. 1, 2; рис. 1).
Таблиця 1. Результати лікування пацієнтів з НРГЗ ПХТ+ПТ [12]
| Автор | Кількість пацієнтів | Лікування | Медіанавиживаності | Медіанавиживаності | Загальнавиживаність | Безрецидивнавиживаність |
| De Lena et al., 1978 | 36 | ПХТ+ПТ+/−ПХТ | 36 | 25 | 25% (36 міс) | − |
| Krutchiket et al., 1979 | 32 | ПХТ+ПТ+ПХТ | − | 24 | 42% (36 міс) | 34% (36 міс) |
| Pouillartet et al., 1981 | 77 | ПХТ+ХПТ+ПХТ | − | 34 | 48% (36 міс) | 45% (36 міс) |
| Rouesse et al., 1986 | 91*79 | ПХТ+ХПТ+ПХТ+ГТ | − | − | 44%76% (48 міс) | 28%46% (48 міс) |
| Koh et al., 1990 | 40 | ПХТ+ХПТ+ПХТ | 56 | 39 | 37% (60 міс) | 35% (60 міс) |
| Chevalier et al., 1993 | 64 | ПХТ+ХПТ | − | 25 | 29% (60 міс) | 18% (60 міс) |
| Palangie et al., 1994 | 223 | ПХТ+ХПТ | 95 | 41 | 41% (60 міс) | 25% (60 міс) |
| Perez et al., 1954 | 35 | ПХТ+ПТ | − | − | 16% (60 міс) | 6% (60 міс) |
*З 1976 по 1980 р. 91 пацієнту проводили ПХТ з використанням доксорубіцину, вінкристину та метотрексату. З 1980 по 1982 р. у 79 пацієнтів застосовували більш інтенсивну схему з використанням доксорубіцину, вінкристину, циклофосфаміду, метотрексату та 5-флуороуроцилу. ГТ — гормонотерапія.
Таблиця 2. Результати лікування пацієнтів із НРГЗ, які отримували системну хіміотерапію, оперативне лікування та ПТ [12]
| Автор | Кількість пацієнтів | Лікування | Медіанавиживаності | Виживаність, міс | Загальнавиживаність | Безрецидивнавиживаність |
| Pawlicki et al., 1983 | 13 | ПХТ+Х+ПТ+ПХТ | − | − | 62% (36 міс) | 39% (36 міс) |
| Brun et al., 1988 | 11 | ПХТ+ ПТ+Х+ПХТ | − | 37 | 36% (48 міс) | 18% (48 міс) |
| Fields et al., 1989 | 37 | ПХТ+Х+ПТ+ПХТ | 30 | 44 | 48% | 37% |
| Thorns et al., 1989 | 61 | ПХТ+Х+ПТ+ПХТ | 36 | − | 35% | 58% |
| Koh et al., 1990 | 2343 | ПХТ+Х+ПТ+ПХТ | 56 | 3851 | 30%48% | 22%31% |
| Mailosel et al., 1990 | 43 | ПХТ+Х+ПТ+ПХТ | − | 46 | 75% | 48% |
| Pisanski et al., 1992 | 36 | ПХТ/ПТ+Х+ПХТ | 30 | − | 34% | 24% |
| Fein et al., 1994 | 33 | ПХТ+ПТ+Х | 24 | − | − | 50% |
| Perez et al., 1994 | 86 | ПХТ+Х+ПТ | − | − | 38% | 40% |
| Colozza et al., 1996 | 10 | ПХТ+Х+ПХТ/ПТ | 72 | 22 | 35% (36 міс) | − |
| Harris et al., 2003 | 52 | ПХТ+ПТ+Х | 60 | 62 | 56% | 49% |
Х — хірургічне лікування.
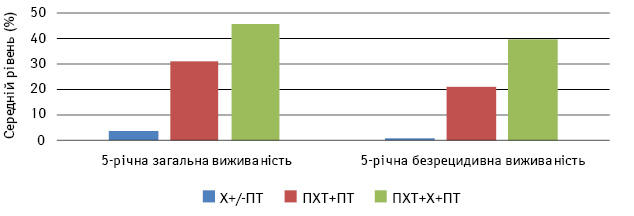
Рис. 1. Рівні 5-річної загальної та безрецидивної виживаності хворих на НРГЗ із застосуванням хірургічного методу лікування (мастектомія) ±ПТ, первинної ПХТ+ПТ або ПХТ+Х+ПТ. Не було жодної пацієнтки, що прожила 5 років без рецидиву хвороби після лікування Х±ПТ. Х — хірургічне лікування
Наразі, за численними даними [11, 13–15], питання необхідності хірургічного етапу вважається вирішеним, але за певної умови. Помічено, що показники виживаності зростають тільки для тих хворих, що отримали відповідь на попередню неоад’ювантну терапію. Тому сучасні рекомендації лікування пацієнтів із НРГЗ (ASCO, NCCN, Sent Gallen) включають хірургічне втручання тільки після оцінки результатів попередньої ПХТ (табл. 3, рис. 2). За умов досягнення повної або часткової регресії наступним етапом є хірургічне лікування. За відсутності динаміки або прогресування хвороби призначають ПХТ за додатковими схемами та радіотерапію. Якщо динаміка позитивна — пропонується хірургічне лікування, але не досягнуто згоди щодо лікування при НРГЗ за відсутності відповіді на попередню неоад’ювантну ПХТ.
Таблиця 3. Рекомендації щодо лікування пацієнтів із НРГЗ, наведені в NCCN 2016
| Клініко-гістологічна верифікація НРГЗСтадія T4d, N0–3, M0 | ||
| Збір анамнезу захворювання та фізикальне обстеженняТести для визначення функції печінкиГістологічна верифікація
Імуногістохімічне дослідження Двобічна мамографія Магнітно-резонансна томографія грудних залоз за необхідності Обговорення фертильності при пременопаузі Сканування кісток Комп’ютерна томографія органів грудної, черевної порожнини та малої миски Генетична консультація, якщо є високий ризик |
||
| Доопераційна системна терапія, антрацикліни + таксани (переважно). Якщо пухлина HER2-позитивна — HER2-таргетна терапія | ||
| Чутлива | Нечутлива | |
| Мастектомія + ПТ на грудну стінку та надключичну ділянку (+ внутрішні грудні лімфатичні вузли, якщо уражені) ± відтермінована реконструкція грудної залози | Розглядають додаткові схеми хіміотерапії та/або передопераційної ПТ | |
| Завершення запланованих курсів ПХТ, якщо не були закінчені, гормонотерапія гормонопозитивних форм ракуЗавершення HER2-таргетної терапії до 1 року. Може бути проведено одночасно з ПТ та гормонотерапією, якщо показана | Чутлива | Нечутлива |
| Див. вище | Індивідуалізація схеми | |
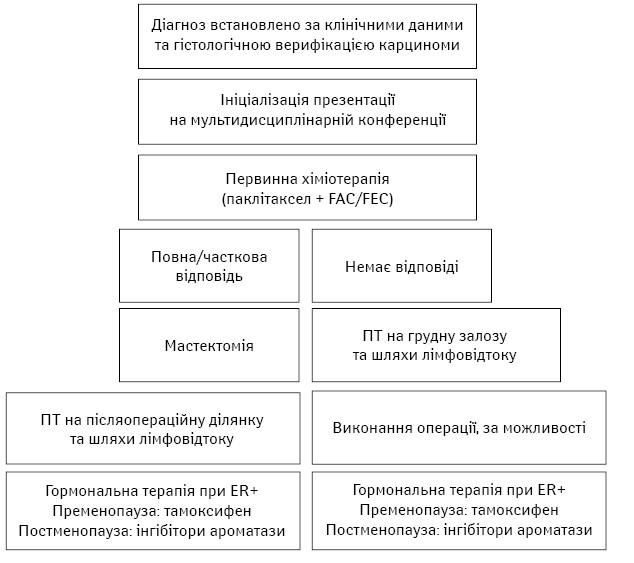
Рис. 2. Рекомендації MD Anderson Cancer Center, Техас, США
Вважається незаперечним, що адекватним обсягом оперативного втручання при НРГЗ є радикальна мастектомія. Існують поодинокі повідомлення щодо виконання органозберігаючих операцій у пацієнток із НРГЗ [16], але немає жодних даних щодо успішності такої тактики. Натомість наводяться дані щодо зростання кількості випадків локорегіонарного рецидивування майже втричі. Суть проблеми полягає в тому, що при явищах «набряку», тобто лімфогенної дисемінації пухлинних клітин в тканину залози та підшкірно, достеменна оцінка лікувального ефекту утруднена. За інформацією [17, 18], клініко-рентгенологічна регресія при неоад’ювантному лікуванні корелює із залишком елементів пухлини більш ніж у 60% пацієнтів. Саме тому при цій формі РГЗ вкрай важливим моментом є дослідження чистоти країв резекції, навіть при виконанні радикальних мастектомій. У дослідженні [19] наведено ретроспективні дані лікування 90 пацієнток із НРГЗ. У тих із них, яким вдалося досягнути відсутності пухлини у краях резекції (негативний край), загальна 3-річна виживаність становила 47,4%, а безрецидивна — 37,5%. Водночас ті самі показники при позитивних краях резекції становили 0 та 16,7% відповідно. Спадає на думку, що невдачі хірургічного лікування при НРГЗ були спричинені не тільки прихованою системністю цієї форми РГЗ, що цілком справедливо, а й браком радикалізму місцевого лікування, при якому резидуальна пухлина лишалася у вигляді пухлинних емболів в лімфатичних і кровоносних судинах.
Сучасним трендом є естетичність хірургічної тактики у хворих на РГЗ, у зв’язку з чим дотримуються концепції онкопластичної хірургії, загальноприйнятої наразі серед онкологів. Не є винятком такий підхід при лікуванні пацієнтів із НРГЗ. Питання відновлення грудної залози цілком актуальне для хворих цієї групи — реконструкція має бути проведена, але за певних умов та обмежень. Як відомо, аутопластика та ендопротезування — найбільш використовувані методики в сучасній хірургії при місцево-поширеному РГЗ. Оскільки ендопротезування виконується після підшкірної мастектомії, така тактика є загрозливою при хірургічному лікуванні з приводу НРГЗ, зважаючи на широку лімфогенну дисемінацію пухлинних емболів у шкіру та підшкірну клітковину, тому вона й не набула поширення. Водночас пластика переміщеними шкірними клаптями демонструвала сприятливі естетичні результати і зіставні показники ускладнень (5–16%) [20]. Вважається доцільним проводити відтерміновану реконструкцію у хворих на НРГЗ, хоча останнім часом висловлено думку щодо можливості виконання одномоментних відновлювальних втручань. Так, у дослідженні [21] 23 пацієнткам виконували реконструкції після мастектомії при хірургічному лікуванні РГЗ, причому у 14 хворих операції проводили одномоментно, а 9 — відстрочено. Найпоширенішим втручанням була пластика TRAM-клаптем (18 хворих), також виконали 3 ендопротезування та 2 пластики торакодорсальним клаптем. Медіана виживаності становила 44 міс, не було статистично достовірних відхилень у показниках обох груп. Однак, зважаючи на потенційну швидкість прогресування при НРГЗ, адекватна тактика ПТ є однією з вимог комплексного лікування. Радіотерапія, почата завчасно, шкодить процесам репарації і може призвести до руйнації шкірного клаптя. Водночас відтермінування радіотерапії може призвести до рецидивування і маніфестації хвороби. Саме тому відновний етап радять планувати після закінчення ад’ювантного лікування.
Наш досвід хірургічної терапії при НРГЗ включає 234 операції, виконані пацієнткам із НРГЗ. Хірургічні втручання проводили після ад’ювантного лікування, причому у 77% випадків це була неоад’ювантна ПХТ, а у решті — комбінована хіміопроменева терапія. Мінімальна кількість курсів ПХТ — 4, максимальна — 12. Головною метою передопераційного лікування було досягнення регресії пухлини, і тільки після цього виконували оперативний етап. Слід зауважити, що відповідь на лікування досліджували як за критеріями RECIST, так і гістологічно, шляхом декількох трепан-біопсій, що виконувалися з різних позицій. Саме лікувальний патоморфоз ставав орієнтиром, що визначав подальшу тактику лікування, оскільки часто відзначали відсутність кореляції між динамікою за RECIST та морфологічними змінами у тканинах залози. Операцією вибору у всіх випадках була радикальна мастектомія, виконана у 183 пацієнток за методикою Маддена, у решти — за методикою Петі та Холстеда. У всіх випадках визначали чистоту країв резекції. У 29 пацієнток виникла потреба у різноманітних пластичних мобілізаціях з метою закриття операційної рани з причини позитивного краю резекції. Органозберігаючих операцій та ендопротезування не виконували. Через 1 рік після радикальної мастектомії у 38 пацієнток проведено відновні реконструкції. Показники ускладнень та локорегіонарного рецидивування на 2-річний термін становили 8 та 16,3% відповідно, що корелює із загальносвітовими результатами.
Окреме питання — одномоментні відновні реконструкції у цієї групи пацієнток. Попри зафіксоване в багатьох стандартах положення щодо недоречності одномоментних пластик, ми наважилися у пацієнток, у котрих пухлинний набряк розміщувався в центральному секторі, виконати одночасну реконструкцію TRAM-клаптем. У 2014 р. за даною методикою проведено операції у 7 хворих з приводу РГЗ ІІІБ та ІІІС стадій. Із них у 3 пацієнток діагностовано РГЗ T4bN2M0, ще у 3 — T4dN2M0, в 1 — T4dN3M0. Вік жінок був у межах 23–42 років. Усіх кандидаток на онкопластичну операцію об’єднував молодий вік та стійка мотивація зберегти залозу. Усі хворі до початку лікування мали залучені регіонарні лімфатичні вузли, що відповідали N2 та N3 (1 пацієнтка). Першим етапом лікування у всіх пацієнток була внутрішньоартеріальна ПХТ. У зазначеній групі пацієнток після проведення 4 курсів внутрішньоартеріальної ПХТ у 3 хворих констатували повну регресію, а у 4 — часткову. Вартим уваги є те, що всі випадки повної відповіді на неоад’ювантне лікування зафіксовано у пацієнток з істинним НРГЗ.
Слід зауважити, що кандидатами на операційне втручання ставали лише ті пацієнтки, у яких набряк локалізувався в центральному секторі, без залучення меж мастектомічних розтинів. Усім хворим проводили оцінку стану нижніх епігастральних судин і їх колатералей шляхом проведення передопераційного дуплексного ультразвукового сканування лінійними датчиками частотою 7,5; 10 і 12,5 МГц і стандартну розмітку поперечного клаптя живота. Хворі були прооперовані за умови досягнення повної і часткової регресії після попередньої ПХТ. Усім пацієнткам виконували радикальну мастектомію з одномоментною реконструкцією TRAM-клаптем. З огляду на поширеність процесу обов’язковою умовою було дослідження чистоти країв резекції після виконання радикальної мастектомії. Після виконання мастектомії в модифікації Маддена здійснювали виділення TRAM-клаптя на контралатеральній ніжці, переміщали його в зону післяопераційної рани через сформований тунель, фіксували. Дефект прямого м’яза живота коригували проленовою сіткою. У післяопераційний період всім хворим була проведена ад’ювантна системна ПХТ за схемою, наведеною вище, тривалістю не менше 4 курсів. У 3 жінок із гормонозалежними пухлинами розпочато гормонотерапію аналогами гіпоталамічного рилізинг-фактора, 1 пацієнтка з підтвердженим позитивним Her2neu-статусом знайшла можливість придбати трастузумаб.
Усі оперативні втручання виконано успішно, шкірно-м’язові клапті були життєздатні, був досягнутий косметичний ефект, що задовольнив усіх хворих. Також у всіх випадках досягнуто чистоти країв резекції після виконання мастектомії. У ранній післяопераційний період відзначено 2 випадки крайових некрозів, які потребували незначної хірургічної корекції. Також зареєстровано випадок тривалої лімфореї в 1 пацієнтки. Через 2 роки в 1 хворої відзначено прогресування хвороби у вигляді віддалених метастазів у кістки хребта і малого таза. В 1 пацієнтки виявлено регіонарний рецидив у переміщеному клапті поблизу післяопераційного рубця. Решта пацієнток — без ознак продовження хвороби.
Попередні результати дослідження свідчать про принципову можливість одномоментної реконструкції як етапу хірургічного лікування у пацієнток із НРГЗ за умови досягнення ефекту після неоад’ювантної внутрішньоартеріальної ПХТ і забезпечення чистоти країв резекції. Виконання одночасної реконструкції у пацієнток цієї групи — технічно складний процес, більш ризикований в хірургічному аспекті порівняно з радикальною мастектомією, що загрожує великою кількістю післяопераційних ускладнень. Однак, як видно з наведених даних, кількість ускладнень та отримані результати корелюють з аналогічними показниками, повідомленими для форм РГЗ без набряку. У 3 пацієнток за їхнім бажанням виконано коригуючі пластичні втручання (видалення післяопераційних рубців, контралатеральної мастопексії), у 5 сформовано сосково-ареолярний комплекс. Пацієнтки з реконструкцією грудної залози краще соціально адаптувалися, їхнє суб’єктивне самопочуття було на порядок вищим, ніж у пацієнток, які перенесли радикальну мастектомію без реконструкції.
Таким чином, хірургічний етап є одним з основних у комплексному лікуванні хворих на НРГЗ. Хірургічна тактика має базуватися на принципах онкологічного радикалізму та естетичної доцільності. Методом вибору оперативної техніки є радикальна мастектомія. Краї рани мають бути досліджені на чистоту. Органозберігаючі втручання та підшкірні ендопротезування при цій формі не виправдані. Зважаючи на невеликий досвід успішних одномоментних пластик, реконструктивно-відновні операції в більшості випадків мають бути відтерміновані і проведені після закінчення ад’ювантного лікування та повного загоєння післяопераційної рани.
Список використаної літератури
1. American Joint Committee on Cancer (2002) AJCC Cancer Staging Manual. 6th ed. Chicago: Springer-Verlag: 257–280.
2. Jaiyesimi I.A., Buzdar A.U., Hortobagyi G. (1992) Inflammatory breast cancer: a review. J. Clin. Oncol., 10: 1014–1024.
3. Kim T., Lau J., Erban J. (2006) Lack of uniform diagnostic criteria for inflammatory breast cancer limits interpretation of treatment outcomes: a systematic review. Clin. Breast Cancer, 7(5): 386–395.
4. De Boer R.H., Saini A., Johnston S.R. et al. (2000) Continuous infusional combination chemotherapy in inflammatory breast cancer: a phase II study. Breast, 9(3): 149–155.
5. Rueth N.M., Lin H.Y., Bedrosian I. et al. (2014) Underuse of trimodality treatment affects survival for patients with inflammatory breast cancer: an analysis of treatment and survival trends from the National Cancer Database. J. Clin. Oncol., 32(19): 2018–2024.
6. Tsai C.J., Li J., Gonzalez-Angulo A.M. et al. (2015) Outcomes after multidisciplinary treatment of inflammatory breast cancer in the era of neoadjuvant HER2-directed therapy. Am. J. Clin. Oncol., 38(3): 242–247.
7. De Boer R.H., Allum W.H., Ebbs S.R. et al. (2000) Multimodality therapy in inflammatory breast cancer: is there a place for surgery? Ann. Oncol., 11(9): 1147–1153.
8. Fisher E.R., Gregorio R. M., Fisher B. еt al. (1975) The pathology of invasive breast cancer: a syllabus derived from findings of the National Surgical Adjuvant Breast Project (protocol № 4). Cancer, 36: 1–85.
9. Fleming R.Y., Asmar L., Buzdar A.U. et al. (1997) Effectiveness of mastectomy by response to induction chemotherapy for control in inflammatory breast carcinoma. Ann. Surg. Oncol., 4: 452–461.
10. Panades M., Olivotto I.A., Speers C.H. et al. (2005) Evolving treatment strategies for inflammatory breast cancer: A population based survival analysis. J. Clin. Oncol., 23 (9): 1941–1950.
11. Chevallier B., Bastit P., Graic Y. et al. (1993) The Centre H. Becquerel studies in inflammatory non metastatic breast cancer: combined modality approach in 178 patients. Br. J. Cancer, 67: 594–601.
12. Singletary S.E. (2008) Surgical management of inflammatory breast cancer. Sem. Oncol., 35(1): 72–77.
13. Hennessy B.T., Gonzalez-Angulo A.M., Hortobagyi G.N. et al. (2006) Disease-free and overall survival after pathologic complete disease remission of cytologically proven in flammatory breast carcinoma axillary lymph node metastases after primary systemic chemotherapy. Cancer, 106(5): 1000–1006.
14. Jaiyesimi I.A., Buzdar A.U., Hortobagyi G. (1992) Inflammatory breast cancer: a review. J. Clin. Oncol., 10: 1014–1024.
15. Kim T., Lau J., Erban J. (2006) Lack of uniform diagnostic criteria for inflammatory breast cancer limits interpretation of treatment outcomes: a systematic review. Clin. Breast Cancer, 7(5): 386–395.
16. De Boer R.H., Allum W.H., Ebbs S.R. et al. (2000) Multimodality therapy in inflammatory breast cancer: is there a place for surgery? Ann. Oncol., 11: 1147–1153.
17. Hortobagyi G., Singletary S.E., Strom E.A. (2000) Treatment of locally advanced and inflammatory breast cancer. in: J.R. Harris, M.E. Lippman, M. Morrow (Eds.) Treatment of locally advanced and inflammatory breast cancer. Lippincott, Williams & Wilkins: Philadelphia: 645–660.
18. Vlastos G., Fornage B.D., Mirza N.W. et al. (2000) The correlation of axillary ultrasonography with histologic breast cancer downstaging after induction chemotherapy. Am. J. Surg., 179: 446–452.
19. Curcio L.D., Rupp E., Williams W.L. et al. (1999) Beyond palliative mastectomy in inflammatory breast cancer — a reassessment of margin status. Ann. Surg. Oncol., 6: 249–254.
20. Williams J.K., Carlson G.W., Bostwick J. et al. (1997) The effects of radiation treatment after TRAM flap breast reconstruction. Plast. Reconstr. Surg., 100: 1153–1160.
21. Chin P.L., Anderson J.S., Somlo G. et al. (2000) Esthetic reconstruction after mastectomy for inflammatory breast cancer: is it worthwhile? J. Am. Coll. Surg., 190: 304–309.
Отечные формы рака грудной железы: особенности хирургической тактики
Национальный институт рака, Киев
Резюме. Хирургическая тактика при отечном раке грудной железы должна базироваться на принципах онкологического радикализма и эстетической целесообразности. Методом выбора оперативной техники является радикальная мастэктомия. Края раны должны быть исследованы на чистоту. Органосохраняющие вмешательства и подкожные эндопротезирования при этой форме не оправданы. Реконструктивно-восстановительные операции должны быть отсрочены и проведены после окончания адъювантного лечения и полного заживления послеоперационной раны.
рак грудной железы, хирургическая тактика, реконструктивно-восстановительные операции.
Адреса:
Ляшенко Андрій Олександрович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: artzdoctor@gmail.com














Leave a comment