Інноваційний прорив в імунотерапії пухлин: можливості пембролізумабу
Резюме. Імуномодулюючі препарати моноклональних антитіл є інноваційними імунотерапевтичними агентами в онкології з принципово новим механізмом дії. Інноваційність підходу полягає в самій філософії імунотерапії пухлини, що полягає не в прямому руйнуванні пухлинних клітин під впливом препарату, яке неминуче супроводжується низкою тяжких побічних ефектів, а в усуненні ключового механізму пухлино-індукованої імуносупресії, за допомогою якого неоплазія ухиляється від імунного нагляду. Пембролізумаб, гуманізовані моноклональні антитіла імуноглобуліну G4 до молекули PD-1, є найбільш досконалим представником цієї групи імунобіологічних антитуморозних агентів. Блокуючи коінгібуючий рецептор PD-1 на поверхні специфічних цитотоксичних CD8+ T-лімфоцитів, які інфільтрують пухлину, пембролізумаб забезпечує стійкість ефекторних імунокомпетентних клітин до імуносупресивної дії злоякісних клітин, що реалізується через вісь PD-1/PD-L1 і PD-1/PD-L2. Препарат скасовує індукований пухлиною вибірковий клітинний імунодефіцит, надаючи імунній системі можливість здійснити ефективну цитотоксичну реакцію проти неоплазії. Результати клінічних випробувань дозволяють рекомендувати пембролізумаб при неоперабельній або метастатичній меланомі, яка не відповідає на лікування іпілімумабом та інгібітором BRAF. Обнадійливими є попередні результати випробувань пембролізумабу при недрібноклітинному раку легені. Успіхи інноваційної імунотерапії в онкології відкривають багатообіцяльні перспективи ефективного, безпечного і, головне, фізіологічно обґрунтованого лікування злоякісних новоутворень людини.
Резюме. Иммуномодулирующие препараты моноклональных антител являются инновационными иммунотерапевтическими агентами в онкологии с принципиально новым механизмом действия. Инновационность подхода состоит в самой философии иммунотерапии опухоли, состоящей не в прямом разрушении опухолевых клеток под воздействием препарата, неизбежно сопровождающемся рядом тяжелых побочных эффектов, а в устранении ключевого механизма опухоль-индуцированной иммуносупрессии, при помощи которого неоплазия уклоняется от иммунного надзора. Пембролизумаб, гуманизированные моноклональные антитела иммуноглобулина G4 к молекуле PD-1, является наиболее совершенным представителем данной группы иммунобиологических антитуморозных агентов. Блокируя коингибирующий рецептор PD-1 на поверхности специфических цитотоксических CD8+ T-лимфоцитов, инфильтрирующих опухоль, пембролизумаб обеспечивает стойкость эффекторных иммунокомпетентных клеток к иммуносупрессивному воздействию злокачественных клеток, реализуемому через ось PD-1/PD-L1 и PD-1/PD-L2. Препарат отменяет индуцированный опухолью избирательный клеточный иммунодефицит, предоставляя иммунной системе возможность осуществить эффективную цитотоксическую реакцию против неоплазии. Результаты клинических испытаний позволяют рекомендовать пембролизумаб при неоперабельной или метастатической меланоме, не отвечающей на лечение ипилимумабом и ингибитором BRAF. Обнадеживающими являются предварительные результаты испытаний пембролизумаба при немелкоклеточном раке легкого. Успехи инновационной иммунотерапии в онкологии открывают многообещающие перспективы эффективного, безопасного и, главное, физиологически обоснованного лечения злокачественных новообразований человека.

Тот, кто научится лечить
иммунодефицит, научится лечить рак
Р. Петров
ВВЕДЕНИЕ
Знаменитое высказывание выдающегося советского иммунолога Рэма Викторовича Петрова стало путеводной звездой для нескольких поколений врачей, специализирующихся в области иммунотерапии опухолей. Но только сейчас благодаря беспрецедентным инновационным достижениям в иммуноонкологии становится все более очевидной обнадеживающая перспектива достижения высоких идеалов физиологически выверенного, эффективного и безопасного иммунотерапевтического ведения пациентов со злокачественными новообразованиями. Данная статья посвящена новой группе препаратов моноклональных антител с принципиально иным механизмом противоопухолевого действия, максимально соответствующим нормальному, естественному иммунному ответу против малигнизированных клеток. Пембролизумаб — гуманизированные моноклональные антитела иммуноглобулина (Ig) G4 к рецептору PD‑1 [9].
История иммунотерапии опухолей
История применения иммунотерапевтических агентов в онкологии включает несколько важных этапов. Впервые в сообщениях о клинических случаях и небольших контролируемых испытаниях была показана эффективность нормального Ig для внутривенного введения при злокачественной тимоме [22], колоректальном раке [7], а также при профилактике метастазов солидных опухолей [8]. Также были предприняты попытки создания иммунотоксинов — Ig, к которым присоединены цитостатические химиопрепараты или радиоизотопы, однако недостаточная прицельность действия иммунотоксинов в связи с незначительными антигенными отличиями опухолей от здоровых тканей не позволила внедрить данный иммунотерапевтический подход в широкую клиническую практику.
Параллельно развивалась клеточная терапия опухолей. Были разработаны методики лечения неоплазий при помощи так называемых лимфоцитов, инфильтрирующих опухоль (ЛИО), и лимфокин-активированных киллеров. Эти иммунотерапевтические подходы продемонстрировали эффективность в клинических испытаниях, однако непредсказуемость эффекта, дороговизна и техническая сложность выполнения не позволили клеточной терапии стать элементом рутинной практики онкологов, хотя такие технологии сейчас применяются в некоторых клинических центрах. В последнее время клеточные технологии вышли на новый уровень развития благодаря разработке методик лечения опухолей при помощи дендритных клеток с заданными свойствами (так называемых противоопухолевых вакцин), а также попыткам использования стволовых клеток. Однако такие подходы пока еще не получили достаточной доказательной базы эффективности и безопасности.
Следующим этапом развития иммунотерапии опухолей стало внедрение цитокинотерапии. Среди множества апробированных иммунотерапевтических агентов именно препараты интерферонов-α (ИФН-α) и рекомбинантного интерлейкина (ИЛ)‑2 получили наибольшую доказательную базу эффективности. На данный момент в онкологии продемонстрирована польза от применения естественных (лейкоцитарных), лимфобластоидных и рекомбинантных ИФН-α, однако именно рекомбинантные ИФН-α2а и ИФН-α2b вошли в современные международные протоколы лечения пациентов с новообразованиями. Так, ИФН-α2а показан при волосатоклеточном лейкозе, саркоме Капоши и хроническом миелоидном лейкозе. ИФН-α2b применяют в клинической практике при меланоме, волосатоклеточном лейкозе, остроконечных кондиломах и саркоме Капоши.
Новую эру в иммунотерапии опухолей открыла разработка препаратов моноклональных антител, полученных при помощи гибридомных технологий. Первые препараты моноклональных антител были наделены прямой и опосредованной противоопухолевой активностью, благодаря чему напоминали цитостатические химиопрепараты. Примером успеха в этом направлении является ритуксимаб, рекомендованный для лечения В-клеточных лимфом. Препарат оказывает прямое онкостатическое действие благодаря блокаде молекулы СD20 на поверхности В-лимфоцитов и опосредованное цитолитическое воздействие на В-клетки, осуществляемое путем индукции реакций комплемент-опосредованной и антителозависимой клеточно-опосредованной цитотоксичности [15]. Хотя ритуксимаб привел к прорыву в лечении при В-клеточных лимфомах, такой подход имеет существенные недостатки из-за неспецифичности воздействия и индукции вторичного иммунодефицита. Так, в связи с истощением пула В-лимфоцитов формируется тяжелая гипоиммуноглобулинемия, которую необходимо корректировать путем дополнительного назначения Ig для внутривенного введения.
И наконец, последним этапом становления иммунотерапии опухолей стала разработка препаратов моноклональных антител, которые направлены не на непосредственное разрушение опухолевых клеток, а на устранение индуцированной опухолью иммуносупрессии, что позволяет организму человека реализовать эффективную иммунную реакцию против опухоли даже в случае начальной иммунорезистентности неоплазии. Примерами таких иммунотерапевтических агентов являются ипилимумаб и пембролизумаб, которые на данный момент успешно прошли клинические испытания в онкологии.
Механизм противоопухолевого иммунного ответа
Сейчас это может показаться странным, но до недавнего времени значимость иммунного ответа в противоопухолевой защите вызывала сомнения. Ф. Бернет, автор всемирно признанной клонально-селекционной теории иммунитета, впервые обобщил доказательства участия иммунитета в противоопухолевой защите. К таким доказательствам он отнес:
- мононуклеарную клеточную инфильтрацию опухолей;
- продукцию специфических антител и цитотоксических Т-лимфоцитов;
- положительные кожные тесты гиперчувствительности немедленного и замедленного типа на введение экстрактов из опухолевых клеток у больных онкологического профиля;
- длительное развитие опухолей (опухоли-свидетели);
- случаи спонтанной регрессии опухолей;
- признаки активации естественных киллеров и цитотоксических Т-лимфоцитов.
Еще одним доказательством важной роли иммунной системы в противоопухолевой защите является повышенная частота развития онкологических осложнений при первичных иммунодефицитах, а также при ВИЧ-инфекции, индуцирующей синдром приобретенного иммунодефицита. Если ранее указывали на риск возникновения новообразований при тяжелых, редко встречающихся первичных иммунодефицитах, то в последнее время получены доказательства ассоциации онкологических осложнений с минорными иммунными дисфункциями. Так, недавно J.F. Ludvigsson и соавторы в популяционном когортном исследовании с участием 2320 пациентов с тотальным дефицитом IgA и 23 130 лиц общей популяции продемонстрировали ассоциацию этой иммунодефицитной болезни с раком, особенно гастроинтестинальной локализации (относительный риск — ОР — 1,64; 95% доверительный интервал — ДИ — 1,07–2,5) [19].
Знание механизма противоопухолевого иммунного ответа позволяет понять принцип действия иммунотерапевтических агентов, применяемых в онкологии. Различают инициальную, распознающую фазу иммунного ответа, реализующуюся в периферических иммунных органах, и завершающую, повреждающую фазу, которая проходит непосредственно в ткани, где расположена опухоль. Выделение этих фаз важно в понимании различий в механизме действия и профиле безопасности ипилимумаба и пембролизумаба. Естественные киллеры являются первой линией защиты от малигнизированных клеток. Эти лимфоциты индуцируют апоптоз или некроз опухолевых клеток при отсутствии на их поверхности молекул HLA I класса (меток «своего») или при нарушении баланса сигналов, полученных через киллинг-активирующие и киллинг-ингибирующие рецепторы. Апоптотические тельца или элементы некротического детрита захватываются дендритными клетками или макрофагами, которые выделяют и представляют иммуногенные пептиды опухоли в составе молекул HLA II класса специфическим Т-хелперам и в составе HLA I — цитотоксическим Т-лимфоцитам, экспрессирующим молекулу CD8 (феномен двойного распознавания). Для полноценной активации опухольспецифический цитотоксический Т-лимфоцит должен получить контактный антигенспецифический сигнал от дендритной клетки и удаленный цитокиновый сигнал от Т-хелперов 1-го типа (ИЛ‑2, ИФН-γ, факторы некроза опухоли). Если не поступает надлежащего цитокинового сигнала, то специфический цитотоксический Т-лимфоцит переходит в состояние анергии, если же такой сигнал получен, он мигрирует в ткань, где расположена опухоль, и распознает иммуногенный пептид в составе молекул HLA I на поверхности малигнизированных клеток, индуцируя их апоптоз или некроз путем продукции перфорина и гранзимов.
Продукция специфических антител плазматическими клетками при поддержке Т-хелперов 2-го типа также важна в противоопухолевой иммунной защите. Ig нейтрализуют некоторые опасные антигены опухоли, а также модулируют иммунный ответ путем обеспечения реакций иммунного фагоцитоза, комплемент-опосредованной и антителозависимой клеточно-опосредованной цитотоксичности.
Механизмы индуцированной опухолью иммуносупрессии
Рост и прогрессия опухоли становятся возможными только при проявлении защитных реакций со стороны малигнизированных клеток по отношению к иммунному ответу.
Следует отметить, что опухоли различаются по чувствительности к иммунотерапии, так как обладают различной иммунорезистентностью. Выделяют новообразования, высокочувствительные к иммунотерапевтическим вмешательствам (меланома, рак почки, мочевого пузыря), со средней (рак толстой кишки, некоторые лимфомы) и низкой чувствительностью (рак грудной железы, легкого).
Опухоль развивается на фоне развертывания по крайней мере двух противоположно направленных процессов — иммунного ответа, который нацелен на уничтожение злокачественных клеток, и опухоль-индуцированной иммуносупрессии, способствующей уклонению новообразования от иммунного ответа путем подавления иммунных реакций. Динамика опухолевого роста определяется текущим результатом взаимодействия анти- и пробластомных факторов.
Выделяют два типа нарушений в системе взаимодействия иммунитета и опухоли, обусловливающих онкогенез: развитие новообразования при первичных иммунодефицитах, когда имеется предсуществующее генетически детерминированное нарушение противоопухолевого иммунного ответа, и выживание опухоли при нормальном иммунном ответе вследствие своевременной индукции опухоль-опосредованной иммуносупрессии. Именно пациенты из второй группы с вызванным опухолью вторичным иммунодефицитом могут отвечать на современную иммунотерапию пембролизумабом, направленную на устранение индуцированной иммуносупрессии и нормализацию иммунного ответа против злокачественных клеток.
К известным механизмам иммунорезистентности опухолей относят низкую иммуногенность антигенов, дисбаланс между скоростью пролиферации опухолевых и иммунокомпетентных клеток, изменение антигенов при опухолевой прогрессии, селекцию иммунорезистентных малигнизированных клеток, прекращение экспрессии молекул гистосовместимости I класса, появление растворимых антигенов, быстрый катаболизм антител на поверхности опухоли, продукцию иммуносупрессивных субстанций, появление рецепторов к ростовым факторам, индукцию апоптоза цитотоксических клеток иммунной системы и экспрессию рецепторов-ловушек (таблица).
Таблица. Основные механизмы иммунорезистентности опухолей
|
Низкая иммуногенность антигенов опухоли Поскольку опухолевые клетки образуются из собственных клеток макроорганизма, они сохраняют большинство аутоантигенов, к которым эффективно поддерживается иммунная толерантность |
|
Дисбаланс между скоростью пролиферации опухолевых и иммунокомпетентных клеток Вполне реальна такая ситуация, когда интенсивность опухолевой пролиферации превысит скорость накопления противоопухолевых иммунных факторов, что непременно приведет к несостоятельности иммунного ответа |
|
Изменение антигенов при опухолевой прогрессии В результате опухолевой прогрессии накапливаются генетические отличия опухолевых клеток, находящихся в разных условиях пролиферации. Это связано с усиленным мутагенезом неоплазии и приводит к появлению новых поверхностных антигенов, которые не в состоянии распознать имеющиеся Т-киллеры. Время, необходимое для иммунологического распознавания новых антигенов, пролиферации и созревания антигенспецифических цитотоксических лимфоцитов, используется опухолью для активной пролиферации и экспрессии новых антигенных субстанций |
|
Селекция иммунорезистентных клеток опухоли Опухолевые клетки, которые наиболее чувствительны к эффекторным механизмам иммунного ответа, уничтожаются еще на ранних этапах роста опухоли. С увеличением срока существования опухоли снижается эффективность направленных против нее иммунных реакций, поскольку сам иммунный ответ способствует селекции иммунорезистентных неопластических клеток |
|
Прекращение экспрессии молекул гистосовместимости І класса на поверхности клеток опухоли Это явление наиболее часто возникает вследствие селекции иммунорезистентных опухолевых клеток. Клетки, прекратившие экспрессию указанных молекул, становятся нечувствительными к цитотоксическому действию Т-киллеров, поскольку не распознаются ими |
|
Появление растворимых антигенов, ассоциированных с опухолью Некоторые молекулы опухолевых антигенов способны покидать мембрану клетки и циркулировать в свободном состоянии. Они распознаются иммунной системой, «отвлекая» иммунный ответ от опухоли-продуцента |
|
Быстрый катаболизм антител на мембране опухолевых клеток Антитела, фиксированные на мембране опухолевых клеток, «визуализируют» неоплазию для факторов врожденной резистентности (макрофагов, комплемента, естественных киллеров). В то же время благодаря продукции протеолитических ферментов опухолевые клетки отсоединяют иммунные комплексы от своей поверхности раньше, чем антитела успевают выполнить свою биологическую функцию |
|
Продукция опухолью иммуносупрессивных веществ Одним из таких веществ является трансформирующий фактор роста b, угнетающий реакции клеточного иммунитета |
|
Появление клеточных рецепторов к разным ростовым факторам и стимулирующим рост цитокинам Огромное количество рецепторов к факторам роста (тромбоцитарному, эпидермальному, фибробластическому) и к стимулирующим деление цитокинам (например ИЛ‑1 или ИЛ‑2) позволяет опухолевой клетке поддерживать чрезвычайно высокий темп пролиферации |
|
Способность индуцировать апоптоз цитотоксических Т-лимфоцитов Известно, что активированные Т-клетки экспрессируют молекулы Fas, являющиеся рецепторами апоптоза. Т-лимфоциты не погибают, поскольку при взаимодействии с другими клетками получают сигналы, временно отменяющие апоптоз. Некоторые опухоли начинают экспрессию Fas-лиганда, способного индуцировать апоптоз в Fas-положительных клетках. В связи с этим опухольспецифические Т-киллеры не только не повреждают злокачественные клетки, но и сами гибнут при взаимодействии с ними |
|
Экспрессия опухолевыми клетками рецепторов-ловушек Такие рецепторы (например TRAIL‑3, TRAIL‑4) по структуре соответствуют молекулам, инициирующим апоптоз в клетке. При этом их цитоплазматический участок лишен домена смерти. Более того, их активация сопровождается синтезом белков, стимулирующих деление клетки. Активация этих рецепторов осуществляется лимфоцитами с целью уничтожения опухолевых клеток путем апоптоза, но, как и следует ожидать, в результате подобных воздействий злокачественные клетки не только не гибнут, но и получают возможность ускорить собственную пролиферацию |
Именно механизм индукции апоптоза цитотоксических Т-лимфоцитов, в норме разрушающих опухолевые клетки, является ключевым механизмом уклонения от иммунного ответа при ряде новообразований. Его устранение играет решающую роль в достижении прогностически благоприятного изменения баланса про- и антибластомных факторов.
Моноклональные антитела, блокирующие ключевые точки опухоли
Пассивная иммунотерапия опухолей основывается на применении специфических Ig. Эти антитела воздействуют на новообразование при помощи трех принципиальных механизмов:
1) специфического повреждения сигнальных рецепторов на поверхности малигнизированных клеток;
2) нейтрализации трофических сигналов, продуцируемых опухолевыми клетками или стромальным микроокружением;
3) специфического распознавания неопластических клеток за счет связывания с опухольассоциированными антигенами [9].
Различают 5 вариантов атакующих опухоль Ig:
1) антитела, угнетающие сигнальные рецепторы малигнизированных клеток, необходимые для их выживания или прогрессии (цетуксимаб, ингибитор рецептора эпидермального фактора роста; лечение больных раком головы и шеи и колоректальной карциномой);
2) антитела, активирующие потенциально летальные рецепторы опухоли (тигатузумаб, активатор рецепторов к фактору некроза опухоли; находится на стадии испытаний);
3) иммунные конъюгаты, состоящие из молекул Ig, связанных с токсинами или радионуклидами (гемтузумаб озогамицин, состоящий из анти-CD33 Ig, конъюгированных с калихеамицином; лечение при остром миелоидном лейкозе);
4) опухольспецифические антитела, которые опсонизируют неоплазию, индуцируя антителозависимую клеточно-опосредованную цитотоксичность, антителозависимый фагоцитоз опухолевых клеток и комплемент-опосредованную цитотоксичность (ритуксимаб, моноклональные антитела к молекуле CD20; лечение пациентов с хроническим лимфолейкозом и неходжкинскими лимфомами);
5) биспецифические Т-клеточные усилители, представляющие собой химерные молекулы, состоящие из двух разных Ig, один из которых распознает клетки опухоли, а другой связывается с Т-лимфоцитом (блинатумомаб, химерное антитело к молекулам CD19 и CD3; лечение пациентов с В-клеточным острым лимфобластным лейкозом без филадельфийской хромосомы) [10].
Если говорить об иммуномодулирующих моноклональных антителах, то в этом направлении разработано 4 различных терапевтических подхода:
1) угнетение иммуносупрессивных рецепторов, экспрессирующихся на Т-лимфоцитах (ипилимумаб, ингибитор CTLA‑4, и пембролизумаб, ингибитор PD‑1, см. ниже);
2) ингибирование лигандов к указанным иммуносупрессивным молекулам лимфоцитов (например молекулы PD-L1, лиганда PD‑1; препараты BMS‑936559, MPDL3280A и MED4736, находящиеся на стадии клинических испытаний);
3) активация костимуляционных рецепторов иммунокомпетентных клеток, например суперсемейства рецепторов фактора некроза опухоли (тигатузумаб);
4) нейтрализация иммуносупрессивных факторов микроокружения опухоли, таких как трансформирующий фактор роста β1 [14].
Именно иммуномодулирующие препараты моноклональных антител первого типа на данный момент имеют наибольшую доказательную базу и внедрены в клиническую практику. Анти-CTLA‑4-препарат ипилимумаб одобрен Управлением по контролю качества пищевых продуктов и лекарственных препаратов США (FDA) для использования при неоперабельной меланоме в марте 2011 г. [29], анти-PD‑1-агент пембролизумаб одобрен FDA по ускоренной процедуре для лечения по поводу метастатической меланомы [13], ниволумаб рекомендован в Японии министерством здравоохранения для лечения меланомы с июля 2014 г. [4].
Проведение клинических испытаний препаратов моноклональных антител, блокирующих ключевые точки опухоли, таких как ипилимумаб, ниволумаб и пембролизумаб, стало возможным благодаря формированию фундаментальных знаний о механизме регуляции активации Т-лимфоцитов. Доказана модель двух сигналов, описывающая механизм активации Т-клеток, согласно которой первый сигнал формируется при активации антигенраспознающего рецептора лимфоцита опухолевым антигеном, а второй — при реализации костимуляционного взаимодействия между молекулами В7 и CD28. Получение двойного сигнала приводит к активации Т-киллера и реализации противоопухолевого цитотоксического ответа. Если Т-лимфоцит распознает опухоль, но не получает костимуляционного сигнала, то переходит в состояние анергии (функциональной бездеятельности). Так формируется приобретенная иммунная толерантность к опухоли, провоцирующая прогрессирование неоплазии. Если же вместо костимулирующего сигнала Т-лимфоцит получает коингибирующий стимул, то иммунокомпетентная клетка может погибнуть путем апоптоза [21].
Клетки злокачественных новообразований часто экспрессируют такие коингибиторные молекулы для формирования иммунорезистентности. Это приводит к развитию специфического клеточного иммунодефицита к опухоли из-за избирательного подавления или гибели опухольспецифических Т-лимфоцитов. Напротив, блокада коингибиторных молекул, таких как CTLA‑4 (4-й антиген цитотоксических Т-лимфоцитов), PD‑1 (рецептор программированной смерти 1-го типа) и LAG3 (лимфоцит-активационный ген 3), равно как и стимуляция костимулирующих молекул GITR (индуцированный кортикостероидами рецептор к фактору некроза опухоли), OX40 и 4-1BB, могут усиливать Т-клеточный ответ против опухоли (рис. 1) [20].
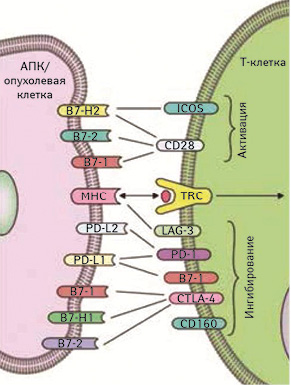
Молекулы CTLA‑4 и PD‑1 функционируют на разных этапах иммунного ответа против опухоли. Так, CTLA‑4 (СD152) ослабляет раннюю активацию наивных Т-лимфоцитов и Т-клеток памяти в лимфоидных органах при связывании с CD80 (В7-1) или CD84 (В7-2), в то время как молекула PD‑1 (CD279) вовлечена в модуляцию Т-клеточной активности в завершающую фазу иммунного ответа в периферических тканях, включая место расположения опухоли, путем взаимодействия со специфическими лигандами PD-L1 (В7-Н1, или СD274) и PD-L2 (В7-DC, или CD273) (рис. 2) [25].
Высокая экспрессия PD‑1 на ЛИО, равно как и наличие PD-L1 на клетках различных опухолей, позволяют считать этот путь важным в реализации феномена уклонения неоплазии от иммунного ответа. PD-L1 и PD-L2 экспрессируются на поверхности многих опухолей человека, включая урологические неоплазии, рак яичника, грудной железы, шейки матки, толстой кишки, поджелудочной железы и желудка, а также меланому, глиобластомы и рак легкого. Такие молекулы идентифицированы на некоторых гематологических новообразованиях — лимфоме Ходжкина, первичной медиастинальной В-клеточной лимфоме, ангиоиммунобластической Т-клеточной лимфоме, множественной миеломе, остром миелоидном лейкозе, хроническом лимфоцитарном лейкозе и Т-клеточных лимфомах у взрослых [29].
Уровень экспрессии PD-L1 коррелирует с прогнозом при указанных опухолях. Это подтверждает представления о том, что выработка PD-L1 является ключевым механизмом уклонения неоплазий от иммунного надзора. Так, карцинома почки и рак яичника характеризуются неблагоприятным прогнозом в случае экспрессии PD‑1 и PD-L1 [12]. В другом исследовании показано, что появление PD‑1 на поверхности ЛИО при меланоме ассоциировано с критическим нарушением функциональной активности CD8+ Т-лимфоцитов [1].
Блокирование взаимодействия в системе PD‑1/PD-L1 и PD‑1/PD-L2 может быть многообещающим объектом иммунотерапевтических вмешательств, направленных на устранение избирательной супрессии специфического клеточного иммунного ответа в опухолевом микроокружении. Таким образом, неоплазии, использующие экспрессию молекул PD-L1 и PD-L2 для выживания путем уклонения от иммунного ответа, являются потенциальными мишенями для пембролизумаба — препарата моноклональных антител к PD‑1, обеспечивающего нечувствительность периферических цитотоксических Т-лимфоцитов, инфильтрирующих опухоль, к иммуносупрессивному влиянию неоплазии через молекулы PD-L1 и PD-L2.
Молекула PD‑1 экспрессируется шире, нежели CTLA‑4. Эта молекулярная структура может появляться на поверхности естественных киллеров и В-лимфоцитов, лимитируя их активность. Поэтому, хотя основной терапевтический эффект пембролизумаба осуществляется благодаря усилению активности опухольспецифических цитотоксических Т-лимфоцитов, препарат дополнительно усиливает цитотоксический потенциал естественных киллеров и продукцию антител производными В-клеток [6].
Также следует отметить, что PD-L1 может функционировать как лиганд и рецептор в зависимости от текущих условий. При блокаде PD‑1 под воздействием пембролизумаба PD-L1 начинает действовать как стимулятор Т-лимфоцитов, в связи с чем иммуносупрессивная активность опухоли парадоксально оборачивается усилением антитуморозного иммунного ответа [29].
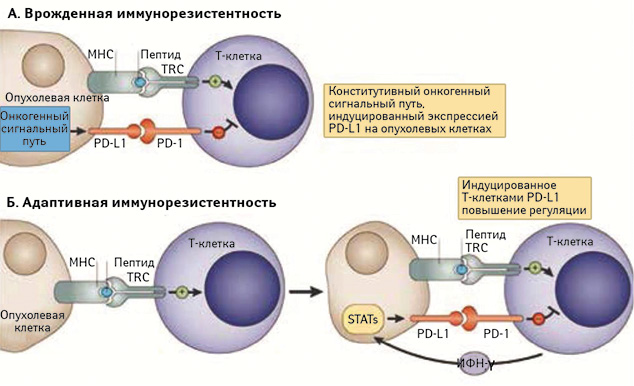
Существует 2 основных механизма регуляции PD-L1 опухолевыми клетками: врожденная и адаптивная иммунорезистентность (рис. 3). Некоторые опухоли, например глиобластомы, экспрессируют PD-L1 конститутивно в контексте реализации типичных онкогенных сигнальных путей пролиферации и прогрессии (врожденная иммунорезистентность, не связанная с реализацией иммунного ответа). Это мешает инициации противоопухолевой клеточной иммунной реакции и формированию опухольспецифических Т-клеток. При адаптивной иммунорезистентности отмечается индуцибельная экспрессия молекулы PD-L1 на опухолевых клетках во время осуществления иммунной агрессии, причем воздействие ИФН-γ, продуцируемого Т-лимфоцитами, является главным предиктором такой экспрессии. При этом иммунный ответ против опухоли реализуется, однако инфильтрирующие неоплазию цитотоксические Т-лимфоциты инактивируются или даже уничтожаются опухолевыми клетками [18]. Применение пембролизумаба позволяет противостоять как врожденной, так и адаптивной иммунорезистентности опухоли, опосредованной экспрессией PD-L1.
На мышиной модели продемонстрирован терапевтический потенциал блокирования оси PD‑1 [33]. Мыши с генетически детерминированным дефицитом PD‑1 характеризуются более сильным иммунным ответом на опухоль, но и повышенным риском формирования аутоиммунных осложнений по типу дилатационной кардиомиопатии [24] и волчаночноподобного синдрома [23]. Тем не менее при дефиците PD‑1 формируется более мягкий аутоиммунный фенотип по сравнению с дефицитом молекулы CTLA‑4.
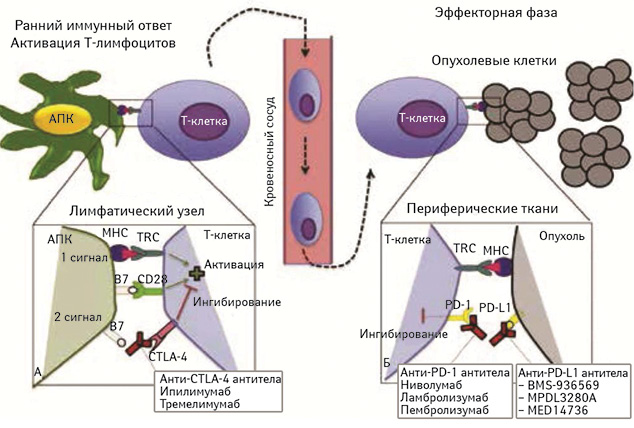
Моноклональные антитела к CTLA‑4 (ипилимумаб) отменяют иммунную толерантность на ранней стадии противоопухолевого иммунного ответа, реализующейся в периферических иммунных органах (лимфатических узлах, селезенке), вызывая значительное ослабление иммунной толерантности. Моноклональные антитела к PD‑1 (пембролизумаб) блокируют опухоль-индуцированную анергию и апоптоз специфических цитотоксических Т-лимфоцитов в периферических тканях, включая саму опухоль. Пембролизумаб действует на заключительной, эффекторной фазе иммунного ответа против опухоли, во время которой Т-киллеры непосредственно индуцируют апоптоз или некроз неопластических клеток.
Таким образом, ипилимумаб ингибирует проксимальный, лимфоидный этап формирования иммунной толерантности к опухоли, а пембролизумаб — дистальный, тканевой, реализующийся в непосредственной близости к неоплазии. Эти различия крайне важны для безопасности терапии.
Побочные реакции иммуномодулирующих препаратов моноклональных антител
Ранние исследования показали, что PD-L1 в норме не экспрессируется на здоровых клетках солидных органов, включая грудные железы, толстую кишку, поджелудочную железу, почки, матку, скелетные мышцы и легкие, что делает антагонисты PD‑1 привлекательными иммунотерапевтическими агентами в плане безопасности лечения.
Хотя результаты клинических испытаний свидетельствуют о безопасности обеих иммунотерапевтических стратегий и их преимуществах перед цитостатическими химиопрепаратами, ипилимумаб вызывает большее количество побочных эффектов по сравнению с пембролизумабом. Дело в том, что ипилимумаб оказывает более обширное влияние на систему поддержания иммунной толерантности, что приводит к нежелательной отмене анергии некоторых аутореактивных клеток, покоящихся в иммунных органах, и связанной с этим индукции ряда аутоиммунных осложнений. Эти медикаментозно-индуцированные аутоиммунные реакции обычно являются нетяжелыми и купируются при помощи кортикостероидов или блокаторов фактора некроза опухоли, включая инфликсимаб, которые используются при неэффективности стероидов. Тем не менее развитие таких осложнений снижает комплайенс и ухудшает качество жизни пациентов онкологического профиля.
Аутоиммунные реакции встречаются как минимум в 25–30% случаев при применении ипилимумаба, причем чаще всего развиваются дерматит и колит, несколько реже — пневмонит, гепатит, пангипопитуитаризм и тиреоидит. Применение коротких курсов ипилимумаба c использованием 4 доз препарата по 3 мг/кг каждые 3 нед, одобренное FDA, позволяет сократить удельный вес тяжелых побочных эффектов до 10–15% случаев [32].
При рассмотрении механизма развития аутоиммунных осложнений иммунотерапии следует учитывать, что CTLA‑4 и PD‑1 экспрессируются на высоком уровне на регуляторных СD4+CD25+ Т-лимфоцитах, которые участвуют в поддержании механизмов периферической иммунной толерантности. Активация этих рецепторов приводит к усилению пролиферации регуляторных Т-клеток и служит профилактикой срыва иммунной толерантности к антигенам собственного организма. Поскольку многие опухоли инфильтрированы регуляторными Т-лимфоцитами, блокада их активности при помощи пембролизумаба позволяет усилить противоопухолевый иммунный ответ, помимо прочего, и путем устранения иммуносупрессии, опосредованной регуляторными Т-лимфоцитами, инфильтрирующими опухоль. Тем не менее параллельное подавление регуляторных Т-клеток периферических иммунных органов, более выраженное при использовании ипилимумаба с проксимальным механизмом действия, приводит к срыву иммунной толерантности и индукции аутоиммунных осложнений у некоторых пациентов, получающих иммунотерапию.
Пембролизумаб не воздействует на систему поддержания иммунной толерантности в лимфоидных органах. Этот препарат оказывает прицельное, сосредоточенное влияние на эффекторные цитотоксические Т-клетки, накапливающиеся в периферических тканях, включая ЛИО. Поэтому частота тяжелых побочных эффектов, требующих применения стероидов, не превышает 13–14% даже при проведении длительных курсов терапии [2]. При этом пембролизумаб отменяет опухоль-индуцированный апоптоз специфических Т-киллеров, распознающих опухолевые антигены, то есть купирует вторичный дефицит специфического клеточного иммунитета, лежащий в основе прогрессирования злокачественного новообразования. Данный эффект не позволяет опухоли ускользать от иммунного ответа и создает условия для реализации эффективной клеточной цитотоксической реакции против неоплазии.
Пембролизумаб не наделен свойствами цитостатика и не разрушает опухоль непосредственно, что позволяет избежать ряда тяжелых побочных эффектов. Этот препарат устраняет вызванный опухолью иммунодефицит, а разрушение опухоли и профилактику метастазов осуществляет иммунная система организма.
Результаты клинических испытаний
Ипилимумаб успешно прошел двойные слепые плацебо-контролируемые исследования у пациентов с меланомой [28]. Пембролизумаб находится на завершающей стадии исследований, посвященных терапии меланомы и рака легкого, однако убедительные предварительные результаты позволили уже сейчас внедрить данное лекарственное средство в современные алгоритмы лечения при меланоме.
Недавно A. Daud и соавторы представили результаты последнего рандомизированного клинического исследования с участием 411 пациентов с неоперабельной меланомой. В целом общая частота ответов составила 34%, в группе пациентов, не получавших ранее ипилимумаб, — 39%, а в группе ипилимумаба — 29%. В 81% случаев отмечался клинический ответ на иммунотерапию с медианой на уровне 18 мес.
Результаты последнего открытого мультикогортного клинического исследования Ib фазы с участием 665 пациентов с запущенной меланомой показывают, что назначение пембролизумаба ассоциировано с возрастанием общего уровня ответа на терапию на 33%, 12-месячной выживаемости без прогрессирования — на 35% и медианы общей выживаемости — на 23 мес. Побочные эффекты III и IV степени тяжести отмечали лишь в 14% случаев [27].
Пембролизумаб доказал эффективность при немелкоклеточном раке легкого. Экспрессия PD‑1, выявленная при иммуногистохимическом анализе образцов ткани опухоли, была информативным предиктором положительного ответа на иммунотерапию, поскольку 67% пациентов с такой экспрессией ответили на лечение, в то время как лишь у 4% лиц без молекул PD‑1 отмечался хороший ответ на иммунотерапевтические вмешательства [11]. Повторное лечение антагонистом PD‑1 было апробировано у пациента, который ответил на первичный курс иммунотерапии, и это вмешательство способствовало 16-месячной ремиссии опухоли. Поэтому есть основания для инициации специальных исследований, посвященных повторным курсам анти-PD‑1-иммунотерапии у отвечающих на лечение.
Комбинированная терапия при помощи анти-CTLA‑4-агента ипилимумаба и ниволумаба, блокирующего PD‑1, недавно продемонстрировала благоприятный профиль безопасности и более сильный терапевтический эффект по сравнению с монотерапией каждым препаратом в специально спланированном исследовании с небольшим количеством участников, причем у 42% пациентов отмечалась редукция опухоли более чем на 80% на протяжении 36 нед терапии, однако удельный вес аутоиммунных осложнений возрос до 73–93% случаев [30]. Пациент с фолликулярной лимфомой положительно ответил на комбинированную терапию пембролизумабом и ритуксимабом без развития тяжелых побочных эффектов [15]. На данный момент проходит II фаза клинических испытаний подобного комбинированного подхода. Также продолжаются исследования I/II фаз комбинированной терапии пембролизумабом и леналидомидом при множественной миеломе и пембролизумабом со стандартной химиотерапией при ряде солидных опухолей, включая рак поджелудочной железы.
Результаты недавнего открытого сравнительного рандомизированного клинического исследования ІІІ фазы с участием 305 пациентов с запущенным PD-L1-положительным немелкоклеточным раком легкого, проведенное M. Reck и соавторами, указывают на медиану выживаемости без прогрессирования на уровне 10,3 мес у пембролизумаба и лишь 6 мес — у конвенционной химиотерапии. Кроме того, уровень общей 6-месячной выживаемости (80,2 против 72,4%), равно как и чувствительность к лечению (44,8 против 27,8%), были выше у пембролизумаба по сравнению с рекомендуемыми химиотерапевтическими препаратами. При лечении пембролизумабом отмечалось вдвое меньше побочных эффектов III–V степени тяжести (26,6 против 53,3% случаев) [26].
Данные открытого рандомизированного когортного клинического исследования ІІ фазы KEYNOTE‑021 с участием 123 пациентов с запущенным несквамозным немелкоклеточным раком легкого указывают на пользу от добавления пембролизумаба к цитостатикам карбоплатину и пеметрекседу в схеме противоопухолевой терапии. Объективный ответ на проводимое лечение отмечен в 55% случаев в группе с применением пембролизумаба по сравнению с 18% случаев в группе использования только химиотерапевтических агентов (расчетная терапевтическая разница 26%; 95% ДИ 9–42%; p=0,0016), хотя количество зарегистрированных побочных эффектов выше III степени тяжести оказалось одинаковым в обеих группах наблюдения [18].
Биомаркеры инновационной иммунотерапии
Выявление экспрессии PD‑L1 при иммуногистохимическом анализе образцов ткани опухоли, полученных при биопсии, является предиктором выраженного положительного ответа на пембролизумаб [11], что открывает возможности для внедрения персонифицированной иммунотерапии злокачественных новообразований. Тем не менее показана эффективность PD‑1-антагонистов и при PD-L1-отрицательных опухолях. Возрастание абсолютного количества лимфоцитов в крови на 3; 7-й и 12-й неделе терапии ипилимумабом коррелировало с клиническим улучшением и выживаемостью пациентов. Также показано, что увеличение количества эозинофилов между 2-й и 3-й инфузией ипилимумаба связано с повышенной выживаемостью участников исследования [5]. Небольшой стартовый размер опухоли (<90 мм) ассоциирован с лучшим клиническим ответом на пембролизумаб, хотя препарат был эффективным и при больших по размеру новообразованиях [16]. По уровню ИЛ‑17 в сыворотке крови на 7-й неделе терапии можно прогнозировать развитие колита во время применения ипилимумаба [3]. Также следует учитывать, что у пациентов с анамнезом аутоиммунных заболеваний чаще развиваются побочные реакции иммуномодулирующей иммунотерапии.
Выводы
Блокада взаимодействия в системе PD‑1/PD-L1 и PD‑1/PD–L2 при помощи иммуномодулирующего препарата моноклональных антител пембролизумаба является многообещающей инновационной стратегией лечения злокачественных новообразований человека. На сегодня пембролизумаб одобрен FDA для лечения метастатической меланомы в 1-й линии терапии, немелкоклеточного рака легкого при высокой экспрессии PD-L1 в 1-й линии, плоскоклеточного рака головы и шеи при прогресировании при платиносодержащей химиотерапии.
Иммуногистохимическое определение экспрессии PD-L1 в ткани опухоли — эффективный способ отбора пациентов, которые потенциально ответят на иммунотерапию. Это открывает возможности для персонифицированной терапии в онкологии.
Инновационность подхода обусловлена самой философией иммунотерапии опухоли, заключающейся не в прямом разрушении опухолевых клеток под воздействием препарата, неизбежно сопровождающемся рядом тяжелых побочных эффектов, а в устранении ключевого механизма опухоль-индуцированной иммуносупрессии, при помощи которого неоплазия уклоняется от иммунного надзора. При этом осуществляется минимальное вмешательство в деятельность организма человека, позволяющее реализоваться естественному механизму противоопухолевой защиты, сформированному в процессе миллионов лет эволюционного развития человеческого вида. Успехи инновационной иммунотерапии в онкологии открывают ошеломляющие и поистине вдохновляющие перспективы эффективного, безопасного и, главное, патофизиологически обоснованного лечения злокачественных новообразований человека.
В Украине пембролизумаб зарегистрирован под торговым наименованием Китруда® и показан для лечения меланомы (нерезектабельной или метастатической) в виде монотерапии, а также для лечения локально прогрессирующего или метастатического немелкоклеточного рака легких у взрослых, у которых опухоль экспрессирует PD-L1 и которые получали ранее как минимум один курс химиотерапии.
Пациенты с EGFR– либо ALK-положительными мутациями также должны получать плановую терапию при этих мутациях до начала лечения препаратом Китруда.
Список использованной литературы
1. Ahmadzadeh M., Johnson L.A., Heemskerk B. et al. (2009) Tumor antigenspecific CD8 T cells infiltrating the tumor express high levels of PD‑1 and are functionally impaired. Blood, 114(8): 1537–1544.
2. Berger R., RotemYehudar R., Slama G. et al. (2008) Phase I safety and pharmacokinetic study of CT‑011, a humanized antibody interacting with PD‑1, in patients with advanced hematologic malignancies. Clin. Cancer Res., 14: 3044–3051.
3. Callahan M.K., Yang A., Tandon S. et al. (2011) Evaluation of serum IL‑17 levels during ipilimumab therapy: Correlation with colitis. J. Clin. Oncol., 29, abstr. 2505.
4. Deeks E.D. (2014) Nivolumab: a review of its use in patients with malignant melanoma. Drugs, 74: 1233–1239.
5. Delyon J., Mateus C., Lefeuvre D. et al. (2013) Experience in daily practice with ipilimumab for the treatment of patients with metastatic melanoma: an early increase in lymphocyte and eosinophil counts is associated with improved survival. Ann. Oncol., 24: 1697–1703.
6. Fanoni D., Tavecchio S., Recalcati S. et al. (2011) New monoclonal antibodies against B-cell antigens: possible new strategies for diagnosis of primary cutaneous B-cell lymphomas. Immunol. Lett., 134: 157–160.
7. Faraone V., Arsena A., De Pasquale M.C. (1993) Purified human IgG administration, after chemotherapy, to patients with colorectal carcinoma. Minerva Gastroenterol. Dietol., 39(1): 37–39.
8. Fishman P., BarYehuda S., Shoenfeld Y. (2002) IVIg to prevent tumor metastases. Int. J. Oncol., 21(4): 875–880.
9. Galluzzi L., Kroemer G., Eggermont A. (2014) Novel immune checkpoint blocker approved for the treatment of advanced melanoma. Oncoimmunology, 3(11): e967147.
10. Galluzzi L., Vacchelli E., Bravo-San Pedro J.M. et al. (2014) Classification of current anticancer immunotherapies. Oncotarget., 5(24): 12472–12508.
11. Garon E.B., Balmanoukian A., Hamid O. et al. (2014) MK‑3475 monotherapy for previously treated nonsmall cell lung cancer: preliminary safety and clinical activity. Clin. Cancer. Res., 20 (abstract nr A20).
12. Hamanishi J., Mandai M., Iwasaki M., Okazaki T. et al. (2007) Programmed cell death 1 ligand 1 and tumorinfiltrating CD8+ T lymphocytes are prognostic factors of human ovarian cancer. Proc. Natl. Acad. Sci USA, 104(9): 3360–3365.
13. Hamid O., Robert C., Daud A. et al. (2013) Safety and tumor responses with lambrolizumab (antiPD‑1) in melanoma. N. Engl. J. Med., 369(2): 134–144.
14. Henick B.S., Herbst R.S., Goldberg S.B. (2014) The PD‑1 pathway as a therapeutic target to overcome immune escape mechanisms in cancer. Expert. Opin. Ther. Targets, 18(12): 1407–1420.
15. Herbst R.S., Gordon M.S., Fine G.D. et al. (2013)A study of MPDL3280A enengineered PD-L1 antibody in patients with locally advanced or metastatic tumors. ASCO Meeting Abstract, 31: 3000.
16. Joseph R.W., Elassaiss-Schaap J., Wolchok J.D. et al. (2014) Baseline tumor size as an independent prognostic factor for overall survival in patients with metastatic melanoma treated with the anti-PD‑1 monoclonal antibody MK‑3475. J. Clin. Oncol., 32, abstr. 3015.
17. Kyi C., Postow M.A. (2014) Checkpoint blocking antibodies in cancer immunotherapy. FEBS Lett., 588(2): 368–376.
18. Langer C., Gadgeel S.M., Borghaei H. et al. (2016) Carboplatin and pemetrexed with or without pembrolizumab for advanced, nonsquamous nonsmallcell lung cancer: a randomised, phase 2 cohort of the openlabel KEYNOTE‑021 study. Lancet Oncology [Epub ahead of print].
19. Ludvigsson J.F., Neovius M., Ye W., Hammarstrom L. (2015) IgA deficiency and risk of cancer: a population-based matched cohort study. J. Clin. Immunol., 35(2): 182–188.
20. Luke J.J., Ott P.A. (2015) PD‑1 pathway inhibitors: the next generation of immunotherapy for advanced melanoma. Oncotarget, 6(6): 3479–3492.
21. Momtaz P., Postow M.A. (2014) Immunologic checkpoints in cancer therapy: focus on the programmed death‑1 (PD‑1) receptor pathway. Pharmgenomics Pers. Med., 7: 357–365.
22. Murie-Fernandez M., Gurpide A., de la Cruz S., de Castro P. (2006) Total remission of thymus carcinoma after treatment with intravenous immunoglobulin. Clin. Transl. Oncol., 8(9): 697–699.
23. Nishimura H., Nose M., Hiai H. et al. (1999) Development of lupuslike autoimmune diseases by disruption of the PD‑1 gene encoding an ITIM motif-carrying immunoreceptor. Immunity, 11: 141–151.
24. Nishimura H., Okazaki T., Tanaka Y. et al. (2001) Autoimmune dilated cardiomyopathy in PD‑1 receptordeficient mice. Science, 291: 319–322.
25. Pardoll D.M. (2012) The blockade of immune checkpoints in cancer immunotherapy. Nat. Rev. Cancer, 12(4): 252–264.
26. Reck M., Rodrigez-Abreu D., Robinson A.G. et al. (2016) Pemrolizumab versus chemotherapy for PD-L1-positive nonsmallcell lung cancer. N. Eng. J. Med., Oct. 8 [Epub ahead of print].
27. Ribas A., Hamid O., Daud A. et al. (2016) Association of Pembrolizumab with tumor response among patients with advanced melanoma. JAMA, 315(15): 1600–1609.
28. Robert C., Ribas A., Wolchok J.D. et al. (2014) Anti-programmed-death-receptor‑1 treatment with pembrolizumab in ipilimumabrefractory advanced melanoma: a randomised dosecomparison cohort of a phase 1 trial. Lancet, 384: 1109–1117.
29. Thompson R.H., Webster W.S., Cheville J.C. et al. (2005) B7–H1 glycoprotein blockade: a novel strategy to enhance immunotherapy in patients with renal cell carcinoma. Urology, 66: 10–14.
30. Wolchok J.D., Daud A.I. (2013) Nivolumab plus ipilimumab in advanced melanoma. N. Engl. J. Med., 369: 122–133.
31. Wolchok J.D., Neyns B., Linette G. et al. (2010) Ipilimumab monotherapy in patients with pretreated advanced melanoma: a randomised, doubleblind, multicentre, phase 2, doseranging study. Lancet Oncol., 11: 155–164.
32. Yervoy® (ipilimumab) prescribing information. Princeton, NJ, USA: 2013. BristolMyers Squibb Company (http://packageinserts.bms.com/pi/pi_yervoy.pdf).
33. Zeng J., See A.P., Phallen J. et al. (2013) Anti-PD‑1 blockade and stereotactic radiation produce long-term survival in mice with intracranial gliomas. Int. J. Radiat. Oncol. Biol. Phys., 86: 343–349.
Настоящая информация предоставлена компанией MSD в качестве профессиональной поддержки специалистам здравоохранения. Информация, относящаяся к любому продукту(-ам), может не совпадать с инструкцией по применению препарата. Пожалуйста, ознакомьтесь с полным текстом инструкции для получения точной информации или данных по продуктам, рассматриваемым в настоящей публикации, до назначения.
ONCO-1205186-0000














Leave a comment