Комбінована анестезія як метод вибору при радикальній цистектомії
Клімчук Л.В., Лісний І.І., Войленко О.А., Колеснік О.О., Стаховський Е.О.
Резюме. Метою цього дослідження було провести оцінку ефективності та безпеки використання комбінованої спінально-епідуральної анестезії та загальної анестезії при хірургічному лікуванні хворих на інвазивний рак сечового міхура. Авторами було проведено обстеження 75 хворих, яким було проведено радикальну цистектомію з приводу інвазивного раку сечового міхура. В групу А ввійшли 50 хворих, яким була проведена комбінована спінально-епідуральна анестезія зі штучною вентиляцією легень. Післяопераційна анальгезія була виконана з використанням подовженої епідуральної інфузії маркаїну 0,125% — 6–8 мл/год. У контрольну групу ввійшли 25 хворих, яким була проведена загальна анестезія з седацією та з штучною вентиляцією легень. Післяопераційна анальгезія була виконана з використанням опіоїдного анальгетика омнопону 2% — 1 мл 3–4 рази на добу. Проводилося вимірювання: артеріального тиску та частоти серцевих скорочень. У післяопераційний період проводилася оцінка рівня болю, а саме на таких етапах: після закінчення операції та пробудження хворого, потім кожні 2 год протягом 3 діб. У групі А під час оперативного втручання було знижено дозу опіоїдних анальгетиків на 53%. Так, у хворих у групі А відзначалося скорочення часу встановлення свідомості після операції та зниження дози гипнотиків порівняно з хворими з групи В. Під час анестезії виявлено розбіжність між групами щодо зміни показників гемодинаміки, об’єму крововтрати під час операції, але відсутні достовірні розбіжності у рівні гликемії між 2 групами. Результати дослідження показали, що застосування комбінованої спінально-епідуральної анестезії під час операції викликає значне зниження рівня болю в перші 3 доби післяопераційного періоду після оперативних втручань з приводу радикальної цистектомії. Такий режим введення не викликав збільшення кількості побічних ефектів в періопераційний період, сприяв скороченню застосування ліків і швидкому пробудженню хворого після анестезії, а також зменешенню об’єму крововтрати.

Вступ
Епідуральна та спінальна анестезія, запропонована на початку ХХ ст. Джорджем Крайлем, переживає ренесанс у зв’язку з високою якістю післяопераційного знеболювання і меншою кількістю післяопераційних ускладнень [9]. Спінальна та епідуральна анестезія мають певні переваги й недоліки. До переваг першої в чистому виді потрібно віднести високу якість анестезії в місці оперативного втручання та швидкий початок її дії, до недоліків — значні зміни гемодинаміки, особливо у хворих похилого віку, та короткий період анальгезії, що потребує додаткового введення анальгетиків. Перевагами епідуральної анестезії вважаються більш тривалий ефект анестезії порівняно зі спінальною, недоліками — забезпечення недостатньої глибини міорелаксації при швидкому початку операції [1, 4, 5, 15]. Одночасне використання спінальної та епідуральної анестезії нівелює недоліки кожного з методів та акумулює їх позитивні риси. Комбінована спінально-епідуральна анестезія при оперативних втручаннях має певні переваги перед іншими методами анестезії: швидкий початок оперативних втручань, забезпечення адекватного рівня релаксації під час операцій. [1, 9, 18, 23, 25]. Не дивлячись на великий перелік опіоїдних та неопіоїдних анальгетиків епідуральна анальгезія є найбільш оптимальним та ефективним методом післяопераційного знеболювання. Метод подовженої епідуральної анестезії та анальгезії частіше почав застосовуватися при проведенні оперативних втручань і для подальшого знеболювання хворих. Подовжена епідуральна анестезія дозволяє значно зменшити кількість препаратів, які вводяться як під час наркозу, так і в ранній післяопераційний період, що дуже важливо, враховуючи супутню патологію у хворих старшого віку і поєднання хірургічного втручання із застосуванням поліхіміотерапії [5, 6, 19, 22]. Подовжена епідуральна анестезія дозволяє відмовитися від введення опіоїдних анальгетиків, а також дозволяє значно прискорити процес відновлення перистальтики кишечнику і початок раннього ентерального харчування, знизити частоту виникнення ускладнень, пов’язаних з оперативним втручанням[8, 11, 13]. Існують певні закономірності впливу загальної анестезії на функцію нирок. Вона викликає зворотне зниження ниркового кровотоку, діурезу, екскреції натрію. Ці зміни менш виражені при регіонарній та спiнальній анестезії [2, 20]. Більшість індукованих операцією ендокринних і метаболічних змін (підвищення в плазмі концентрацій катехоламінів, кортизолу, глюкози тощо) значно знижені внаслідок адекватного рівня сенсорного блоку, викликаного регіональною анестезією[7]. Зниження інтраопераційної крововтрати під час комбінованої спінально-епідуральної анестезії порівняно із загальною анестезією може призвести до гіпотонії внаслідок блокади симпатичної нервової системи або перерозподілу крові з місця операції. Багатьма авторами [3, 6, 8, 13, 17] було показано, що місцеві анестетики, крім основного ефекту, мають також значну протизапальну та антитромботичну дії. Метою цього дослідження було порівняти ефективність та безпеку застосування комбінованої спiнально-епідуральної анестезії із загальною анестезією при хірургічному втручанні у хворих на інвазивний рак сечового міхура.
Матеріали та методи
За період з 01.02.2009 р. по 01.06.2011 р. у дослідженні взяли участь 75 хворих на рак сечового міхура, у яких було проведено радикальну цистектомію. Пацієнти булиі рандомізовані у співвідношенні 1:3 залежно від методу анестезії при проведенні оперативного втручання. В групі А (50 хворих) була проведена комбінована спінально-епідуральна анестезія (КСЕА)з седацією та штучною вентиляцією легень. Післяопераційна анальгезія в цій групі була виконана з використанням подовженої епідуральної інфузії бупівакаїну 0,125% — 6–8 мл/год. В контрольній групі В (25 хворих) була проведена загальна анестезія (ЗА) зі штучною вентиляцією легень. Післяопераційна анальгезія в цій групі була виконана з використанням опіоїдного анальгетика омнопону 2% — 1 мл 3—4 рази на добу. Склад груп пацієнтів був близьким за супутньою патологією та ступенем анестезіологічного ризику за класифікацією АSА і мав II–III ст. Проводилося вимірювання: артеріального тиску (систолічного та діастолічного) й частоти серцевих скорочень з інтервалом 10 хв протягом оперативного втручання. В післяопераційний період контроль вказаних показників проводили кожні 2 год протягом перших 3 діб. З урахуванням початку дії препаратів, що застосовувалися, реєстрацію змін цих показників проводили: перед початком операції; через 30 хв після початку анестезії; на травматичному етапі операції; в кінці операції. Під час анестезії проводився розрахунок загальної дози анестетиків, гіпнотиків та м’язових релаксантів. У групі А під час оперативного втручання дози опіоїдних анальгетиків вводилися на початку оперативного втручання (0,1 мг фентанілу); для зменшення гемодинамичної реакції на інтубацію трахеї (в подальшому 0,1 мг фентанілу залежно від показників гемодинаміки). Міорелаксанти під час операції в групі А вводилися тількі для інтубації трахеї. Гіпнотик (тіопентал натрію) в групі вводився: початкова доза — для вводного наркозу — 200–400 мг з наступним введеням по 50–100 мг з інтервалом 30–40 с до досягнення бажанного результату, та підтримувальна доза — 3–5 мг/кг/год. Проводився розрахунок часу встановлення свідомості після анестезії в обох групах, оцінка рівня болю по візуально-аналогової шкалі болю за 10-бальною шкалою, де 0 — абсолютна відсутність болю, а 10 — найсильніший, нестерпний біль. Оцінку рівня болю проводили на таких етапах: після закінчення операції та пробудження хворого; потім кожні 2 год протягом 12 год у післяопераційний період. У цей же період проводився розрахунок дози анальгетиків для післяопераційного знеболення, поява перистальтики кишечнику. При недостатній анальгезії у хворих обох груп (при рівні болю по візуально-аналоговій шкалі більше 3 балів) додатково застосовували омнопон 2% — 1 мл внутрішньом’язово. У всіх хворих враховувалася загальна доза омнопону для додаткового знеболення. Для оцінки крововтрати під час операції проводився контроль гематокриту, вмісту гемоглобіну та тромбоцитів перед операцією, під час оперативного втручання, в середені травматичного етапу операції, в кінці операції та в перші 3 доби після неї. Для оцінки стрес-реакції визначали вміст глюкози в крові перед операцією, в кінці операції та в перші 3 доби після оперативного втручання.
Статистичну обробку отриманих результатів проводили за допомогою програмного забезпечення «STATISTICA 8.0» («StatSoft. Ink.», 2008). Оцінку розподілення безперервних данних в групі проводили за допомогою побудови діаграм розподілення, а також за критерієм Колмогорова — Смірнова. Враховуючи, що розподілення в групах не було нормальним, порівняння між групами проводили, використовуючи непараметричі методи оцінки данних. Узагальнювальна статистика включала обчислення середнього, зі стандартною помилкою та 95% довірчим інтервалом (ДІ), стандартного відхилення, медиани та квадратильного розмаху (діапазону між 25 та 75 процентилем). Порівняння кількісних показників між групами проводили з використанням критерію Манна — Уітні, якісних — з використанням двустороннього критерію Фішера. Статистично значимими вважалися відмінності при вірогідності помилки 1-го роду менше 5% (р=0,05).
Результати дослідження
У дослідженні взяли участь 75 хворих, яких було розподілено на 2 групи. В групу А увійшли 50 осіб (45 чоловіків та 5 жінок), у яких оперативне втручання проводилося за допомогою комбінованої спiнально-епідуральної анестезії з седацією та штучною вентиляцією легень. В групу В увійшли 25 хворих (15 чоловіків та 10 жінок), у яких оперативне втручання проводилося за допомогою загальної анестезії. Вік хворих у групах: А — 56±10 років (8–15 ДІ); 58 [51–64], В — 56±7 років (5–12 ДI); 58 [57–60], р=0,8454 (Wilcoxon Pairs Test).
Об’єм інфузійної підтримки з метою попередження гіпотензії та крововтрати в групі А на початку оперативного втручання становив 1500–2000 мл, a в групі В з метою попередження крововтрати — 500–1000 мл кристалоїдів та колоїдів. Спочатку вводилися колоїди, далі — ізотонічні розчини NaCl 0,9%. Обсяг інфузії контролювали за рівнем центрального венозного тиску, який наприкінці інфузійної підготовки до початку оперативного втручання становив 13–15 см вод. ст. Об’єм інфузії протягом оперативного втручання становив 78,8±13,5 мл/кг в групі А і 55±14,2 мл/кг групі В. Вони достовірно відрізнялися між групами (р=0,001).
Об’єм крововтрати становив 515±241,9 мл (187,1–342,4 ДI); 500,0 [350,0–600,0] в групі А та 1268±709,4 мл (508,7–1171,0 ДI); 900,0 (800,0–1600,0) в групі В (р=0,001) (Wilcoxon Pairs Test); (рис. 1.) При об’ємі крововтрати 700 мл та вище і вмісті гемоглобіну нижче 70 г/л хворим вводилася одногрупна еритроцитарна маса. Свіжозаморожена плазма вводилася всім хворим для профілактики післяопераційної гіпопротеїнемії.
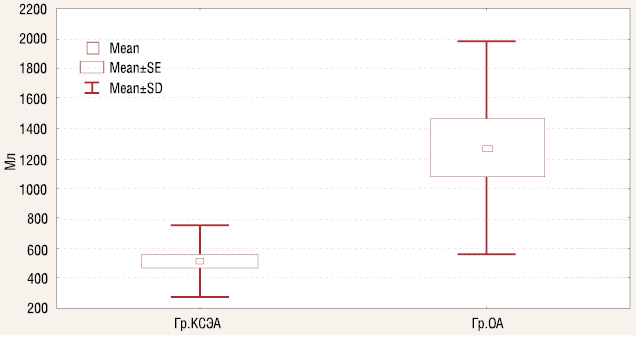
Вміст гемоглобіну та перед операцією в групі А становив 123,9±20,4 г/л, а показник гематокриту — 36,8±2,1%, в післяопераційний період ці показники становили 96,4±13,4 г/л и 27,5±3,2% (р=0,279). У групі В перед операцією вміст гемоглобіну становив 115,2±12,1 г/л, а гематокриту — 28,5±2,3%, в післяопераційний період ці показники становили 89,8±12,7 г/л и 22,7±2,1% (р=0,206). Показники тромбоцитів у хворих у групі А до операції становили (197,8±44,0)·10, а після неї — (221,2±81,8)·10 (р=0,091). У хворих у групі В рівень тромбоцитів до операції становив (231,3±77,5)·10, а після неї — (212,4±45,8)·10 (р=0,360). Достовірних відмінностей при порівняні між групами рівнів гемоглобіну, гематокриту та тромбоцитів у періопераційний період не виявлено, р=0,693 (Mann-Whitney U Test). В групі А під час оперативного втручання було відзначено достовірне зниження загальної дози фентанілу. Так, в групі А загальна доза фентанілу становила 0,49±0,11 мкг, а в групі В — 0,80±0,22 мкг. В групі А протягом оперативного втручання доза фентанілу становила 0,0057 мкг/кг, в групі В — 0,014 мкг/кг і достовірно відрізнялася між групами (U=27,85298, Z=0,60000, р=0,001) (Mann-Whitney U Test). Загальна доза тіопенталу натрію в групі А становила 739,1±175,1 мг (135,5–247,9 ДI), 800,0 [600,0–800,0] та була достовірно нижчою при порівнянні з групою В — 984,6±279,4 мг (200,4–461,3 ДI), 1000,0 [800,0–1200,0] (U=800,00, Z=7,284281, р=0,007) (Mann-Whitney U Test). Введення міорелаксантів під час операції в групі А проводилося в знижених дозах. Потреба в ардуані становила в групі А 4,9±1,46 мг (1,13–2,06 ДI), 4,0 [4,0–6,0] порівняно з групою В — 12,0±1,63 мг (1,17–2,70 ДI), 12,0 [12,0–12,0] та достовірно відрізнялася між групами (U=25,43478, Z=6,0000, р=0,001) (Mann-Whitney U Test). У хворих в групі А відзначалося відновлення свідомості після закінчення операції через 14,3±3,7 хв у групі А та через 23,5±3,3 хв в групі В (р=0,005). Повільне відновлення свідомості значно затримувало переведення хворого на самостійне дихання та екстубацію трахеї в групі В.
Під час анестезії було виявлено достовірні розбіжності між групами за показниками гемодинаміки. Дані частоти серцевих скорочень представлені на рис. 2.
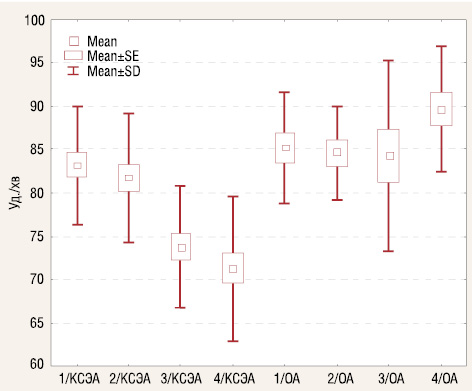
При дослідженні змін показників гемодінамики під час оперативного втручання було встановлено, що частота серцевих скорочень у хворих в групах до початку операції становила: в групі А 83±6 уд./хв (5–10 ДI) 80,0 [80,0–90,0] порівняно з групою В 85±6 уд./хв (5–11 ДI) 88,0 [80,0–90,0]. На початку оперативного втручання частота серцевих скорочень у хворих у групі А становила 81±7 уд./хв (6–10 ДI) 80,0 [76–88,0], на травматичному етапі — 73±7 уд./хв (5–10,0 ДI) 72,0 [70,0–76,0], після закінчення оперативного втручання — 71±8 уд./хв (6–12 ДI) 72,0 [64,0–76,0]. У групі В частота серцевих скорочень у хворих на початку оперативного втручання становила 84±5 уд./хв (4–9 ДІ) 86,0 [80,0–88,0], на травматичному етапі — 84±11 уд./хв (8–18,0 ДI) 84,0 [80,0–88,0], після закінчення оперативного втручання — 89±7 уд./хв (5–12 ДI) 92,0 [88,0–92,0] (U=32,62532, Z=80, 00), (р=0,001) (Mann-Whitney U Test).
Дані стосовно систолічного артеріального тиску представлені на рис. 3.
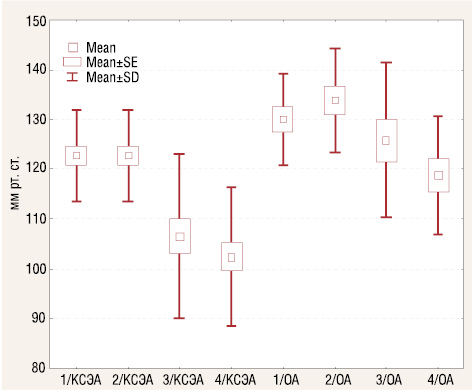
В групі А під час оперативного втручання були відзначені зміни артеріального тиску до початку операції: 122±9 мм рт. ст. (7–13 ДI) 120,0 [120,0–130,0] при порівнянні з групі В 130,0±9 мм рт. ст. (7–15 ДI) 130,0 [120,0–130,0]. Протягом оперативного втручання показники артеріального тиску в групі А становили: на початку оперативного втручання — 123±9 мм рт. ст. (11–20 ДI) 120,0 [110,0–130,0], на травматичному етапі — 106±16 мм рт. ст. (13–23 ДI) 100,0 [90,0–110,0], після закінчення оперативного втручання — 102±14 мм рт. ст. (11–20 ДI) 100,0 [90,0–110,0]; в групі В: на початку оперативного втручання — 134±10 мм рт. ст. (7–17 ДI) 130,0 [130,0–140,0], на травматичному етапі — 126±16 мм рт. ст. (11–25 ДI) 130,0 [130,0–130,0], після закінчення оперативного втручання — 119±12 мм рт. ст. (8–20 ДI) 20,0 [115,0–120,0], відмінності мали статистично достовірний характер між групами (U=120,000, Z=36,23456), (р=0,001) (Mann-Whitney U Test).
При аналізі динаміки рівня глікемії у хворих обох груп у періопераційний період було встановлено, що рівень глюкози в групі А становив перед операцією 6,1±1,6 ммоль/л (5,6–6,4, ДІ); 5,7 [5,0–6,1], в післяопераційний період — 5,5±0,2 ммоль/л (5,1–5,8,ДI); 5,5 [4,9–6,0], р=0,120. В групі В перед операцією рівень глікемії становив 5,8±0,7 ммоль/л (5,5–6,1, ДI); 5,7 [5,5–6,0], в післяопераційний період цей показник становив 5,7±1,3 ммоль/л (5,1–6,3 ДI); 5,7 [4,9–5,9], р=0,178957, (Wilcoxon Test). Достовірних відмінностей в рівні глікемії між групами в перед- та післяопераційний період не виявлено (р=0,894) (Mann-Whitney U Test).
При аналізі динаміки рівня болю було встановлено, що у хворих в групі А (КСЕА) рівень болю за візуально-аналоговою шкалою був достовірно нижче (на 50–58%), ніж у хворих в групі В (ЗА) протягом 12 год післяопераційного періоду (рис. 4).
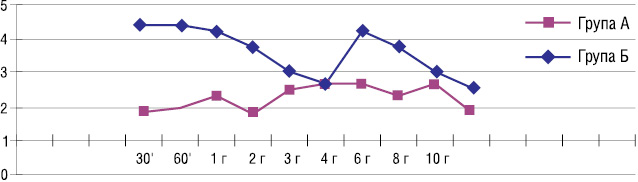
У хворих в групі А перистальтика кишечнику була збережена протягом всього періопераційного періоду. В групі В перші ознаки перистальтики почали з’являтися через 18–23 год після операції (р=0,01).
Обговорення результатів дослідження
Епідуральна та спінальна анестезія в урологічній практиці знайшла широке застосування, перш за все при операціях на простаті та сечовому міхурі. В цілому спінальна і епідуральна анестезія поширена як у світовій, так і у вітчизняній анестезіологічній практиці, тому добре вивчена [14, 16, 18, 26]. Проте, за даними літератури, немає єдиної думки щодо вибору методу анестезії у хворих онкологічного профілю, спеціально не вивчалося питання про специфіку використання методів регіонарної анестезії у хворих онкологічного профілю з високим операційно-анестезіологічним ризиком [12, 24]. Це достатньо актуально, якщо врахувати, що в онкологічній практиці досить часто виявляють хворих з тяжкими супутніми захворюваннями, що супроводжуються значним зниженням функціональних резервів життєво важливих органів і систем (перш за все, серцево-судинної і дихальної), і пацієнтів похилого віку [3,10]. Інколи прямо ставиться питання, що переважає — ризик операції чи періопераційних ускладнень, викликаних супутніми захворюванями. Проведене дослідження показало, що застосування комбінованої спінально-епідуральної анестезії не викликало збільшення побічних ефектів в періопераційному періоді. Це вказує на позитивний вплив комбінованої спінально-епідуральної анестезії на гомеостаз в цілому в перебігу анестезії, скорочення застосування ліків, що не супроводжується погіршенням якості забезпечення знеболювання під час оперативних втручань. Дефіцит об’єму рідини характерний для хворих онкологічного профілю. Передопераційне очищення кишечнику, інтраопераційна втрата рідини і кровотеча можуть викликати абсолютний дефіцит рідини, тоді як вазодилатація, викликана судинорозширювальними препаратами (наприклад анестетиками) також може призвести до відносного дефіциту об’єму рідини в організмі. Під час операції інфузійна терапія є одним з головних методів профілактики і лікування порушення функцій життєво важливих органів і систем. Якщо при хірургічному втручанні передбачається велика крововтрата, то на початку операції проводять інфузійну терапію, спрямовану на поповнення об’єму ціркулюючої крові, яка триває впродовж усієї операції. Всім пацієнтам групи А перед початком оперативного втручання протягом 30 хв проводили внутришньовенну інфузію 1500–2000 мл розчинів з метою попередження гіпотензії та крововтрати, а в групі В — 500–1000 мл. Розчини, які застосовувалися для попередження гідратації, не містили глюкози, оскільки вона викликає значне підвищення концентрації глюкози в крові, що може призвести не лише до збільшення діурезу, а й до розвитку метаболічного ацидозу. Застосування розчинів — це забезпечення стабільної системної гемодинаміки шляхом швидкого відновлення об’єму циркулюючої плазми, уникаючи надмірного накопичення рідини в інтерстиціальному просторі. Проводився контроль динаміки центрального венозного тиску, гемоглобіну, гематокриту, погодинного діурезу. Об’єм інфузійної підтримки в групі А та В достовірно відрізнялися. Хоча розбіжності були статистично недостовірними, можна відзначити, що у хворих в групі А об’єм крововтрати був меншим порівняно з групою В, але об’єм інфузійної підтримки до оперативного втручання був більшим в групі А порівняно з групою В. Вміст гемоглобіну, тромбоцитів та показник гематокриту перед операцією в обох групах був майже на одному рівні, а в післяопераційний період ці показники відрізнялися. В групі А вміст гемоглобіну, тромбоцитів та показник гематокриту були вищими порівняно з групою В.
В групі А під час оперативного втручання було відзначено зниження на 53% дози опіоїдних анальгетиків. Вони вводилися тільки на початку оперативного втручання (0,1 мг фентанілу) для зменшення гемодинамичної реакції на інтубацію трахеї (в подальшому — 0,1 мг фентанілу залежно від показників гемодинаміки). Введення міорелаксантів під час операції в групі А не проводилося, в зв’язку з тим, що комбінована спінально-епідуральна анестезія сама по собі викликає достатній рівень м’язової релаксації. Цей ефект епідуральної анестезії дає можливість раннього відновлення самостійного дихання при припиненні введення гіпнотиків (тіопенталу натрію, дипривану) та швидкого пробудження хворого. Так, у пацієнтів в групі А відзначалося встановлення свідомості через 11±5 хв після закінчення введення гіпнотиків, тоді як у хворих в групі В це відбувалося через 23±5 хв після введення препаратів для седації, що, відповідно, значно затримувало екстубацію трахеї. Це було зумовлено тим, що загальна доза тіопенталу натрію та ардуану була на 40–48% вищою у хворих у групі В, ніж в групі А.
У групі В перші ознаки перистальтики почали з’являтися через 18–23 год після операції, що затримувало початок раннього харчування хворих. У хворих в групі А перистальтика кишечнику майже не порушувалася в ранньому післяопераційному періоді, що надавало можливість раніше починати ентеральне харчування. Цей показник вказує на більш адекватну післяопераційну анальгезію з використанням епідурального введення місцевого анестетика для післяопераційної анальгезії при порівнянні з опіоїдним анальгетиком омнопоном.
Висновки
Комбінована спінально-епідуральна анестезія — методика регіонального знеболення, яка розширює можливості анестезіолога і дозволяє досягти адекватного рівня знеболення, технічно не складна, має високу міру доступності і ефективності. Використання комбінованої спінально-епідуральної анестезії при оперативних втручаннях має певні переваги над іншими методами анестезії: швидкий початок оперативного втручання; забезпечує адекватний рівень анестезії і релаксації під час операції, яку при необхідності можна продовжити завдяки епідуральному катетеру; стійкий знеболювальний ефект в післяопераційний період; невисока вартість процедури.
Отримані результати показали, що при проведенні операцій у хворих на інвазивний рак сечового міхура з використанням методики комбінованої спінальної-епідуральної анестезії та інтраопераційної гемодилюції, створювалися умови для помірної артеріальної гіпотензії і нормосистолії, що сприяло зменшенню крововтрати під час оперативного втручання. Комбінована спінально-епідуральна анестезія сприяє значному зменшенню потреби в анестетиках і м’язових релаксантах під час оперативного втручання.
Пролонгована епідуральна анальгезія є безпечним методом післяопераційного знеболювання при оператиному втручанні у хворих на інвазивний рак сечового міхура. Інфузія місцевих анестетиків при подовженій епідуральній анальгезії забезпечує адекватне знеболення після операцій у хворих на інвазивний рак сечового міхура. При використанні пролонгованої епідуральної анестезії зменшується потреба у введенні опіоїдних анальгетиків, прискорюється активізація хворого, стимулюється перистальтика кишечнику, що сприяє зменшенню кількості ускладнень в ранній післяопераційний період.
Литература
- 1. Витенбек И.Л. (1981) Сочетанная спинально-перидуральная анестезия как вариант проводникового обезболивания в период оперативных вмешательствВестник хирургии, 1: 123-128.
- 2. Гармиш О.С., Забашний С.І., Овчинникова Л.Ю. (2008) Комбінована анестезія в онкоурології. Ж.Біль,знеболюванняі інтенсивна терапія. 2
- 3. Глущенко В.А., Гаврилова Е.Г., Макатун В.Н. (2000) К вопросу о применении комбинированной спинально-эпидуральной анестезии Terra medica, 2.
- 4. Глумчер Ф.С., Тріщинський А.І. Руководство по анестезиологии.
- 5. Гуля М.Б., Лесной И.И., Радчук И.П., Фесенко В.С. Опыт использования спинально-эпидуральной анестезии в Житомирском обласном онкологическом диспансере.
- 6. Гуля М.Б., Лісний І.І., Радчук І.П. Досвід використання спінально- епідуральної анестезії.
- 7. Джавад-Заде М.Д., Линьов С.Н. Гомеостаз при операциях на органах мочеполовой системы.
- 8. Др.О.Грек. Послеоперационный контроль при перидуральной анальгезии с постоянной инфузией.
- 9. Європейский Конгрес Анестезіологів, (2007) Мюнхен. Матеріали конгресу.
- 10. Клиническая анестезиология. (2001) Справочник: Пер. с англ., доп. / Под ред. В.А. Гологорского, В.В. Яснецова. М., ГЭОТАР-МЕД, 816.
- 11. Кукушкин М.Л, Решетняк В.К Механізми патологічної болі.
- 12. Морган Дж., Михаил М.С. (2000) Клиническая анестезиология: Пер. с англ. М. СПб.: Издательство БИНОМ Невский Диалект, 2: 366 с.
- 13. Овечкін А.М. (2006 ) Спінальна та епідуральна анестезія в хірургії. Клінічне значення і вплив на результати лікування.
- 14. Овечкін А.М., Гнезділов А.В. Лікування та профілактика післяопераційного болю.
- 15. Пол Д. Барах Брюс, Ф. Куллен Роберт, К. Стэлтинг Клиническая анестезия. часть 3. Эпидуральная спинальная анестезия.
- 16. Руденко М.И., Ефименко H.A., (2002) Регионарная анестезия в плановой и экстренной хирургии: Методическое пособие. М.: ГВКГ им. H.H. Бурденко, 55-103
- 17. Суслов В.В. (1981) Інтенсивна терапія та знеболювання в урології. К.Здоров’я.
- 18. Суджан A.B., Горожанская Э.Г., Розанова Н.Б. и др. (1991) Метаболические изменния и их коррекция в онкологии Вестник ВОНЦ, (2): 14–16.
- 19. Ситнік А.Г., Родослав Л.С., Левін М.Б. Методика устранения острой боли.
- 20. Brett B. Gunshe, M.D. Проведення епідуральної анестезії.
- 21. Ek M., Engblom D., Saha S., Blomqvist A., Jakobsson P.J., Ericsson-Dahlstran A. (2001) Pathway across the blood-brain barrier. Nature, 410: 430–1
- 22. Eger EI. New inhaled anesthetics. (1994) Anesthesiology. (80): 906.
- 23. Cousins M.J., Siddall P.J. Послеоперационная боль: роль механизмов периферической и центральной сенситизации.
- 24. Kehlet H., Dahl J.B. Anaesthesia, surgery and challenges in postoperative Recovery Lancet 2003; 362: 1921–8.
- 25. Mission J.P., Bolandard F., Tubert V., Duband P., Schoeffler P. (1998) Comparison of three regional anesthesia techniques for elective cesarean section. Anesthesiology. (89): 874.
- 26. Curatolo M., Orlando A., Zbinden A., Venuti F.S. (1995)Failure rate of epidural anaesthesia for foot and ankle surgery. A comparison with other surgical procedures. Eur. J. Anaesthesiol, 12(4): 363–367.
Комбинированная анестезия как метод выбора при радикальной цистэктомии
Национальный институт рака, Киев
Резюме. Целью данного исследования было проведение оценки эффективности и безопасности применения сочетания комбинированной спинально-эпидуральной анестезии и общей анестезии при хирургическом лечении больных с инвазивным раком мочевого пузыря. Авторами было проведено исследование с участием 75 больных, у которых планировалось проведение оперативного вмешательства по поводу радикальной цистэктомии. В группу исследования А вошли 50 больных, которым была проведена комбинированная спинально-эпидуральная анестезия с седацией и искусственной вентиляцией легких. Послеоперационная анальгезия была проведена с использованием продленной эпидуральной анестезией маркаином 0,125% — 6–8 мл/ч. В контрольную группу В вошли 25 больных, которым была проведена общая анестезия с искусственной вентиляцией легких. Послеоперационная анальгезия была проведена с использованием опиоидных анальгетиков омнопона 2% — 1 мл 3–4 раза в сутки. Проводилось определение артериального давления и частоты сердечных сокращений. В послеоперационный период проводилась оценка болевого синдрома, расчет времени восстановления сознания после анестезии, уровня глюкозы в плазме, объема кровопотери. В групе А было отмечено снижение на 53% дозы наркотических анальгетиков, сокращение времени восстановления сознания после операции, снижение дозы гипнотиков (тиопентала натрия), чем у больных в группе В. Во время анестезии было выявлено различие между группами по изменению показателей гемодинамики, экстубации трахеи, объему кровопотери во время операции, но не выявлено достоверных различий в уровне гликемии между двумя группами. Результаты исследования показали, что применение комбинированной спинально-эпидуральной анестезии во время операции вызывает значительное снижение уровня боли в первые 2 сут после оперативных вмешательств по поводу радикальной цистэктомии. Такой режим введения не вызывает увеличения количества побочных эффектов в периоперационный период, способствует сокращению применения препаратов и быстрому пробуждению больных после анестезии, а также уменьшению объема кровопотери.
комбинированная спинально-эпидуральная анестезия, общая анестезия.














Leave a comment