Хірургічне лікування при пухлинах підшлункової залози в дітей
Лукашенко А.В., Колеснік О.О., Климнюк Г.І., Тіунова І.А.
Резюме. Злоякісні новоутворення підшлункової залози (ПЗ) у дітей виникають рідко. Тактика лікування при пухлинах підшлункової залози (ППЗ) є невизначеною, оскільки більшість даних у публікаціях представлені окремими клінічними випадками. Метою нашого дослідження було оптимізувати лікування при ППЗ в дітей, виходячи з власного досвіду та даних світової літератури. Проведено аналіз результатів лікування при ППЗ в дітей в Національному інституті раку з 1990 по 2016 р. У цей період 17 пацієнтів віком до 18 років були прооперовані з приводу ППЗ. Радикальне (R0) хірургічне лікування проведено в 16 (94,2%) хворих. В 11 (64,7%) пацієнтів виконано дистальні резекції відповідно до локалізації пухлини в тілі або хвості ПЗ. Панкреатодуоденальну резекцію (ПДР) проведено в 4 (23,5%) хворих. Органозберігаючі операції виконано в 5 (31,3%) випадках: в 1 (6,2%) — енуклеацію пухлини в зоні хвоста ПЗ, у 2 (12,5%) — ПДР зі збереженням пілоруса, ще в 2 (12,5%) — дистальні резекції ПЗ зі збереженням селезінки. Не зареєстровано жодного випадку післяопераційної летальності. Післяопераційні ускладнення зафіксовано в 2 (12,5%) хворих, що потребувало додаткового лікування. Медіана післяопераційного спостереження становила 114 міс (16–292 міс), значних пізніх функціональних порушень в екзокринній та ендокринній функціях ПЗ не виявлено. На момент останнього спостереження всі хворі живі. ППЗ у дітей характеризуються більш сприятливим перебігом, ніж в дорослих. Хірургічний метод є пріоритетним в терапії при ППЗ у дітей. Оперативне лікування новоутворень ПЗ у дітей слід проводити у високоспеціалізованих центрах, що мають досвід виконання аналогічних операцій у дорослих.

Вступ
Пухлини підшлункової залози (ППЗ) у дітей виникають рідко, тому важко встановити фактори ризику розвитку цього захворювання. Згідно з епідеміологічною базою даних США (Surveillance, Epidemiology and End Results — SEER), в період з 1973 по 2006 р. зареєстровано 69 пацієнтів із ППЗ віком до 19 років [1]. Відповідно до даних I.B. Brecht та співавторів, серед захворювань підшлункової залози (ПЗ) злоякісні пухлини, що виникають у віці до 20 років, діагностують не більше ніж в 1% випадків [1]. Новоутворення ПЗ становлять 0,2% у загальній структурі смертності від злоякісних пухлин у дітей віком до 14 років [2]. На відміну від дорослих, джерелом розвитку ППЗ у дітей майже не буває протоковий епітелій, що принципово впливає на прогностичні властивості зазначеного захворювання [3]. Основними гістологічними типами ППЗ у дітей є панкреатобластоми (ПБ), солідні псевдопапілярні пухлини (СПП), рідше виникають ацинарно-клітинні карциноми, нейроендокринні пухлини (НЕП) [4]. СПП частіше діагностують у підлітковому віці, для ПБ найвища медіана захворюваності становить 4 роки [5]. Середні показники 5-річної виживаності у випадку СПП становлять 88%, при ПБ — 66%, при НЕП — 58%, при карциномах — 33% [6]. Оскільки ППЗ в дітей розвиваються рідко, більшість даних у міжнародній літературі представлені окремими клінічними випадками [4, 7, 8]. Наразі відсутні загальноприйняті діагностичні алгоритми та протоколи лікування ППЗ у дітей [9]. Хірургічний метод є провідним в більшості випадків ППЗ в дітей, роль хіміотерапії та хіміопроменевої терапії ще остаточно невизначена [7].
У третині випадків ППЗ у дітей розвиваються безсимптомно, не супроводжуються клінічними проявами та діагностуються випадково. Віддалені метастази та місцеве розповсюдження ППЗ відмічають в 19,5% первинних випадків при СПП та в 33% — при ПБ [4, 10–12].
Об’єкт і методи дослідження
Проведено аналіз результатів лікування хворих із ППЗ віком до 18 років в період з 1990 по 2016 р. в клініці Національного інституту раку. Комплекс діагностичних заходів та морфологічні критерії верифікації застосовували згідно з рекомендаціями Всесвітньої організації охорони здоров’я [13].
Аналіз ранніх післяопераційних ускладнень проводили відповідно до класифікації Клав’єна — Діндо [14]. Критерії специфічних ускладнень, притаманних операціям на ПЗ (панкреатична фістула, затримка евакуації зі шлунка та ін.), відповідали рекомендаціям Групи досліджень в хірургії підшлункової залози (International Study Group on Pancreatic Surgery) [15].
У пізній післяопераційний період проводили оцінку залишкової тканини ПЗ шляхом магнітно-резонансної томографії (МРТ) — холангіопанкреатографії, критерієм атрофії ПЗ було зменшення паренхіми залози <15 мм [16]. Показником екзокринної недостатності була наявність стеатореї >3 разів на добу з відповідними змінами калу. Екзокринну недостатність визначали за серологічними показниками глюкози та глікозильованого гемоглобіну (HbA1c) відповідно до рекомендацій K. Sugito та співавторів [17]. Також визначали відповідність розвитку дитини віковим критеріям росту та маси тіла, таким чином реєстрували ознаки нутритивної недостатності. Проводили оцінку безрецидивної та загальної виживаності. Дані наведено станом на грудень 2016 р.
Результати
З 1990 по 2016 р. в клініці Національного інституту раку хірургічне лікування проведено у 17 пацієнтів віком до 18 років із діагнозом ППЗ. Загальна характеристика хворих, локалізація пухлин та вид хірургічного втручання наведені в таблиці. Із загальної групи 23,5% становили пацієнти чоловічої статі, 76,5% — жіночої статі. Розподілення за періодами дитинства було таким: новонароджених та пацієнтів грудного віку не було, 1 (5,8%) пацієнт переддошкільного віку, 2 (11,8%) — дошкільного, 2 (11,8%) — молодшого шкільного, 12 (70,6%) — старшого шкільного віку.
Таблиця. Загальна характеристика хворих із ППЗ
| Пацієнт | Діагноз | Вік на момент встановлення діагнозу | Стать | Рік початку лікування |
Вид хірургічного лікування | Хіміотерапія | Радіотерапія | Локалізація пухлини | Додаткові дані |
|---|---|---|---|---|---|---|---|---|---|
| 1 | ПБ | 16 років 7 міс | ж | 1992 | Гастроентероанастомоз | + | + | Головка | |
| 2 | Ангіосаркома | 14 років 11 міс | ж | 1994 | ДП | 0 | 0 | Тіло/хвіст | |
| 3 | НЕП | 14 років 1 міс | ж | 1998 | ДП | 0 | 0 | Хвіст | |
| 4 | Лімфома Ходжкіна | 7 років 5 міс | ч | 1998 | ДП | + | 0 | Хвіст | |
| 5 | Фібросаркома | 17 років 1 міс | ж | 2000 | ДП | 0 | 0 | Тіло | |
| 6 | Аденокарцинома | 15 років 7 міс | ж | 2000 | ДП | 0 | 0 | Тіло | |
| 7 | НЕП | 16 років 4 міс | ж | 2006 | Енуклеація | 0 | 0 | Хвіст | |
| 8 | НЕП | 16 років 4 міс | ч | 2011 | ДП | 0 | 0 | Хвіст | 17 міс після операції: метастаз в головной мозок, терапія ізотопом I-mIBG із подальшою хіміотерапією |
| 9 | СПП | 10 років 10 міс | ж | 2012 | ДП | 0 | 0 | Тіло/хвіст | |
| 10 | СПП | 15 років 9 міс | ж | 2012 | ДП | 0 | 0 | Тіло | |
| 11 | НЕП | 15 років 3 міс | ж | 2013 | ДП | 0 | 0 | Тіло/хвіст | 12 міс після операції: 3 метастази в печінку, виконана резекція печінки із подальшою хіміотерапією |
| 12 | СПП | 12 років 1 міс | ж | 2013 | ДП зі збереженням селезінки | 0 | 0 | Тіло | |
| 13 | Тератома | 1 років 9 міс | ч | 2013 | ПДР із резекцією ВБВ | 0 | 0 | Головка | |
| 14 | НЕП | 5 років 3 міс | ж | 2013 | ПДР | 0 | 0 | Головка | 11 міс після операції: 2 метастази в печінку, виконана РЧА із подальшою хіміотерапією |
| 15 | Цистаденома | 5 років 1 міс | ч | 2014 | ПДР зі збереженням пілоруса | 0 | 0 | Головка | |
| 16 | СПП | 13 років 10 міс | ж | 2014 | ДП зі збереженням селезінки | 0 | 0 | Хвіст | 5 діб після операції: дренування піддіафрагмального скупчення рідини під контролем ультразвукового дослідження |
| 17 | СПП | 13 років 7 міс | ж | 2015 | ПДР зі збереженням пілоруса | 0 | 0 | Головка | 14 діб після операції: гастростаз, медикаментозне лікування |
ВБВ — верхня брижова вена; ДП — дистальна панкреатектомія; ПДР — панкреатодуоденальна резекція; РЧА — радіочастотна абляція.
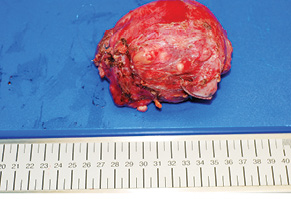
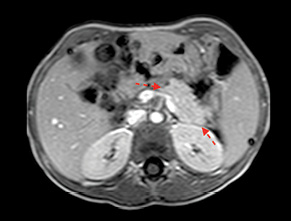
У 29,4% випадків пухлина містилася в головці ПЗ, в 41,2% — в тілі, в 29,4% — в хвості (рис. 1, 2). В 1 (5,8%) випадку у зв’язку з місцево-розповсюдженим процесом була виконана симптоматична операція — гастроентероанастомоз. Радикальне хірургічне лікування проведено в 16 (94,2%) випадках. У більшості хворих виконували дистальні резекції відповідно до локалізації пухлини в тілі або хвості ПЗ (рис. 3, 4). ПДР була виконана в 4 (23,5%) хворих, в одному випадку із резекцією верхньої мезентеріальної вени. Органозберігаючі операції проведено в 5 (31,3%) випадках із 16 радикальних втручань: в 1 (6,3%) — енуклеацію пухлини в зоні хвоста ПЗ, в 2 (12,5%) — ПДР зі збереженням пілоруса, ще в 2 (12,5%) — дистальні резекції ПЗ зі збереженням селезінки.
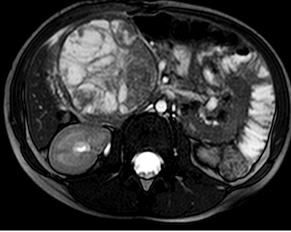
Не зареєстровано жодного випадку післяопераційної летальності. Післяопераційні ускладнення виявлено в 2 хворих: в одному випадку після ПДР розвинувся тривалий гастростаз протягом 14 діб, що потребувало медикаментозної корекції (I ступінь за шкалою Клав’єна — Діндо), у другому пацієнта через 5 діб після ДП діагностували скупчення рідини в лівому піддіафрагмальному просторі, що потребувало додаткового дренування під контролем ультразвукового дослідження (IIIа ступінь за шкалою Клав’єна — Діндо). Середній термін післяопераційного перебування в стаціонарі становив 14,7 доби (7–28 діб).
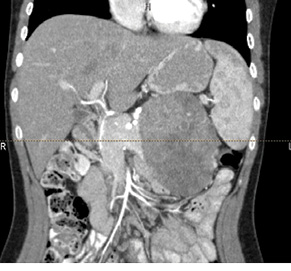
За результатами післяопераційного морфологічного дослідження встановлено у 5 (29,4%) випадках діагноз НЕП, ще 5 (29,4%) — СПП, у 2 (11,8%) — саркоми ПЗ (ангіосаркома та фібросаркома) та в одиничних випадках діагностовано протокову аденокарциному, тератому, цистаденому та лімфому Ходжкіна. У всіх пацієнтів при резекції ПЗ отримано чистий край — R0-резекцію.
Двоє хворих (11,8%) у післяопераційний період отримували додаткове ад’ювантне лікування: пацієнту із діагнозом лімфоми Ходжкіна проводили хіміотерапію та хворій із нерезектабельною ПБ — хіміопроменеву терапію.
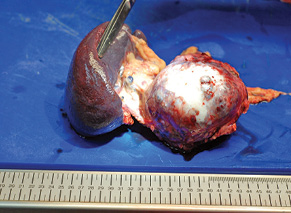
Медіана подальшого спостереження становила 114 міс (16–292 міс), значних пізніх функціональних порушень в екзокринній та ендокринній функціях ПЗ не виявлено. Жодних розладів у розвитку або нутритивному статусі дітей також не зафіксовано (рис. 5, 6).
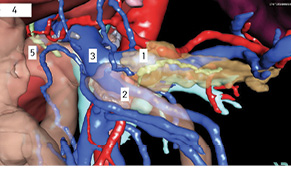
У 3 (17,6%) хворих діагностовано прогресування захворювання. У пацієнтки віком 5 років через 11 міс після ПДР з приводу НЕП головки ПЗ при контрольному обстеженні виявлено 2 новоутворення печінки розмірами 5 і 7 мм. Шляхом СORE-біопсії новоутворень отримано імуногістохімічне підтвердження їх метастатичного генезу, у пацієнтки проведено РЧА метастазів у печінці з подальшою хіміотерапією протягом 6 міс. Період подальшого спостереження становив 33 міс, пацієнтка жива без ознак продовження захворювання. У випадку НЕП в дитини віком 16 років через 17 міс після дистальної резекції ПЗ діагностовано метастази в головному мозку. Пацієнт отримав променеву терапію ізотопом I-mIBG у поєднанні з хіміотерапією. Час спостереження після променевої терапії становив 50 міс, на момент контролю пацієнт живий, подальшого прогресування не виявлено. У хворої 15 років після дистальної резекції ПЗ з приводу НЕП через 1 рік після первинної операції виявлено 3 метастази в печінці, у подальшому їй проведено атипові резекції печінки та 6 циклів хіміотерапії, період спостереження становив 32 міс. На момент останнього спостереження всі хворі живі.
Обговорення
У дітей ППЗ у більшості випадків мають гетерогенне походження та можуть розвиватися як з ендокринних, так і з екзокринних клітин [3, 4, 7]. Певні підтипи пухлин походять зі стовбурових клітин ПЗ та мають ознаки обох типів [18, 19]. У дорослих основні морфологічні підтипи ППЗ становлять протокова аденокарцинома та кістозні пухлини, в дітей — ПБ та СПП [7, 8]. Пухлини, що походять з ендокринних клітин, мають більш доброякісний перебіг, особливо інсуліноми, на відміну від пухлин з екзокринною етіологією, яким притаманний злоякісний перебіг в будь-якому віці [20].
За даними літератури, найчастішою серед ППЗ у дітей є СПП (60%), яка в дорослій популяції переважно виникає в жінок (80–90%). СПП часто характеризується низькою диференціацією [8, 21], проте дуже рідко метастазує в інші органи (10–15%). СПП в основному мають сприятливий прогноз, навіть при локальному розповсюдженні на великі судини [22–25]. У нашому дослідженні СПП діагностували майже в третині випадків, усі хворі були жіночої статі. Гістогенез СПП залишається остаточно нез’ясованим [18, 19, 24, 26–28], жодна з 3 епітеліальних клітинних ліній ПЗ не проявляє себе переконливо в цій пухлині. Для СПП характерна наявність фокального некрозу, іноді присутні кальцифікати [28, 29], частими є випадки внутрішньопухлинних крововиливів, що призводять до значної анемії, розривів пухлини з інтраабдомінальною кровотечею [28, 30]. Рівень альфа-фетопротеїну при СПП не виходить за межі норми [31]. У клітинах СПП іноді присутні рецептори естрогенів або прогестерону [18, 23, 24, 28].
Другою за розповсюдженістю серед ППЗ у дітей є ПБ. J.M. Kissane та співавтори [18] трактують обидва підтипи (СПП та ПБ) як «бластоми» та наполягають на спільному їх походженні від клітин-попередників ПЗ, але різного ступеня диференціювання. СПП описана на нижчій сходинці диференціації, ніж ПБ. Більшість дослідників вважають ці пухлини принципово різними [19, 24]. ПБ мають певні особливості: частіше виникають у хлопчиків, ніж у дівчаток, більшість хворих на момент встановлення діагнозу перебувають у віці молодше 10 років, ПБ є найбільш розповсюдженою пухлиною серед ППЗ у першій декаді життя [18, 19]. Поодинокі випадки ПБ у новонароджених іноді супроводжуються синдромом Беквіта — Відемана [32]. Лише в декількох публікаціях є дані про ПБ, що розвинулася в дорослому віці, та хворобі був притаманний більш агресивний перебіг [19]. ПБ походить із плюрипотентних клітин, що мають здатність до диференціювання в будь-яку з трьох ліній клітин ПЗ. Симптоматика та клінічний перебіг ПБ дуже схожі на ацинарно-клітинну карциному в дорослих, іноді морфологічна диференційна діагностика цих двох пухлин викликає значні труднощі. Серологічний показник альфа-фетопротеїну в більшості випадків підвищується в хворих на ПБ, що дозволяє в післяопераційний період використовувати зазначений маркер для раннього виявлення продовження хвороби. Проте поодинокі повідомлення свідчать про можливість відсутності віражу маркера на фоні наявних масивних метастазів, навіть при фіксації такого віражу у минулому, перед видаленням первинної пухлини [33]. Прогностична цінність альфа-фетопротеїну при ПБ досі не визначена.
Також слід зазначити про можливість виникнення ППЗ із неепітеліальних клітин ПЗ. Ці пухлини включають поодинокі випадки саркоми [34], лімфоми [35], тератоми [36]. НЕП — пухлини з клітин ПЗ, що виконують ендокринну функцію. За даними літератури [2], частота діагностування НЕП серед ППЗ становить 25%, в нашому дослідженні — 29,4%. НЕП належать до злоякісних пухлин, що можуть метастазувати у віддалені органи, та супроводжуються специфічними синдромами у разі, якщо пухлина гормонально активна. У випадку мультифокальної гіперваскулярної ППЗ, особливо у молодому віці, необхідно виключити генетичний MEN-1 синдром [7, 37].
Цистаденоми ПЗ (муцинозні, серозні) у ранньому віці виникають рідко, оскільки більшість доброякісних кіст ПЗ, які виявляють у дітей, є вродженими вадами розвитку, рідше пухлинами [34, 37]. J.L. Grosfeld та співавтори [34] встановили, що основні кістозні пухлини ПЗ (серозна цистаденома, муцинозна цистаденома та цистаденокарцинома), які більш характерні для дорослих, а саме жінок середнього віку, також можуть виникати в дітей. Проте не існує задокументованих випадків цистаденокарциноми в дитячому віці, за винятком декількох випадків цистаденоми, що були описані не дуже докладно, зі значними відмінностями від характеру цих пухлин у дорослих [18, 38–41]. Два випадки цистаденоми описано за наявності в хворого цитомегаловірусу [42, 43], в одному з них у подальшому пухлина трансформувалася в рабдоміосаркому [34], в другому були поєднані спадкові кістозні утворення легень [44], що більше характеризує «цистаденоми» ПЗ у дітей як прояви мальформацій, ніж неопластичний процес [40]. У нашому дослідженні спостерігали 1 випадок цистаденоми, що містилася в головці ПЗ у хлопчика віком 5 років. Наявність пухлини супроводжувалася періодичними кровотечами в просвіт великої панкреатичної протоки, що призвело до хронічної анемії, яка не піддавалася медикаментозній корекції протягом 1 року, пацієнту була виконана ПДР. Хворий перебуває під спостереженням 2 роки, без ознак захворювання.
Основним симптомом ППЗ у дітей є деформація пухлиною черевної стінки або біль [27]. Жовтяниця розвивається набагато рідше, ніж в дорослих [27], враховуючи той факт, що в ППЗ у дітей більш схильні до зовнішнього експансивного росту за межі залози, на відміну від інфільтративного росту при ППЗ у дорослих.
Найкращі результати лікування при ППЗ у дітей пов’язані з можливістю радикальної R0 резекції, але оптимальний обсяг резекції ПЗ залишається невизначеним [22]. Резидуальна пухлина, місцеві рецидиви, навіть віддалені метастази не завжди мають прямий вплив на віддалені результати лікування. Описано поодинокі спостереження тривалого життя хворих (>12 років) за відсутності будь-якого хірургічного лікування [7, 23, 24, 28]. Безумовно, у вищезгаданих випадках йдеться про пухлини, що характеризуються більш доброякісним перебігом. У більшості досліджень основним рекомендованим лікуванням є радикальна операція [24]. Слід зазначити про високу ефективність застосування хірургічної тактики у разі відносно резектабельних віддалених метастазів [10, 22, 24, 30].
У дослідженні D.C. Yu та співавторів [4] представлено високі показники післяопераційної летальності (41%) та післяопераційних ускладнень (45%). Ці дані пов’язані з наявністю супутніх захворювань у 5 із 7 хворих, що померли. Тому важливим є передопераційне мультидисциплінарне обговорення кожного клінічного випадку з метою виявлення ризиків хірургічного лікування з приводу ППЗ. Післяопераційна летальність та ускладнення залежать як від загального стану дитини та наявності супутніх захворювань, так і від рівня кваліфікації лікарів та технічного забезпечення клініки. У літературі продовжується дискусія з приводу оптимального місця проведення операції: спеціалізоване педіатричне відділення чи відділення хірургії ПЗ. R. Dasgupta та P.C. Kim [45] повідомляють, що операцію треба проводити у відділенні з кращим технічним забезпеченням. Автори відзначають, що рівень життя 5 пацієнтів віком молодше 1 року, яким виконано ПДР у педіатричному відділенні, був не гіршим за рівень життя пацієнтів, прооперованих у центрах, що спеціалізуються на хірургії ПЗ. В іншому дослідженні [46] описують суттєвий вплив на віддалені результати об’єму залишку паренхіми ПЗ. За даними літератури, мінімальний досвід роботи спеціалістів, які виконують операцію, повинен становити не менше 3 років [47]. Післяопераційні ускладнення після тотальної панкреатектомії пов’язані з відсутністю органа та меншою мірою залежать від досвіду чи кваліфікації лікарів, які виконували оперативне втручання, або оснащення відділення. Проведення операції фахівцями, які спеціалізуються на хірургії ПЗ, покращують віддалені результати [48]. Такі фактори, як спеціальне технічне забезпечення, наявність обладнання для інтервенційної рентгенохірургії, спеціалізована реанімація, є перевагами високоспеціалізованих центрів [49–51]. Для своєчасної діагностики порушень ендокринної та екзокринної функції ПЗ важливе довготривале спостереження за пацієнтом ендокринологами та гастроентерологами з метою своєчасної діагностики порушень ендокринної та екзокринної функції органа. Прогноз після хірургічного лікування з приводу ППЗ є варіабельним та залежить від гістологічного типу та чистоти краю резекції [2–4, 7, 8, 12].
Висновки
ППЗ у дітей характеризуються більш сприятливим перебігом, ніж у дорослих. Хірургічний метод є пріоритетним в терапії при ППЗ у дітей. Оперативне лікування новоутворень ПЗ у дітей слід проводити у високоспеціалізованих центрах, що мають досвід виконання аналогічних операцій у дорослих.
Список використаної літератури
1. Brecht I.B., Schneider D.T., Kloppel G. et al. (2011) Malignant pancreatic tumors in children and young adults: evaluation of 228 patients identified through the Surveillance, Epidemiology, and End Result (SEER) database. Klin. Padiatr., 223(6): 341–345.
2. Perez E.A., Gutierrez J.C., Koniaris L.G. et al. (2009) Malignant pancreatic tumors: incidence and outcome in 58 pediatric patients. J. Pediatr. Surg., 44(1): 197–203.
3. Luttges J., Stigge C., Pacena M. et al. (2004) Rare ductal adenocarcinoma of the pancreas in patients younger than age 40 years. Cancer, 100(1): 173–182.
4. Yu D.C., Kozakewich H.P., Perez-Atayde A.R. et al. (2009) Childhood pancreatic tumors: a single institution experience. J. Pediatr. Surg., 44(12): 2267–2272.
5. Lee S.E., Jang J.Y., Hwang D.W. et al. (2008) Clinical features and outcome of solid pseudopapillary neoplasm: differences between adults and children. Arch. Surg., 143(12): 1218–1221.
6. Marchegiani G., Crippa S., Malleo G. et al. (2011) Surgical treatment of pancreatic tumors in childhood and adolescence: uncommon neoplasms with favorable outcome. Pancreatol., 11(4): 383–389.
7. Shorter N.A., Glick R.D., Klimstra D.S. et al. (2002) Malignant pancreatic tumors in childhood and adolescence: The Memorial Sloan-Kettering experience, 1967 to present. J. Pediatr. Surg., 37(6): 887–892.
8. Park M., Koh K.N., Kim B.E. et al. (2011) Pancreatic neoplasms in childhood and adolescence. J. Pediatr. Hematol. Oncol., 33(4): 295–300.
9. Choi S.H., Kim S.M., Oh J.T. et al. (2006) Solid pseudopapillary tumor of the pancreas: a multicenter study of 23 pediatric cases. J. Pediatr. Surg., 41(12): 1992–1995.
10. Horisawa M., Niinomi N., Sato T. et al. (1995) Frantz’s tumor (solid and cystic tumor of the pancreas) with liver metastasis: successful treatment and long-term follow-up. J. Pediatr. Surg., 30(5): 724–726.
11. Yonekura T., Kosumi T., Hokim M. et al. (2006) Aggressive surgical and chemotherapeutic treatment of advanced pancreatoblastoma associated with tumor thrombus in portal vein. J. Pediatr. Surg., 41(3): 596–598.
12. Zampieri N., Schiavo N., Capelli P. et al. (2011) Pseudopapillary tumor in pediatric age: clinical and surgical management. Pediatr. Surg. Int., 27(12): 1271–1275.
13. Hamilton S.R., Aaltonen L.A. (2000) Pathology and genetics of tumours of the digestive system. Lyon: IARC Press; Oxford 320 p.
14. Dindo D., Demartines N., Clavien P.A. (2004) Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Ann. Surg., 240(2): 205–213.
15. Tan W.J., Kow A.W., Liau K.H. (2011) Moving towards the New International Study Group for Pancreatic Surgery (ISGPS) definitions in pancreaticoduodenectomy: a comparison between the old and new. HPB (Oxford), 13(8): 566–572.
16. Heuck A., Maubach P.A., Reiser M. et al. (1987) Age-related morphology of the normal pancreas on computed tomography. Gastrointest. Radiol., 12(1): 18–22.
17. Sugito K., Furuya T., Kaneda H. et al. (2012) Long-term follow-up of nutritional status, pancreatic function, and morphological changes of the pancreatic remnant after pancreatic tumor resection in children. Pancreas, 41(4): 554–559.
18. Kissane J.M. (1994) Pancreatoblastoma and solid and cystic papillary tumor: two tumors related to pancreatic ontogeny. Semin. Diagn. Pathol., 11(2): 152–164.
19. Klimstra D.S., Wenig B.M., Adair C.F. et al. (1995) Pancreatoblastoma. A clinicopathologic study and review of the literature. Am. J. Surg. Pathol., 19(12): 1371–1389.
20. Kissane J.M. (1975) Carcinoma of the exocrine pancreas: pathologic aspects. J. Surg. Oncol., 7(2): 167–174.
21. Ky A., Shilyansky J., Gerstle J. et al. (1998) Experience with papillary and solid epithelial neoplasms of the pancreas in children. J. Pediatr. Surg., 33(1): 42–44.
22. Todani T., Shimada K., Watanabe Y. et al. (1988) Frantz’s tumor: a papillary and cystic tumor of the pancreas in girls. J. Pediatr. Surg., 23(2): 116–121.
23. Mao C., Guvendi M., Domenico D.R. et al. (1995) Papillary cystic and solid tumors of the pancreas: a pancreatic embryonic tumor? Studies of three cases and cumulative review of the world’s literature. Surgery, 118(5): 821–828.
24. Klimstra D.S., Wenig B.M., Heffess C.S. (2000) Solid-pseudopapillary tumor of the pancreas: a typically cystic carcinoma of low malignant potential. Semin. Diagn. Pathol., 17(1): 66–80.
25. Ohata R., Okazaki T., Ishizaki Y. et al. (2010) Pancreaticoduodenectomy for pancreatoblastoma: a case report and literature review. Pediatr. Surg. Int., 26(4): 447–450.
26. Tsukimoto I., Watanabe K., Lin J.B. et al. (1973) Pancreatic carcinoma in children in Japan. Cancer, 31(5): 1203–1207.
27. Lack E.E., Cassady J.R., Levey R. et al. (1983) Tumors of the exocrine pancreas in children and adolescents. A clinical and pathologic study of eight cases. Am. J. Surg. Pathol., 7(4): 319–327.
28. Sclafani L.M., Reuter V.E., Coit D.G. et al. (1991) The malignant nature of papillary and cystic neoplasm of the pancreas. Cancer, 68(1): 153–158.
29. Friedman A.C., Lichtenstein J.E., Fishman E.K. et al. (1985) Solid and papillary epithelial neoplasm of the pancreas. Radiology, 154(2): 333–337.
30. Jaksic T., Yaman M., Thorner P. et al. (1992) A 20-year review of pediatric pancreatic tumors. J. Pediatr. Surg., 27(10): 1315–1357.
31. Jung S.E., Kim D.Y., Park K.W. et al. (1999) Solid and papillary epithelial neoplasm of the pancreas in children. World J. Surg., 23(3): 233–236.
32. Drut R., Jones M.C. (1988) Congenital pancreatoblastoma in Beckwith-Wiedemann syndrome: an emerging association. Pediatr. Pathol., 8(3): 331–339.
33. Defachelles A.S., Martin De Lassalle E., Boutard P. et al. (2001) Pancreatoblastoma in childhood: clinical course and therapeutic management of seven patients. Med. Pediatr. Oncol., 37(1): 47–52.
34. Grosfeld J.L., Vane D.W., Rescorla F.J. et al. (1990) Pancreatic tumors in childhood: analysis of 13 cases. J. Pediatr. Surg., 25(10): 1057–1062.
35. Eisenhuber E., Schoefl R., Wiesbauer P. et al. (2001) Primary pancreatic lymphoma presenting as acute pancreatitis in a child. Med. Pediatr. Oncol., 37(1): 53–54.
36. Das P.C., Radhakrishna K., Rao P.L. (1996) Cystic teratoma of the pancreas. Pediatr. Surg. Int., 11(2–3): 177–178.
37. O’Neill J.A. Jr. (2003) Principles of pediatric surgery. 2 edition. J.A. O’Neill Jr. et al., eds. St. Louis, Mo.; Great Britain: Mosby, 2004.
38. Gundersen A.E., Janis J.F. (1969) Pancreatic cystadenoma in childhood. Report of a case. J. Pediatr. Surg., 4(4): 478–481.
39. Gille P., Barbier G., Leclerc D. et al. (1972) Pancreatic cystadenoma in a 2-year-old child. Ann. Chir. Infant., 13(6): 437–442.
40. Warfel K.A., Faught P.R., Hull M.T. (1988) Pancreatic cystadenoma in an infant: ultrastructural study. Pediatr. Pathol., 8(5): 559–565.
41. Jenkins J.M., Othersen H.B. Jr. (1992) Cystadenoma of the pancreas in a newborn. J. Pediatr. Surg., 27(12): 1569.
42. Chang C.H., Perrin E.V., Hertzler J. et al. (1980) Cystadenoma of the pancreas with cytomegalovirus infection in a female infant. Arch. Pathol. Lab. Med., 104(1): 7–8.
43. Amir G., Hurvitz H., Neeman Z. et al. (1986) Neonatal cytomegalovirus infection with pancreatic cystadenoma and nephrotic syndrome. Pediatr. Pathol., 6(4): 393–401.
44. Murphy J.J., Blair G.K., Fraser G.C. et al. (1992) Rhabdomyosarcoma arising within congenital pulmonary cysts: report of three cases. J. Pediatr. Surg., 27(10): 1364–1367.
45. Dasgupta R., Kim P.C. (2005) Relationship between surgical volume and clinical outcome: should pediatric surgeons be doing pancreaticoduodenectomies? J. Pediatr. Surg., 40(5): 793–796.
46. Birkmeyer J.D., Siewers A.E., Finlayson E.V. et al. (2002) Hospital volume and surgical mortality in the United States. N. Engl. J. Med., 346(15): 1128–1137.
47. Dimick J.B., Welch H.G., Birkmeyer J.D. (2004) Surgical mortality as an indicator of hospital quality: the problem with small sample size. JAMA, 292(7): 847–851.
48. Tseng J.F., Pisters P.W., Lee J.E. et al. (2007) The learning curve in pancreatic surgery. Surgery, 141(5): 694–701.
49. Mabrut J.Y., Fernandez-Cruz L., Azagra J.S. et al. (2005) Laparoscopic pancreatic resection: results of a multicenter European study of 127 patients. Surgery, 137(6): 597–605.
50. Melotti G., Butturini G., Piccoli M. et al. (2007) Laparoscopic distal pancreatectomy: results on a consecutive series of 58 patients. Ann. Surg., 246(1): 77–82.
51. Butturini G., Partelli S., Crippa S. et al. (2011) Perioperative and long-term results after left pancreatectomy: a single-institution, non-randomized, comparative study between open and laparoscopic approach. Surg. Endosc., 25(9): 2871–2878.
Хирургическое лечение при опухолях
поджелудочной железы у детей
Резюме. Злокачественные новообразования поджелудочной железы (ПЖ) у детей возникают редко. Тактика лечения при опухолях поджелудочной железы (ОПЖ) является неопределенной, поскольку большинство данных в публикациях представлены отдельными клиническими случаями. Целью нашего исследования было оптимизировать лечение при ОПЖ у детей, исходя из собственного опыта и данных мировой литературы. Проведен анализ результатов лечения при ОПЖ у детей в Национальном институте рака с 1990 по 2016 г. В этот период 17 пациентов в возрасте до 18 лет были прооперированы по поводу ОПЖ. Радикальное (R0) хирургическое лечение проведено у 16 (94,2%) больных. У 11 (64,7%) пациентов выполнили дистальные резекции в соответствии с локализацией опухоли в теле или хвосте ПЖ. Панкреатодуоденальная резекция (ПДР) проведена у 4 (23,5%) больных. Органосохраняющие операции выполнены в 5 (31,3%) случаях: в 1 (6,2%) — энуклеация опухоли в зоне хвоста ПЖ, в 2 (12,5%) — ПДР с сохранением привратника, еще в 2 (12,5%) — дистальные резекции ПЖ с сохранением селезенки. Не зарегистрировано ни одного случая послеоперационной летальности. Послеоперационные осложнения зарегистрировали у 2 (12,5%) больных, что потребовало дополнительного лечения. Медиана послеоперационного наблюдения составила 114 мес (16–292 мес), значительных поздних функциональных нарушений в экзокринной и эндокринной функциях ПЖ не выявлено. На момент последнего наблюдения все больные живы. ОПЖ у детей характеризуються более благоприятным исходом, чем у взрослых. Хирургический метод является приоритетным в лечении при ОПЖ у детей. Оперативное лечение новообразований ПЖ у детей следует проводить в высокоспециализированных центрах, имеющих опыт выполнения аналогичных операций у взрослых.
злокачественные новообразования поджелудочной железы, хирургическое лечение
Адреса:
Лукашенко Андрій Володимирович
02033, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: mail.onco@gmail.com














Leave a comment