Мутації гена NOTCH1 при хронічній лімфоцитарній лейкемії
Билоус Н.И.1, Абраменко И.В.1, Чумак А.А.1, Крячок І.А.2
- 1ДУ «Національний науковий центр радіаційної медицини Національної академії медичних наук України», Київ
- 2Національний інститут раку, Київ
Резюме. У статті представлено сучасні дані щодо впливу мутацій гена NOTCH1 на розвиток хронічної лімфоцитарної лейкемії: їх розповсюдженість, методи виявлення, асоціація з клінічним перебігом захворювання, прогностичне значення та нові підходи до терапії хворих з мутаціями.Роль мутацій гена NOTCH1 в патогенезі хронічної лімфоцитарної лейкемії

РОЛЬ МУТАЦІЙ ГЕНА NOTCH1 В ПАТОГЕНЕЗІ ХРОНІЧНОЇ ЛІМФОЦИТАРНОЇ ЛЕЙКЕМІЇ
Хронічна лімфоцитарна лейкемія (ХЛЛ) В-клітинного походження належить до найпоширеніших злоякісних новоутворень кровотворної системи дорослого населення України. Механізми, які призводять до появи клону трансформованих клітин, остаточно не з’ясовані. Описано мутації низки генів, зокрема гена NOTCH1, регулятора сплайсингу мРНК гена SF3B1, генів — супресорів пухлинного росту TP53 та ATM, регуляторів передачі сигналу через В-клітинний рецептор (MYD88, BIRC3, NFKBIE) [1–4].
Мутації гена NOTCH1 належать до таких, що можуть виникати вже на ранніх стадіях розвитку злоякісно трансформованих лімфоцитів при ХЛЛ. Вони були виявлені в популяції CD34+CD19− клітин-попередників у хворих на ХЛЛ, а також у пацієнтів із моноклональним В-лімфоцитозом [5, 6]. Таким чином, їх вважають ранніми драйверами розвитку пухлинного клону.
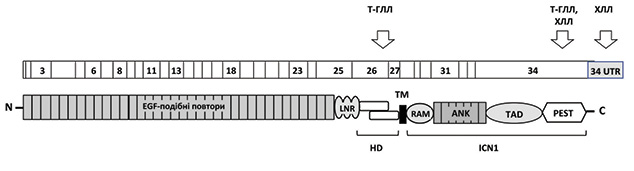
Родина NOTCH рецепторів складається з чотирьох трансмембранних білків із дуже подібними структурними характеристиками (NOTCH1–4). Вони містять зовнішньоклітинну субодиницю, яка опосередковує зв’язування лігандів, та внутрішньоклітинну субодиницю (intracellular NOTCH — ICN), що забезпечує передачу сигналу [7]. На клітинній мембрані NOTCH рецептори представлені у формі гетеродимерів, в яких зовнішньо- і внутрішньоклітинні частини нековалентно зв’язані за допомогою гетеродимеризаційного домену (HD) (рис. 1). Формування гетеродимерних форм при дозріванні рецептора відбувається в трансвідділі апарату Гольджі та опосередковується фуриновими протеазами, які зумовлюють розщеплення попередника білка р300 на два фрагменти (р120 і р200) [8].
Лігандами NOTCH рецепторів є білки родин Jagged та Delta/Serrate, які експресуються на мембранах клітин мікрооточення та безпосередньо на лейкемічних клітинах ХЛЛ. При зв’язуванні ліганда відбуваються конформаційні зміни, що дестабілізують HD і запускають реакції протеолітичного розщеплення рецептора. Відбувається видалення зовнішньоклітинної частини за участю металопротеаз родини ADAM та розщеплення внутрішньоклітинної частини рецептора за допомогою комплексу γ-секретази, що призводить до вивільнення активного ICN в цитоплазму і наступного його переміщення до ядра клітини. В ядрі утворюється транскрипційний комплекс, що включає ICN, фактор транскрипції CBF1/RBP-Jk та низку коактиваторів. Цей транскрипційний комплекс активує CBF1-залежні гени-мішені, включаючи модулятори транскрипції HES1 (Hairy Enhancer of Split 1) та HES-споріднені білки (HEY), онкоген с-MYC, р21, Cyclin D1, BCL2, Deltex1, NF-κB2 [9–12].
У нормальних фізіологічних умовах активація NOTCH є транзиторною і швидко припиняється шляхом убіквітинзалежної протеасомальної деградації активного ICN, що опосередковується убіквітинлігазою FBXW7 (F-box protein). FBXW7 зв’язується з С-кінцевою ділянкою ICN, а саме PEST доменом [пролін (P)-, глутамінова кислота (E)-, серин (S)- та треонін (T)-збагачена послідовність]. Таким чином, PEST домен є критично важливим для припинення NOTCH-індукованої активації транскрипції генів [13].
NOTCH-залежний сигнальний шлях — еволюційно висококонсервативна система, яка опосередковує взаємодію клітин з елементами мікрооточення і бере участь у контролі процесів диференціювання, проліферації та апоптозу в клітинах різного походження, зокрема гемопоетичних. Його дерегуляція є важливим елементом злоякісної трансформації, при цьому більшість генетичних аберацій визначається в гені NOTCH1 [14–17].
На початку 2000-х років ідентифіковано активуючі мутації гена NOTCH1 у клітинах Т-ГЛЛ [18]. У більшості випадків вони локалізуються в HD і в PEST доменах. Мутації в HD домені (екзони 26 і 27) виявляються приблизно у 40% випадків Т-ГЛЛ і призводять до дестабілізації взаємодії між N- і С-термінальною субодиницями рецептора і, як наслідок, до ліганднезалежної його активації. Мутації в PEST послідовності (екзон 34) наявні у 15% випадків Т-ГЛЛ і проявляються як часткова або повна делеція цієї ділянки у складі NOTCH1. При цьому мутований NOTCH1 набуває резистентності до опосередкованої убіквітинлігазою FBXW7 протеасомальної деградації, його період напіврозпаду подовжується вдвічі, а транскрипційна активність значно збільшується, що зумовлює проліферацію пухлинного клону клітин [15, 19].
Активуючі мутації в PEST домені гена NOTCH1 у хворих на В-клітинну ХЛЛ виявлено вперше у 2011 р. [1]. Частота мутацій становила 8,3% у пацієнтів, обстежених на момент діагнозу, 20,8% — у хворих, резистентних до терапії пуриновими аналогами, і 31% — в осіб з синдромом Ріхтера.
При подальшому дослідженні клінічного значення NOTCH1 мутацій на більшій когорті хворих на ХЛЛ (539 осіб) встановлено, що мутації NOTCH1 переважно притаманні пацієнтам з трисомією 12-ї хромосоми і практично відсутні у хворих з мутаціями гена ТР53 [20].
Методи виявлення мутацій гена NOTCH1
У хворих на ХЛЛ більшість мутацій в гені NOTCH1 представлені делецією двох нуклеотидів (c.7544_7545delCT; p.Pro2514ArgfsX4) у послідовності 34-го екзона, що кодує PEST домен. Як наслідок, утворюється стоп-кодон, що призводить до появи білка NOTCH1, позбавленого PEST домену [2, 20]. Так, за даними S. Jeromin та співавторів [21], серед 122 виявлених мутацій у 908 хворих на ХЛЛ 109 були локалізовані у PEST домені, а у 80 пацієнтів була присутня типова делеція c.7544_7545delCT. Результатом інших описаних мутацій також була втрата PEST домену через утворення стоп-кодонів (19 випадків) або зсуву рамки зчитування (9 випадків); у 14 випадках відбувалися амінокислотні заміни, що впливали на функціональні властивості білка. Такі мутації траплялися тільки в поодиноких випадках, лише окремі мутації (наслідком всіх, за винятком останньої, було утворення стоп-кодону) були присутні у декількох хворих: p.Gln2459X (4 випадки); p.Gln2503X (3 випадки); p.Gln2406X, p.Gln2444X та p.Leu2457Val (по 2 випадки кожна).
У дослідженні X.S. Puente та співавторів [22] встановлено новий механізм утворення NOTCH1 білка із втраченим PEST доменом. Автори виявили мутації в 3′UTR-некодуючому регіоні гена NOTCH1, які призводять до появи сайту альтернативного сплайсингу мРНК і, як наслідок, делеції значної частини 34-го екзона, в тому числі й кодуючої ділянки PEST домену. Частота таких мутацій незначна: при обстеженні 506 пацієнтів методом секвенування вони були знайдені у 13 (2,6%) осіб, причому у 11 випадках була присутня мутація с.139390152T>C.
Враховуючи значну частоту делеції c.7544_7545delCT, для виявлення переважної більшості хворих, лейкемічні клітини яких мають мутації гена NOTCH1, запропоновано метод алельспецифічної полімеразної ланцюгової реакції (ПЛР), що не потребує проведення більш складного секвенування ДНК [1]. На рис. 2, 3 представлено власні результати детекції мутації c.7544_7545delCT гена NOTCH1 цим методом та їх підтвердження методикою прямого секвенування. Крім того, нами запропоновано метод виявлення делецій c.7544_7545delCT за допомогою ПЛР у реальному часі з використанням інтеркалюючого барвника SYBR Green, який має певні переваги над алельспецифічною ПЛР, а також новий підхід до виявлення мутації с.139390152T>C методом ПЛР з рестрикцією отриманих продуктів реакції.
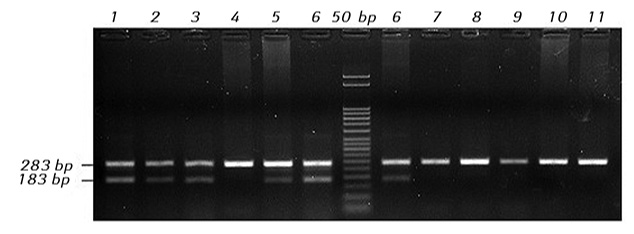
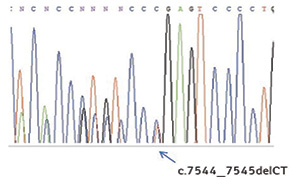
Таким чином, різні ПЛР-базовані методи дозволяють дослідити найбільш поширені мутації гена NOTCH1 у «гарячих» точках. Детекція всіх ймовірних мутацій потребує застосування секвенування ділянки гена або використання мультиплексного варіанта ПЛР з наступним фрагментним аналізом [23].
Прогностичне значення мутацій гена NOTCH1
Мутації гена NOTCH1 при ХЛЛ, за даними більшості дослідників, асоційовані з несприятливими біологічними і клінічними характеристиками:
- при встановленні діагнозу: пролонгованою стадією захворювання, вищим ініціальним лейкоцитозом, більш вираженою лімфаденопатією, іншими маркерами несприятливого перебігу (немутований статус генів імуноглобулінів, IGHV; висока експресія антигенів CD38 і ZAP-70);
- коротшими періодами до початку терапії (time to treatment — ТТТ) та безрецидивної виживаності (progression-free survival — PFS);
- підвищеною частотою трансформації Ріхтера.
Так, у дослідженні S. Chiaretti та співавторів [24] при обстеженні 163 первинних хворих на ХЛЛ мутації гена NOTCH1 (c.7544_7545delCT) були знайдені у 15,9% випадків. Їх наявність асоціювалася з немутованим статусом генів IGHV (р=0,0001), високим рівнем експресії антигенів CD38 і ZAP-70 (р=0,0025 і р=0,026 відповідно), трисомією 12-ї хромосоми (р=0,0028) та тенденцією до скорочення періоду ТТТ (р=0,058).
При обстеженні більшої кількості раніше не лікованих хворих (391 пацієнт) NOTCH1 мутації були присутні на клональному рівні у 14,2% та субклональному — у 7,6% випадків (у цілому — 21,8%). Усі виявлені мутації були локалізовані у 34-му екзоні (80,5% з них були представлені делецією c.7544_7545delCT), або в 3′UTR регіоні. Клональні та субклональні мутації призводили до скорочення періоду ТТТ: протягом першого року спостереження терапія була призначена 74% пацієнтів із клональними мутаціями, 69% — із субклональними мутаціями і тільки 34% — без наявності мутацій. Водночас на тривалість загальної виживаності впливали тільки клональні мутації гена NOTCH1 (р=0,001), але не субклональні (р=0,94) [25].
Практично такі самі дані отримано і в дослідженні S. Weissmann та співавторів [26]: мутації гена NOTCH1 були асоційовані з немутованим статусом IGHV генів (4,5% — при мутованому статусі проти 23,7% — у хворих із немутованим статусом IGHV генів; р=0,001), трисомією 12-ї хромосоми (34,2% проти 10%; р=0,001), скороченням періоду ТТТ (медіана 3,6 року порівняно з медіаною 7,5 року у хворих без мутацій; р=0,005).
Крім того, встановлено, що частота мутацій гена NOTCH1 підвищена у хворих із трансформацією Ріхтера [27].
Скорочення загальної виживаності за наявності мутації гена NOTCH1 було встановлено у вже цитованій роботі [25], а також у рандомізованому дослідженні порівняння прийому хлорамбуцилу і флударабіну з або без циклофосфаміду у раніше не лікованих хворих, яке проводилося у Великій Британії (UK LRF CCL4): медіана загальної виживаності становила 54,8 міс порівняно з 74,6 міс у хворих без мутацій (р=0,02) [28]. Однак в іншому дослідженні (CLL8) це не знайшло підтвердження [29].
Підсумовуючи отримані дані, C.S. Zent і W.R. Burack [30] запропонували проведення стратифікації хворих на групи ризику залежно від молекулярно-генетичних ознак лейкемічних клітин. До групи високого ризику віднесено пацієнтів із ХЛЛ із делеціями 17р13 хромосоми, мутаціями гена ТР53, делецією 11q22 хромосоми та мутаціями гена АТМ (усі порушують механізми репарації ДНК); до групи високого/проміжного ризику — хворих з немутованим статусом IGHV генів, стереотипією В-клітинного рецептора, експресією гена IGHV3-21 та мутаціями генів NOTCH1, BIRC3, SF3B1 (активація передачі внутрішньоклітинних сигналів, порушення процесингу мРНК); до групи низького ризику — пацієнтів з відсутністю вищеперелічених ознак.
Підходи до терапії хворих на ХЛЛ за умов наявності мутацій гена NOTCH1
Важливим наслідком наявності в лейкемічних клітинах мутацій гена NOTCH1 є зниження рівня експресії на поверхневих мембранах клітин антигена CD20. Внутрішньоклітинний домен NOTCH1, як зазначалося, активує транскрипцію генів-мішеней в комплексі з транскрипційним фактором RBP-Jk (Recombining Binding Protein suppressor of hairless), який також може зв’язувати гістон-деацетилази (histone deacetylases — HDACs) — ферменти, що каталізують видалення ацетилових груп з e-N-ацетил-лізину гістонів. Гіпоацетилювання гістонів призводить до зменшення проміжку між нуклеосомою та ДНК, що утруднює приєднання транскрипційних факторів до ДНК і, таким чином, пригнічує експресію генів. У випадках, коли транскрипційний комплекс ICN1-RBP-Jk персистує, значна кількість HDACs, не асоційованих з RBP-Jk, зв’язується з промотором гена CD20. Такий механізм запропонували F. Pozzo та співавтори для пояснення зниженої експресії CD20 у клітинах хворих на ХЛЛ з мутаціями гена NOTCH1 [31]. За даними дослідників, застосування інгібіторів HDACs підвищує експресію CD20 в клітинах при ХЛЛ.
Низька експресія CD20 за наявності мутацій гена NOTCH1 пояснює знижену чутливість лейкемічних клітин до лізису, опосередкованого анти-CD20-моноклональними антитілами (МкАТ), та відсутність ефекту у хворих від призначення анти-CD20-МкАТ як доповнення до схеми флударабін-циклофосфамід або терапії хлорамбуцилом [29, 32, 33].
Водночас це спонукало дослідників до розробки нових підходів до терапії хворих на ХЛЛ з мутаціями гена NOTCH1. Одним із них є використання інгібіторів γ-секретази, необхідної для утворення транскрипційно активного внутрішньоклітинного домену білка NOTCH1 — ICN1 [34]. Інші механізми вірогідного впливу: порушення дозрівання NOTCH1 рецептора у ендоплазматичному ретикулумі (застосування інгібіторів Са2+-АТФаз сарко-/ендоплазматичного ретикулума); пригнічення активності металопротеїнази ADAM10, що видаляє зовнішньоклітинну частину NOTCH1 рецептора при зв’язуванні з лігандом; пряма інгібіція активності NOTCH1-опосередкованого транскрипційного комплексу за допомогою високоспецифічного пептиду SAHM1 [35–37].
Таким чином, визначення мутаційного статусу гена NOTCH1 при ХЛЛ може використовуватися як:
- прогностичний маркер;
- предиктивний маркер відповіді на терапевтичні схеми із застосуванням анти-CD20-МкАТ;
- ідентифікація пацієнтів, в терапії яких можуть бути застосовані інгібітори NOTCH1-залежного сигнального шляху.
Список використаної літератури
1. Fabbri G., Rasi S., Rossi D. et al. (2011) Analysis of the chronic lymphocytic leukemia coding genome: Role of NOTCH1 mutational activation. J. Exp. Med., 208(7): 1389–1401.
2. Puente X.S., Pinyol M., Quesada V. et al. (2011) Whole-genome sequencing identifies recurrent mutations in chronic lymphocytic leukaemia. Nature, 475(7354): 101–105.
3. Wang L., Lawrence M.S., Wan Y. et al. (2011) SF3B1 and other novel cancer genes in chronic lymphocytic leukemia. N. Engl. J. Med., 365(26): 2497–2506.
4. Quesada V., Conde L., Villamor N. et al. (2011) Exome sequencing identifies recurrent mutations of the splicing factor SF3B1 gene in chronic lymphocytic leukemia. Nat. Genet., 44(1): 47–52.
5. Quijada-Alamo M., Hernandez-Sanchez M., Robledo C. et al. (2017) Next-generation sequencing and FISH studies reveal the appearance of gene mutations and chromosomal abnormalities in hematopoietic progenitors in chronic lymphocytic leukemia. J. Hematol. Oncol., 10(1): 83.
6. Fabbri G., Dalla-Favera R. (2016) The molecular pathogenesis of chronic lymphocytic leukemia. Nat. Rev. Cancer, 16(3): 145–162.
7. Hori K., Sen A., Artavanis-Tsakonas A. (2013) Notch signaling at a glance. J. Cell Sci., 126(10): 2135–2140.
8. Logeat F., Bessia C., Brou C. et al. (1998) The Notch1 receptor is cleaved constitutively by a furin-like convertase. Proc Nat. Acad Sci., 95 (14): 8108–8112.
9. Fleming R.J., Hori K., Sen A. et al. (2013) An extracellular region of Serrate is essential for ligand-induced cis-inhibition of Notch signaling. Development, 140(9): 2039–2049.
10. Previs R.A., Coleman R.L., Harris A.L., Sood A.K. (2015) Molecular pathways: translational and therapeutic implications of the Notch signaling pathway in cancer. Clin. Cancer Res., 21(5): 955–961.
11. Ronchini C., Capobianco A.J. (2001) Induction of cyclin D1 transcription and CDK2 activity by Notch(ic): implication for cell cycle disruption in transformation by Notch(ic). Mol. Cell. Biol., 21(17): 5925–5934.
12. Oswald F., Liptay S., Adler G., Schmid R.M. (1998) NF-κB2 is a putative target gene of activated Notch-1 via RBP-Jκ. Mol. Cell Biol., 18(4): 2077–2088.
13. Wang Z., Inuzuka H., Zhong J. et al. (2012) Tumor suppressor functions of FBXW7 in cancer development and progression. FEBS Lett., 586(10): 1409–1418.
14. Palomero T., Ferrando A. (2008) Oncogenic NOTCH1 control of MYC and PI3K: challenges and opportunities for anti-NOTCH1 therapy in T-cell acute lymphoblastic leukemias and lymphomas. Clin. Cancer Res., 14(17): 5314–5317.
15. Paganin M., Ferrando A. (2011) Molecular pathogenesis and targeted therapies for NOTCH1-induced T-cell acute lymphoblastic leukemia. Blood Rev., 25(2): 83–90.
16. Gianfelici V. (2012) Activation of the NOTCH1 pathway in chronic lymphocytic leukemia. Haematologica, 97(3): 328–330.
17. Gu Y., Masiero M., Banham A.H. (2016) Notch signaling: its roles and therapeutic potential in hematological malignancies. Oncotarget, 7(20): 29804–29823.
18. Weng A.P., Ferrando A.A., Lee W. et al. (2004) Activating mutations of NOTCH1 in human T cell acute lymphoblastic leukemia. Science, 306(5694): 269–271.
19. Wang K., Zhang Q., Li D. et al. (2015) PEST domain mutations in Notch receptors comprise an oncogenic driver segment in triple-negative breast cancer sensitive to g-secretase inhibitor. Clin. Cancer Res., 21(6): 1487–1496.
20. Rossi D., Rasi S., Fabbri G. et al. (2012) Mutations of NOTCH1 are an independent predictor of survival in chronic lymphocytic leukemia. Blood, 119(2): 521–529.
21. Jeromin S., Weissmann S., Haferlach C. et al. (2014) SF3B1 mutations correlated to cytogenetics and mutations in NOTCH1, FBXW7, MYD88, XPO1 and TP53 in 1160 untreated CLL patients. Leukemia, 28(1): 108–117.
22. Puente X.S., Beà S., Valdés-Mas R. et al. (2015) Non-coding recurrent mutations in chronic lymphocytic leukaemia. Nature, 526(7574): 519–524.
23. Campregher P.V., Petroni R.C., Muto N.H. et al. (2016) A novel assay for the identification of NOTCH1 PEST domain mutations in chronic lymphocytic leukemia. Biomed. Res. Int., 2016: 4247908.
24. Chiaretti S., Marinelli M., Del Giudice I. et al. (2014) NOTCH1, SF3B1, BIRC3 and TP53 mutations in patients with chronic lymphocytic leukemia undergoing first-line treatment: correlation with biological parameters and response to treatment. Leuk. Lymphoma, 55(12): 2785–2792.
25. Nadeu F., Delgado J., Royo C. et al. (2016) Clinical impact of clonal and subclonal TP53, SF3B1, BIRC3, NOTCH1, and ATM mutations in chronic lymphocytic leukemia. Blood, 127 (17): 2122–2130.
26. Weissmann S., Roller A., Jeromin S. et al. (2013) Prognostic impact and landscape of NOTCH1 mutations in chronic lymphocytic leukemia (CLL): a study on 852 patients. Leukemia, 27 (12): 2393–2396.
27. Fabbri G., Khiabanian H., Holmes A.B. et al. (2013) Genetic lesions associated with chronic lymphocytic leukemia transformation to Richter syndrome. J. Exp. Med., 210(11): 2273–2288.
28. Oscier D.G., Rose-Zerilli M.J., Winkelmann N. et al. (2013) The clinical significance of NOTCH1 and SF3B1 mutations in the UK LRF CLL4 trial. Blood, 21(3): 468–475.
29. Stilgenbauer S., Schnaiter A., Paschka P. et al. (2014) Gene mutations and treatment outcome in chronic lymphocytic leukemia: results from the CLL8 trial. Blood, 123(21): 3247–3254.
30. Zent C.S., Burack W.R. (2014) Mutations in chronic lymphocytic leukemia and how they affect therapy choice: focus on NOTCH1, SF3B1, and TP53. Hematology Am. Soc. Hematol. Educ. Program, 2014(1): 119–124.
31. Pozzo F., Bittolo T., Arruga F. et al. (2016) NOTCH1 mutations associate with low CD20 level in chronic lymphocytic leukemia: evidence for a NOTCH1 mutation-driven epigenetic dysregulation. Leukemia, 30(1): 182–189.
32. Bo M.D., Del Principe M.I., Pozzo F. et al. (2014) NOTCH1 mutations identify a chronic lymphocytic leukemia patient subset with worse prognosis in the setting of a rituximab-based induction and consolidation treatment. Ann. Hematol., 93(10): 1765–1774.
33. Tausch E., Beck P., Schlenk R.F. et al. (2013) NOTCH1 mutation and treatment outcome in CLL patients treated with chlorambucil (Chl) or ofatumumab-Chl (O-Chl): results from the phase III study complement 1 (OMB110911). Blood, 122 (21): 527.
34. Lopez-Guerra M., Xargay-Torrent S., Rosich L. et al. (2015) The g-secretase inhibitor PF-03084014 combined with fludarabine antagonizes migration, invasion, and angiogenesis in NOTCH1-mutated CLL cells. Leukemia, 29 (1): 96–106.
35. Moellering R.E., Cornejo M., Davis T.N. et al. (2009) Direct inhibition of the NOTCH transcription factor complex. Nature, 462 (7270): 182–188.
36. Sanchez-Martin M., Ferrando A. (2017) The NOTCH1-MYC highway toward T-cell acute lymphoblastic leukemia. Blood, 129(9): 1124–1133.
37. van Tetering G., van Diest P., Verlaan I. et al. (2009) Metalloprotease ADAM10 is required for Notch1 site 2 cleavage. J. Biol. Chem., 284 (45): 31018–31027.
Мутации гена NOTCH1 при хронической лимфоцитарной лейкемии
ГУ «Национальный научный центр радиационной медицины Национальной академии медицинских наук Украины», Киев
Национальный институт рака, Киев
Резюме. В статье представлены современные данные о влиянии мутаций гена NOTCH1 на развитие хронической лимфоцитарной лейкемии: частота их встречаемости, методы обнаружения, ассоциация с клиническим течением заболевания, прогностическое значение и новые подходы к терапии больных с мутациями.
хроническая лимфоцитарная лейкемия, мутации гена NOTCH1, ингибиторы γ-секретазы.
Адреса:
Білоус Надія
04050, Київ, вул. Мельникова, 53
ДУ «Національний науковий центр радіаційної медицини НАМН України»
Тел.: (044) 452-00-24
E-mail: nbilous@yahoo.com














Leave a comment