Огляд IV видання Японських рекомендацій з лікування раку шлунка
Лукашенко А.В., Бойко А.В., Розумейко И.В., Кошубарова М.В.
Резюме. Рак шлунка (РШ) займає верхні сходинки в структурі смертності від онкологічних захворювань. Шлунок — п’ята за частотою локалізація раку в світі, злоякісні утворення шлунка — третя причина смерті від онкологічної патології. РШ відносять до пухлин поганого прогнозу. У більшості первинних хворих виявляють неоперабельний РШ, ризик рецидивів є високим навіть при лікуванні у ранніх стадіях. Захворюваність на РШ в Україні залишається високою, смертність до року становить 59,4%. Превалювання захворюваності на РШ в Японії і, відповідно, великий досвід японських хірургів порівняно із західним світом, де в більшості країн, до яких належать і США, ця нозологічна одиниця є рідким захворюванням, є підставою до публікації огляду IV англомовного видання Японських рекомендацій з лікування раку шлунка. Представлені рекомендації базовані на результатах рандомізованих досліджень та рішень консенсусів професійних асоціацій. У IV виданні удосконалено процедури діагностики РШ, методи візуалізації та підходи до лікування. У визначенні оптимального лікувального плану повинні бути задіяні лікарі різних дисциплін, хірургія — єдиний метод радикального лікування при локалізованому РШ. При розповсюдженому захворюванні ад’ювантна або неоад’ювантна терапія зазвичай застосовується в поєднанні з хірургічним втручанням. При віддалених метастазах РШ результати лікування залишаються поганими, середня тривалість життя не перевищує 1 року. Основними змінами в цій версії рекомендацій є перегляд розділу про типи операцій і визначення оптимального обсягу резекції шлунка, вперше лапароскопічна дистальна субтотальна резекція при I стадії РШ рекомендована як операція вибору, зроблено перегляд рекомендацій до радикальної ендоскопічної резекції при ранньому РШ. Японською асоціацією раку шлунка розроблено IV видання рекомендацій з метою забезпечити загальну основу для розуміння проблеми РШ серед фахівців, пацієнтів та їхніх сімей, оптимізації вибору належного лікування.

У роботі ми представляємо огляд IV видання Японських рекомендацій з лікування раку шлунка (Japanese Gastric Cancer Treatment Guidelines). Це англійське видання було розроблене на основі японської версії, опублікованої в 2014 р. Рекомендації базовані на огляді даних літератури із додатковими коментарями та новими посиланнями, що ґрунтуються на результатах сучасних досліджень.
При розробці цієї версії клінічних рекомендацій створено декілька робочих груп, кожній з яких було доручено вирішення одного з таких питань, як:
1) обсяг операції та лімфодисекції при раку шлунково-стравохідного переходу;
2) клінічні особливості перебігу раку шлунка (РШ);
3) алгоритм післяопераційного спостереження;
4) лікування резектабельного метастатичного РШ;
5) розрахунок ризику хірургічного втручання;
6) лікування раку кукси шлунка.
Із наведених вище питань консенсусу було досягнуто за першими трьома пунктами, робочі групи зазначили про необхідність подальших досліджень для узгодження за останніми двома темами. Вагоме клінічне значення четвертої теми та відсутність переконливих доказів, пов’язаних із цим розділом, спонукало комітет провести більш докладне обговорення, щоб забезпечити попередні відповіді на важливі клінічні питання про резектабельний метастатичний РШ.
Основні пункти перегляду в поточній версії:
1. Зміни у розділі про термінологію хірургічних втручань при РШ.
2. Надано алгоритм, вибір обсягу лімфодисекції при раку шлунково-стравохідного сполучення при розмірах пухлини <4 см в діаметрі.
3. Лапароскопічна дистальна субтотальна резекція шлунка (ДСРШ) для раку I стадії була переведена із розділу «Клінічні дослідження» до розділу «Рекомендоване лікування».
4. Рекомендації вибору схеми хіміотерапії були розділені на три категорії із рекомендаціями відповідно до рівня доказовості та рішення консенсусу.
5. Зміни у розділі хірургії раннього РШ, оптимізація показань до ендоскопічних резекцій.
6. Переглянуто питання стратегії лікування резектабельного метастатичного РШ, вибір оптимального режиму хіміотерапії.
7. Представлено алгоритми подальшого спостереження хворих на РШ після оперативних втручань.
Класифікація TNM і стадіювання РШ базовані на версії III англійського видання Японської класифікації раку шлунка [1] та ідентичні VII виданню Міжнародного протиракового союзу (International Union Contra Cancer — UICC).
Алгоритм лікування хворих на РШ, рекомендований до застосування в клінічній практиці. Алгоритм показано на рис. 1.
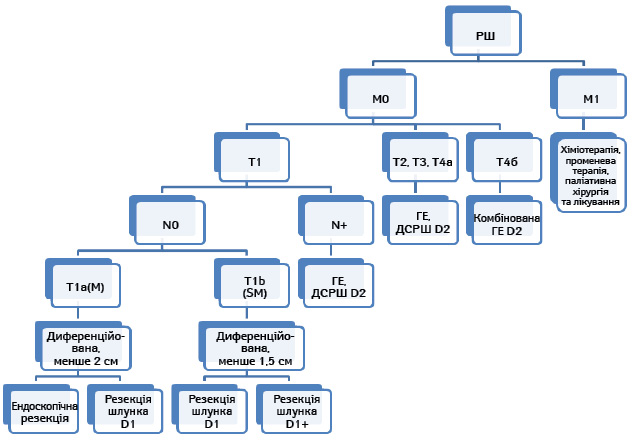
Методи, зазначені як експериментальне лікування (методи, що є предметом клінічних досліджень). Методи, що показали задовільні попередні результати, але потребують подальшого дослідження для затвердження їх як стандарту. Обов’язковою є згода пацієнта на дослідження та ретельне обґрунтування доцільності лікування.
Напрямки клінічних досліджень:
- розширення показань до ендоскопічної підслизової (субмукозальної) дисекції;
- лапароскопічна хірургія для хворих із розповсюдженим РШ;
- локальне видалення пухлини;
- неоад’ювантна хіміотерапія;
- ад’ювантна хіміотерапія (крім препарату S-1);
- неоад’ювантна хіміопроменева терапія;
- ад’ювантна хіміопроменева терапія.
КЛАСИФІКАЦІЯ ХІРУРГІЧНИХ ВТРУЧАНЬ ПРИ РШ
Радикальні втручання (R0)
Стандартні оперативні втручання. Субтотальна резекція шлунка (резекція щонайменше двох третин шлунка), гастректомія (ГЕ) (повне видалення шлунка) із лімфодисекцією — основні радикальні види втручання при РШ.
Нестандартні оперативні втручання. У нестандартній резекції шлунка ступінь резекції шлунка та/або лімфодисекції змінюється залежно від стадії раку.
Модифіковані операції. Обсяг резекції шлунка та/або лімфодисекції зменшується (D1, D1 + і т.д.) порівняно зі стандартною хірургічною операцією.
Розширені операції (1):
- субтотальна резекція або ГЕ з комбінованим видаленням або резекцією суміжних органів, що уражені місцево-поширеною пухлиною;
- субтотальна резекція або ГЕ з розширеною лімфодисекцією (D3).
Паліативні, симптоматичні хірургічні втручання. Ускладнення РШ, такі як кровотеча або стеноз, можуть розвинутися в хворих із місцево-поширеною або метастатичною пухлиною. Хірургічні операції для контролю ускладнень можуть бути розглянуті як варіант лікування. Паліативні резекції шлунка або гастроентероанастомоз показані залежно від резектабельності первинної пухлини, а також з урахуванням хірургічних ризиків. Гастроентероанастомоз із перетином шлунка має переваги порівняно зі стандартним гастроентероанастомозом [2].
Циторедуктивні (R2) операції. Роль циторедуктивної резекції шлунка є невизначеною у пацієнтів з метастатичним РШ за відсутності ургентних симптомів, таких як кровотеча або обструкція. Циторедуктивна хірургія спрямована на продовження тривалості життя або затримання початку симптомів шляхом зменшення об’єму пухлини.
У міжнародному спільному рандомізованому контрольованому дослідженні (REGATTA, JCOG0705/KGCA01 [3]) не виявлено жодних доказів на підтримку циторедуктивної хірургії при РШ.
Класифікація варіантів резекції шлунка:
- ГЕ (повне видалення шлунка), що включає кардію і пілорус;
- ДСРШ, що включає пілорус. Зберігається кардія. При стандартній ДСРШ дві третини шлунка мають бути видалені;
- пілорусзберігаюча резекція шлунка (ПЗРШ). Резекція шлунка, при якій зберігається верхня третина шлунка і пілорус разом з частиною антрума;
- проксимальна резекція шлунка (ПРШ). Резекція, що включає кардію (шлунково-стравохідний перехід). Зберігається пілорус;
- сегментарна резекція. Окружна резекція шлунка зі збереженням кардії і пілоруса;
- локальна резекція;
- нерезекційна операція (шунтування, гастростомія, єюностомія).
ВИЗНАЧЕННЯ ОБСЯГУ РЕЗЕКЦІЇ ШЛУНКА
Край резекції. Проксимальний край завширшки щонайменше 3 см рекомендовано забезпечувати для T2 та більш глибоких пухлин з експансивним типом росту (класифікація за Borrmann, типи 1 і 2) і 5 см — при РШ інфільтративного типу росту (класифікація за Borrmann, типи 3 та 4) (рис. 2). Коли не можуть бути дотримані ці правила, то доцільно розглянути «чистоту» проксимального краю резекції за допомогою інтраопераційної експрес-біопсії (замороженої секції). Для РШ, що поширюється на стравохід, межа 5 см не є обов’язковою, але для забезпечення резекції R0 бажано провести дослідження замороженої секції лінії резекції.
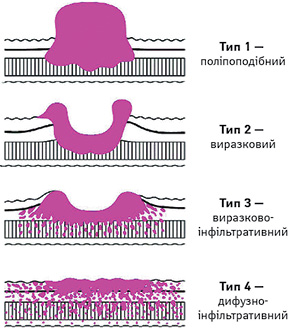
Для пухлин Т1 необхідно дотримуватися відстані 2 см від краю пухлини. Коли при ранньому РШ межа пухлини неясна, передопераційне ендоскопічне маркування кліпсами межі пухлини на основі результатів біопсії буде корисним для прийняття рішення щодо лінії резекції.
Вибір типу резекції шлунка. При клінічних ознаках метастазів у регіонарні лімфатичні вузли (сN+) або при РШ Т2–Т4а рекомендована ГЕ або ДСРШ. ДСРШ є достатнім обсягом операції за умови дотримання негативного проксимального краю резекції. При інвазії в підшлункову залозу, коли є потреба в панкреатоспленектомії, показано виконання ГЕ незалежно від розташування пухлини в шлунку. Якщо пухлина розміщена уздовж великої кривизни та наявні метастази в лімфатичні вузли групи № 4sb, рекомендована ГЕ зі спленектомією, навіть якщо первинна пухлина може бути видалена за допомогою ДСРШ. При аденокарциномі, розташованій в зоні гастроезофагеального переходу, рекомендовано виконання резекції стравоходу із ПРШ та подальшою реконструкцією трансплантатом із кукси шлунка.
При РШ T1N0 рекомендовані такі види резекції шлунка залежно від розташування пухлини:
- ПЗРШ: при пухлинах у середній частині шлунка з дистальним краєм пухлини на відстані принаймні 4 см від пілоруса;
- ПРШ: для пухлин верхньої третини шлунка, коли більше ніж половина шлунка може бути збережена;
- сегментарна резекція і локальна резекція із контролем «сторожового вузла» можуть розглядатися тільки як напрямки клінічних досліджень.
Вибір обсягу лімфодисекції. Обсяг лімфодисекції визначається відповідно до типу резекції шлунка. Коли ступінь виконаної лімфодисекції не повною мірою відповідає критеріям D рівня, група лімфатичних вузлів, яка була додатково видалена або залишена in situ, може бути записана наступним чином: D1 + № 8a або D2 − № 10.
Вибір обсягу лімфодисекції при ГЕ (рис. 3):
- D0: лімфодисекція менше ніж D1;
- D1: № 1–7;
- D1+: D1 + № 8a, 9, 11p;
- D2: D1 + № 8a, 9, 10, 11p, 11d, 12a.
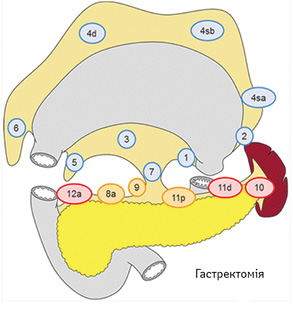
Для РШ, що поширюється на стравохід:
- D1+: як при ГЕ, додатково № 110 (нижні грудні парастравохідні лімфатичні вузли — їх видалення обов’язкове також для отримання достатнього краю резекції);
- D2: як при ГЕ, додатково № 19, 20, 110 та 111.
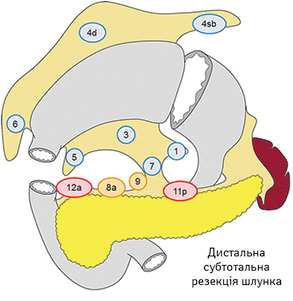
Вибір обсягу лімфодисекції при ДСРШ (рис. 4):
- D0: лімфодисекція менше ніж D1;
- D1: № 1, 3, 4sb, 4d, 5, 6, 7;
- D1+: D1 + № 8a, 9;
- D2: D1 + № 8a, 9, 11p, 12a.
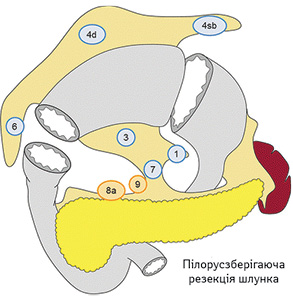
Вибір обсягу лімфодисекції при ПЗРШ (рис. 5):
- D0: лімфодисекція менше ніж D1;
- D1: № 1, 3, 4sb, 4d, 6, 7;
- D1+: D1 + № 8a, 9.
Вибір обсягу лімфодисекції при ПРШ (рис. 6):
- D0: лімфодисекція менше ніж D1;
- D1: № 1, 2, 3a, 4sa, 4sb, 7;
- D1+: D1 + № 8a, 9, 11p.
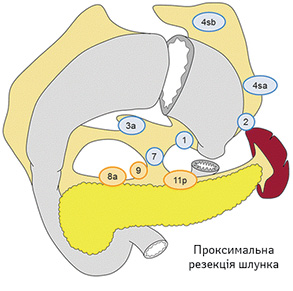
Для РШ, що поширюється на стравохід:
- D1+: як при ПРШ, додатково група лімфатичних вузлів № 110.
Для РШ T1N0 показано виконання D1 або D1+ лімфодисекції. При клінічно виявних метастазах у регіонарних лімфатичних вузлах (cN+) або РШ T2–T4 рекомендована лімфодисекція D2. Оскільки як доопераційне, так і інтраопераційне виявлення метастазів у лімфатичних вузлах залишається ненадійним, D2 лімфодисекція повинна виконуватися у випадках, коли є підозра на ураження регіонарних лімфатичних вузлів при Т1 пухлинах.
D1 лімфодисекція показана при РШ T1a, що не відповідає критеріям для ендоскопічної мукозальної/субмукозальної резекції, а також при РШ T1bN0 диференційованого типу діаметром ≤1,5 см.
D1+ лімфодисекція показана при РШ T1N0, що не підпадає під критерії D1 і D2.
D2 лімфодисекція показана при РШ T2–T4, а також РШ T1N+. Роль рутинної спленектомії для повного видалення групи вузлів № 10 і 11 вже давно стала предметом суперечок. У рандомізованому дослідженні JCOG 0110 виявили, що збереження селезінки не впливає на загальну тривалість життя, таким чином, рутинна спленектомія не повинна виконуватися за умови, що РШ T2–T4 не поширюється безпосередньо на селезінку або пухлина локалізована у великій кривизні верхньої третини шлунка [5]. Водночас видалення лімфатичних вузлів групи № 10 шляхом спленектомії слід розглядати як операцію вибору при РШ T2–T4, локалізованому у великій кривизні верхньої частини шлунка.
D2 + лімфодисекція. Резекція шлунка з розширеною лімфодисекцією понад D2 класифікується як нестандартна резекція. У рандомізованому дослідженні JCOG 9501 не виявлено переваг профілактичної системної парааортальної лімфодисекції (СПАЛД) [6]. Хоча резекція R0 можлива при пухлинах з ураженням парааортальних лімфатичних вузлів, навіть за відсутності інших віддалених метастазів прогноз є поганим. Проте неоад’ювантна хіміотерапія із подальшою резекцією та D2+ лімфодисекцією є перспективним напрямком для клінічних досліджень.
Якщо метастази в парааортальних лімфатичних вузлах обмежуються зоною № 16a2-b1, може бути запропоноване комбіноване лікування, що включає хірургічне втручання з лімфодисекцією парааортальних лімфовузлів за умови відсутності інших факторів неоперабельності. Парааортальні метастази РШ класифікуються як M1, і радикальна операція не показана відповідно до алгоритму лікування у поточних рекомендаціях. Однак, за даними численних ретроспективних досліджень в Японії, проведення СПАЛД при наявних метастазах у парааортальних вузлах у 10–20% пацієнтів може подовжити медіану тривалості життя. Аналогічний результат був недавно отриманий у західних країнах [8]. Таким чином, неможливо повністю заперечувати ефективність СПАЛД у хворих із підтвердженими метастазами в окремі парааортальні лімфатичні вузли групи № 16a2-b1 шляхом виконання СПАЛД. У дослідженні II фази вивчено поєднання комбінації двох курсів неоад’ювантної хіміотерапії (фторпіримідин S-1 із цисплатином) із подальшою резекцією і СПАЛД. Лікування проводили у хворих на РШ як із масивним ураженням заочеревинних лімфатичних вузлів, так і з обмеженим ураженням групи № 16a2-b1 або без ознак ураження заочеревинних лімфатичних вузлів. Перед лікуванням обов’язково виключали канцероматоз шляхом проведення діагностичної лапароскопії. У дослідженні була досягнута 5-річна виживаність у 53% хворих [9]. Ця стратегія лікування, з одного боку, може бути рекомендована для клінік із достатнім досвідом у СПАЛД, з іншого боку, є аргументи на користь того, що 5-річна виживаність близько 10% може бути досягнута шляхом самостійної хіміотерапії, коли метастази в парааортальні лімфовузли є єдиним фактором обмеження радикального хірургічного лікування [10, 11]. Проте ці ретроспективні дослідження, як відомо, включають пацієнтів, яким врешті-решт було проведено хірургічне втручання після відповіді на хіміотерапію і, безперечно, відображають переваги комбінованого підходу.
Роль лімфодисекції 14-ї групи при дистальному РШ є спірною. Дисекція 14-ї групи лімфатичних вузлів була обов’язковим етапом лімфодисекції D2, за версією XIII видання Японської класифікації раку шлунка, але в подальшому виключена з попереднього перегляду (версія III) Японських рекомендацій з лікування раку шлунка. Проте D2+ № 14 може бути корисною для пацієнтів, які мають метастази в лімфатичних вузлах групи № 6 (cN+).
Ураження вузлів групи № 13 визначається як M1 у поточній версії. Проте лімфодисекція D2+ № 13 може бути варіантом вибору при потенційно резектабельному РШ, що поширюється на дванадцятипалу кишку [7].
Рак шлунково-стравохідного сполучення. В Японській класифікації раку шлунка рак гастроезофагеального переходу був визначений як аденокарцинома або плоскоклітинний рак з центром, розташованим у межах 2 см від шлунково-стравохідного сполучення. Наразі немає консенсусу за типом резекції та обсягом лімфодисекції, які були б стандартом в лікуванні при раку шлунково-стравохідного сполучення. У 2012–2013 рр. Японська асоціація з вивчення раку шлунка (Japanese Gastric Cancer Association) і Японська асоціація з вивчення раку стравоходу (Japanese Esophageal Cancer Association) об’єднали зусилля для проведення загальнонаціонального дослідження раку шлунково-стравохідного сполучення діаметром ≤4 см. Виконано оцінку ретроспективних даних 3177 пацієнтів, оперованих у період між 2001 і 2010 р., у дослідженні взяли участь 273 клініки. На основі дослідження побудовано алгоритм вибору обсягу лімфодисекції за локалізацією пухлини, морфологією та з урахуванням Т-критерію (рис. 7). Анатомічна межа між лімфатичними вузлами груп № 19 і 20 та 110, 111 і 112 не може бути визначена чітко. Таким чином, нижні медіастинальні та хіатальні вузли розглядаються як одна група лімфатичних вузлів у поточному аналізі. При виконанні ПРШ можна не проводити лімфодисекцію групи № 3b. Проспективне дослідження фази II для подальшого вивчення цього питання триває.

Доступи до нижньої частини стравоходу. При РШ, що поширюється на стравохід ≤3 см від дистального відділу стравоходу, рекомендується трансхіатальний черевний доступ [23]. Трансторакальний доступ показаний, коли є поширення >3 см.
Збереження блукаючого нерва. Збереження печінкової гілки переднього та/або черевної гілки заднього блукаючих нервів сприяє поліпшенню післяопераційної якості життя за рахунок зменшення ризику утворення жовчних каменів, виникнення діареї та/або втрати маси тіла після резекції шлунка. У разі ПЗРШ печінкова гілка блукаючого нерва має бути збережена для підтримання задовільної функції воротаря.
Видалення великого сальника. Оментектомія, як правило, включена в стандарт при резекції шлунка у хворих на РШ T3 (проростання серозного шару) або більш глибоких пухлин. При РШ T1/T2 великий сальник може бути збережений на відстані >3 см від шлунково-сальникової аркади.
Бурсектомія. При РШ, що проростає серозну оболонку задньої стінки шлунка, виконання бурсектомії (видалення очеревини сальникової сумки) було запропоновано з метою видалення мікроскопічних метастазів пухлини в сальниковій сумці. На сьогодні немає доказів стосовно зниження ризиків перитонеального або місцевого рецидиву при виконанні бурсектомії, зазначена процедура не рекомендована при РШ T1–2 з погляду запобігання можливим ускладненням. Певні переваги виконання бурсектомії при РШ T3–4 були отримані в маломасштабному рандомізованому контрольованому дослідженні [12]. Згодом почато багатоцентрове рандомізоване дослідження для остаточного з’ясування показань до бурсектомії (JCOG 1001).
Коментарі авторів. В 2017 р. опубліковано результати масштабного багатоцентрового рандомізованого дослідження JCOG 1001, що не виявило переваг бурсектомії порівняно зі стандартною оментектомією за показниками загальної та безрецидивної тривалості життя. Таким чином, бурсектомія не рекомендована як стандартне лікування при РШ T3–4, тоді як оментектомія залишається частиною стандартної операції.
Комбіновані (мультивісцеральні) резекції рекомендовані при поширеному РШ, що безпосередньо уражує сусідні органи.
РШ із метастазами в печінку. Метастази РШ у печінку класифікуються як M1, і радикальна операція не показана відповідно до алгоритму лікування у поточних рекомендаціях. Комбінований підхід, що включає хіміотерапію і радикальне хірургічне лікування, може бути застосовано при невеликій кількості метастазів, за відсутності інших факторів неоперабельності.
РШ із метастатичним ураженням печінки часто вважають нерезектабельним, оскільки в більшості випадків метастази виявляють у вигляді множинних вузликів, розподілених в обох частках печінки, що, ймовірно, супроводжуються метастатичним ураженням поза печінкою. Жодного проспективного дослідження з вивчення переваг резекцій печінки при метастазах РШ не проводилося. На сьогодні доступні тільки ретроспективні одноцентрові дослідження невеликих когорт, зібраних протягом кількох десятиріч [13−15]. Однак у цих дослідженнях повідомляють про 5-річну виживаність 10–40%. Таким чином, не можна заперечувати факт, що резекція печінки сприяє подовженню медіани тривалості життя в певної групи хворих. Наявність поодиноких або обмеженої кількості печінкових метастазів РШ виділено як сприятливий прогностичний фактор у більшості досліджень [16]. З огляду на підвищення якості променевих методів діагностики і той факт, що діагноз одиночних метастазів РШ може бути недостовірним у старих дослідженнях, резекція печінки рекомендована для пацієнтів із невеликою кількістю метастазів. Обсяг резекції шлунка не є обмеженням за умови, що немає інших факторів неоперабельності. Оскільки не було досягнуто консенсусу щодо прогностичних відмінностей синхронних і метахронних метастазів РШ, хірургічне втручання також може бути рекомендовано при рецидивуючих метастазах у печінку, якщо є всі зазначені вище умови. У більшості хворих у подальшому виникають рецидиви, таким чином, неоад’ювантна хіміотерапія може бути рекомендована для хворих, яким не проводилася ад’ювантна хіміотерапія до виявлення метастазів у печінці. Однак на сьогодні недостатньо даних щодо рекомендацій режимів хіміотерапії в подібних випадках.
Тактика лікування хворих на РШ з позитивним цитологічним змивом черевної порожнини (CY1). Комбіноване лікування, що включає хірургію, може бути запропоновано пацієнтам без будь-яких інших факторів неоперабельності. Якщо статус CY1 виявлено після операції, можна рекомендувати ад’ювантну хіміотерапію препаратом S-1.
В Японії зразки змивів із черевної порожнини зазвичай беруть під час операції для цитологічного дослідження з метою виявлення вільних ракових клітин. Вільні клітини РШ в перитонеальній порожнині (CY1) класифікуються як M1, радикальна операція не показана відповідно до алгоритму лікування у поточних рекомендаціях. Проте пацієнтам зі статусом CY1 часто проводять хірургічне лікування за відсутності інших факторів неоперабельності. Загальні результати незадовільні, з медіаною тривалості життя приблизно 12 міс і 5-річною виживаністю 7,8%, але описані дослідження переважно включали пацієнтів, які лікувалися тільки хірургічним шляхом [17].
Останнім часом було проведено проспективне дослідження фази II, в якому пацієнтам із місцево-резектабельним РШ з CY1 як фактором неоперабельності (пацієнти з мінімальним перитонеальним індексом) виконували хірургічне лікування із подальшою монотерапією S-1 до ознак прогресування захворювання. Медіана безрецидивної та загальної тривалості життя відповідно становила 376 і 705 днів, а 5-річна безрецидивна і загальна виживаність — відповідно 21 і 26% [18]. Крім того, одноцентрове ретроспективне дослідження, що включило 120 пацієнтів із РШ CY1, яким було проведено хірургічне втручання з подальшою монотерапією S-1, показало 5-річну виживаність 26,6% [19], що відповідало даним попереднього дослідження. Ці результати набагато кращі, ніж отримані до застосування комбінованих підходів, та еквівалентні результатам хірургічного лікування при РШ 4-го типу за Borrmann (cкір), який часто рецидивує у вигляді канцероматозу [20]. Триває дослідження JCOG0501 III фази: неоад’ювантна хіміотерапія S-1 із цисплатином при РШ 4-го типу за Borrmann, в групі контролю проводиться первинно хірургічне втручання із подальшим призначенням S-1.
Таким чином, пацієнтам з CY1 може бути рекомендована радикальна операція з ад’ювантною хіміотерапією. Крім того, післяопераційна монотерапія S-1 може бути рекомендована хворим, в яких CY1 виявлено в післяопераційному змиві. З іншого боку, якщо статус CY1 був отриманий до операції, хіміотерапія повинна бути першим етапом лікування. Пацієнтам, в яких після передопераційної хіміотерапії цитологічне дослідження перитонеального змиву стало негативним, рекомендована операція [21, 22]. Стратегія комбінованого лікування в зазначених вище випадках, оптимальний режим хіміотерапії і кількість циклів мають бути більш детально розроблені в майбутніх клінічних дослідженнях.
Лапароскопічна хірургія. Лапароскопічна ДСРШ рекомендована в загальній клінічній практиці для лікування хворих на РШ I стадії (рекомендація рівня B). Безпека лапароскопічного підходу була доведена в проспективному дослідженні II фази (JCOG0703), в якому брали участь тільки сертифіковані хірурги з достатнім досвідом [24], перевага щодо короткострокових результатів підтверджена за допомогою маломасштабних досліджень і метааналізу. Проте хірурги повинні знати, що проблема кривої навчання існує, і вказівка на цей підхід має вирішуватися в кожній установі на основі досвіду співробітників, які беруть участь у цьому типі операції. Дані про довгострокові результати ще не опубліковані, і очікуються результати основних досліджень III фази, проведених в Японії (JCOG0912 [25]) і Кореї (KLASS01 [26]). Що стосується поширеного раку, то наразі немає доказів, щоб рекомендувати лапароскопічний підхід, оскільки тепер проводяться рандомізовані дослідження для оцінки безпеки і довгострокових результатів (JLSSG0901, KLASS02).
Лапароскопічна ГЕ була оцінена відповідно до рекомендацій Японського товариства ендоскопічної хірургії (2014 р.) як рекомендація категорії C1 (може бути розглянута як варіант хірургічного лікування в хворого, що потребує ГЕ, але на сьогодні немає наукових доказів для стандартизації цієї операції). Ті, хто має невеликий досвід виконання ГЕ, повинні планувати лапароскопічну ГЕ обережно, оскільки післяопераційні ускладнення, як повідомлялося, були значно частішими в перший рік її введення в практику.
Рекомендовані методи реконструкції після ГЕ:
- езофагоєюностомія за Ру;
- інтерпозиція сегмента тонкої кишки;
- метод подвійного тракту.
У кожного з методів є свої переваги і недоліки. Функціональні переваги реконструкції з формуванням «штучного шлунка» ще не встановлені.
Рекомендовані методи реконструкції після ДСРШ:
- Більрот I гастродуоденостомія;
- Більрот II гастроєюностомія;
- Ру-гастроєюностомія;
- інтерпозиція сегмента тонкої кишки.
Рекомендована реконструкція після ПЗРШ:
- гастро-гастростомія.
Рекомендовані методи реконструкції після ПРШ:
- езофагогастростомія;
- інтерпозиція сегмента тонкої кишки;
- метод подвійного тракту.
ЕНДОСКОПІЧНІ РЕЗЕКЦІЇ ПРИ РАННЬОМУ РШ
Ендоскопічна мукозальна резекція (ЕМР). Зона ураження разом із навколишньою слизовою оболонкою «піднімається» шляхом інфільтрації підслизовою ін’єкцією фізіологічного розчину (нормо- або гіпертонічного) і видаляється з використанням високочастотної коагуляції.
Ендоскопічна субмукозальна резекція (ЕСР). Слизову оболонку, що оточує ураження, вирізають по колу з використанням високочастотної коагуляції (зазвичай з ізоляцією), підслизовий шар відділяють від м’язового шару.
Обробка ендоскопічно резектованих зразків. Резектовані зразки повинні оброблятися відповідно до протоколів, описаних в Японській класифікації раку шлунка [1].
Зразки біопсії й ендоскопічно видалені пухлини підрозділяють на диференційований або недиференційований морфологічний варіанти. Перший включає папілярну аденокарциному (pap) і тубулярну аденокарциному (tub1, tub2). Останній — погано диференційовану аденокарциному (por1, por2) і перснеподібно-клітинну карциному (sig). Ендоскопічна дисекція повинна бути визначена як нерадикальна, якщо в підслизовому шарі виявлено муцинозну аденокарциному (muc), незалежно від того, вважається вона диференційованою чи недиференційованою.
Гістологічна перевага та внутрішньопухлинні виразкові (UL) знахідки. Пухлина, що складається з компонентів як диференційованого, так і недиференційованого типу, класифікується за одним із двох типів відповідно до кількісної переваги. Крім того, коли в пухлині виявлено більше одного гістологічного типу, всі гістологічні типи слід реєструвати в порядку кількісної переваги, наприклад tub2 > tub1. Діагноз UL(+) головним чином встановлюють на основі гістологічного доказу знайдених виразкових уражень. Однак при встановленні остаточного діагнозу слід враховувати ендоскопічні та/або радіологічні дані. У разі ендоскопічного видалення рубця зазвичай морфологічне дослідження виявляє фіброз, обмежений невеликими ділянками, розташованими прямо під м’язовою пластинкою слизової оболонки. Однак, якщо його не можна відрізнити від рубця після виразки, слід класифікувати як UL(+).
Показання до ендоскопічної резекції. Ендоскопічна резекція рекомендована при ранньому РШ, який має дуже низьку ймовірність метастазів у лімфатичні вузли і придатний для резекції en-bloc.
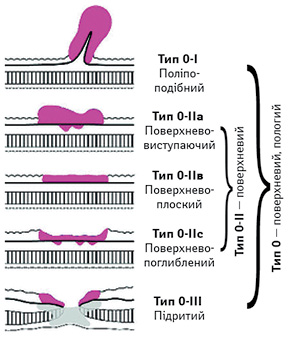
З моменту складання першої версії цього видання було розроблено дві незалежні групи показань до ендоскопічної резекції: показання до стандартної ЕМР/ЕСР та розширені показання до ЕСР, які розглядалися як дослідження. Докази щодо рекомендацій останнього методу залишаються недостатніми, і процедура повинна бути запропонована з обережністю (рис. 8).
Показання до ендоскопічної резекції як стандарт лікування (абсолютне показання). ЕМР або ЕСР визначаються як стандартний підхід при аденокарциномі диференційованого типу без виразкових знахідок [UL(−)], глибина інвазії клінічно діагностується як T1a, діаметр ≤2 см.
Показання до ендоскопічної резекції як клінічні дослідження (розширені показання). Пухлини в наступних категоріях мають дуже низьку ймовірність метастазування в лімфатичні вузли, не супроводжуються лімфоваскулярною інфільтрацією [ly(−), v(−)] і можуть бути видалені за допомогою ендоскопічної резекції [27, 28]. Необхідно виконувати ЕСР, а не ЕМР, щоб досягти R0 резекцію. Оскільки на сьогодні відсутні дані про віддалені результати лікування, ендоскопічне лікування цих уражень слід розглядати як клінічне дослідження до тих пір, поки не будуть отримані результати випробування JCOG0607.
Пухлини, клінічно діагностовані як T1a:
- диференційованого типу, UL(−), але >2 см в діаметрі;
- диференційованого типу, UL(+) і ≤3 см в діаметрі;
- недиференційованого типу, UL(−) і ≤2 см в діаметрі.
Місцевий рецидив після ЕМР/ЕСР. Місцеві рецидиви РШ після ЕМР/ЕСР, які виконувалися за абсолютними показаннями, можна вважати такими, що відповідають критеріям розширених показань. У такому разі може бути запропонована інша ЕСР. Однак, з огляду на недостатність доказів щодо довгострокової виживаності, повторну ЕСР слід розглядати як напрямок клінічних досліджень.
Радикальне видалення. Ендоскопічна резекція РШ визначається як радикальна, коли виконуються всі наступні умови: резекція en-bloc, розмір пухлини ≤2 см, гістологічно диференційований тип, pT1a, негативний горизонтальний край (HM0), негативний вертикальний край (VM0) і відсутність лімфоваскулярної інфільтрації (ly(−), v(−)).
Радикальне видалення пухлин за розширеними показаннями. Резекція вважається радикальною, коли виконуються всі нижченаведені умови:
- en-bloc резекції, HM0, VM0, ly(−), v(−) і:
а) розмір пухлини >2 см, гістологічно диференційованого типу, pT1a, UL(−);
б) розмір пухлини ≤3 см, гістологічно диференційованого типу, pT1a, UL(+);
в) розмір пухлини ≤2 см, гістологічно недиференційованого типу, pT1a, UL(−);
г) розмір пухлини ≤3 см, гістологічно диференційованого типу, pT1b (SM1, <500 мкм від мускулатури слизової оболонки).
Оскільки доказів все ще недостатньо для групи пухлин диференційованого типу, які мають декілька ділянок недиференційованого типу, такі резекції нині вважаються нерадикальним, і слід рекомендувати резекцію шлунка в таких випадках:
- ділянки карциноми недиференційованого типу перевищують 2 см в наведеному вище (а);
- недиференційований компонент в частині, яка уражує підслизову основу в вищевказаному (г).
Нове правило в поточній версії полягає в тому, що, якщо в наведеному вище (б) виявлено компонент недиференційованої карциноми, який не був переважаючим гістологічним типом, ризик розвитку регіонарних метастазів оцінюється як низький [29], а ендоскопічна резекція буде вважатися радикальною.
ЛІКУВАННЯ ПІСЛЯ ЕНДОСКОПІЧНОЇ РЕЗЕКЦІЇ
Після радикального видалення рекомендовано повторне проведення ендоскопії щорічно або два рази на рік.
Після радикального видалення за розширеними показаннями. Рекомендовано щорічно або два рази на рік проводити абдомінальну ультрасонографію чи комп’ютерну томографію (КТ), а також ендоскопію.
В обох випадках рекомендовано визначення та ерадикацію Helicobacter pylori. Однак деякі дослідження показали, що ерадикація Helicobacter pylori після ендоскопічної резекції не вплинула на частоту виникнення метахронного РШ. Рекомендовано подальші дослідження в цьому напрямку.
Лікування після нерадикального ендоскопічного видалення рекомендовано в обсязі резекції шлунка. Однак, оскільки ризик регіонарного метастазування дуже низький, ендоскопічне лікування, таке як повторна ЕСР, ендоскопічна коагуляція з використанням лазерного або аргоноплазмового коагулятора чи спостереження за ефектом опіку після початкової ЕСР, може бути рекомендовано як альтернатива за умови інформованої згоди пацієнта. Також рекомендовано:
- виконання еn-bloc резекції пухлини диференційованого типу з позитивним горизонтальним краєм HM1 (що є єдиним фактором нерадикального лікування);
- ступінчаста резекція раку диференційованого типу для інших варіантів.
Коли клінічні/морфологічні дані виходять з категорій (б) або (г) розділу «Радикальне видалення пухлин за розширеними показаннями», розмір залишкового ураження слизової оболонки слід повторно оцінити за допомогою ендоскопії. Якщо сума довжин резектованих і залишкових уражень перевищує 3 см, показана резекція шлунка. Коли є позитивний горизонтальний край або в край при поступовій резекції залучена частина із підслизовою інвазією категорії (г), рекомендована резекція шлунка.
ХІМІОТЕРАПІЯ
Хоча недавні досягнення в галузі хіміотерапії дозволили отримувати значну регресію в багатьох випадках неоперабельного/рецидивуючого РШ, вони у кінцевому підсумку не сприяли значному подовженню загальної тривалості життя хворих. Медіана тривалості життя при розповсюджених пухлинах залишається 6–13 міс. Тому нинішня мета хіміотерапії полягає в тому, щоб затримати розвиток ускладнень РШ та/або продовжити тривалість життя. Перевага хіміотерапії над симптоматичним лікуванням була доведена в рандомізованих контрольованих дослідженнях у пацієнтів з неоперабельним РШ із загальним станом (ЗС) 0–2. Лише в поодиноких випадках повідомляється про 5-річну тривалість життя хворих із поширеним РШ, що отримували тільки хіміотерапію. Таким чином, хіміотерапія — це лікування, яке перш за все розглядається при неоперабельному/рецидивуючому РШ в хворих із задовільним ЗС.
Принципи показань для хіміотерапії. Хіміотерапія показана пацієнтам з неоперабельним або рецидивуючим РШ або після паліативних операцій (R2), із задовільним ЗС 0–2, з неоперабельним захворюванням T4b стадії, значним ураженням лімфатичних вузлів, наявністю печінкових метастазів, канцероматозом або іншою локалізацією віддалених метастазів.
Схеми хіміотерапії, рекомендовані для японських пацієнтів. Рекомендаційна категорія була визначена членами комітету на основі рівнів представлених доказів і врешті шляхом консенсусу, досягнутого після ретельного огляду літератури та обговорення.
Рекомендаційна категорія 1: схеми лікування, рекомендовані в клінічній практиці.
Схеми, включені в цю категорію, повинні бути або кращими, або не поступатися стандартним методам лікування за результатами досліджень III фази із врахуванням загальної тривалості життя. Крім того, у членів комітету повинен бути досягнутий консенсус щодо інтерпретації результатів дослідження фази III, наявності ліків в Японії та достатніх даних з безпеки та ефективності з японськими учасниками.
Рекомендаційна категорія 2: схеми лікування, які можуть бути вибрані в клінічній практиці.
Режими хіміотерапії в цій категорії включають: (1) ті, які були визнані кращими або не поступаються стандартним методам лікування в дослідженнях III фази, але не змогли отримати достатню підтримку від членів комітету, які були включені в категорію 1; (2) схеми з достатніми даними про ефективність і безпеку, отримані в ході випробування фази II, і консенсус, досягнутий серед членів комітету.
Рекомендаційна категорія 3: схеми лікування, які не можна рекомендувати в клінічній практиці.
Схеми хіміотерапії цієї категорії або не продемонстрували переваг чи нерівноцінності з погляду загальної виживаності в дослідженні III фази, або не мали достатніх даних щодо ефективності/безпеки в популяції японських хворих.
ЛІКУВАННЯ ПЕРШОЇ ЛІНІЇ
Тест HER2. Оскільки режим, що включає трастузумаб, став стандартом лікування при HER2-позитивному РШ, тестування на HER2 настійно рекомендується всім пацієнтам, які є кандидатами для хіміотерапії з приводу неоперабельного РШ.
HER2-негативний РШ. Комбінація S-1 + цисплатин є стандартом вибору (рекомендаційна категорія 1) на підставі результатів двох досліджень III фази, проведених в Японії (дослідження SPIRITS [30] і JCOG 9912 [31]).
Комбінація капецитабін + цисплатин нині є одним зі стандартних методів лікування за межами Японії і була використана як контроль у глобальних дослідженнях III фази, дослідженнях ToGA [32] і AVAGAST [33]. Оскільки аналіз підмножини японських учасників цих випробувань показав безпеку і ефективність, ця комбінація може бути обрана в клінічній практиці (рекомендаційна категорія 2).
Комбінація S-1 із доцетакселом не показала переваги монотерапії S-1 у первинному аналізі виживаності в дослідженні START, проведеному із залученням японських і корейських учасників, але перевага в загальній виживаності спостерігалася при повторному аналізі після з’ясування результатів декількох випадків [34]. Цей режим можна вибрати для певних груп хворих, наприклад тих, хто хоче лікуватися амбулаторно (рекомендаційна категорія 2).
Комбінації іринотекану із цисплатином і S-1 з іринотеканом не рекомендовані як перша лінія, тому що не продемонстрували значної переваги над монотерапією 5-флуороурацилом (5-ФУ) або S-1 відповідно в рандомізованих дослідженнях, проведених в Японії [31, 35] (рекомендаційна категорія 3).
Що стосується триплетних режимів, то ефективність комбінації 5-ФУ із цисплатином і доцетакселом була доведена в дослідженні V325 [36], проведеному в західних країнах. З огляду на надмірну токсичність і відсутність даних для японських пацієнтів, цей режим не можна рекомендувати для загальної практики (рекомендація 3). В Японії триплет, що складається з S-1, цисплатину і доцетакселу (режим DCS), тепер оцінюється в дослідженні III фази JCOG1013 після деяких результатів II фази. Таким чином, режим DCS наразі потребує подальшого дослідження.
На сьогодні не вистачає даних для вибору певних режимів хіміотерапії для конкретних груп пацієнтів, що мають обмеження до перорального прийому або при канцероматозі (пацієнти з помірним або високим ступенем асциту чи обструкції кишечнику), а також у хворих літнього віку.
Дослідження SOX-GC [37] і REAL2 [38] з вивчення ефективності комбінації S-1 із оксаліплатином або капецитабіну із оксаліплатином показали задовільні результати, що дозволило рекомендувати зазначені схеми для першої лінії хіміотерапії при РШ (рекомендаційна категорія 2).
HER2-позитивний РШ. Хворі на РШ IHC3+ або FISH+ брали участь у дослідженні ToGA [32]. Подовження медіани тривалості життя спостерігали в когорти IHC3+ або FISH+/IHC2+. Таким чином, схеми, що містять трастузумаб, рекомендовані пацієнтам з IHC3+ або FISH+/IHC2+. За результатами дослідження ToGA, найкращою є комбінація трастузумабу з цисплатином і капецитабіном (або 5-ФУ) (рекомендаційна категорія 1). Хоча дослідження фази II трастузумабу в поєднанні з S-1 та цисплатином показало позитивні результати, сьогодні комбінація залишиться в категорії 2 через недостатній обсяг даних про ефективність і безпеку.
ЛІКУВАННЯ ДРУГОЇ ЛІНІЇ
Рекомендована монотерапія будь-яким з трьох агентів: доцетакселом, іринотеканом або паклітакселом у щотижневому введенні (рекомендаційна категорія 1).
Рандомізовані дослідження, проведені в Німеччині [39] і Кореї [40], показали значну перевагу за показником загальної тривалості життя порівняно з найкращим симптоматичним лікуванням. У японському дослідженні III фази WJOG4007 [41] із порівнянням щотижневого введення іринотекану та паклітакселу не було виявлено переваг за показником медіани тривалості життя, що в обох групах становила приблизно 9 міс та загалом була кращою, ніж в попередніх дослідженнях хіміотерапії другої лінії. Це можна пояснити тим, що більша частина учасників цього дослідження отримала ще одну лінію лікування (таксани в групі іринотекану та іринотекан в групі паклітакселу). Таким чином, дослідження WJOG4007 демонструє, що пацієнти із задовільним ЗС можуть отримати користь від лікування третьої лінії.
У поточному виданні за результатами досліджень RAINBOW [42] і REGARD [43] комбінація паклітакселу з рамуцирумабом стала новим стандартом другої лінії (рекомендаційна категорія 1), тоді як монотерапія рамуцирумабом оцінювалася як рекомендаційна категорія 2.
Післяопераційна ад’ювантна хіміотерапія. Післяопераційну ад’ювантну хіміотерапію призначають з метою зменшення проявів рецидиву, контролюючи залишкові пухлинні клітини після резекції. Різні схеми були протестовані в численних клінічних випробуваннях в Японії без отримання твердих доказів на підтримку ад’ювантної хіміотерапії, ефективність S-1 не була доведена в дослідженні ACTS-GC [44, 45], яке забезпечило місце післяопераційної хіміотерапії S-1 як стандарту лікування (рекомендаційна категорія 1). Після цього була вивчена можливість застосування декількох комбінацій цитостатиків з S-1 в післяопераційний період [46, 47], і деякі з комбінацій наразі оцінюються в дослідженнях III фази. З іншого боку, інші докази III фази на підтримку післяопераційної хіміотерапії були знайдені в 2012 р. у дослідженні III фази CLASSIC [48], в якому показано значне збільшення безрецидивної тривалості життя при застосуванні комбінації капецитабіну з оксаліплатином.
За результатами досліджень J-CLASSIC [49] і SOX-ад’ювант [50], комбіновані режими капецитабін або S-1 + оксаліплатин були схвалені як ад’ювантна терапія РШ в Японії.
Особливості призначень. S-1 повинен бути призначений протягом 6 тиж після операції після достатнього відновлення після хірургічного втручання. Шеститижневий цикл, що складається з 4 тиж щоденного перорального введення S-1 в дозі 80 мг/м з подальшим 2-тижневим відпочинком, повторюється протягом 12 міс після операції (8 циклів). Оскільки пацієнти після операції, як правило, більш уразливі як до гематологічних, так і до негематологічних побічних ефектів, слід враховувати відповідне зниження дози та зміну розкладу, включаючи перехід на графік 2-тижневого застосування із тижнем відпочинку.
Вибір режиму хіміотерапії при рецидиві РШ в період післяопераційної ад’ювантної хіміотерапії S-1 або через 6 міс після її завершення. Хоча немає ніяких доказів ефективності певного режиму, більшість лікарів уникають монотерапії S-1 як хіміотерапії другої лінії.
Частота відповіді на лікування комбінацією S-1 + цисплатин дуже низька — 5% у хворих із рецидивом/метастазами РШ, які виявили до 6 міс після завершення ад’ювантної терапії S-1, порівняно з показником 37,5% у пацієнтів, в яких виявили ознаки захворювання через 6 міс після закінчення ад’ювантної терапії [51]. Ці дані багатоцентрового ретроспективного дослідження свідчать, що ранні рецидиви/метастази, виявлені під час або після завершення ад’ювантної хіміотерапії, стійкі до препарату, застосовуваного в попередній схемі лікування. З іншого боку, ретроспективний аналіз пацієнтів, зареєстрованих для дослідження ACTS-GC, показав, що хворі, які отримали S-1 серед інших препаратів у лікуванні другої лінії, жили довше після рецидиву, ніж ті, хто не приймав S-1, незалежно від інтервалу між ад’ювантною хіміотерапією і рецидивом. Однак результати цього дослідження слід інтерпретуватися з обережністю, оскільки дослідження залежить від можливості перорального прийому (пацієнти, які не отримували S-1 після діагностики рецидиву, можливо, були з обструкцією кишечнику, дисфагією, поганим ЗС).
При лікуванні колоректального раку в епоху ад’ювантної монохіміотерапії з 5-ФУ, препарати, які використовувалися як друга лінія терапії, призначали залежно від інтервалу між датами завершення ад’ювантної хіміотерапії і виявлення рецидиву. Нові схеми були розроблені в якості першої лінії для пацієнтів, у яких рецидив був виявлений через більше ніж 6 міс після завершення ад’ювантної терапії, і другої лінії для тих, в кого було діагностовано рецидив захворювання під час або протягом 6 міс після ад’ювантної терапії.
Це ж правило застосовували для хворих на РШ, і пацієнти з пізнім рецидивом після ад’ювантного лікування брали участь у клінічних випробуваннях, в яких вивчали терапію першої лінії, тоді як ті, у кого були ранні рецидиви, були зареєстровані в клінічних дослідженнях для лікування другої лінії.
Таким чином, пацієнти з рецидивами під час або після завершення ад’ювантної терапії вважаються кандидатами на лікування другої лінії, і для цієї популяції зазвичай уникають монотерапії S-1. Однак наразі немає жодних доказів для рекомендації конкретного режиму лікування.
Схема хіміотерапії, рекомендована для пацієнтів з синдромом обструкції кишечнику або масивного асциту внаслідок канцероматозу. Слід обережно призначати хіміотерапію, беручи до уваги ЗС пацієнта. Рекомендовано лікарські препарати з м’яким профілем токсичності, такі як 5-ФУ у формі інфузії і паклітаксел.
Не встановлено оптимальної схеми лікування для цієї групи хворих, оскільки пацієнти не були допущені до більшості клінічних випробувань при прогресуючому/метастатичному РШ. Більшість пацієнтів у цій групі мали поганий ЗС, що робило неможливим застосування комбінації S-1 + цисплатин. При призначенні хіміотерапії слід ретельно враховувати ризики, і симптоматичну терапію необхідно розглядати як альтернативу.
Дослідження JCOG0106 було одним з небагатьох, в яке були включені тільки пацієнти з перитонеальними метастазами, підтвердженими на КТ. У цьому дослідженні проводили терапію за схемою метотрексат/5-ФУ, в контрольній групі — безперервну монотерапію 5-ФУ. Не отримано достовірної різниці в медіані тривалості життя між групами, проте тривалі інфузії 5-ФУ були менш токсичними [52]. Більш того, в групі 5-ФУ пероральний прийом їжі став можливим у 41% (7/27) пацієнтів, які мали повну дисфагію на початку дослідження. Таким чином, 5-ФУ — препарат першої лінії для пацієнтів з обструкцією кишечнику через перитонеальні метастази, але його вплив на масивний асцит залишається незначним. З іншого боку, III фаза дослідження ISO-5FU10 не показала переваг комбінації 5-ФУ + лейковорин проти S-1 [53]. Так, 5-ФУ + лейковорин, який може бути застосований амбулаторно, є ще одним варіантом лікування пацієнтів із відносно задовільним ЗС.
У дослідженні фази II щотижневого введення паклітакселу в хворих на РШ з асцитом (динаміку оцінювали за допомогою КТ) спостерігали зменшення асциту у 39% (25/64) пацієнтів [54]. У рандомізованому дослідженні фази II другої лінії хіміотерапії порівнювали щотижневе введення паклітакселу з 5-ФУ (або 5-ФУ тривалою інфузією, або метотрексат/5-ФУ, який не використовували в лікуванні першої лінії) у хворих із канцероматозом. Виявлено перевагу паклітакселу у подовженні медіани безрецидивної тривалості життя без впливу на медіану загальної тривалості життя. Водночас паклітаксел був пов’язаний з більш сприятливим профілем токсичності [55]. Таким чином, щотижневе введення паклітакселу може бути рекомендовано для пацієнтів із канцероматозом як в першій, так і в другій лінії. Дослідження фази II режиму FLTAX (комбінація паклітаксел + 5-ФУ + лейковорин) показало зменшення асциту у 44% пацієнтів [56]. Очікуються подальші дослідження порівняння комбінацій препаратів з монотерапією.
Вибір схеми хіміотерапії для пацієнтів літнього віку з неоперабельним РШ. Комбінація S-1 + цисплатин може бути рекомендована хворим із задовільним ЗС, але слід виявляти максимальну обережність, оскільки пацієнти літнього віку в цілому більш уразливі до побічних дій. Монотерапія S-1 може бути обрана для хворих із гіршим ЗС.
Хоча комбінація S-1 + цисплатин є стандартом першої лінії при неоперабельному/рецидивуючому РШ в Японії, тільки пацієнти віком до 74 років брали участь у дослідженні SPIRITS, і тільки 17% (50/298) учасників насправді були віком 70 років і старше. Не виявлено переваги додавання цисплатину в людей похилого віку. Фактично не було ніякої різниці у виживаності між групою комбінованого лікування — S-1 + цисплатин і пацієнтами, які отримували монотерапію S-1 у ретроспективному дослідженні лікування поширеного РШ у хворих віком 70 років. Крім того, відносно сприятливий результат був отриманий при монотерапії S-1 у когорті пацієнтів віком 75 років у дослідженні II фази [57].
Подальші клінічні дослідження необхідні для визначення оптимального режиму хіміотерапії в хворих літнього віку з неоперабельним РШ. Дослідження повинні враховувати ЗС пацієнта з особливою увагою до ниркової і серцевої функції. Після початку лікування треба приділяти увагу не тільки тяжким побічним ефектам, але також враховувати анорексію, стоматит і діарею, які можуть бути особливо виснажливими для пацієнтів цієї вікової категорії.
Хіміотерапевтичний режим, рекомендований як друга лінія терапії при лікуванні хворих на HER2-позитивний РШ. Можуть бути рекомендовані таксани або іринотекан, як і у випадках HER2-негативного РШ. Однак, якщо схема, що містить трастузумаб, не була призначена як лікування першої лінії, можна рекомендувати комбінацію паклітакселу і трастузумабу в режимі щотижневого введення.
Трастузумаб рекомендовано як терапію першої лінії при HER2-позитивному РШ за результатами дослідження ToGA [32]. Немає ніяких даних для рекомендацій певного режиму пацієнтам із HER2-позитивними пухлинами, які прогресували під час або після першої лінії лікування трастузумабом. Таксани або іринотекан можуть бути обрані у випадку лікування другої лінії при HER2-негативному РШ.
З іншого боку, в дослідженні II фази JFMC45-1102 з вивченням щотижневого введення паклітакселу з трастузумабом 46 пацієнтам з HER2-позитивним РШ, яким попередньо була проведена хіміотерапія без трастузумабу, отримано багатообіцяючу частоту відповіді — 37,0% (95% довірчий інтервал 23,2–52,5) із показником контролю захворювання 82,6% (95% довірчий інтервал 68,2–92,2) [58]. Однак пацієнти, що були включені в описане дослідження, не відповідають типовій групі хворих другої лінії лікування, що попередньо отримали комбінацію цисплатин + фторпіримідин. Серед них 12 (26%) хворих проліковані тільки в ад’ювантному режимі; 5 (11%) одержали 2 лінії хіміотерапії. Визначення серцевих функцій після лікування проведено тільки в 1 хворого (>10%), виявлено зниження викиду лівого шлуночка, що потребує подальшого вивчення токсичності.
На сьогодні при прогресуванні захворювання немає доказів на користь ефективності або безпеки продовження застосування трастузумабу у разі його попереднього прийому.
Алгоритм хірургії швидкого відновлення після операції з приводу РШ. Основний напрямок алгоритмів хірургії швидкого відновлення побудований навколо часу виконання деяких основних елементів, таких як видалення назогастральної трубки, початок перорального прийому рідини, початок прийому твердих харчових продуктів, введення антибіотиків, зупинка внутрішньовенного введення рідини і виписка з лікарні (табл. 1). Ці клінічні протоколи рекомендовані до всіх типів оперативних втручань, включаючи ДСРШ, ПРШ або ГЕ, незалежно від того, була операція виконана лапароскопічно чи відкритим способом. Проте післяопераційне лікування повинно бути індивідуалізоване для пацієнтів з високим ризиком з тяжкими супутніми захворюваннями, які включають порушення серцевої, легеневої, печінкової або ниркової функції. Останнім часом дослідники схильні прагнути до подальшого скорочення тривалості післяопераційних госпіталізацій через концепцію хірургії швидкого відновлення, але цінність таких програм в хірургії РШ ще не визначена.
| Дії | День |
| Видалення назогастрального зонда | 1-й день після операції |
| Початок перорального прийому рідини | 1-й день після операції |
| Початок перорального прийому твердої їжі | З 2-го по 4-й день після операції |
| Профілактичний прийом антибіотиків | У день операції |
| Видалення епідурального катетера | На 3-й день після операції |
| Видалення уринарного катетера | На 3-й день після операції |
| Внутрішньовенне введення рідини | До 5–7-го дня після операції |
| Видалення дренажів | На 5-й день після операції |
| Виписка | З 8-го по 14-й день після операції |
Спостереження після операцій з приводу РШ. Наступні дії в амбулаторній клінічній практиці корисні для адаптації пацієнтів до життя вдома, контролю пострезекційних симптомів, подолання проблем із харчуванням. Крім того, епіднагляд за раннім виявленням рецидивів і вторинним раком зазвичай проводиться відповідно до рівня ризику рецидиву, який оцінюється на основі клінічних даних. Однак докази того, що таке спостереження фактично збільшує тривалість життя, відсутні. Через недостатність проспективних досліджень, в яких вивчали програми спостереження після операцій з приводу РШ, неможливо дати будь-які рекомендації щодо того, як часто повинні проводитися обстеження. Однак деякі ретроспективні дослідження показують, що КТ, вимірювання маркерів пухлин (СЕА і СА19-9) і ендоскопія ефективні для виявлення рецидивів, раку кукси шлунка і метахронного множинного раку. Рівень пухлинних маркерів, за необхідності, схильний зростати за 2–3 міс до того, як метастатичні ураження можуть бути виявлені за допомогою методів візуалізації. Моделі програм раннього раку і поширеного раку показано в табл. 2, 3.
| Тривалість | Рік | 1 | 2 | 2,5 | 3 | 4 | 5 | |||
| Місяць | 1 | 6 | 12 | 15 | 24 | 30 | 36 | 48 | 60 | |
| Медичне обстеження, індекс маси тіла | + | + | + | + | + | + | + | + | + | |
| Аналіз крові, онкомаркери | + | + | + | + | + | + | + | + | + | |
| КТ, ультразвукова діагностика | + | + | + | + | + | + | ||||
| Ендоскопія | + | + | + | |||||||
| Тривалість | Рік | 1 | 2 | 2,5 | 3 | 3,5 | 4 | 4,5 | 5 | |||||||
| Місяць | 1 | 3 | 6 | 9 | 12 | 15 | 18 | 21 | 24 | 30 | 36 | 42 | 48 | 54 | 60 | |
| Медичне обстеження, індекс маси тіла | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | |
| Аналіз крові, онкомаркери | + | + | + | + | + | + | + | + | + | + | + | |||||
| КТ, ультразвукова діагностика | + | + | + | + | + | + | + | + | + | |||||||
| Ендоскопія | + | + | + | |||||||||||||
Дослідження, які додатково проводять за необхідності: рентгенографія органів грудної порожнини, колоноскопія, сцинтиграма кістки, позитронна емісійна томографія.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Japanese Gastric Cancer Association. Japanese classification of gastric carcinoma: 3 English edition (2011) Gastric Cancer, 14: 101–112.
2. Kaminishi M., Yamaguchi H., Shimizu N. et al. (1997) Stomach-partitioning gastrojejunostomy for unresectable gastric carcinoma. Arch. Surg., 132: 184–187.
3. Fujitani K., Yang H.K., Mizusawa J. et al. (2016) Gastrectomy plus chemotherapy versus chemotherapy alone for advanced gastric cancer with a single non-curable factor (REGATTA): a phase 3, randomised controlled trial. Lancet Oncol., 17: 309–318.
4. Japanese gastric cancer treatment guidelines 2014 (ver. 4) (2017) Gastric Cancer, 20(1): 1−19.
5. Sano T., Sasako M., Mizusawa J. et al. (2017) Randomized controlled trial to evaluate splenectomy in total gastrectomy for proximal gastric carcinoma. Ann. Surg., 265(2): 277−283.
6. Sasako M., Sano T., Yamamoto S. et al. (2008) D2 lymphadenectomy alone or with para-aortic nodal dissection for gastric cancer. N. Engl. J. Med., 359: 453–462.
7. Tokunaga M., Ohyama S., Hiki N. et al. (2009) Therapeutic value of lymph node dissection in advanced gastric cancer with macroscopic duodenum invasion: is the posterior pancreatic head lymph node dissection beneficial? Ann. Surg. Oncol., 16: 1241–1246.
8. Roviello F., Pedrazzani C., Marrelli D. et al. (2010) Super-extended (D3) lymphadenectomy in advanced gastric cancer. Eur. J. Surg. Oncol., 36: 439–446.
9. Tsuburaya A., Mizusawa J., Tanaka Y. et al. (2014) Neoadjuvant chemotherapy with S-1 and cisplatin followed by D2 gastrectomy with para-aortic lymph node dissection for gastric cancer with extensive lymph node metastasis. Br. J. Surg., 101: 653–660.
10. Yoshida M., Ohtsu A., Boku N. et al. (2004) Long-term survival and prognostic factors in patients with metastatic gastric cancers treated with chemotherapy in the Japan Clinical Oncology Group (JCOG) study. Jpn. J. Clin. Oncol., 34: 654–659.
11. Park I.H., Kim S.Y., Kim Y.W. et al. (2011) Clinical characteristics and treatment outcomes of gastric cancer patients with isolated para-aortic lymph node involvement. Cancer Chemother Pharmacol., 67: 127–136.
12. Fujita J., Kurokawa Y., Sugimoto T. et al. (2012) Survival benefit of bursectomy in patients with resectable gastric cancer: interim analysis results of a randomized controlled trial. Gastric Cancer, 15: 42–48.
13. Sakamoto Y., Sano T., Shimada K. et al. (2007) Favorable indications for hepatectomy in patients with liver metastasis from gastric cancer. J. Surg. Oncol., 95: 534–539.
14. Takemura N., Saiura A., Koga R. et al. (2012) Long-term outcomes after surgical resection for gastric cancer liver metastasis: an analysis of 64 macroscopically complete resections. Langenbecks Arch. Surg., 397: 951–957.
15. Cheon S.H., Rha S.Y., Jeung H.C. et al. (2008) Survival benefit of combined curative resection of the stomach (D2 dissection) and liver in gastric cancer patients with liver metastases. Ann. Oncol., 19: 1146–1153.
16. Kodera Y., Fujitani K., Fukushima N. et al. (2014) Surgical resection of hepatic metastasis from gastric cancer: a review and new recommendation in the Japanese gastric cancer treatment guidelines. Gastric Cancer, 17: 206–212.
17. Bando E., Yonemura Y., Takeshita Y. et al. (1999) Intraoperative lavage for cytological examination in 1297 patients with gastric carcinoma. Am. J. Surg., 178: 256–262.
18. Kodera Y., Ito S., Mochizuki Y. et al. (2012) Long-term follow up of patients who were positive for peritoneal lavage cytology: final report from the CCOG0301 study. Gastric Cancer, 15: 335–337.
19. Bando E., Makuuchi R., Miki Y. et al. (2013) Clinical significance of intraoperative peritoneal cytology in gastric carcinoma-analysis of 3124 patients. 10 International Gastric Cancer Congress, 2013: abstract P27–5.
20. Kinoshita T., Sasako M., Sano T. et al. (2009) Phase II trial of S-1 for neoadjuvant chemotherapy against scirrhous gastric cancer (JCOG0002). Gastric Cancer, 12: 37–42.
21. Okabe H., Ueda S., Obama K. et al. (2009) Induction chemotherapy with S-1 plus cisplatin followed by surgery for treatment of gastric cancer with peritoneal dissemination. Ann. Surg. Oncol., 16: 3227–3236.
22. Mezhir J.J., Shah M.A., Jacks L.M. et al. (2010) Positive peritoneal cytology in patients with gastric cancer: natural history and outcome of 291 patients. Ann. Surg. Oncol., 17: 3173–3180.
23. Sasako M., Sano T., Yamamoto S. et al. (2006) Left thoracoabdominal approach versus abdominal-transhiatal approach for gastric cancer of the cardia or subcardia: a randomised controlled trial. Lancet Oncol., 7: 644–651.
24. Katai H., Sasako M., Fukuda H. et al. (2010) Safety and feasibility of laparoscopy-assisted distal gastrectomy with suprapancreatic nodal dissection for clinical stage I gastric cancer: a multicenter phase II trial (JCOG 0703). Gastric Cancer, 13: 238–244.
25. Nakamura K., Katai H., Mizusawa J. et al. (2013) A phase III study of laparoscopy-assisted versus open distal gastrectomy with nodal dissection for clinical stage IA/IB gastric Cancer (JCOG0912). Jpn. J. Clin. Oncol., 43: 324–327.
26. Kim H.H., Hyung W.J., Cho G.S. et al. (2010) Morbidity and mortality of laparoscopic gastrectomy versus open gastrectomy for gastric cancer: an interim report-a phase III multicenter, prospective, randomized Trial (KLASS Trial). Ann. Surg., 251: 417–420.
27. Gotoda T., Yanagisawa A., Sasako M. et al. (2000) Incidence of lymph node metastasis from early gastric cancer: estimation with a large number of cases at two large centers. Gastric Cancer, 3: 219–225.
28. Hirasawa T., Gotoda T., Miyata S. et al. (2009) Incidence of lymph node metastasis and the feasibility of endoscopic resection for undifferentiated-type early gastric cancer. Gastric Cancer, 12: 148–152.
29. Takizawa K., Kawata N., Tanaka M. et al. (2013) Treatment for intramucosal gastric cancer with mixed type histology (differentiated and undifferentiated). Stomach Intest., 48: 1567–1579.
30. Koizumi W., Narahara H., Hara T. et al. (2008) Randomized phase III study of S-1 alone versus S-1 + cisplatin in the treatment for advanced gastric cancer (The SPIRITS trial) SPIRITS: S-1 plus cisplatin vs S-1 in RCT in the treatment for stomach cancer. Lancet Oncol., 9: 215–221.
31. Boku N., Yamamoto S., Shirao K. et al. (2009) Fluorouracil versus combination of irinotecan plus cisplatin versus S-1 in metastatic gastric cancer: a randomized phase 3 study. Lancet Oncol., 10: 1063–1069.
32. Bang Y.J., Van Cutsem E., Feyereislova A. et al. (2010) Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet, 376: 687–697.
33. Ohtsu A., Shah M.A., Van Cutsem E. et al. (2011) Bevacizumab in combination with chemotherapy as first-line therapy in advanced gastric cancer: a randomized, double-blind, placebo-controlled phase III study. J. Clin. Oncol., 29: 3968–3976.
34. Koizumi W., Kim Y.H., Fujii M. et al. (2014) Addition of docetaxel to S-1 without platinum prolongs survival of patients with advanced gastric cancer: a randomized study (START). J. Cancer Res. Clin. Oncol., 140: 319–328.
35. Narahara H., Ishii H., Imamura H. et al. (2011) Randomized phase III study comparing the efficacy and safety of irinotecan plus S-1 with S-1 alone as first-line treatment for advanced gastric cancer (study GC0301/TOP-002). Gastric Cancer, 14: 72–80.
36. Cutsem E.V., Moiseyenko V.M., Tjulandin S. et al. (2006) Phase III study of docetaxel with cisplatin and 5-fluorouracil as first-line therapy for advanced gastric cancer: a report of the V325 study group. J. Clin. Oncol., 24: 4991–4997.
37. Yamada Y., Higuchi K., Nishikawa K. et al. (2015) Phase III study comparing oxaliplatin plus S-1 with cisplatin plus S-1 in chemotherapy-naïve patients with advanced gastric cancer. Ann. Oncol., 26: 141–148.
38. Cunningham D., Starling N., Rao S. et al. (2008) Capecitabine and oxaliplatin for advanced esophagogastric cancer. N. Engl. J. Med., 358: 36–46.
39. Thuss-Patience P.C., Kretzschmar A., Bichev D. et al. (2011) Survival advantage for irinotecan versus best supportive care as second-line chemotherapy in gastric cancer: a randomized phase III study of the Arbeitsgemeinschaft Internistische Onkologie (AIO). Eur. J. Cancer, 47: 2306–2314.
40. Kang J.H., Lee S.I., Lim D.H. et al. (2012) Salvage chemotherapy for pretreated gastric cancer: a randomized phase III trial comparing chemotherapy plus best supportive care with best supportive care alone. J. Clin. Oncol., 30: 1513–1518.
41. Hironaka S., Ueda S., Yasui H. et al. (2013) Randomized, open-label, phase III study comparing irinotecan with paclitaxel in patients with advanced gastric cancer without severe peritoneal metastasis after failure of prior combination chemotherapy using fluoropyrimidine plus platinum: WJOG 4007 trial. J. Clin. Oncol., 31: 4438–4444.
42. Wilke H., Muro K., Van Cutsem E. et al. (2014) Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (RAINBOW): a double-blind, randomised phase 3 trial. Lancet Oncol., 15: 1224–1235.
43. Fuchs C.S., Tomasek J., Yong C.J. et al. (2014) Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (REGARD): an international, randomised, multicenter, placebo-controlled, phase 3 trial. Lancet, 383: 31–39.
44. Sakuramoto S., Sasako M., Yamaguchi T. et al. (2007) Adjuvant chemotherapy for gastric cancer with S-1, an oral fluoropyrimidine. N. Engl. J. Med., 357: 1810–1820.
45. Sasako M., Sakuramoto S., Katai H. et al. (2011) Five-year outcomes of a randomized phase III trial comparing adjuvant chemotherapy with S-1 versus surgery alone in stage II or III gastric cancer. J. Clin. Oncol., 29: 4387–4393.
46. Takahari D., Hamaguchi T., Yoshimura K. et al. (2011) Feasibility study of adjuvant chemotherapy with S-1 plus cisplatin for gastric cancer. Cancer Chemother. Pharmacol., 67: 1423–1428.
47. Kodera Y., Ishiyama A., Yoshikawa T. et al. (2010) A feasibility study of postoperative chemotherapy with S-1 and cisplatin (CDDP) for gastric carcinoma (CCOG0703). Gastric Cancer, 13: 197–203.
48. Noh S.H., Park S.R., Yang H.K. et al. (2014) Adjuvant capecitabine plus oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC): 5-year follow-up of an open-label, randomised phase 3 trial. Lancet Oncol., 15: 1389–1396.
49. Fuse N., Bando H., Chin K. et al. (2017) Adjuvant capecitabine plus oxaliplatin after D2 gastrectomy in Japanese patients with gastric cancer: a phase II study. Gastric Cancer, 20(2): 332–340.
50. Shitara K., Chin K., Yoshikawa T. et al. (2015) Phase II study of adjuvant chemotherapy of S-1 plus oxaliplatin for patients with stage III gastric cancer after D2 gastrectomy. Gastric Cancer. doi:10.1007/s10120-015-0581-1.
51. Shitara K., Morita S., Fujitani K. et al. (2012) Combination chemotherapy with S-1 plus cisplatin for gastric cancer that recurs after adjuvant chemotherapy with S-1: multi-institutional retrospective analysis. Gastric Cancer, 15: 245–251.
52. Shirao K., Boku N., Yamada Y. et al. (2013) Randomized phase III study of 5-fluorouracil continuous infusion vs. sequential methotrexate and 5-fluorouracil therapy in far advanced gastric cancer with peritoneal metastasis (JCOG0106). Jpn. J. Clin. Oncol., 43: 972–980.
53. Sawaki A., Yamaguchi K., Nabeya Y. et al. (2009) 5FU/l-LV (RPMI) versus S-1 as first-line therapy in patients with advanced gastric cancer: a randomized phase III non-inferiority trial (ISO-5FU10 Study Group trial). Eur. J. Cancer, 7: 364.
54. Imamoto H., Oba K., Sakamoto J. et al. (2011) Assessing clinical benefit response in the treatment of gastric malignant ascites with non-measurable lesions: a multicenter phase II trial of paclitaxel for malignant ascites secondary to advanced/recurrent gastric cancer. Gastric Cancer, 14: 81–90.
55. Nishina T., Boku N., Gotoh M. et al. (2016) Randomized phase II study of second-line chemotherapy with the best available 5-fluorouracil regimen versus weekly administration of paclitaxel in far advanced gastric cancer with severe peritoneal metastases refractory to 5-fluorouracil-containing regimens (JCOG0407). Gastric Cancer, 19(3): 902–910.
56. Iwasa S., Goto M., Yasui H. et al. (2012) Multicenter feasibility study of combination therapy with fluorouracil, leucovorin and paclitaxel (FLTAX) for peritoneal disseminated gastric cancer with massive ascites or inadequate oral intake. Jpn. J. Clin. Oncol., 42: 787–793.
57. Koizumi W., Akiya T., Sato A. et al. (2010) Phase II study of S-1 as first-line treatment for elderly patients over 75 years of age with advanced gastric cancer: the Tokyo Cooperative Oncology Group study. Cancer Chemother. Pharmacol., 65: 1093–1099.
58. Isawa S., Nishikawa K., Miki A. et al. (2013) Multicenter, phase II study of trastuzumab and paclitaxel to treat HER2-positive, metastatic gastric cancer patients naïve to trastuzumab (JFMC45-1102). J. Clin. Oncol., 31(15(S)): 4096.
Обзор IV издания Японских рекомендаций по лечению рака желудка
Национальный институт рака, Киев
Резюме. Рак желудка (РЖ) является одной из главных причин смертности от рака во всем мире. Желудок — пятая по частоте локализация рака, злокачественные образования желудка — третья причина смерти от онкологической патологии. РЖ относят к опухолям с плохим прогнозом. У большинства первичных пациентов выявляют неоперабельный РЖ, риск рецидива является высоким даже после лечения в ранних стадиях. Заболеваемость РЖ в Украине остается высокой, смертность до года составляет 59,4%. Превалирование заболеваемости РЖ в Японии и, соответственно, большой опыт японских хирургов по сравнению с западным миром, где в большинстве стран, к которым относятся и США, эта нозологическая единица является редким заболеванием, является основанием к публикации данного обзора IV англоязычного издания Японских рекомендаций по лечению рака желудка. Представленные рекомендации базируются на результатах рандомизированных исследований и решений консенсусов профессиональных ассоциаций. В IV издании усовершенствованы процедуры диагностики РЖ, методы визуализации и подходы к лечению. В определении оптимального лечебного плана должны быть задействованы врачи разных дисциплин, хирургия — единственный радикальный метод лечения при локализованном РЖ. При распространенном заболевании адъювантная или неоадъювантная терапия обычно применяется в сочетании с хирургическим вмешательством. При отдаленных метастазах РЖ результаты лечения остаются плохими, а средняя выживаемость не превышает 1 года. Основными изменениями в данной версии рекомендаций являются пересмотр раздела о типах операций и определение оптимального объема резекции желудка, впервые лапароскопическая дистальная субтотальная резекция при I стадии РЖ рекомендована в качестве операции выбора, сделан пересмотр рекомендаций к радикальной эндоскопической резекции при раннем РЖ. Японской ассоциацией рака желудка разработано IV издание рекомендаций с целью обеспечить общую основу для понимания проблемы РЖ среди специалистов, пациентов и их семей, оптимизации выбора надлежащего лечения.
рак желудка, клинические рекомендации, стандарты лечения.














Leave a comment