Клінічний випадок одночасного діагностування плоскоклітинного раку і фібросаркоми гортані
Русин А.В.1, Петросов О.В.2, Чумак А.І. 2
- 1Ужгородський національний університет
- 2Закарпатський обласний клінічний онкологічний диспансер, Ужгород
Резюме. У Закарпатському обласному клінічному онкологічному диспансері діагностовано та проліковано хворого з первинно-множинними злоякісними новоутвореннями гортані. Після клінічного та лабораторно-інструментальних методів обстеження у пацієнта виявлено злоякісне новоутворення гортані, проведено курс хіміо- та променевої терапії, а при контрольному обстеженні діагностовано неповний регрес пухлини, після чого прийнято рішення про оперативне втручання і виконано ларингектомію. Після гістологічного та імуногістохімічного дослідження операційного матеріалу діагностовано синхронні первинно-множинні злоякісні новоутворення гортані: плоскоклітинний рак і фібросаркому.

ВСТУП
Первинно-множинні злоякісні пухлини (ПМЗП) — одна з найбільш складних, цікавих і найменш вивчених тем в онкології. Захворюваність на такі новоутворення щорічно зростає. Тривалий час вважали, що виникнення ПМЗП є випадковістю [1]. ПМЗП — це 2 і більше пухлини різної гістологічної будови, які з’явилися в різних органах і дають свої метастази [2]; за іншим визначенням, полінеоплазії — це одночасне або почергове утворення самостійних і незалежних одне від одного вогнищ злоякісного росту [3]. За світовою статистикою, частота розвитку ПМЗП становить 9–10%. Найчастіше виникають 2 пухлини (94%), рідше — 3 (5,5%), а більше ніж 4 — взагалі зрідка (0,03–0,05%) [4–6]. Важливим питанням у проблемі полінеоплазій є критерій первинної множинності. Обов’язковою вимогою щодо достовірності множинних пухлин є їхня дійсна первинність, яка найбільш надійно підтверджується відмінностями в гістологічній структурі. Сучасний етап диференційної діагностики включає застосування імуногістохімічного дослідження, молекулярної біології, які дозволяють виявити принципові відмінності в морфофункціональних характеристиках пухлин, що типуються, в порушенні регуляції в них проонкогенів та генів систем репарації ДНК [3, 4].
За часом виникнення ПМЗП поділяються на синхронні (розвиваються одночасно з первинною пухлиною або протягом 6 міс з моменту її діагностування) і метахронні (розвиваються через різні проміжки часу або після 6-місячного терміну верифікації первинної пухлини). Встановлено факт переважання метахронних ПМЗП над синхронними. Цей інтервал досить умовний, оскільки темпи росту пухлин різні та залежать від їх локалізації в тому чи іншому органі, гістологічної структури та реактивності організму [3, 7].
Основні критерії синхронних ПМЗП:
- гістологічно підтверджена картина злоякісності кожної пухлини (поліморфізм клітин, гіперхромія ядер, висока мітотична активність);
- розміщення пухлин окремо, і між ними має бути як мінімум 0,2 см здорової тканини;
- виключена можливість того, що одна з пухлин є метастазом іншої [4].
У структурі загальної захворюваності на злоякісні новоутворення рак гортані, за різними даними, посідає 4-те–8-ме місце та становить 1–8% усіх локалізацій. Проте в структурі онкооториноларингології злоякісні новоутворення гортані становлять 38–70% [8−11]. За даними Національного канцер-реєстру України [7], захворюваність на рак гортані протягом останніх років в Україні залишається відносно стабільною і сягає 5,2–5,4 на 100 000 населення. До важливих етіологічних факторів, які призводять до розвитку злоякісних новоутворень гортані, належать тютюнопаління та вживання алкоголю. Такий зв’язок підтверджується дослідженнями щодо мутації антионкогену p53 при раку гортані. Крім того, певну роль у виникненні пухлинного процесу відіграють фактори харчування, довкілля, а також HPV-інфікування (human papilloma virus infection) [12–14]. Співвідношення хворих на рак гортані серед чоловіків і жінок становить 10:1 [15–17]. За іншими даними, онкопроцес цієї локалізації в 70% випадків зустрічається у чоловіків [8]. Таким чином, на злоякісні новоутворення гортані хворіють переважно чоловіки працездатного віку (41–60 років). При цьому за частотою виникнення зазначена локалізація злоякісного процесу у чоловіків віком 35–54 років посідає 3-тє місце. Міське населення хворіє на рак гортані в 2 рази частіше, ніж сільське [7, 15, 18]. У більшості випадків (95–98%) злоякісні новоутворення гортані представлені різними гістологічними типами плоскоклітинного раку. Досить рідко виникають саркома (0,5–2,2%), веретеноподібний рак та аденокарцинома [11, 15, 16, 19]. Залежно від первинної локалізації виділяють пухлини: надскладкового (вестибулярного) відділу (50–70%); складкового відділу (25–40%) та підскладкового відділу (0,5–3%) [8, 15, 16]. За характером росту розрізняють: екзофітні (папілярну, вузлову), ендофітно-інфільтративну та змішану форми новоутворень гортані.
У літературі знайдено поодинокі повідомлення про одночасне діагностування злоякісних епітеліальних і м’якотканинних пухлин в одному анатомічному органі та жодної публікації про одночасне діагностування плоскоклітинного раку і фібросаркоми гортані. Знайдене у вітчизняній літературі повідомлення про одночасне діагностування плоскоклітинного раку і рабдоміосаркоми гортані свідчить про те, що проблема множинних пухлин існує в Україні і є доволі актуальною [20].
Мета дослідження — вивчити, діагностувати та описати клінічний випадок одночасного виявлення плоскоклітинного раку та фібросаркоми гортані.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
Хворий А., 1972 р. народження, історія хвороби № 5943/2016, поступив 20.07.2016 р. у Закарпатський обласний клінічний онкологічний диспансер зі скаргами на сиплість голосу та біль в горлі. З анамнезу захворювання відомо, що в листопаді 2015 р. хворий звертався в Закарпатську обласну клінічну лікарню м. Ужгорода з вищезгаданими скаргами, при обстеженні виявлено новоутворення гортані, після чого виконано біопсію пухлиноподібного утворення в ділянці голосових зв’язок. Гістологічний висновок — плоскоклітинний рак G2. З 11.01.2016 по 25.03.2016 р. хворий отримав курс хіміотерапії та телегамматерапії (ТГТ) згідно з протоколом лікування: з 11.01.2016 по 12.02.2016 р. — цисплатин в дозі 150 мг одноразово і 5-флуороурацил в дозі 1000 мг щоденно протягом 4 днів та курс ТГТ сумарною дозою 40 Гр (по 2 Гр на добу); з 29.02.2016 по 25.03.2016 р. — цисплатин в дозі 150 мг одноразово та 5-флуороурацил в дозі 1000 мг/добу упродовж 4 днів та 2-й етап ТГТ сумарною дозою 66 Гр (по 2 Гр щоденно). При контрольному обстеженні в липні 2016 р. виконано ендоскопічне дослідження, під час якого виявлено неповний регрес пухлини, а саме: рухомість гортані дещо знижена зліва. У ділянці голосових зв’язок візуалізується екзоендофітне утворення, червоно-жовтого кольору, щільне. Просвіт в місці пухлини перекритий на ⅓–½. Стан після хіміо- та променевого лікування (2016 р.). Виконано біопсію новоутворення № 14091 від 14.07.2016 р. Гістологічний висновок: комплекси низькодиференційованої злоякісної пухлини G3. Клінічний діагноз: рак гортані зв’язково-підзв’язкової ділянки II стадії T2N0M0. Хворий госпіталізований для хірургічного лікування. Застосовано клініко-лабораторні методи обстеження. Загальний аналіз крові: еритроцити — 4,3•1012/л; гемоглобін — 136 г/л; лейкоцити — 8•109/л; нейтрофіли паличкоядерні — 5%; нейтрофіли сегментоядерні — 65%; еозинофіли — 3%; базофіли — 1%; лімфоцити — 22%; моноцити — 4%; тромбоцити — 285•109/л. Біохімічне дослідження крові: загальний білок — 64,6 г/л, креатинін — 122,1 ммоль/л, сечовина — 5,7 ммоль/л, аланінамінотрансфераза — 11,3 од., аспартатамінотрансфераза — 18,0 од., глюкоза — 4,6 ммоль/л. Загальний аналіз сечі: кількість — 100 мл; колір — жовтий; питома вага — 1012; реакція — кисла; білок — «−»; еритроцити — «−»; лейкоцити — 5–10 у полі зору; глюкоза — «−». Рентгенографічне дослідження: патологій не виявлено. Ультразвукове дослідження органів черевної порожнини: патологій не виявлено. 21.07.2016 р. виконано оперативне втручання — ларингектомію. Операційний матеріал доставлено в патоморфологічну лабораторію для гістологічного дослідження. Макроскопічна картина: у порожнині гортані в зв’язково-підзв’язковій ділянці визначається екзофітне округле утворення діаметром 0,7 см, рожевого кольору, на широкій ніжці, в її основі на відстані 0,3 см візуалізується ендофітне утворення розміром 2 × 1,4 × 0,8 см, біло-сірого кольору, крихке. До стінки гортані ззовні інтимно прилягає щитоподібна залоза розміром 3 × 2,7 × 2 см, на розрізі — темно-червоного кольору з кістами діаметром 0,1–0,3 см.
Гістологічний висновок № 14409-11 від 22.07.2016 р.: екзофітний вузол на ніжці являє собою злоякісну м’якотканинну пухлину з вираженим поліморфізмом клітин, високою мітотичною активністю, в тому числі патологічними мітозами (рис. 1).
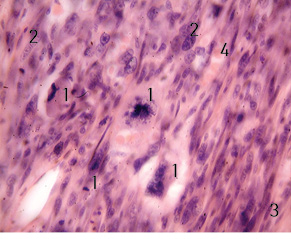
1 — Патологічні мітози в клітинах м’якотканинної злоякісної пухлини; 2 — виражений поліморфізм клітин; 3 — фібробласти; 4 — гемолізовані еритроцити
Вузол вкритий багатошаровим плоским епітелієм звичайної будови (рис. 2).
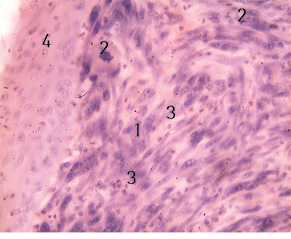
1 — М’якотканинна злоякісна пухлина з вираженим поліморфізмом клітин; 2 — патологічні мітози в клітинах пухлини; 3 — нейтрофільні поліморфно-ядерні лейкоцити; 4 — багатошаровий плоский епітелій
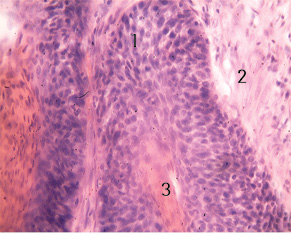
Прилягаюча до ніжки вузла ендофітна пухлина — плоскоклітинний рак G1 без глибокої інфільтрації прилеглих тканин. У краях операційних розрізів пухлинних клітин обох пухлин не виявлено (рис. 3).
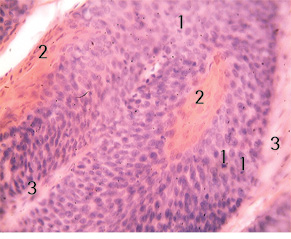
1 — Патологічні мітози в клітинах плоскоклітинного раку; 2 — рогові «перлини» в комплексах плоскоклітинного раку; 3 — стромальна тканина
Після цього хворому виконано імуногістохімічне дослідження обох пухлин на такі маркери, як Vimentin, Cytokeratin AE1/AE3, Desmin.
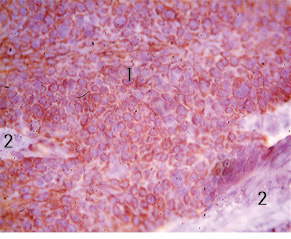
Результати імуногістохімічного дослідження: Vimentin — різко позитивна експресія в клітинах м’якотканинної злоякісної пухлини і від’ємна — в клітинах плоскоклітинного раку та багатошаровому плоскому епітелію, що покриває пухлину (рис. 4, 5). Cytokeratin AE1/AE3 — різко позитивна експресія в клітинах плоскоклітинного раку та від’ємна — в клітинах м’якотканинної злоякісної пухлини (рис. 6).
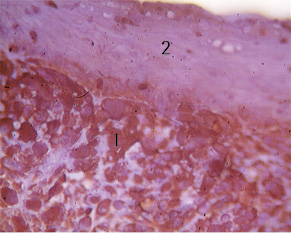
1 — Експресія Vimentin (Monoclonal Mouse Anti-Vimentin Clone V9 Ready-to-Use «Dako», хромоген DAB) в клітинах м’якотканинної пухлини; 2 — багатошаровий плоский епітелій, що покриває пухлину
1 — Від’ємна експресія Vimentin (Monoclonal Mouse Anti-Vimentin Clone V9 Ready-to-Use «Dako», хромоген DAB) в клітинах плосклоклітинного раку; 2 — сполучна тканина; 3 — рогові «перлини» в комплексах плоскоклітинного раку
1 — Експресія Cytokeratin (Monoclonal Mouse Anti-Human Cytokeratin AE1/AE3 Ready-to-Use «Dako», хромоген DAB) в клітинах плоскоклітинного раку; 2 — стромальна тканина
На основі даних гістологічного та імуногістохімічного дослідження можна вважати абсолютно доведеним, що у хворого два злоякісних новоутворення гортані — плоскоклітинний рак G1 і фібросаркома G3.
Отже, на основі клінічних даних, гістологічного та імуногістохімічного дослідження стало можливим встановити остаточний клінічний діагноз — первинно-множинні злоякісні новоутворення: плоскоклітинний рак гортані зв’язково-підзв’язкової локалізації T2N0M0, pG1, II стадія. Продовження хвороби після хіміопроменевої терапії. Фібросаркома гортані T1aN0M0, pG3, IIА стадія.
Через 3 міс хворий звернувся в Закарпатський обласний клінічний онкологічний диспансер для контрольного огляду зі скаргами на наявність припухлості та болю в передній ділянці шиї. При клінічному обстеженні: стан після ларингектомії. На передній поверхні шиї визначається післяопераційний рубець, сформована трахеостома. У передній ділянці шиї визначається щільний, помірно болісний інфільтрат, нерухомий, без чітких меж розміром ~8×6 см. Регіонарні лімфатичні вузли не збільшені. Виконано біопсію інфільтрату. Цитологічний висновок № 7692 від 11.10.2016 р.: аморфні маси на все поле зору, поодинокі лейкоцити. Проведено консервативне лікування з приводу запального інфільтрату передньої ділянки шиї. Лабораторні методи обстеження: загальний аналіз крові: еритроцити — 3,9•1012/л; гемоглобін — 121 г/л; лейкоцити — 7,7•109/л; нейтрофіли паличкоядерні — 3%; нейтрофіли сегментоядерні — 70%; еозинофіли — 1%; лімфоцити — 20%; моноцити — 6%; тромбоцити — 285•109/л. Загальний аналіз сечі: кількість — 100 мл; колір — жовтий; питома вага — 1012; реакція — кисла; білок — 0,025 г/л; еритроцити — «−»; лейкоцити — 15–20 у полі зору; глюкоза — «−». Після проведеного консервативного лікування хворий виписаний з покращенням.
ВИСНОВКИ
Описаний клінічний випадок цікавий тим, що два злоякісних новоутворення, які локалізуються в одному анатомічному органі, мають різну гістологічну структуру без змішування клітинних елементів і відповідають критеріям синхронних ПМЗП. Також, враховуючи підвищення частоти виникнення ПМЗП, практикуючому лікарю слід пам’ятати про можливість наявності двох і більше злоякісних новоутворень в одного пацієнта не тільки в різних органах і системах, а й в одному анатомічному органі, тому слід проводити детальний огляд і збір анамнезу. Причому обов’язкове гістологічне та імуногістохімічне дослідження новоутворень. Припущення, що друга пухлина (фібросаркома) була індукована проведеним специфічним лікуванням, було виключено через дані літератури, згідно з якими латентний період розвитку пухлин, індукованих специфічною терапією, становить 3–20 років [21–28].
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Слинчак С.М. (1968) Множественные злокачественные опухоли. Киев: Здоров’я: 191 с.
2. Абдурасулов Д.М., Никишин К.Е. (1968) Первично-множественные опухоли. Ташкент: Медицина: 652 с.
3. Чиссов В.И., Давыдов М.И. (2008) Онкология: национальное руководство. М.: ТЭЩТАР-Медиа: 537–538.
4. Hulikal N., Ray S., Thomas J., Fernandes D.J. (2012) Second primary malignant neoplasms: a clinicopathological analysis from a cancer centre in India. Asian Pacific. J. Cancer Prevention, 13: 6087–6091.
5. Бохман Я.В. (2002) Первично-множественные злокачественные опухоли. Москва: 47–59.
6. Пачес А.И. (2000) Опухоли головы и шеи. М.: Медицина: 126–141.
7. Федоренко З.П., Михайлович Ю.Й., Гулак Л.О. та ін. (2009) Рак в Україні, 2007–2008. Захворюваність, смертність, показники діяльності онкологічної служби. Бюл. Нац. канцер-реєстру України, 10: 103 с.
8. Абизов Р.А. (2001) Онкоотоларингологія. Лекції. Київ: Книга плюс, 272 с.
9. Заридзе Д.Г. (2004) Канцирогенез. М.: Медицина, 576 с.
10. Краевский Н.А., Смольяняков А.В., Саркисов Д.С. (1993) Патологоанатомическая диагностика опухолей человека. Руководство для врачей в 2-х томах. 4-е изд., перераб. М.: Медицина, Т. 1, 560 с.
11. Barnes L., Eveson J., Richard P., Sidransky D. (2005) World Health Organization of Tumor’s Pathology and Genetics of Head and Neck Tumours. Lyon: IARC Press, 430 p.
12. Gissmann L., Wolnik L., Ikenberg H. (1983) Human papillomavirus types 6 and 11 DNA sequences in genital and laryngeal papillomas and in some cervical cancers. Proc. Nat. Acad. Sci. USA, 80: 560–563.
13. Hussein M.R. (2005) Alterations of p53 and Bcl-2 protein expression in the laryngeal intraepithelial neoplasia. Cancer Biol. Ther., 4(2): 213–217.
14. Lindeberg H., Krogdahl A. (1999) Laryngeal cancer and human papillomavirus: HPV is absent in the majority of laryngeal carcinomas. Cancer Lett., 146: 9–13.
15. Ольшанский В.О. (1988) Злокачественные опухоли полости рта, глотки и гортани. М.: Медицина, 274 с.
16. Пачес А.И. (2000) Опухоли головы и шеи. М.: Медицина, 467с.
17. Ушаков В.С., Иванов С.В. (2003) Рак гортани: современные возможности и перспективы. Практическая онкология, 4(1): 56–60.
18. Шалимов С.А., Федоренко З.П., Гулак Л.О. (2001) Структура заболеваемости населения Украины злокачественными новообразованиями. Онкология, 3(2–3): 91–95.
19. Пальцев М.А., Аничков Н.М. (2005) Атлас патологии опухолей человека. М.: Медицина, 424 с.
20. Фёдоров Д.Ю., Ярынич К.В., Ярынич В.И., Царева Е.В. (2015) Рабдомиосаркома гортани у взрослых. Обзор литературы. Клинические наблюдения. Случай сочетания рабдомиосаркомы гортани и плоскоклеточного рака. Клин. онкол., 4(20): 39–43.
21. Вихтер А.М., Переслегин И.А., Галил-Оглы Г.А., Порошин К.К. (1977) Опухолевидные образования и опухоли соединительной ткани. М.: Медицина, 132 с.
22. Wakeford R. (2004) The cancer epidemiology of radiation. Oncogene, 23 (38): 6404–6428.
23. Канаев С.В. (2002) Роль лучевой терапии в лечении рака молочной железы. Практическая онкология, 3(1): 45–51.
24. Гусева Л.И., Гунько Р.Л., Зарецкая А.И. и др.(1981) Саркома подвздошной кости, индуцированная облучением опухоли яичника. Мед. радиол., 26(7): 54–56.
25. Максимов С.Я. (2009) Первично-множественные опухоли органов репродуктивной системы. Практическая онкология, 10(2): 117–123.
26. Орлова А.Л. (1974) Клиническое излечение рака культи влагалища, возникшего через 19 лет после комбинированного лечения рака шейки матки. Вопр. онкол., 20(11): 105.
27. Castra E.B., Rosen P.P., Quan S.H.Q. (1973) Carcinoma of large intestine in patients irradiated for carcinoma of cervix and uterus. Cancer, 31(1): 45–52.
28. O’Connor T.W., Rombeau J.L., Levine Y.S. et al. (1979) Late development of colorectal cancer subsequent to pelvic irradiation. Dis. Colon Rectum, 27(2): 123–128.
Клинический случай одновременного диагностирования плоскоклеточного рака и фибросаркомы гортани
Закарпатский областной клинический онкологический диспансер, Ужгород
Ужгородский национальный университет
Резюме. В Закарпатском областном клиническом онкологическом диспансере диагностирован и пролечен больной с первично-множественными злокачественными новообразованиями гортани. После клинического и лабораторно-инструментальных методов обследования у пациента выявлено злокачественное новообразование гортани, проведен курс химио- и лучевой терапии, а при контрольном обследовании диагностирован неполный регресс опухоли, после чего принято решение об оперативном вмешательстве и выполнена ларингэктомия. После гистологического и иммуногистохимического исследования операционного материала диагностированы синхронные первично-множественные злокачественные новообразования гортани: плоскоклеточный рак и фибросаркома.
первично-множественные злокачественные новообразования, гортань, плоскоклеточный рак, фибросаркома, иммуногистохимическое исследование.














Leave a comment