Зв’язок кількісних метаболічних показників злоякісних пухлин шийки матки зі ступенем їх клітинної диференціації за даними позитронно-емісійної томографії
Бабкіна Т.М.1, Новіков М.Є.2, Вінницька А.Б.2
- 1Національна медична академія післядипломної освіти імені П.Л. Шупика, Київ
- 2Лікарня ізраїльської онкології «LISOD», Київська обл., Обухівський р-н, с. Плюти
Резюме. Представлене ретроспективне дослідження присвячене зв’язку різноманітних кількісних метаболічних показників первинних плоскоклітинних злоякісних пухлин шийки матки, які розраховуються при ПЕТ/КТ, зі ступенем клітинної диференціації цих пухлин. Отримані результати свідчать про статистично достовірне збільшення SUVmean та TLG (p<0,05) у групі низькодиференційованих пухлин (G3). Достовірної різниці значення інших досліджуваних кількісних показників при цій невеликій групі досліджуваних не виявлено. Отримані результати свідчать про можливість застосування кількісної метаболічної інформації ПЕТ/КТ у формуванні прогнозу захворювання. Проте наявність контрастних та неоднорідних результатів досліджень взаємозв’язку кількісних метаболічних параметрів та морфологічних характеристик пухлин шийки матки, а також показників виживаності цих пацієнтів зумовлює подальшу необхідність досліджень зі збільшенням груп пацієнтів для пошуку метаболічних параметрів, які б найбільш достовірно забезпечували додаткову предиктивну інформацію задля долучення її до процесу мультидисциплінарного вибору тактики лікування таких пацієнтів.
Одержано 10.01.2018
Прийнято до друку 01.03.2018
Вступ
Рак шийки матки займає друге місце за розповсюдженістю серед усіх злоякісних новоутворень у жінок у світі. В Україні, за даними Національного канцер-реєстру України, посідає п’яте місце у структурі захворюваності та сьоме — у структурі смертності жіночого населення [1, 2]. Захворюваність на цю патологію широко варіює у всьому світі, від менш ніж одного випадку до більш ніж п’ятдесяти на сто тисяч населення [3]. Незважаючи на значне зниження захворюваності та смертності, перш за все завдяки широкому розповсюдженню цитологічного дослідження (тест Папаніколау) зі скринінговою метою та вакцинації проти папіломавірусу у розвинутих країнах, рак шийки матки залишається значущою загрозою для жіночого здоров’я у всьому світі, призводячи до близько ста п’ятдесяти тисяч смертей щорічно [4–6]. Близько 80–85% карцином шийки матки — плоскоклітинні, а 15–20% становлять аденокарциноми та аденосквамозні пухлини [7]. Приблизно у третини всіх пацієнтів з раком шийки матки виникають рецидиви захворювання, зазвичай протягом перших двох років після завершення первинного лікування [8]. Перед початком лікування точне стадіювання, оцінка прогностичних факторів та факторів ризику є ключовими для скерування мультидисциплінарного підходу до вибору тактики лікування. Первинне стадіювання раку шийки матки зазвичай забезпечується об’єднанням інформації, отриманої при клінічному гінекологічному обстеженні, магнітно-резонансній та комп’ютерній томографії (КТ) [9]. Наявні системи стадіювання, що застосовуються до пухлин шийки матки (FIGO, TNM), враховують перш за все розміри первинної пухлини, її розповсюдження на прилеглі та навколишні структури в тазу, наявність або відсутність метастатичного ураження регіонарних лімфатичних вузлів та віддалене, або гематогенне, метастатичне ураження [10–13]. Додатково рак шийки матки розподіляють на три градації відповідно до гістологічних критеріїв. Така градація є відображенням диференціації пухлинних клітин, їх подібності до клітин та тканин походження: перша градація (G1, добре диференційовані) та друга градація (G2, помірно диференційовані) є найбільш частими категоріями, в той час як третя градація (G3, низькодиференційовані) відповідає найбільш агресивним пухлинам. Позитронно-емісійна томографія (ПЕТ) із міченою фтордезоксиглюкозою є важливим інструментом діагностики та стадіювання раку шийки матки, який забезпечує отримання метаболічних даних щодо пухлинного процесу [14]. Метою дослідження є ретроспективна оцінка взаємозв’язку низки кількісних метаболічних показників первинних плоскоклітинних пухлин шийки матки зі ступенем клітинної диференціації цих пухлин.
Об’єкт і методи дослідження
Для дослідження ретроспективно відібрано 21 пацієнтку (віком 28–59 років, середній вік 47 років) з верифікованим плоскоклітинним раком шийки матки, з первинними пухлинами, які відповідали критерію Т2 (за TNM класифікацією, 7-ма редакція) або вище, яким було проведено ПЕТ/КТ перед початком спеціального лікування з метою визначення розповсюдженості процесу, 12 (57%) пацієнток з помірно диференційованими пухлинами (G2) та відповідно 9 (43%) — з низькодиференційованими. Усім пацієнткам ПЕТ/КТ-дослідження проведено за допомогою комбінованого томографа Philips Gemini 16 із використанням протоколу дослідження із дотриманням рекомендацій EANM щодо метаболічної візуалізації солідних пухлин (рис. 1). Збір ПЕТ-даних виконували в 3D-режимі, реконструкцію ПЕТ-зображень проведено за стандартними алгоритмами виробника (Philips 3D RAMLA). Вимірювання та розрахунок кількісних показників з отриманих ПЕТ-зображень проведено за допомогою програмного забезпечення OsiriX MD, статистичну обробку даних — із використанням GraphPad Prism 7. Ретроспективно вимірювали та розраховували такі кількісні метаболічні показники первинних пухлин шийки матки: SUVmax (значення найбільш інтенсивного вокселя в ділянці інтересу), SUVpeak (середнє значення вокселів в сфері об’ємом 1 см, центром якої є найбільш інтенсивний воксель всього об’єму інтересу, якщо таких вокселів декілька, обирається сфера з найбільшим результатом), SUVmean (середнє значення всіх вокселів у сегментованому об’ємі інтересу), MTV 41%max (загальна кількість вокселів, або об’єм ділянки інтересу, яка сегментована за правилом включення вокселів, значення яких не менше 41% від значення SUVmax), TLG 41%max (добуток MTV 41%max та середнього значення всіх у нього включених вокселів). Визначення об’ємів інтересу проводилося в напівавтоматичному режимі — розташування первинного об’єму інтересу вручну із застосуванням сферичного VOI та подальшою автоматичною сегментацією та розрахунком кількісних показників. Враховуючи анатомічні особливості розташування первинних пухлин, у кожному випадку проводилася корекція за допомогою кореляції з багатоплощинними реконструкціями для уникнення включення до ділянки інтересу або сегментованого об’єму активності сечі в сечовому міхурі.
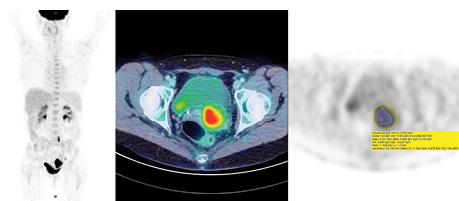
Результати
Середні значення виміряних та розрахованих кількісних метаболічних показників у групах із помірно диференційованими та низькодиференційованими плоскоклітинними пухлинами шийки матки наведено у таблиці.
| G | Кількісні метаболічні показники | ||||
| SUVmax | SUVpeak | SUVmean | MTV 41%max | TLG 41%max | |
| G2 | 13,49±1,162 | 11,35±1,068 | 7,921±0,7258 | 32,66±4,284 | 274,9±44 |
| G3 | 17,7±1,959 | 15,25±1,795 | 11,53±1,116 | 43,76±7,672 | 556,6±140,7 |
Статистично достовірна відмінність (p<0,05) кількісних метаболічних показників між помірно диференційованими та низькодиференційованими пухлинами була визначена за SUVmean (p=0,0108) та TLG 41%max (p=0,0449) — ці показники значимо вищі в групі пацієнток із низькодиференційованими пухлинами. Розподіл значень цих показників продемонстровано на рис. 2 та 3 відповідно.
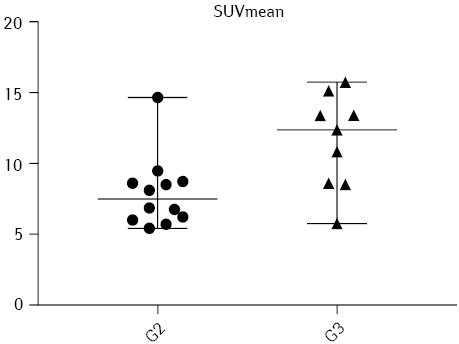
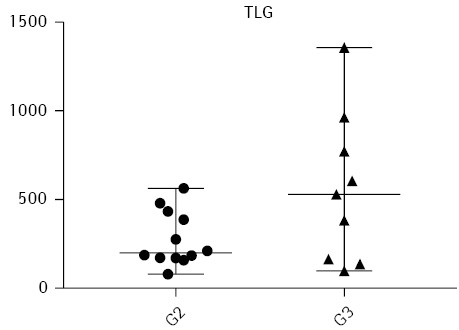
Відмінності інших розрахованих кількісних метаболічних показників у групах із помірно диференційованими та низькодиференційованими пухлинами у цій невеликій популяції пацієнтів не були статистично достовірними, хоча й продемонстрували тенденцію до збільшення значень у низькодиференційованих пухлинах.
Обговорення
Медична візуалізація відіграє важливу роль в обстеженні пацієнтів з раком шийки матки — від первинної діагностики до оцінки розповсюдженості захворювання. У низці досліджень [15, 16] продемонстровано корисність ПЕТ в оцінці прогнозу у таких пацієнтів завдяки визначенню первинних пухлин та віддаленого метастатичного ураження, що забезпечує стратифікацію ризиків у цій когорті хворих. Дані метаболічної ПЕТ мають велике значення для прийняття рішень у різноманітних клінічних онкологічних ситуаціях, наприклад, швидше та точніше відображаючи зміни після проведення лікування, порівняно зі структурними радіологічними критеріями, забезпечуючи більш точну оцінку ефективності проведеного лікування [17–19]. В умовах первинного стадіювання ПЕТ/КТ є ефективним методом визначення нодального лімфатичного розповсюдження, в першу чергу при наявності локально розповсюджених пухлин (FIGO >1B2), та виявлення віддаленого гематогенного метастазування. Проте метаболічна ПЕТ має низьку ефективність у скринінгу раку шийки матки та виявленні невеликих пухлин насамперед через обмежену просторову роздільну здатність [20, 21]. Окрім інформації, яка доповнює або уточнює клінічне стадіювання та дані конвенційних/структурних методів візуалізації, ПЕТ із фтордезоксиглюкозою має можливість кількісно відобразити та оцінити метаболічні властивості пухлини за допомогою розрахунку низки кількісних метаболічних показників, заснованих на стандартизованих значеннях накопичення радіофармпрепарату (SUV). Такі дані корелюють із морфологічними та структурними предиктивними факторами або несуть самостійне предиктивне значення щодо загального прогнозу та/або відповіді на спеціальне лікування [22–26]. Аналізуючи результати проведеного дослідження, слід зазначити як його ретроспективний характер, так і відносно малу групу досліджуваних. Проте, незважаючи на невеликий обсяг даних, продемонстровано статистично достовірну різницю таких кількісних метаболічних показників, як SUVmean та TLG, у групах із помірно та низькодиференційованими плоскоклітинними пухлинами. Необхідно зазначити, що дослідження різних груп авторів демонстрували як наявність, так і відсутність значущого зв’язку між різними кількісними метаболічними параметрами первинних пухлин шийки матки та їх гістологічними характеристиками і параметрами виживаності. Так, наприклад, F. Xue та співавтори [23] дійшли до висновку, що метаболічна активність пухлин шийки матки є предиктором виживаності, спираючись на показник SUVmax. Цей показник часто вважають найкращим відображенням накопичення радіофармпрепарату пухлиною як найменш залежний від парціального об’ємного ефекту та операторонезалежний, проте найбільш варіабельний через високий рівень шуму в ПЕТ-даних. До того ж цей параметр відображає інформацію щодо лише одного вокселя з усієї ділянки інтересу та може не надавати достатньо інформації про розподілення препарату у всій пухлині [27, 28]. Також опубліковано результати досліджень інших груп авторів, які демонструють значущу кореляцію таких кількісних метаболічних даних, як MTV, зі ступенем диференціації пухлин шийки матки [29, 30]. Водночас наявні й дані на користь відсутності зв’язку між кількісними метаболічними параметрами та ступенем диференціації злоякісних пухлин шийки матки [31].
Висновки
Наявність контрастних та неоднорідних результатів при дослідженнях взаємозв’язку різноманітних кількісних метаболічних параметрів та морфологічних характеристик пухлин шийки матки, а також різноманітних показників виживаності цих пацієнтів зумовлює подальшу необхідність досліджень зі збільшенням досліджуваних груп для пошуку кількісних метаболічних параметрів, які б найбільш достовірно забезпечували додаткову предиктивну інформацію задля долучення її до процесу мультидисциплінарного вибору тактики ведення та лікування таких пацієнтів.
Список використаної літератури
1. Parkin D.M., Bray F., Ferlay J., Pisani P. (2005) Global cancer statistics, 2002. CA Cancer J. Clin., 55: 74–108.
2. Рак в Україні, 2015-2016. Захворюваність, смертність, показники діяльності онкологічної служби (2017) Бюл. Нац. Канцер-реєстру України, № 18: 10–13.
3. Arbyn M., Castellsagu X., de Sanjos S. et al. (2011) Worldwide burden of cervical cancer in 2008. Ann. Oncol., 22: 2675–2686.
4. Stanley M. (2008) Human papillomavirus vaccines versus cervical cancer screening. Clin. Oncol. (R. Coll. Radiol.), 20: 388–394.
5. Jemal A., Siegel R., Ward E. et al. (2008) Cancer statistics, 2008. CA Cancer J. Clin., 58: 71–96.
6. Plummer M., Franceschi S. (2002) Strategies for HPV prevention. Virus Res., 89: 285–293.
7. Chaturvedi A.K., Kleinerman R.A., Hildesheim A. et al. (2009) Second cancers after squamous cell сarcinoma and adenocarcinoma of the cervix. J. Clin. Oncol., 27: 967–973.
8. Grigsby P.W. (2008) The prognostic value of PET and PET/CT in cervical cancer. Cancer Imaging, 8: 146–155.
9. Son H., Kositwattanarerk A., Hayes M.P. et al. (2010) PET/CT evaluation of cervical cancer: spectrum of disease. RadioGraphics, 30: 1251–1268.
10. Mirpour S., Mhlanga J.C., Logeswaran P. et al. (2013) The role of PET/CT in the management of cervical cancer. AJR Am. J. Roentgenol., 201: W192–W205.
11. Quinn M.A., Benedet J.L., Odicino F. et al. (2006) Carcinoma of the cervix uteri. FIGO 26th Annual Report on the Results of Treatment in Gynecological Cancer. Int. J. Gynaecol. Obstet., 95 (Suppl. 1): S43–S103.
12. Guo L., Liu X., Wang L. et al. (2015) Outcome of international federation of gynecology and obstetrics stage iib cervical cancer from 2003 to 2012: An evaluation of treatments and prognosis: A retrospective study. Int. J. Gynecol. Cancer, 25: 910–918.
13. Ellenson L.H., Wu T.C. (2004) Focus on endometrial and cervical cancer. Cancer Cell., 5: 533–538.
14. Zhao Q., Feng Y., Mao X., Qie M. (2013) Prognostic value of fluorine‑18‑fluorodeoxyglucose positron emission tomography or PET‑computed tomography in cervical cancer: A meta‑analysis. Int. J. Gynecol. Cancer, 23: 1184–1190.
15. Yoo J., Choi J.Y., Moon S.H. et al. (2012) Prognostic significance of volume‑based metabolic parameters in uterine cervical cancer determined using 18F‑fluorodeoxyglucose positron emission tomography. Int. J. Gynecol. Cancer, 22: 1226–1233.
16. Miccò M., Vargas H.A., Burger I.A. et al. (2014) Combined pre‑treatment MRI and 18F‑FDG PET/CT parameters as prognostic biomarkers in patients with cervical cancer. Eur. J. Radiol., 83: 1169–1176.
17. Wahl R.L., Jacene H., Kasamon Y., Lodge M.A. (2009) From RECIST to PERCIST: Evolving considerations for PET response criteria in solid tumors. J. Nucl. Med., 50 (Suppl. l): S122–S150.
18. Michaelis L.C., Ratain M.J. (2006) Measuring response in a post‑RECIST world: From black and white to shades of grey. Nat. Rev. Cancer, 6: 409–414.
19. Stefano A., Russo G., Ippolito M. et al. (2014) Evaluation of erlotinib treatment response in non‑small cell lung cancer using metabolic and anatomic criteria. Q. J. Nucl. Med. Mol. Imaging, May 9 (Epub. ahead of print).
20. Ohno Y., Nishio M., Koyama H. et al. (2013) Comparison of quantitatively analyzed dynamic area-detector CT using various mathematic methods with FDG PET/CT in management of solitary pulmonary nodules. Am. J. Roentgenol., 200: 593–602.
21. Kitajima K., Murakami K., Kaji Y., Sugimura K. (2010) Spectrum of FDG PET ICT findings of uterine tumors. Am. J. Roentgenol., 195: 737–743.
22. Kidd E.A., Siegel B.A., Dehdashti F. (2007) The standardized uptake value for F-18 fluorodeoxyglucose is a sensitive predictive biomarker for cervical cancer treatment response and survival. Cancer, 110: 1738–1744.
23. Xue F., Lin L.L., Dehdashti F. (2006) F-18 Fluorodeoxyglucose uptake in primary cervical cancer as an indicator of prognosis after radiation therapy. Gynecol. Oncol., 101: 147–151.
24. Singh A.K. (2003) FDG-PET lymph node staging and survival of patients with FIGO stage IIIb cervical carcinoma. Int. J. Radiat. Oncol. Bio. Phys., 56: 489–493.
25. Kwee T.C., Basu S., Saboury B. et al. (2011) A new dimension of FDG‑PET interpretation: Assessment of tumor biology. Eur. J. Nucl. Med. Mol. Imaging, 38: 1158–1170.
26. Kidd E.A., Spencer C.R., Huettner P.C. et al. (2009) Cervical cancer histology and tumor differentiation affect 18F‑fluorodeoxyglucose uptake. Cancer 115: 3548–3554.
27. Stefano A., Gallivanone F., Messa C. et al. (2014) Metabolic impact of partial volume correction of (18F) FDG PET‑CT oncological studies on the assessment of tumor response to treatment. Q. J. Nucl. Med. Mol. Imaging, 58: 413–423.
28. Tanvetyanon T., Eikman E.A., Sommers E. et al. (2008) Computed tomography response, but not positron emission tomography scan response, predicts survival after neoadjuvant chemotherapy for resectable non‑small‑cell lung cancer. J. Clin. Oncol., 26: 4610–4616.
29. Grueneisen J., Schaarschmidt B.M., Heubner M. et al. (2015) Integrated PET/MRI for whole‑body staging of patients with primary cervical cancer: preliminary results. Eur. J. Nucl. Med. Mol. Imaging, 42: 1814–1824.
30. Kurokawa T., Yoshida Y., Kawahara K. et al. (2004) Expression of GLUT‑1 glucose transfer, cellular proliferation activity and grade of tumor correlate with (F‑18)‑fluorodeoxyglucose uptake by positron emission tomography in epithelial tumors of the ovary. Int. J. Cancer, 109: 926–932.
31. Mocciaro V., Scollo P., Stefano A. et al. (2016) Correlation between histological grade and positron emission tomography parameters in cervical carcinoma. Oncology Letters, 12(2): 1408–1414.
Связь количественных метаболических показателей злокачественных опухолей шейки матки со степенью их клеточной дифференциации по данным позитронно-эмиссионной томографии
Национальная медицинская академия последипломного образования имени П.Л. Шупика, Киев
Больница израильской онкологии «LISOD», Киевская обл., Обуховский р-н, с. Плюты
Резюме. Представленное ретроспективное исследование посвящено связи различных количественных показателей первичных плоскоклеточных злокачественных опухолей шейки матки, рассчитываемых при ПЭТ/КТ, со степенью клеточной дифференциации этих опухолей. Полученные результаты свидетельствуют о статистически достоверном увеличении SUVmean и TLG (p<0,05) в группе низкодифференцированных опухолей (G3). Достоверного различия значения других количественных показателей при данной небольшой выборке не выявлено. Полученные результаты свидетельствуют о возможности использования количественной метаболической информации ПЭТ/КТ в формировании прогноза заболевания. Впрочем, наличие контрастных и неоднородных опубликованных результатов исследований, посвященных взаимосвязи различных метаболических количественных показателей и морфологических характеристик опухолей шейки матки, а также различных показателей выживаемости этих пациентов обусловливает дальнейшую необходимость исследований с увеличением групп для поиска параметров, которые бы наиболее достоверно обеспечивали дополнительную предиктивную информацию для включения ее в процесс мультидисциплинарного выбора тактики лечения таких пациентов.
карцинома шейки матки; метаболическая ПЭТ/КТ; количественные метаболические показатели; степень дифференциации опухолей.
Новіков Микола Євгенович
08720, Київська обл., Обухівський р-н, с. Плюти, вул. А. Малишка, 27
Лікарня ізраїльської онкології «ЛІСОД»
E-mail: nicknovi@gmail.com
Correspondence:
Novikov Mykola Evgenovych
27 A. Malyshko str., Pliuty, Obukhivskyi dist., Kyiv region 08720
Israeli Oncologic Hospital «LISOD»
E-mail: nicknovi@gmail.com














Leave a comment