Сучасна диференційна цитологічна діагностика аденокарциноми, мезотеліоми і реактивного серозиту
Резюме. У статті викладена узагальнююча інформація про використання сучасного імуноцитохімічного (ІЦХ) методу в диференційній цитологічній діагностиці аденокарциноми, мезотеліоми і реактивного серозиту. Показана можливість використання ІЦХ методу на традиційних цитологічних препаратах. Встановлено, що для клітин аденокарциноми найбільш характерні позитивні ІЦХ реакції до епітеліального антигену (Ber-EP4) (85–90%), раково-ембріонального антигену (40–67%), епітеліально-мембранного антигену (60–63%); для мезотеліоми — до панцитокератину (C AE1/AE3) (92–100%), цитокератину 5/6 (44–50%), калретиніну (62–100%) і віментину (50–56%); у клітинах реактивного мезотелію ІЦХ реакція до віментину позитивна в 28% випадків, калретиніну — в 28%.
Резюме. В статье изложена обобщающая информация об использовании современного иммуноцитохимического (ИЦХ) метода в дифференциальной цитологической диагностике аденокарциномы, мезотелиомы и реактивного серозита. Показаны возможности использования ИЦХ метода на традиционных цитологических препаратах. Установлено, что для клеток аденокарциномы наиболее характерны положительные ИЦХ реакции к эпителиальному антигену (клон Ber-EP4) (85–90%), раково-эмбриональному антигену (40–67%), эпителиально-мембранному антигену (60–63%); для мезотелиомы — к панцитокератину (C AE1/AE3) (92–100%), цитокератину 5/6 (44–50%), калретинину (62–100%) и виментину (50–56%); в клетках реактивного мезотелия ИЦХ реакция к виментину положительна в 28% случаев, калретинину — в 28%.
Получено 08.02.2018
Принято в печать 20.03.2018
Злокачественные заболевания часто сопровождаются выпотом в плевральную и брюшную полости, а цитологический метод является основным при изучении его клеточного состава. Цитологическое исследование экссудатов из серозных полостей часто оказывается единственным методом морфологической верификации диагноза до начала проведения специального лечения.
Мезотелиома, как поражение серозных оболочек, встречается гораздо реже по сравнению с метастатическим, вторичным заболеванием. Известно, что чаще всего метастазируют в серозные полости с поражением мезотелия раковые опухоли железистого типа различной локализации: у мужчин — в 66% и у женщин — в 82% наблюдений [4].
В одних наблюдениях клетки мезотелия выглядят малоизмененными и их можно легко оценить. Но в большинстве случаев при опухолевых заболеваниях мезотелий приобретает признаки пролиферации различной степени выраженности и атипии, что значительно усложняет их дифференциальную диагностику с элементами злокачественной опухоли.
В подобных наблюдениях отмечается высокая клеточность мазков, увеличение размера и изменение формы клеток, заметная гипертрофия ядер и ядрышек в отдельных клетках, формирование объемных, сферических структур, присутствие патологических митозов как в клетках мезотелия, так и в опухолевых клетках, наличие многоядерных клеток. Наличие гистиоцитарных элементов с признаками выраженной пролиферации, которые отмечаются в выпотной жидкости при воспалительном процессе, можно ошибочно принять за клетки рака. Следует учитывать также, что в жидкой среде все клетки, как опухолевые, так и неопухолевые, имеют тенденцию округляться, их специфические черты сглаживаются и они становятся похожими друг на друга.
Таким образом, можно подытожить, что клетки мезотелия с признаками пролиферации и нерезко выраженной атипии сложно дифференцировать от клеток аденокарциномы и мезотелиомы.
Эти сложности удается преодолеть с помощью современного иммуноцитохимического (ИЦХ) метода, основанного на высокоспецифичной реакции антиген-антитело, которая позволяет установить в клетках локализацию разнообразных молекулярных структур и выяснить их гистогенетическую природу. Согласно данным литературы, чувствительность рутинного цитологического метода на светооптическом уровне составляет 57%, а специфичность — 89%. В то же время ИЦХ исследование в ряде случаев, по данным некоторых авторов, повышает чувствительность до 93%, а специфичность — до 97% [4]. Кроме того, с помощью ИЦХ метода можно в 79% наблюдений подтвердить диссеминацию опухоли, заподозренную по материалам традиционного цитологического исследования, и при этом в 17% — избежать гипердиагностики опухолевого процесса [1].
ИЦХ метод известен еще с конца 70-х годов прошлого столетия. На протяжении последних 40 лет изучено применение большого количества различных моноклональных антител (МкАТ) для дифференциальной диагностики первичных и вторичных поражений серозных оболочек. Подобраны некоторые панели МкАТ для решения вопроса о доброкачественном или злокачественном характере патологического процесса по выпоту и первичной локализации метастатических опухолевых клеток в экссудате. При этом в каждом случае используют специально подобранный набор антител.
В Украине одной из первых публикаций, посвященных использованию ИЦХ метода в дифференциальной диагностике пролиферирующего мезотелия и метастазов злокачественных опухолей, является монография профессора Д.Ф. Глузмана и соавторов [2, 3], в которой показано, что для дифференциации раковых и мезотелиальных клеток наибольшее значение имеют МкАТ к раково-эмбриональному антигену (CEA), эпителиальному антигену (клон Ber-EP4), антигену В 6.2.
Другие авторы освещают чувствительность того или иного антитела в диагностике клеток эпителиального или мезотелиального происхождения [5–12]. Следует отметить, что в работе Z.A. Syed и S.C. Edmund [10] подтверждается высокая чувствительность применения ИЦХ метода. Авторы показали, что чувствительность клеток мезотелиомы к калретинину составляет 65–100%, цитокератину (CK) 5/6 — 83%, WT1 — 78%, тогда как положительная реакция к эпителиальному антигену в клетках аденокарциномы составляет 92%, к CEA — 85–95% [10].
Зарубежные авторы проводят изучение чувствительности и специфичности МкАТ, используемых для ИЦХ диагностики выпотов. Так, в результате статистического анализа с помощью программы Meta-Disc 1.4 и STATA 12.0 установлена суммарная оценка для Ber-EP4 с чувствительностью 0,8 (95% доверительный интервал (ДИ) 0,78–0,82), специфичностью 0,94 (95% ДИ 0,93–0,96), коэффициентом положительного правдоподобия 12,72 (95% ДИ 8,66–18,7), коэффициентом отрицательного правдоподобия 0,18 (95% ДИ 0,12–0,26) и коэффициентом установления диагноза 95,05 (95% ДИ 57,26–157,77). Полученные результаты показывают, что Ber-EP4 является наиболее дифференциально значимым в цитологической диагностике экссудатов [12]. Аналогичная работа посвящена изучению калретинина, а полученные уточненные данные о его чувствительности и специфичности свидетельствуют о высокой эффективности применения данного антитела для диагностики мезотелиомы [10].
Современная ИЦХ диагностика экссудатов проводится с использованием «клеточных блоков» (КБ). Это метод приготовления цитологических препаратов основан на технике заливки клеточного материала (взвеси клеток) объемлющей средой для формирования КБ с последующим изготовлением из него тонких срезов и нанесением их на предметное стекло (как при гистологической технике) [1].
Использование КБ, в отличие от традиционных цитологических препаратов для ИЦХ исследования, имеет ряд преимуществ: во-первых, экономия МкАТ, потому что зона обработки клеток значительно меньше для проведения ИЦХ исследования, то есть, если для КБ используемого антитела необходимо максимум 20 мкл, то для традиционного цитологического препарата используется как минимум 50 мкл; во-вторых, методика ИЦХ исследования унифицирована с иммуногистохимическим (ИГХ) при использовании КБ, то есть любое антитело разработано производителем для гистологического блока, а при использовании традиционных цитологических препаратов необходимы фиксирующие растворы и следует соответственно к ним подбирать демаскировочные реактивы в зависимости от применяемого МкАТ.
Но использование КБ имеет и ряд недостатков. Во-первых, ИЦХ метод так же, как ИГХ, не может проводиться без традиционного цитологического или гистологического исследования.
Морфологические признаки аденокарциномы, мезотелиомы и реактивного мезотелия в КБ значительно отличаются от таковых в традиционном цитологическом мазке, что затрудняет выбор антител. Во-вторых, для изготовления КБ необходимы дополнительные значительные материальные затраты. В-третьих, по данным отдельных авторов [1], такое антитело, как эпителиальный антиген (Ber-EP4), которое является одним из основных в дифференциальной цитологической диагностике аденокарциномы, мезотелиомы и реактивного мезотелия на цитологических препаратах, не всегда позволяет идентифицировать нозологическую форму на КБ из-за, вероятнее всего, использования формалина в качестве фиксатора при его изготовлении. В то же время на традиционных цитологических препаратах это антитело дает положительную реакцию.
Таким образом, весь перечень цитоморфологических признаков реактивного, метастатического и первичного поражения мезотелия создает сложную ситуацию при цитологической дифференциальной диагностике упомянутых изменений, что обосновывает необходимость применения дополнительных методических подходов. Одним из таковых может быть ИЦХ, с помощью которого можно уточнить гистогенетическую природу отмеченных поражений. На сегодня разработаны панели МкАТ для определения характера патологических процессов выпотной жидкости и органопренадлежности метастатических опухолевых клеток. При этом, как правило, ИЦХ реакции проводятся на КБ. Мы поставили задачу разработать методический подход для менее затратного и доступного в выполнении исследования и с высокой эффективностью провести дифференциальную диагностику аденокарциномы, мезотелиомы и реактивного серозита по окрашенным и предварительно изученным цитологическим препаратам с последующим прицельным применением ИЦХ реактивов в выявленных клетках.
Цель — усовершенствовать цитологическую дифференциальную диагностику мезотелиомы, метастазов аденокарциномы и реактивного серозита с помощью ИЦХ метода на традиционно окрашенных и изученных цитологических препаратах.
Объект и методы исследования
Проведено цитологическое исследование материала жидкостей серозных полостей у 50 больных. Из осадка отцентрифугированной жидкости готовили цитологические препараты и после подсушивания на воздухе окрашивали по методу Романовского. Затем при исследовании традиционных цитологических препаратов определяли клетки с наиболее выраженными признаками атипии и очерчивали их гидрофобным карандашом. Затем на выделенных участках применили непрямой двухслойный ИЦХ метод с использованием ряда антител в зависимости от результатов цитологического исследования к: эпителиальному антигену (Ber-EP4), панцитокератину (C AE1/AE3), виментину, калретинину, моноклональному раково-эмбриональному антигену (mCEA), СК 5/6 и эпителиально-мембранному антигену (ЭМА).
Впервые на традиционных цитологических препаратах, приготовленных из выпотных жидкостей, применялась известная ИЦХ методика. При этом фиксатор и последующую демаскировку подбирали для МкАТ, предложенных рядом авторов [2–5, 10]. Используя перечисленные выше МкАТ, апробировали ИЦХ метод на традиционных цитологических препаратах. При этом фиксировали препараты метиловым спиртом, а демаскировку проводили 0,1% раствором трипсина.
Результаты цитологического исследования у 39 больных верифицированы гистологическим методом, у 11 (9 — с реактивными серозитами, 2 — мезотелиомой) подтверждены убедительными клинико-рентгенологическими данными.
Результаты исследования
На основании изучения цитоморфологических данных выделены три группы больных.
1-ю группу составили 20 (40%) пациентов, у которых при исследованиях выпота выявлено значительное количество клеток мезотелия с выраженными признаками пролиферации, в части из них — с атипией, цитологические признаки не позволяли подтвердить наличие только мезотелиальных клеток. У всех больных этой группы диагноз при поступлении был сформулирован как «выпот неясной этиологии» или «подозрение на рак». С целью дифференциальной диагностики между аденокарциномой и реактивным серозитом у этих пациентов проводили ИЦХ исследование.
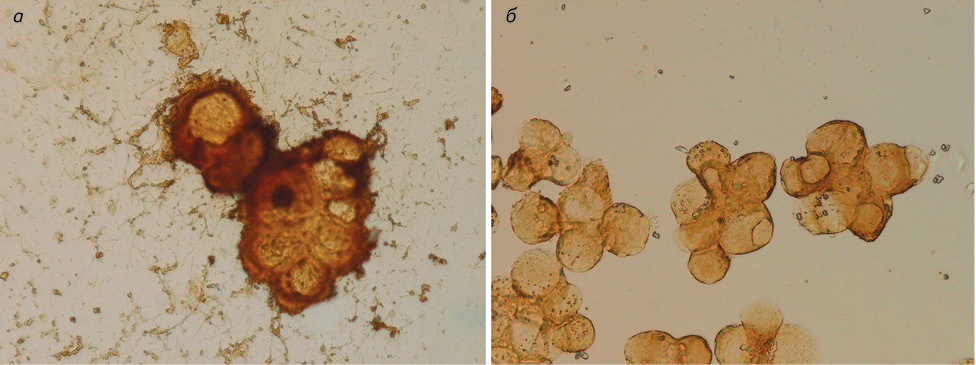
В результате у 7 (35%) пациентов установлены реактивные серозиты. При этом в клетках реактивного мезотелия выявлен виментин и калретинин по 2 из 7, что составило по 28%. В этой группе больных проведенные ИЦХ реакции к эпителиальным антигенам были отрицательные, что подтверждает их мезотелиальную природу. У 13 (65%) пациентов отмечены положительные реакции к эпителиальному антигену (Ber-EP4) — 11/13 (85%), ЭМА — 6/10 (60%) и CEA — 4/10 (40%), что подтвердило наличие злокачественной эпителиальной опухоли — аденокарциномы (таблица, рис. 1).
| МкАТ к: | Дифференциально-диагностические группы | |||||||||||
| Аденокарцинома/реактивный серозит (n=20) |
Мезотелиома/реактивный серозит (n=18) |
Мезотелиома/аденокарцинома (n=12) |
||||||||||
| Аденокарцинома (n=13) |
Реактивный серозит (n=7) |
Мезотелиома (n=16) |
Реактивный серозит (n=2) |
Мезотелиома (n=2) |
Аденокарцинома (n=10) |
|||||||
| ИЦХ реакция, n (%) | ||||||||||||
| Положительная | Отрицательная | Положительная | Отрицательная | Положительная | Отрицательная | Положительная | Отрицательная | Положительная | Отрицательная | Положительная | Отрицательная | |
| эпителиальному антигену (клон Ber-EP4) |
11/13(85) | 2/13(15) | 0/7(0) | 7/7(100) | 0/16(0) | 16/16(100) | 1/2(50) | 1/2(50) | 0/2(0) | 2/2(100) | 9/10(90) | 1/10(10) |
| mCEA | 4/10(40) | 6/10(60) | 0/6(0) | 6/6(100) | 1/16(6) | 15/16(94) | 0/2(0) | 2/2(100) | 1/2(50) | 1/2(50) | 6/9(67) | 3/9(33) |
| ЭМА | 6/10(60) | 4/10(40) | 0/6(0) | 6/6(100) | 3/16(19) | 13/16(81) | 0/2(0) | 2/2(100) | 0/2(0) | 2/2(100) | 5/8(63) | 3/8(37) |
| панцитокератинам (C AE1/AE3) | − | − | − | − | 12/13(92) | 1/13(8) | − | − | 2/2(100) | 0/2(0) | 5/6(83) | 1/6(17) |
| СК 5/6 | − | − | − | − | 7/16(44) | 9/16(56) | − | − | 1/2(50) | 1/2(50) | 1/6(17) | 5/6(83) |
| калретинину | 0/12(0) | 12/12(100) | 2/7(28) | 5/7(72) | 10/16(62) | 6/16(38) | 2/2(100) | 0/2(0) | 2/2(100) | 0/2(0) | 1/10(10) | 9/10(90) |
| виментину | 2/10(20) | 8/10(80) | 2/7(28) | 5/7(72) | 9/16(56) | 7/16(44) | 2/2(100) | 0/2(0) | 1/2(50) | 1/2(50) | 1/8(12) | 7/8(88) |
«−» — реакция не проводилась, так как она не обоснована в данных диагностических группах.
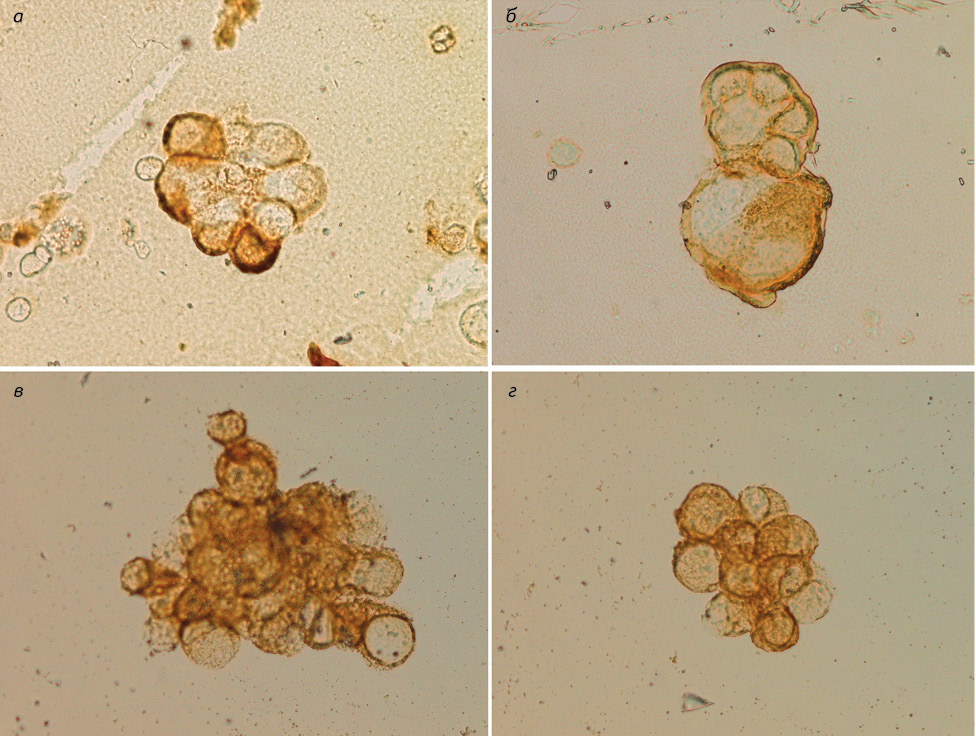
У пациентов 2-й группы при исследовании окрашенных по Паппенгейму цитологических препаратов выявлено значительное количество мезотелиальных клеток с выраженными признаками пролиферации, в части из них — атипии, что потребовало проведения дифференциальной диагностики мезотелиомы и реактивного серозита. Поэтому у 18 (36%) больных, которые составили 2-ю группу, проведено ИЦХ исследование с использованием МкАТ к: эпителиальному антигену (Ber-EP4), ЭМА, mCEA, панцитокератину (С AE1/AE3), СК 5/6, виментину, калретинину. В результате у 16 (89%) пациентов установлена мезотелиома, а у 2 (11%) — реактивный серозит. При этом для клеток мезотелиомы более характерна экспрессия панцитокератина (С AE1/AE3) — 12/13 (92%), калретинина — 10/16 (62%), виментина — 9/16 (56%), CK 5/6 — 7/16 (44%), тогда как экспрессия эпителиального антигена (Ber-EP4) вовсе не выявлена — 0/16 (0%), а других эпителиальных маркеров — слабо выражена. Так, ЭМА был положителен у 3/16 (18%) пациентов, CEA — у 2 (6%) из них (см. таблицу, рис. 2) в небольшой группе больных (2) с реактивным серозитом, калретинин и виментин выявлены в 100% наблюдений.
У больных 3-й группы определение злокачественного процесса по материалу выпота не вызывало диагностических затруднений, поскольку все клетки в цитологических препаратах имели явные признаки атипии, но необходимо было провести ИЦХ исследования для установления гистогенетической принадлежности опухоли — мезотелиома или метастатическое поражение.
У 12 (24%) больных 3-й группы в результате использования ИЦХ метода у 10 (83%) пациентов выявлена аденокарцинома, а у 2 (17%) — мезотелиома. В клетках аденокарциномы экспрессия эпителиального антигена (Ber-EP4) отмечена у 9/10 (90%) пациентов, mСЕА — у 6/9 (67%), ЭМА — у 5/8 (63%), что показало их высокую чувствительность именно для аденокарциномы. Вместе с тем чувствительность панцитокератина для мезотелиомы составляет 100%, а для аденокарциномы — 83%, что почти одинаково и указывает на отсутствие дифференциальных возможностей данного МкАТ для двух этих неопластических процессов, в отличие от МкАТ к СК 5/6, которое положительно в 50% мезотелиомы, а в случаях аденокарциномы — лишь в 17%. В опухолевых клетках эпителиального происхождения выявлены калретинин — 1/10 (10%) и виментин 1/8 (12%), в отличие от клеток мезотелиомы, для которой экспрессия калретинина составила 100%, виментина — 50% и является более характерной. Исходя из этих данных, для дифференциальной диагностики аденокарциномы и мезотелиомы наиболее показательными являются антитела к эпителиальному антигену (Ber-EP4), CEA, ЭМА, CK 5/6, калретинину и виментину (см. таблицу, рис. 1).
Таким образом, апробированный ИЦХ метод на традиционных цитологических препаратах выпотных жидкостей после их изучения позволил определить дифференциально-диагностические параметры аденокарциномы, мезотелиомы, реактивных серозитов и представить в виде выводов.
Цитологическое исследование и последовательное изучение набора МкАТ с использованием ИЦХ метода на традиционных цитологических препаратах позволяет с высокой степенью достоверности провести дифференциальную диагностику аденокарциномы, мезотелиомы и реактивного мезотелия, что имеет решающее значение для выбора адекватного лечения.
Выявлено, что для клеток аденокарциномы наиболее характерны положительные ИЦХ реакции к эпителиальному антигену (Ber-EP4) (85–90%), CEA (40–67%), ЭМА (60– 63%), а слабоположительные реакции — к калретинину (10%) и виментину (12%).
Признаки выраженной пролиферации с наличием атипии в клетках мезотелия при изучении окрашенных цитологических препаратов обосновывают проведение ИЦХ реакций для дифференциальной диагностики между мезотелиомой и реактивным серозитом. Положительные реакции к МкАТ — панцитокератину (C AE1/AE3) (92–100%), CK 5/6 (44–50%), калретинину (62–100%) и виментину (50–56%) — позволили установить мезотелиому.
Выявлено на разных количествах больных (7 и 2) двух дифференциально-диагностических групп, что экспрессия калретинина и виментина составила соответственно 28 и 100%, что подтверждает реактивный серозит и требует дальнейшего изучения.
Список использованной литературы
1. Волченко Н.Н., Борисова О.В. (2014) Технология «клеточный блок» в цитологической практике. Новости клинической цитологии России, 18(1–2): 3–32.
2. Глузман Д.Ф., Абраменко И.В., Скляренко Л.М., Писнячевская Г.В. (1993) Иммуноцитохимическая диагностика злокачественных экссудатов. Наукова думка, Киев, 96 с.
3. Глузман Д.Ф., Скляренко Л.М., Надгорная В.А., Крячок И.А. (2003) Диагностическая иммуноцитохимия опухолей. Киев, 155 с.
4. Григорук О.Г., Лазарев А.Ф., Богатырёв В.Н. (2012) Дифференциальная цитологическая диагностика плевритов. Барнаул: 173–180 с.
5. Antonangelo L., Sales R.K., Corá A.P. et al. (2015) Pleural fluid tumour markers in malignant pleural effusion with inconclusive cytologic results. Curr. Oncol., 22(5): 336–341.
6. Chen M., Xie S., Wan C. et al. (2017) Diagnostic performance of CTLA-4, carcinoembryonic antigen and CYFRA 21–1 for malignant pleural effusion. Postgrad. Med., 129(6): 644–648.
7. Feng M., Zhu J., Liang L. et al. (2017) Diagnostic value of tumor markers for lung adenocarcinoma-associated malignant pleural effusion: a validation study and meta-analysis. Int. J. Clin. Oncol., 22(2): 283–290.
8. Li D., Wang B., Long H., Wen F. (2015) Diagnostic accuracy of calretinin for malignant mesothelioma in serous effusions: a meta-analysis. Sci. Rep., 7(1): 18051.
9. Sharma S.K., Bhat S., Chandel V. et al. (2015) Diagnostic utility of serum and pleural fluid carcinoembryonic antigen, and cytokeratin 19 fragments in patients with effusion from nonsmall cell lung cancer. J. Carcinog., 27: 7–14.
10. Syed Z.A., Edmund S.C. (2012) Serous Cavity Fluid and Cerebrospinal fluid cytopathology. Springer, New York Dordrecht Heidelberg London.: 35–75.
11. Tozzoli R., Basso S.M., D’Aurizio F. et al. (2016) Evaluation of predictive value of pleural CEA in patients with pleural effusions and histological findings: A prospective study and literature review. Clin. Biochem., 49: 1227–1231.
12. Wang B., Li D., Ou X. et al. (2014) Diagnostic accuracy of Ber-EP4 for metastatic adenocarcinoma in serous effusions: a meta-analysis. PLoS One., 9(9): 107741.
Мариненко Светлана Вячеславовна
03022, Киев, ул. Ломоносова, 33/43
Национальный институт рака
E-mail: labrida@ukr.net
Correspondence:
Marynenko Svitlana
33/43 Lomonosova str., Kyiv 03022
National Cancer Institute
E-mail: labrida@ukr.net














Leave a comment