Імунотерапія метастатичного раку легені в першій лінії: що нового в 2018 р.
Рыспаева Д.Э.1, Пономарева О.В.2, Лисовская Н.Ю.3
- 1Національний інститут раку, Київ
- 2Інститут експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького НАН України, Київ
- 3Филиал «Медицинский центр «Кибер Клиника Спиженко» (ООО «Компания Адонис»), Киев
Резюме. Впровадження моноклональних антитіл — інгібіторів контрольних точок (чекпоінтів) імунної відповіді призвело до зміни парадигми лікування багатьох злоякісних новоутворень, у тому числі й раку легені. Показання до застосування інгібіторів чекпоінтів для терапії недрібноклітинного раку легені (НДРЛ) продовжують розширюватися, і міжнародні настанови вже рекомендують тестування на експресію PD-L1 до початку системного лікування. У статті проведено аналіз останніх клінічних досліджень, в яких вивчали нові підходи до лікування НДРЛ. Доведено, що для підвищення ефективності першої лінії терапії метастатичного НДРЛ монотерапія пембролізумабом стала стандартом лікування у пацієнтів з експресією PD-L1 ≥50% на пухлинних клітинах. Додавання пембролізумабу до стандартної хіміотерапії першої лінії значно збільшувало медіану загальної виживаності незалежно від експресії PD-L1 у пухлині у пацієнтів із метастатичним НДРЛ. Ці дані свідчать про те, що розширилися можливості у виборі оптимальної стратегії лікування метастатичного НДРЛ з метою поліпшення якості життя і виживаності цих пацієнтів.
Резюме. Внедрение моноклональных антител — ингибиторов контрольных точек (чекпоинтов) иммунного ответа привело к изменению парадигмы лечения многих злокачественных новообразований, в том числе и рака легкого. Показания к применению ингибиторов чекпоинтов для терапии немелкоклеточного рака легкого (НМРЛ) продолжают расширяться, и международные руководства уже рекомендуют тестирование на экспрессию PD-L1 до начала системного лечения. В статье проведен анализ последних клинических исследований, в которых изучали новые подходы к лечению НМРЛ. Доказано, что для повышения эффективности первой линии терапии метастатического НМРЛ монотерапия пембролизумабом стала стандартом лечения у пациентов с экспрессией PD-L1 ≥50% на опухолевых клетках. Добавление пембролизумаба к стандартной химиотерапии первой линии значительно увеличивало медиану общей выживаемости независимо от экспрессии PD-L1 в опухоли у пациентов с метастатическим НМРЛ. Эти данные свидетельствуют о том, что расширились возможности в выборе оптимальной стратегии лечения метастатического НМРЛ с целью улучшения качества жизни и выживаемости этих пациентов.
Получено 11.06.2018
Принято в печать 13.06.2018
Введение
Рак легкого является наиболее распространенной злокачественной опухолью в мире [1, 2]. Примерно 85% составляет немелкоклеточный рак легкого (НМРЛ), в 57% случаев опухоль выявляется в IV стадии [3, 4].
Исторически стандартная терапия для большинства пациентов с IV стадией НМРЛ представляла собой дублет на основе препаратов платины, без существенных различий в эффективности различных схем химиотерапии (ХТ). В целом платиносодержащие дублеты ХТ продемонстрировали медиану общей выживаемости (ОВ) примерно 8 мес и 1-летнюю выживаемость 33% [5]. За последние годы произошло значительное расширение доступных вариантов лечения НМРЛ, включая целенаправленное (таргетное) лечение и иммунотерапию.
В международных рекомендациях подчеркивается необходимость определения гистологических подтипов и молекулярного тестирования для дифференциации терапевтических подходов [6]. Молекулярное тестирование для EGFR, ALK, ROS1 и BRAF является обязательным для пациентов с аденокарциномой и выборочным — для пациентов с плоскоклеточным подтипом (например никогда не курившие, неопределенная гистологическая классификация и небольшие размеры биоптата). Тестирование на активирующие мутации EGFR или ALK-транслокации теперь рассматривается как стандарт лечения, поскольку пациенты с этими генетическими изменениями могут извлечь преимущество из таргетной терапии ингибиторами тирозинкиназы (ИTK) EGFR или ALK в качестве инициальной терапии [7, 8]. Назначение им ИТК в первой–второй линиях терапии позволило добиться значительного прогресса в увеличении продолжительности жизни.
В течение длительного времени стандартной терапией второй линии при НМРЛ был один лишь доцетаксел, который обеспечивал общую частоту ответа (overall response rate — ORR) 9% и медиану ОВ примерно 7 мес [9, 10].
Внедрение моноклональных антител — ингибиторов контрольных точек (чекпоинтов) иммунного ответа привело к изменению парадигмы лечения при многих злокачественных новообразованиях, в том числе и раке легкого [11]. Изученными ингибиторами чекпоинтов являются моноклональные антитела против белка CTLA-4 (cytotoxic T-lymphocyte associated protein 4) и блокаторы сигнального пути программируемой клеточной гибели PD-1 и его лиганда — PD-L1 (Programmed cell Death pathway). Показано, что гиперэкспрессия PD-L1 в опухоли является одним из ключевых механизмов «избегания» злокачественными клетками надзора иммунной системы. PD-1 представляет собой важный контрольный пункт, который модулирует иммунный ответ. Чтобы избежать иммунного надзора, опухолевые клетки блокируют иммунную систему с помощью различных механизмов, включая повышение активности PD-1 и его лиганда, PD-L1 [12]. Созданные моноклональные антитела способны блокировать рецептор PD-1 (ниволумаб и пембролизумаб) или лиганд PD-L1 (атезолизумаб, дурвалумаб и авелумаб) и, таким образом, предотвращать нейтрализацию цитотоксических лимфоцитов, задачей которых является реализация противоопухолевого иммунитета.
Обновленные международные руководства рекомендуют ингибиторы чекпоинтов в качестве предпочтительной терапии второй линии метастатического НМРЛ [6]. Анти-PD-1 антитела пембролизумаб и ниволумаб и анти-PD-L1 антитело атезолизумаб одобрены во второй линии терапии НМРЛ после рандомизированных клинических испытаний, показавших дополнительные преимущества по сравнению с доцетакселом [13–16]. В настоящее время продолжают изучаться остальные ингибиторы иммунных контрольных точек.
Несмотря на то что ингибиторы чекпоинтов улучшают результаты лечения пациентов, их использование в клинической практике замедляется множеством практических проблем, включая эффективный отбор пациентов, оценку реакции на терапию и управление иммуноопосредованными нежелательными явлениями [17–19]. Более того, различающиеся рекомендации по разным типам опухолей еще более усложняют оптимальное использование этих препаратов. За последние пару лет утверждены новые области для применения ингибиторов чекпоинтов, и показания продолжают расширяться, что создает некоторую неопределенность среди клиницистов относительно оптимального применения данных препаратов.
Ингибиторы PD-1 в монотерапии первой линии метастатического НМРЛ
На сегодня известны два клинических исследования с ингибиторами PD-1 в монотерапии первой линии метастатического НМРЛ: KEYNOTE-024 (пембролизумаб) и CheckMate-026 (ниволумаб) (рис. 1). Главное отличие этих исследований заключается в статусе экспрессии PD-L1 на опухолевых клетках.
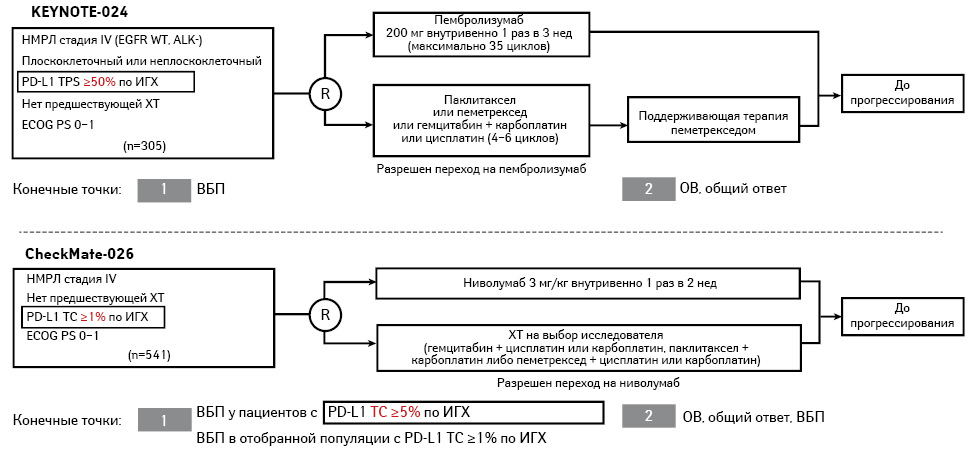
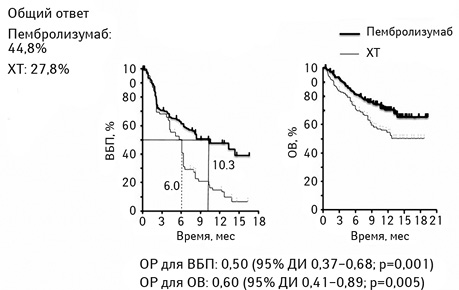
Рандомизированное открытое контролируемое исследование III фазы KEYNOTE-024 (ClinicalTrials.gov, NCT02142738), в котором изучался пембролизумаб против ХТ на основе платины в первой линии терапии НМРЛ с любым гистологическим подтипом, с экспрессией PD-L1 TPS (tumor proportion score) ≥50% и без мутации EGFR или ALK-транслокаций, продемонстрировало значительное улучшение как ВБП (отношение рисков (ОР) 0,50; 95% доверительный интервал (ДИ) 0,37–0,68, p<0,001), так и ОВ (ОР 0,60; 95% ДИ 0,41–0,89, p=0,005) для пембролизумаба (рис. 2). Согласно данным этого исследования ингибитор PD-1 пембролизумаб был одобрен для использования в монотерапии первой линии у пациентов с метастатическим НМРЛ, в опухоли которых выявлена экспрессия PD-L1 ≥50% [20].
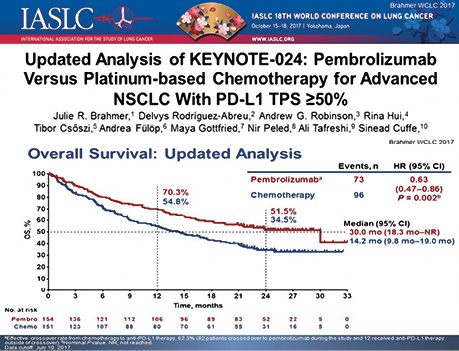
Обновленные данные KEYNOTE-024 (медиана наблюдения 25 мес), доложенные на IASLC — Всемирном конгрессе по раку легкого — в октябре 2017 г., подтвердили преимущество пембролизумаба. Медиана ОВ (95% ДИ) в группе пембролизумаба составила 30 мес (18,3 мес–не достигнуто) против группы ХТ 14,2 мес (9,8–19,0 мес). Оценка 1-летней ОВ составила 70,3% (95% ДИ 62,3–76,9%) для группы с пембролизумабом и 54,8% (95% ДИ 46,4–62,4%) для группы ХТ (рис. 3). Согласно полученным данным более половины пациентов были живы при длительном наблюдении, что свидетельствовало о превосходстве пембролизумаба перед платиносодержащей ХТ [21]. В исследовании же CheckMate-026 у пациентов, получавших ниволумаб, по сравнению с проведением ХТ, ОВ оказалась ниже [22].
Монотерапия пембролизумабом является текущим стандартом лечения у пациентов с метастатическим НМРЛ и высокой экспрессией PD-L1, определяемой как окрашивание опухолевых клеток PD-L1 ≥50% по иммуногистохимическому (ИГХ) анализу на платформе 22C3 pharmDx. Экспрессия PD-L1 в настоящее время — лучший доступный биомаркер для оценки того, являются ли пациенты с метастатическим НМРЛ кандидатами на лечение пембролизумабом [6].
Руководство NCCN (National Comprehensive Cancer Network) рекомендует, что у пациентов с метастатическим НМРЛ в дополнение к молекулярному тестированию на EGFR, ALK, ROS1 и BRAF тестирование на PD-L1 должно проводиться до начала лечения первой линии [6]. Кроме того, согласно этим рекомендациям тест PD-L1 следует считать обязательным как при плоскоклеточном, так и неплоскоклеточном подтипе НМРЛ. Руководство ESMO (Европейское общество медицинских онкологов) также указывает на то, что пациенты должны быть тестированы на наличие EGFR, ALK и PD-L1 до начала лечения [23].
Существует множество различных анализов для измерения экспрессии PD-L1. Тест 22C3 считается соответствующей платформой для пембролизумаба; кроме того, использование данного теста даже включено в инструкцию препарата. Тесты 28-8 и SP142 считаются комплементарной диагностической опцией для ниволумаба и атезолизумаба соответственно. В исследовании Blueprint PD-L1 IHC Assay Comparison Project показано, что три из четырех оцениваемых анализов (22C3, 28-8 и SP 263 (связанный с дурвалумабом)) имели высокий уровень согласованности для оценки экспрессии PD-L1 на опухолевых клетках, а результаты, полученные с использованием SP142, не были похожи на таковые трех остальных, продемонстрировав последовательно меньшее количество окрашенных опухолевых клеток [24].
В пресс-релизе от 10 апреля 2018 г. представлены предварительные данные исследования KEYNOTE-042 [25], по дизайну похожего на KEYNOTE-024, но отличающегося разделительным срезом экспрессии PD-L1 ≥1%. Предварительные результаты свидетельствуют о позитивном эффекте с достижением первичной точки исследования (ОВ) [26].
Таким образом, в настоящее время FDA одобрен единственный ингибитор иммунных контрольных точек — пембролизумаб в монотерапии первой линии ранее не леченного метастатического НМРЛ, и это стало стандартной терапией [6]. Его применение ограничивается пациентами с высокой экспрессией PD-L1 (≥50%) в опухоли.
Комбинация иммунотерапии и химиотерапии в первой линии лечения метастатического НМРЛ
Принимая во внимание, что только около половины пациентов с метастатическим НМРЛ получают вторую линию терапии [27] и существует небольшое количество пациентов с экспрессией PD-L1 (≥50%) в популяции, продолжается поиск различных подходов для повышения эффективности режима первой линии терапии. Ингибиторы иммунных контрольных точек ранее были утверждены во второй линии терапии метастатического НМРЛ. Исследованы различные комбинации, основанные на иммунотерапии, к которой добавлялся другой класс иммунотерапевтического препарата (например анти-PD-1 + анти-CTLA-4), ХТ, таргетная или лучевая терапия. Показано, что потенцирование иммунного ответа при ингибировании сигнальных путей PD-1 и PD-L1 может быть усилено эффектами цитотоксической терапии. Рак легкого является гетерогенным заболеванием, что отражается в различных ответах на иммунотерапию.
Вопрос, который волновал многих исследователей, — способствует ли повышению выживаемости одновременная ХТ и иммунотерапия в первой линии, — был рассмотрен в исследованиях II фазы KEYNOTE-021, III фазы KEYNOTE-189.
В 2017 г. комбинированный режим карбоплатин/пеметрексед/пембролизумаб одобрен FDA для лечения первой линии метастатического неплоскоклеточного НМРЛ независимо от экспрессии PD-L1 на основании результатов когорты G исследования KEYNOTE-021. В когорте G многоцентрового открытого исследования KEYNOTE-021 II фазы (ClinicalTrials.gov, NCT02039674) оценивали эффективность и безопасность добавления пембролизумаба к пеметрекседу/карбоплатину по сравнению с одной ХТ пеметрекседом/карбоплатином в терапии первой линии для пациентов с метастатическим неплоскоклеточным НМРЛ [28].
Популяция KEYNOTE-021G насчитывала всего 123 пациента, которые были рандомизированы только в группу ХТ (n=63) или ХТ с пембролизумабом (n=60), с довольно равномерным распределением пациентов с <1%, 1–49% или ≥50% экспрессии PD-L1 в опухоли в обеих группах. У пациентов с экспрессией ≥50% PD-L1 опухолей отмечали 80% уровень ответа в комбинации лечения (против 57 и 26% для пациентов с экспрессией опухолей <1% и 1–49% PD-L1 соответственно). В исследовании KEYNOTE-021 когорта G показала значительное улучшение и общего ответа независимо от экспрессии PD-L1 (разница в уровне ответа 25%, 95% ДИ 7–41, p=0,0029) и ВБП (19,0 мес против 8,9 мес; ОР 0,54; 95% ДИ 0,33–0,88, p=0,0067) в группе с добавлением пембролизумаба к карбоплатину/пеметрекседу против одной ХТ карбоплатином/пеметрекседом (рис. 4).
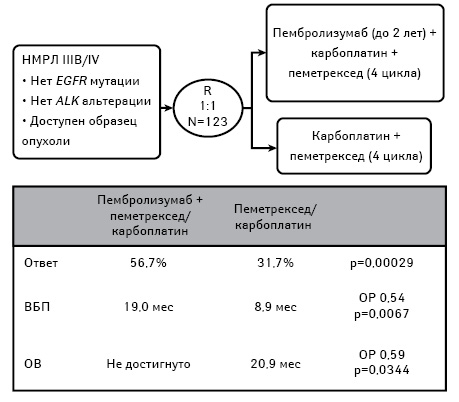
Поскольку это был довольно ограниченный набор данных для оправдания новой стратегии лечения, все ожидали результаты исследования KEYNOTE-189 III фазы (ClinicalTrials.gov, NCT02578680), в котором была рассмотрена схема применения карбоплатина/пеметрекседа плюс пембролизумаб против карбоплатина/пеметрекседа плюс плацебо в качестве терапии первой линии в гораздо большей популяции пациентов с неплоскоклеточным НМРЛ (n=616) с первичными конечными точками ОВ и ВБП.
В KEYNOTE-189 были включены пациенты независимо от уровня экспрессии опухоли PD-L1 [29]. Группа рандомизированных на комбинацию с пембролизумабом составила 410 пациентов и на плацебо-комбинацию — 206. Данные KEYNOTE-189 показывают, что введение иммунотерапии в лечение первой линии может оказать благоприятный долгосрочный эффект на клинические результаты.
В общей популяции пациентов риск смерти у больных, получавших пембролизумаб плюс ХТ, был вдвое ниже, чем у пациентов, получавших ХТ плюс плацебо (ОР 0,49; 95% ДИ 0,38–0,64, p<0,001), как и пропорция пациентов, которые были живы в течение года — 69,2% против 49,4% соответственно. Примечательно, что преимущество ОВ наблюдалось не только у пациентов с высокой экспрессией PD-L1 (≥50% [n=202]), ОР 0,42; 95% ДИ 0,26–0,68), но и у пациентов с экспрессией PD-L1 от 1% до 49% ([n=186], ОР 0,55; 95% ДИ 0,34–0,90) и <1% ([n=190], ОР 0,59; 95% ДИ 0,38–0,92). Аналогичное улучшение медианы ВБП также представлено во всех подгруппах уровней экспрессии PD-L1.
С точки зрения других результатов в данном исследовании, частота ответа составляла 47,6% (95% ДИ 42,6–52,5) в группе комбинации с пембролизумабом и 18,9% (95% ДИ 13,8–25,0) — в группе плацебо-комбинации (p<0,001). Следует отметить, что наибольшая разница между группами отмечена у пациентов с показателем экспрессии PD-L1 в опухоли ≥50% (61,4% против 22,9%). Средняя продолжительность ответа также была лучше в группе с пембролизумабом (11,2 мес против 7,8 мес).
Нежелательные побочные явления были схожими (99,8% против 99,0%) как в целом, так и по степени ≥III (67,2 и 65,8%) в группе ХТ плюс пембролизумаб и ХТ плюс плацебо соответственно. В обеих группах наиболее частыми побочными явлениями были тошнота, анемия и усталость, в группе комбинации с пембролизумабом — диарея и сыпь. Профиль токсичности был приемлемым, добавление пембролизумаба к ХТ не повышало частоту нежелательных явлений, исключением оказалась немного более высокая частота, чем ожидалось, острой почечной недостаточности степени ≥III (2%) и нефрита (1,5%).
Основываясь на данных исследования KEYNOTE-189, теперь можно рассматривать схему карбоплатин/пеметрексед плюс пембролизумаб как стандарт лечения для пациентов с метастатическим неплоскоклеточным НМРЛ и особенно у пациентов с низкой экспрессией PD-L1 <50%.
Но как мы должны лечить наших пациентов с экспрессией опухоли PD-L1 ≥50% с учетом данных, которые у нас есть сейчас? Следует ли рекомендовать пембролизумаб отдельно или в комбинации с карбоплатином/пеметрекседом? Исследование KEYNOTE-024 показало примерно на 40% снижение риска смерти при монотерапии пембролизумабом в этой группе пациентов по сравнению с примерно 50% снижением риска смерти при комбинации пембролизумаба с карбоплатином/пеметрекседом в исследовании KEYNOTE-189. Довольно схожие данные ОВ позволяют рекомендовать оба варианта лечения и, возможно, выбирать монотерапию пембролизумабом у большинства пациентов с экспрессией PD-L1 ≥50%.
В настоящее время руководства по метастатическому НМРЛ быстро меняются. В дополнение к последним двум исследованиям на ежегодном собрании ASCO (Американское общество клинических онкологов) в 2018 г. сообщены новые данные, которые также могут повлиять на то, как мы лечим наших пациентов, в том числе результаты трех важных исследований III фазы: KEYNOTE-042 по сравнению пембролизумаба в первой линии со стандартной ХТ у пациентов с экспрессией PD-L1 ≥1%, IMpower131 и IMpower150, которые сравнивают различные стандартные схемы ХТ первой линии с атезолизумабом или без него у пациентов с НМРЛ независимо от уровня экспрессии PD-L1.
Таким образом, новые интересные результаты исследований по лечению рака легкого помогут выбрать оптимальные стратегии терапии НМРЛ и улучшить качество жизни и выживаемость этих пациентов.
Список использованной литературы
1. Siegel R.L., Miller K.D., Jemal A. (2017) Cancer Statistics, 2017. CA Cancer J. Clin., 67(1): 7–30.
2. Ferlay J., Soerjomataram I., Dikshit R. et al. (2015) Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int. J. Cancer, 136(5): E359–E386.
3. SEER Cancer Statistics Review, 1975–2013.
4. Govindan R., Page N., Morgensztern D. et al. (2006) Changing epidemiology of small-cell lung cancer in the United States over the last 30 years: analysis of the surveillance, epidemiologic, and end results database. J. Clin. Oncol., 24(28): 4539–4544.
5. Schiller J.H., Harrington D., Belani C.P. et al. (2002) Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer. N. Engl. J. Med., 346(2): 92–98.
6. National Comprehensive Cancer Network. Clinical practice guidelines in oncology: non-small cell lung cancer. Version 4.2018.
7. Mok T.S., Wu Y.L., Thongprasert S. et al. (2009) Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. N. Engl. J. Med., 361(10): 947–957.
8. Solomon B.J., Mok T., Dong-Wan Kim et al. (2014) First-line crizotinib versus chemotherapy in ALK-positive lung cancer. N. Engl. J. Med., 371(23): 2167–2177.
9. Fossella F.V., DeVore R., Kerr R.N. et al. (2000) Randomized phase III trial of docetaxel versus vinorelbine or ifosfamide in patients with advanced non-small-cell lung cancer previously treated with platinum-containing chemotherapy regimens. The TAX 320 Non-Small Cell Lung Cancer Study Group. J. Clin. Oncol., 18(12): 2354–2362.
10. Hanna N., Shepherd F.A., Fossella F.V. et al. (2004) Randomized phase III trial of pemetrexed versus docetaxel in patients with non-small-cell lung cancer previously treated with chemotherapy. J. Clin. Oncol., 22(9): 1589–1597.
11. Martin-Liberal J., Hierro C., Ochoa de Olza M., Rodon J. (2017) Immuno-Oncology: The third paradigm in early drug development. Target Oncol., 12(2): 125–138.
12. Vinay D.S., Ryan E.P., Pawelec G. et al. (2015) Immune evasion in cancer: Mechanistic basis and therapeutic strategies. Semin. Cancer Bio., 35 Suppl: S185–S198.
13. Borghaei H., Paz-Ares L., Horn L. et al. (2015) Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer. N. Engl. J. Med., 373(17): 1627–1639.
14. Herbst R.S., Baas P., Kim D.W. et al. (2016) Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial. Lancet, 387(10027): 1540–1550.
15. Fehrenbacher L., Spira A., Ballinger M. et al. (2016) Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR): a multicentre, open-label, phase 2 randomised controlled trial. Lancet, 387(10030): 1837–1846.
16. Rittmeyer A., Barlesi F., Waterkamp D. et al. (2017) Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer (OAK): a phase 3, open-label, multicentre randomised controlled trial. Lancet, 389(10066): 255–265.
17. Gibney G.T., Weiner L.M., Atkins M.B. (2016) Predictive biomarkers for checkpoint inhibitor-based immunotherapy. Lancet Oncol., 17(12): e542–e551.
18. Champiat S., Lambotte O., Barreau E. et al. (2016) Management of immune checkpoint blockade dysimmune toxicities: a collaborative position paper. Ann. Oncol., 27(4): 559–574.
19. Postow M.A., Callahan M.K., Wolchok J.D. (2015) Immune checkpoint blockade in cancer therapy. J. Clin. Oncol., 33(17): 1974–1982.
20. Reck M., Rodríguez-Abreu D., Robinson A.G. et al. (2016) Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer. N. Engl. J. Med., 375(19): 1823–1833.
21. Brahmer J., Rodríguez-Abreu D., Robinson A. et al. (2017) OA 17.06 Updated Analysis of KEYNOTE-024: Pembrolizumab vs Platinum-Based Chemotherapy for Advanced NSCLC With PD-L1 TPS ≥50%. J. Thorac. Oncol., 12(11, Suppl. 2): S1793–S1794.
22. Carbone D.P., Reck M., Paz-Ares L. et al. (2017) First-line nivolumab in stage IV or recurrent non-small-cell lung cancer. N. Engl. J. Med., 376(25): 2415–2426.
23. Novello S., Barlesi F., Califano R. et al. (2016) Metastatic non-small-cell lung cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol., 27(suppl. 5): v1–v27.
24. Hirsch F.R., McElhinny A., Stanforth D. et al. (2017) PD-L1 Immunohistochemistry Assays for Lung Cancer: Results from Phase 1 of the Blueprint PD-L1 IHC Assay Comparison Project. J. Thorac. Oncol., 12(2): 208–222.
25. Mok T., Wu Y.L., Sadowski S. et al. (2016) 195TiP: Pembrolizumab (MK-3475) versus platinum-based chemotherapy for PD-L1+ NSCLC in a phase 3, randomized, open-label study: KEYNOTE-042. J. Thorac. Oncol., 11(4 Suppl): S142.
26. http://clinicaltrials.gov/ct2/show/NCT02220894. Accessed: April 10, 2018.
27. Fidias P., Novello S. (2010) Strategies for prolonged therapy in patients with advanced non-small-cell lung cancer. J. Clin. Oncol., 28(34): 5116–5123.
28. Borghaei H., Langer C., Gadgeel S. et al. (2017) OA 17.01 Pemetrexed-Carboplatin Plus Pembrolizumab as First-Line Therapy for Advanced Nonsquamous NSCLC: KEYNOTE-021 Cohort G Update. J. Thorac. Oncol., 12(11, Suppl. 2): S1791.
29. Gandhi L., Rodríguez-Abreu D., Gadgeel Sh. et al. (2018) Pembrolizumab plus chemotherapy in metastatic non-small-cell lung cancer. N. Engl. J. Med., 378(22): 2078–2092.
Рыспаева Динара Эсенбековна
03022, Киев, ул. Ломоносова, 33/43
Национальный институт рака
E-mail: ryspayeva1@gmail.com
Correspondence:
Ryspayeva Dinara
33/43 Lomonosova str., Kyiv 03022
National Cancer Institute
E-mail: ryspayeva1@gmail.com
ONCO-1261403-0000
ООО «МСД Украина», адрес: 03038, Киев, БЦ «Горизонт Парк», ул. Н. Амосова, 12, 3-й этаж.
Тел.: +38 (044) 393-74-80; факс: +38 (044) 393-74-81.
Если у Вас появились вопросы относительно препаратов компании MSD, пишите нам по адресу: medinfo@merck.com. Авторские права © [2018] ООО «МСД Украина». Все права защищены.
Материал изготовлен: июнь 2018 г. Материал пригоден до: июнь 2020 г.
Эта информация предоставлена компанией MSD как профессиональная поддержка специалистам здравоохранения. Информация, касающаяся любого продукта (-ов), может не совпадать с инструкцией по применению препарата. Пожалуйста, ознакомьтесь с полным текстом инструкции для получения точной информации или данных о продуктах, рассматриваемых в этой публикации, до назначения.
Данный материал предназначен для специалистов здравоохранения и публикации в специализированных изданиях, а также распространения на специализированных медицинских мероприятиях.














Leave a comment