Ерлотиніб (Тарцева) в першій лінії терапії пацієнтів із недрібноклітинним раком легені з мутаціями EGFR: аналіз ефективності
Резюме. У статті наводяться результати відкритого рандомізованого клінічного дослідження OPTIMAL з визначення ефективності та профілю безпеки ерлотинібу як першої лінії терапії за участю азіатських пацієнтів з недрібноклітинним раком легені (НДРЛ) на пізніх стадіях з мутаціями EGFR. Його значні переваги щодо виживання без прогресування, якості життя та переносимості свідчать: ерлотиніб слід розглядати як один зі стандартних методів першої лінії терапії у пацієнтів із НДРЛ у пізніх стадіях із мутаціями EGFR.
Резюме. Эрлотиниб (Тарцева®) в первой линии терапии пациентов с немелкоклеточным раком легкого с мутациями EGFR: анализ эффективностиВ статье приведены результаты открытого рандомизированного клинического исследования OPTIMAL по изучению эффективности и профиля безопасности эрлотиниба в качестве 1-й линии терапии с участием пациентов азиатской популяции с немелкоклеточным раком легкого (НМРЛ) в поздних стадиях с мутациями EGFR. Были показаны значительные преимущества при применении эрлотиниба в отношении выживаемости без прогрессирования заболевания, качества жизни и переносимости терапии. Они свидетельствуют в пользу того, что применение эрлотиниба следует рассматривать как один из стандартных методов 1-й линии терапии у пациентов с НМРЛ в поздних стадиях и с подтвержденными мутациями EGFR.
Рак легкого является ведущей причиной онкологической смертности во всем мире [1]. В Украине в 2010–2012 гг. данная патология удерживала 1-е место в структуре онкологической заболеваемости (17,5%) и смертности (24,3%) среди мужского населения. В структуре заболеваемости злокачественными новообразованиями и смертности от них женского населения Украины рак легкого занимает 9-е (3,8%) и 6-е (5,9%) места соответственно [2]. По гистологической структуре различают немелкоклеточную и мелкоклеточную формы рака легкого.
Немелкоклеточный рак легкого (НМРЛ) составляет около 85% в структуре данной патологии. К НМРЛ относятся плоскоклеточный рак, аденокарцинома и крупноклеточный рак. У большинства пациентов НМРЛ диагностируют на поздних стадиях течения заболевания [3]. Ранее в продолжение длительного времени лечение НМРЛ в I–IIIA стадии ограничивалось хирургическим вмешательством. Однако даже в случае радикальных операций 5-летняя выживаемость при НМРЛ была неудовлетворительной и составляла от 67% у больных с IA до 23% у пациентов с IIIA стадией [4]. Это подтверждает целесообразность послеоперационного лечения операбельных больных [5]. Применение химиотерапии при НМРЛ позволяет обеспечить контроль симптомов заболевания и умеренное повышение выживаемости. Сегодня широкое применение у пациентов с НМРЛ в качестве 1-й линии химиотерапии нашли комбинированные платиносодержащие схемы. Однако результаты последних клинических исследований свидетельствуют в пользу того, что современная химиотерапия достигла определенного пика терапевтических возможностей без тенденции к дальнейшему повышению эффективности у пациентов с НМРЛ [6]. Кроме того, после проведения 1-й линии терапии значительная часть пациентов (до 50%) не получает дальнейшего лечения ввиду быстрого ухудшения состояния и развития симптомов. Существует необходимость использования максимально эффективных подходов к терапии больных НМРЛ [7].
Таким образом, поиск новых эффективных методов лечения пациентов с НМРЛ сегодня является актуальным заданием медицины. В последние годы достигнуты значительные успехи в терапии больных со злокачественными новообразованиями, в первую очередь в результате разработки инновационных лекарственных средств. Это стало возможно благодаря достижениям в молекулярной биологии и генетике, которые позволили в полной мере раскрыть механизмы течения заболевания и таким образом обнаружить новые мишени для медикаментозной терапии.
Семейство генов рецепторов эпидермального фактора роста (epidermal growth factor receptor — EGFR) кодирует трансмембранные тирозинкиназы, следствием мутации которых является постоянная активация рецептора и стимулирование процессов митоза, что приводит к нарушению регуляции клеточного цикла, усилению пролиферации опухолевых клеток, росту и метастазированию опухоли. Данную мутацию при НМРЛ отмечают примерно у 10% представителей европейской популяции и у 30% пациентов в странах Азии [8]. По этой причине таргетное воздействие на EGFR представляет большой интерес в контексте лечения больных НМРЛ. Мутации гена, кодирующего EGFR (делеция экзона 19 или точечная мутация L858R в экзоне 21), являются положительным прогностическим фактором для терапии при НМРЛ. Пациенты, у которых были выявлены такие мутации, демонстрируют лучшие результаты лечения при применении ингибиторов тирозинкиназы EGFR по сравнению с пациентами, у которых мутации не выявлены [8–11].
Эрлотиниб (Тарцева) является мощным ингибитором тирозинкиназной активности EGFR. В результате его применения угнетается рост опухоли, ее инвазия в ткани, метастазирование, повышается чувствительность к цитостатикам [12, 13]. Эрлотиниб обладает доказанной эффективностью у пациентов с мутациями гена EGFR [8, 9, 14] — как у больных с рефрактерным, так и с рецидивирующим НМРЛ в поздних стадиях [15]. Профили эффективности и безопасности эрлотиниба хорошо изучены на основании результатов множества клинических исследований.
Ранее опубликованы результаты 4 многоцентровых исследований, проведенных с участием пациентов, принадлежащих к азиатской и европейской популяциям, целью которых было сравнение эффективности ингибиторов тирозинкиназы и стандартной химиотерапии в 1-й линии лечения при распространенном НМРЛ с активирующими EGFR мутациями. В частности, проведено открытое рандомизированное клиническое исследование III фазы OPTIMAL (CTONC0802), в ходе которого сравнивали эффективность и профиль безопасности 1-й линии терапии при НМРЛ в поздних стадиях с применением эрлотиниба и стандартной химиотерапии у пациентов азиатской популяции с мутациями EGFR [16]. В исследование включали пациентов в возрасте старше 18 лет, у которых был диагностирован гистологически подтвержденный поздний или рецидивирующий НМРЛ (стадии IIIB или IV) с наличием активирующей мутации EGFR — делеции экзона 19 или точечной мутации L858R в 21-м экзоне. Ключевыми критериями для исключения пациентов из исследования были проведенная ранее противоопухолевая терапия (кроме адъювантного или неоадъювантного лечения, после окончания которого через ≥6 мес был отмечен рецидив), а также неконтролируемые метастазы в головном мозгу.
В исследовании принимали участие 165 больных с НМРЛ в поздних стадиях и подтвержденным наличием мутаций гена, кодирующего EGFR, которые ранее не получали какой-либо химиотерапии. Из них хотя бы одну дозу препарата получили 154 пациента (таблица). Они были рандомизированы в 2 группы: больным первой группы (82 пациента) был назначен эрлотиниб (перорально — 150 мг 1 раз в сутки, до прогрессирования заболевания), второй (72 пациента) — карбоплатин и гемцитабин (4 цикла: гемцитабин 1000 мг/м в 1-й и 8-й дни + карбоплатин AUC 5 в 1-й день).
Таблица. Основные характеристики пациентов, принявших участие в исследовании
| Показатели | Эрлотиниб (n=82) | Химиотерапия (n=72) |
| Медиана возраста, годы | 57 (31–74) | 59 (36–8) |
| Вораст, n (%) | ||
| <65 лет | 63 (77) | 51 (71) |
| >65 лет | 19 (23) | 21 (29) |
| Пол, n (%) | ||
| Мужчины | 34 (42) | 29 (40) |
| Женщины | 48 (58) | 43 (60) |
| Результаты гистологического обследования, n (%) | ||
| Аденокарцинома | 72 (88) | 62 (86) |
| Не аденокарцинома | 10 (12) | 10 (14) |
| Отношение к курению, n (%)* | ||
| Курящий/ранее куривший | 23 (28) | 22 (31) |
| Некурящий | 59 (72) | 50 (69) |
| Тип EGFR мутаций, n (%) | ||
| Делеция в 19-м экзоне | 43 (52) | 39 (54) |
| LS58R мутация | 39 (48) | 33 (46) |
| Стадия заболевания | ||
| IIIB | 11 (13) | 5 (7) |
| IV | 71 (87) | 67 (93) |
* Пациентов определяли как курящих в том случае, если они выкурили более 100 сигарет в течение своей жизни, вне зависимости, курят ли они на момент проведения исследования или бросили не более 1 года назад; ранее курившие пациенты — те, которые выкурили на протяжении жизни более 100 сигарет и прекратили курить 1 год и более назад; к некурящим относили тех, кто выкурил 100 и менее сигарет в течение жизни или никогда не курил.
Также проведены гистологическое исследование, определение EGFR статуса и др. При анализе результатов исследования принимали во внимание то, получали ли впоследствии пациенты вторую или последующую линию терапии, а также изучали возможное влияние терапии, проводимой уже после завершения исследования,
на общую выживаемость пациентов. При этом первичной конечной точкой клинического исследования была выживаемость без прогрессирования заболевания, а вторичными — общая выживаемость, ответ на терапию, период до прогрессирования процесса, качество жизни, анализ биомаркеров заболевания и профиль безопасности. Медиана длительности лечения составила 55,5 недели для эрлотиниба и 10,4 недели для карбоплатина и гемцитабина.
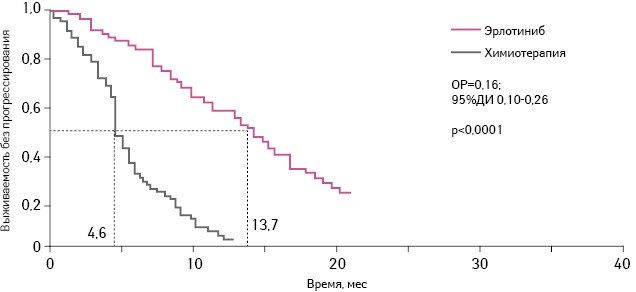
Согласно результатам исследования, опубликованным в 2011 г., лечение эрлотинибом в качестве 1-й линии терапии ассоциировано со статистически достоверно более длительной выживаемостью без прогрессирования по сравнению с химиотерапией (гемцитабин + карбоплатин). При этом медиана выживаемости без прогрессирования заболевания составляла 13,1 мес (95% доверительный интервал (ДИ) 10,58–16,53) в группе пациентов, получавших эрлотиниб; для сравнения — этот показатель в группе больных, принимавших гемцитабин + карбоплатин, составил 4,6 мес (относительный риск (ОР)=0,16; 95% ДИ 0,10–0,26; p
Увеличение выживаемости без прогрессирования заболевания отмечают среди пациентов, получавших эрлотиниб, независимо от возраста, пола, стадии заболевания, результатов гистологического исследования или статуса в отношении курения.
Полный ответ на применение эрлотиниба был достигнут у 2 (2%) пациентов и ни у одного из получавших химиотерапию. У 66 (80%) из 82 больных был получен частичный ответ на применение эрлотиниба по сравнению с 26 (36%) из 72 пациентов, которым была назначена химиотерапия.
На рис. 1 приведены основные гематологические и негематологические нежелательные явления, отмеченные в ходе исследования. Как и ожидалось, химиотерапия была связана со статистически достоверно более высокой частотой гематологических нежелательных явлений, таких как нейтропения (р
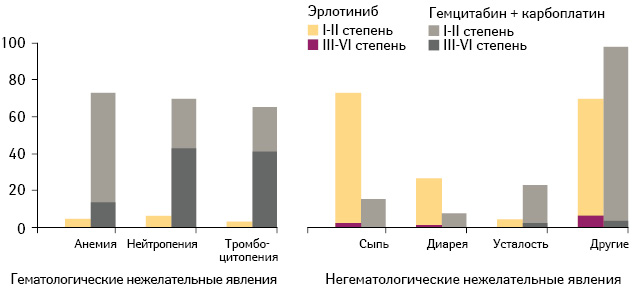
Итак, применение эрлотиниба было ассоциировано с улучшением переносимости терапии [16] и качества жизни пациентов [20] по сравнению со стандартной химиотерапией. Учитывая это, можно предположить, что эрлотиниб может быть экономически оправданной альтернативой платиносодержащим схемам химиотерапии для лечения пациентов с НМРЛ. Так, согласно данным исследования, стоимость проведения химиотерапии из расчета на одного пациента выше, по сравнению с применением эрлотиниба [21].
Таким образом, целесообразность применения эрлотиниба при НМРЛ не вызывает сомнений. Далее будут приведены более поздние результаты клинического исследования OPTIMAL, опубликованные уже в 2012 г. [22].
Согласно полученным в ходе исследования результатам, как и ранее, применение эрлотиниба в качестве 1-й линии терапии статистически достоверно повышало выживаемость без прогрессирования по сравнению с химиотерапией (карбоплатин + гемцитабин) (ОР=0,16; 95% ДИ 0,10–0,26; pТак, медиана выживаемости без прогрессирования при применении эрлотиниба составила 13,7 мес, а аналогичный показатель для больных, получавших комбинацию карбоплатин + гемцитабин, — всего лишь 4,6 мес.По состоянию на 31 декабря 2011 г. 7 пациентов из группы эрлотиниба продолжали получать препарат, при этом отмечали ответ на терапию.
Медикаментозная терапия, которую проводили по завершении исследования, также была проанализирована. Вторую линию терапии, включая химиотерапию, экспериментальные препараты, ингибиторы тирозинкиназы EGFR в группе пациентов, принимавших эрлотиниб, получали 43; 6 и 1 больной соответственно. Аналогичные препараты применяли у 9; 1 и 46 больных соответственно в группе комбинации карбоплатина и гемцитабина.
Какое-либо лечение после 1-й линии терапии по завершении данного клинического исследования не получали 25 пациентов, у которых применяли эрлотиниб, и 16 пациентов, получавших карбоплатин и гемцитабин. Важно обратить внимание на то, что в группе пациентов, получавших карбоплатин + гемцитабин, отмечена высокая частота переключения на терапию с помощью ингибиторов тирозинкиназы EGFR (64%) в качестве 2-й линии лечения.
Общая выживаемость пациентов, принимавших эрлотиниб, у которых применяли химиотерапию в качестве 2-й линии лечения, статистически не отличалась от аналогичного показателя в группе карбоплатин + гемцитабин, в которой впоследствии назначали ингибиторы тирозинкиназы EGFR (ОР=1,08; 95% ДИ 0,61–1,91; p=0,80).
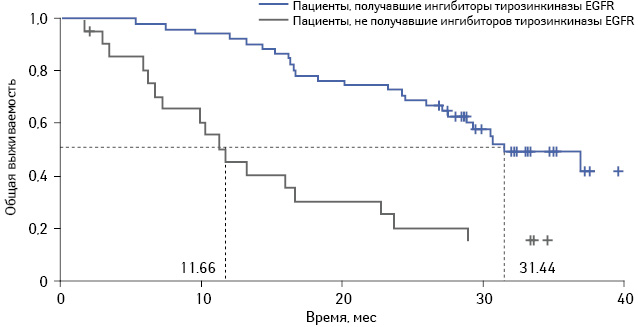
При этом в группе пациентов, получавших карбоплатин и гемцитабин, общая выживаемость пациентов, принимавших в качестве 2-й линии терапии ингибиторы тирозинкиназы EGFR, была статистически достоверно выше по сравнению с теми, кто не получал таковых. Так, медиана общей выживаемости пациентов из группы карбоплатин + гемцитабин, получавших впоследствии ингибиторы тирозинкиназы EGFR, составила 31,4 мес, а аналогичный показатель для пациентов, не принимавших ингибиторы тирозинкиназы EGFR, был на уровне 11,7 мес (рис. 3).
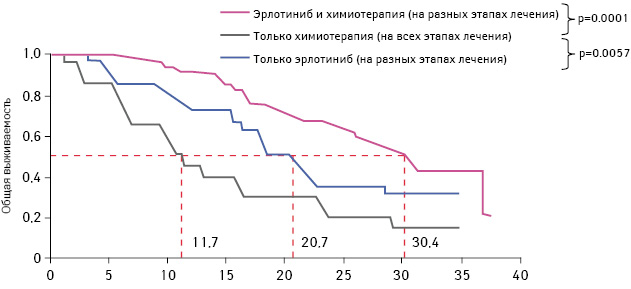
Кроме того, общая выживаемость среди пациентов, которые получали только ингибиторы тирозинкиназы EGFR (включая несколько курсов лечения), была значительно выше по сравнению с пациентами, у которых применяли только химиотерапию. Данный показатель составил 20,7 и 11,7 мес соответственно (рис. 4). Также общая выживаемость среди пациентов, которые получали и ингибиторы тирозинкиназы EGFR, и химиотерапию, была выше по сравнению с больными, у которых применяли только химиотерапию. Показатель составил 30,4 и 11,7 мес соответственно (см. рис. 4).
Результаты дополнительного анализа общей выживаемости после терапии, проведенной по завершении данного этапа исследования, показывают, что эрлотиниб является важным фактором повышения выживаемости пациентов с мутациями EGFR при НМРЛ. Отсутствие статистически достоверного различия показателей общей выживаемости в исследовании OPTIMAL, по мнению его авторов, связано с высоким уровнем перехода с терапии карбоплатином и гемцитабином на ингибиторы тирозинкиназы EGFR в качестве 2-й линии терапии. Однако статистически достоверно показано, что выживаемость без прогрессирования, качество жизни и переносимость терапии эрлотинибом превышали соответствующие показатели для группы карбоплатин + гемцитабин.
Значительные преимущества при применении эрлотиниба по сравнению с химиотерапией (карбоплатин + гемцитабин) отмечают в отношении таких показателей, как выживаемость без прогрессирования заболевания, качество жизни и переносимость терапии. Кроме того, необходимо принимать во внимание экономическую оправданность терапии эрлотинибом по сравнению с химиотерапией.
Таким образом, применение эрлотиниба следует рассматривать как один из стандартных методов 1-й линии терапии у пациентов с НМРЛ в поздних стадиях и с подтвержденными мутациями EGFR.
Необходимо отметить, что авторы продолжили свои наблюдения в рамках данного клинического исследования с целью дальнейшего изучения общей выживаемости в долгосрочной перспективе.
Список использованной литературы
1. Jemal A., Siegel R., Ward E. et al. (2008) Cancer statistics, 2008. CA Cancer J. Clin., 58: 71–96.
2. Рак в Україні, 2011–2012. Захворюваність, смертність, показники діяльності онкологічної служби (2013) Бюл. Нац. канцер-реєстру України, 14: 1–2, 8, 38–9.
3. Spira A., Ettinger D.S. (2004) Multidisciplinary management of lung cancer. N. Engl. J. Med., 350(4): 379–392.
4. Mountain C.F. (1997) Revisions in the international system for staging lung cancer. Chest, 111: 1710–1717.
5. Арсеньев А.И. (2006) Адъювантная химиотерапия и лучевая терапия операбельного немелкоклеточнго рака легкого. Практическая онкология, 7(3): 145–160.
6. Breathnach O.S., Freidlin B., Conley B. et al. (2001) Twenty-two years of phase III trials for patients with advanced non-small-cell lung cancer: sobering results. J. Clin. Oncol., 19: 1734–1742.
7. Stinchcombe T.E., Socinski M.A. (2009) Treatment paradigms for advanced stage non-small cell lung cancer in the era of multiple lines of therapy. J. Thoracic Oncol., 4: 243–50
8. Rosell R., Molina M.A., Serrano M.J. (2012) EGFR mutations in circulating tumour DNA. Lancet Oncol., 13: 239–246.
9. Cappuzzo F., Ciuleanu T., Stelmakh L. et al. (2010) Erlotinib as maintenance treatment in advanced non-small-cell lung cancer: a multicentre, randomised, placebo-controlled phase 3 study. Lancet Oncol., 11: 521–529.
10. Maemondo M., Inoue A., Kobayashi K. et al. (2010) Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR. N. Engl. J. Med., 362: 2380–2388.
11. Mitsudomi T., Morita S., Yatabe Y. et al. (2010) Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor (WJTOG3405): an open label, randomised phase 3 trial. Lancet Oncol., 11(2): 121–128.
12. Arteaga C. (2003) Тargeting HER1/EGFR: for molecular approach to cancer therapy. Semin. Oncol., 30: 3–14.
13. Akita R.W., Sliwkowski M.X. (2003) Preclinical studies with erlotinib (Tarceva). Semin. Oncol., 30: 15–24.
14. Zhu C.Q., da Cunha Santos G., Ding K. et al. (2008) Role of KRAS and EGFR as biomarkers of response to erlotinib in National Cancer Institute of Canada Clinical Trials Group Study BR. 21. J. Clin. Oncol., 26; 4268–4275.
15. Shepherd F.A., Rodrigues Pereira J., Ciuleanu T. et al. (2005) Erlotinib in previously treated non-small-cell lung cancer. N. Engl. J. Med., 353: 123–132.
16. Zhou C., Wu Y.L., Chen G. et al. (2011) Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study. Lancet Oncol.,12: 735–742.
17. Gatzemeier U., Pluzanska A., Szczesna A., et al. (2007) Phase III study of erlotinib in combination with cisplatin and gemcitabine in advanced non–small-cell lung cancer: The Tarceva Lung Cancer Investigation Trial. J. Clin. Oncol., 25(12), 1545–1552.
18. Herbst R.S., Prager D., Hermann R. et al. (2005) TRIBUTE: A phase III trial of erlotinib hydrochloride (OSI-774) combined with carboplatin and paclitaxel chemotherapy in advanced non–small-cell lung cancer. J. Clin. Oncol., 23(25): 5892–5899.
19. Fukuoka M., Yano S., Giaccone G. et al. (2003) Multi-institutional randomized phase II trial of gefitinib for previously treated patients with advanced non-small-cell lung cancer. J. Clin. Oncol., 21(12): 2237–2246.
20. Zhou C., Wu Y.L., Chen G. et al. (2011) Updated efficacy and quality-of-life (QoL) analyses in OPTIMAL, a phase III, randomized, open-label study of first-line erlotinib versus gemcitabine/carboplatin in patients with EGFR-activating mutation-positive (EGFR Act Mut+) advanced non-small cell lung cancer (NSCLC). In ASCO Meet Abstr., 29: 7520.
21. Chung C., Isaranuwatchai W., Di Maio M. et al., (2013) Economic analysis of torch: erlotinib versus cisplatin and gemcitabine as first-line therapy for advanced non-small cell lung cancer (NSCLC). J. Thoracic Oncol., 31, P1.11-020: 602–603.
22. Zhou C., Wu Y.L., Liu X. et al. (2012) Overall survival (OS) results from OPTIMAL (CTONG0802), a phase III trial of erlotinib (E) versus carboplatin plus gemcitabine (GC) as first-line treatment for Chinese patients with EGFR mutation-positive advanced non-small cell lung cancer (NSCLC). J. Clin. Oncol., 30: 7520.
Публикация подготовлена редакцией журнала «Клиническая онкология».














Leave a comment