Новые возможности в лечении метастатического РГЖ в постменопаузе: клинический обзор ключевых исследований
Резюме. За последние несколько десятилетий появилось множество видов эндокринной терапии первой линии для пациенток с ER+/PgR+ распространенным и/или метастатическим раком грудной железы (РГЖ). Рекомендации относительно выбора терапии первой линии для женщин в период постменопаузы с местно-распространенным или метастатическим РГЖ, ER+/PgR+, включают эндокринную терапию ингибитором ароматазы третьего поколения (анастрозол, летрозол или экземестан) или тамоксифеном [1–4]. Известно, что при гормон-рецептор-положительном РГЖ ингибиторы ароматазы третьего поколения обладают более высокой эффективностью по сравнению с тамоксифеном относительно времени до прогрессирования [5–9]. В то же время высокая распространенность резистентности к лечению ингибиторами ароматазы свидетельствует об актуальности разработки дополнительных вариантов терапии с различными механизмами действия. Одним из вариантов, предоставляющих дополнительные возможности терапии, является фулвестрант (Фазлодекс), продемонстрировавший высокую эффективность наравне с приемлемым профилем безопасности.
Получено: 26.07.2019
Принято в печать: 31.07.2019
DOI: 10.32471/clinicaloncology.2663-466X.39.22815
Рост и пролиферация опухолевых клеток гормонзависимого РГЖ зависит от активности рецепторов эстрогенов (oestrogen receptors — ER) — ERα и ERβ, которые в норме активируются эстрогенами. После связывания с гормоном ER подвергаются димеризации и транслоцируются в клеточное ядро. Затем димеры связываются с ДНК в регуляторных областях целевых генов, влияя таким образом на интенсивность их экспрессии. Молекула ERα состоит из нескольких доменов: лигандсвязывающий домен (связывающий 17β-эстрадиол), ДНК-связывающий домен, шарнирный или димеризационный домен и два трансактивирующих домена — AF (activation function)-1 и AF-2. AF-1 – домен с транскрипционной активаторной функцией находится на N-концевом участке рецептора, ответственном за белок-белковые взаимодействия и транскрипционную активацию гена-мишени независимо от связывания с лигандом [10–12]. Лигандсвязывающий домен содержит участок с активационной функцией AF-2, зависимой от присутствия лиганда. Он ответственен за конформационные изменения ER при наличии лигандов и последующее связывание димеров ER с коактиваторами и корепрессорами в зависимости от связывания с лигандом. При связывании лиганда с рецептором происходит его димеризация, ядерная транслокация и трансактивация экспрессии генов-мишеней.
ERα имеет разные механизмы действия:
- функционирует как фактор транскрипции: активирует специфические элементы ответа на эстрогены (oestrogen response elements — ERE) в промоторах генов-мишеней;
- связывание и активация других транскрипционных факторов;
- активация независимым от лиганда способом посредством перекрестного взаимодействия с тирозинкиназными путями;
- оказание «негеномного» действия, при котором эстрогены активируют мембраносвязанные и связанные с G-белком ER (GPER, также известный как GPR30) и запускают нисходящий сигнальный путь.
Управление действиями ER включает рекрутирование корегуляторов AF-доменом. В то время как AF-2 активируется эстрогеном в лигандзависимых процессах, AF1 активируется факторами роста посредством активации митоген-активируемой протеинкиназы (mitogen-activated protein kinase — MAPK) [13, 14]. Полная агонистическая функция рецептора возможна благодаря наличию обеих активностей.
Механизм действия и преимущества применения фулвестранта (Фазлодекс)
Фулвестрант — аналог 17-эстрадиола, является селективным деградатором ER, который блокирует функцию ER [15–17]. Поскольку димеризация рецептора блокируется, это вызывает ускоренную деградацию и отрицательную регуляцию ER [16].
Механизм действия тамоксифена, его метаболитов и эстрогена похожи, а разница основана на дезактивации AF-2 в комплексе тамоксифен-эстрогеновый рецептор (ТАМ-ER). Частичная агонистическая активность тамоксифена является результатом действия AF-1 и зависит от типа клеток и промотора, с которым связан транскрипционный комплекс. Таким образом, тамоксифен частично выключает только активный домен AF-2. В свою очередь, фулвестрант блокирует оба активных домена, практически полностью выключая активность рецептора и приводя к его ускоренному разрушению. Фулвестрант связывается с ERα, конкурируя при этом с эстрадиолом за сайт связывания. Он характеризуется высокой аффинностью связывания, которая составляет 89% таковой для эстрадиола, что намного больше, чем сродство тамоксифена, которое составляет 2,5% [16]. Связывание фулвестранта с ERα препятствует димеризации ER, ингибирует ядерную транслокацию ER и активацию и способствует деградации ER (отрицательная регуляция ER), приводя к полному ингибированию передачи сигналов ERα. Блокируя как AF-1, так и AF-2 (в то время как селективные модуляторы ER ингибируют только AF-2), фулвестрант является селективным деградатором рецептров эстрогена, лишенным какой-либо агонистической активности, включая влияние на эндометрий [18–21].
Связывание комплекса фулвестрант-ER с ERE ингибируется, как и функции AF-1 и AF-2, а также связывание коактиватора. Повышенная деградация ER, опосредованная фулвестрантом, возможно, основана на прекращении активации ER другими медиаторами, например дофамином, циклическим аденозин 3, 5’-монофосфатом (цАМФ) или факторами роста [22–28].
Более того, в отличие от тамоксифена, фулвестрант является селективным деградатором ER, не обладает агонистоподобной активностью, о чем свидетельствуют исследования, оценивающие утеротрофические эффекты препарата у животных и женщин в период постменопаузы с раком грудной железы, а также снижение экспрессии рецептора прогестерона (белка, регулируемого эстрогенами), наблюдаемого при применении фулвестрантом [29–35]. Указанные различия в механизме действия селективных модуляторов ER (selective oestrogen receptor modulators — SERM), к которым принадлежит тамоксифен, и фулвестранта объясняют отсутствие усиления активности роста эндометрия при применении последнего, что отмечалось в ходе доклинических исследований [22].
Фулвестрант также оказывает незначительное влияние на сывороточные уровни фолликулостимулирующего гормона и лютеинизирующего гормона у женщин в период постменопаузы с раком грудной железы [36, 37], что свидетельствует об отсутствии клинически значимых периферических стероидных эффектов [38]. Более того, при применении фулвестранта у пациентов с раком грудной железы не было отмечено клинически значимого изменения уровней маркеров костного обмена в сыворотке крови [39, 40].
Таким образом, фулвестрант селективно связывается с ER, вызывая их деградацию в опухолевых клетках РГЖ и делая рецепторы недоступными для эстрогена и подавляя как эстрогензависимые, так и эстрогеннезависимые сигнальные пути (AF-1 и AF-2), что приводит к полному подавлению сигнального пути эстрогена через ER, в отличие от селективных модуляторов ER. Кроме того, фулвестрант связывается с ER с более высокой аффинностью, чем тамоксифен, и не проявляет агонистической активности.
Первично фулвестрант был одобрен как препарат второй линии, однако успешные результаты его широкого применения дали основания для проведения клинических исследований, которые продемонстрировали его преимущества в качестве первой линии терапии. Сегодня монотерапия фулвестрантом, в соответствии с современными руководствами по лечению ER+/PgR+ распространенного рака грудной железы у женщин в период постменопаузы, рекомендована в качестве первой линии эндокринной терапии наряду с другими вариантами, включая ингибиторы ароматазы (например анастрозол, летрозол, экземестан), селективные модуляторы ER (например тамоксифен) и пр. [41–43]. Выбор наиболее подходящего режима основывается на анализе ряда факторов, таких как тип, продолжительность и время после адъювантной эндокринной терапии (если таковая была), локализация метастазов (например кости, мягкие ткани, внутренние органы), сопутствующие заболевания и предпочтения пациента [42, 44]. Кроме того, следует учитывать, что ежемесячные инъекции фулвестранта по сравнению с ежедневным пероральным приемом, необходимым для других эндокринных терапий, могут способствовать повышению приверженности пациентов лечению [45]. Фулвестрант также может быть приемлемым вариантом для пациентов, испытывающих сложности с пероральным приемом лекарственных средств. Монотерапия фулвестрантом в качестве эндокринного лечения первой линии при распространенном раке грудной железы непосредственно не сравнивалась с другими эндокринными агентами, кроме анастрозола, однако, согласно результатам ряда метаанализов, фулвестрант демонстрирует преимущества по сравнению с несколькими такими компараторами [46, 47]. В одном из таких метаанализов [46] фулвестрант ассоциировался с лучшей выживаемостью без прогрессирования (ВБП), чем анастрозол, экземестан, тамоксифен и торемифен, и имел преимущества по сравнению с анастрозолом, экземестаном и тамоксифеном. Аналогичным образом другой анализ [47] доказал преимущество фулвестранта 500 мг в эффективности по показателю времени до прогрессирования заболевания (ВДП)/ВБП, за которым следует летрозол, анастрозол, экземестан и тамоксифен. Кроме того, поскольку лечение рака грудной железы часто является паллиативным, минимизация токсичности — также важный фактор при выборе подходящего препарата [44]. Так, фулвестрант, как правило, хорошо переносился и демонстрировал низкую частоту серьезных побочных реакций, связанных с лечением.
Таким образом, Фазлодекс (фулвестрант) показан для лечения рака молочной железы с ER+, местно-распространенного или с метастазами у женщин в период постменопаузы: ранее не получавших гормональную терапию; в случае рецидива болезни во время или после адъювантной антиэстрогенной терапии или прогрессирования заболевания при антиэстрогенной терапии [48].
Доза фулвестранта 500 мг была одобрена на основе данных клинического исследования ІІІ фазы, двойного слепого «Comparison of Faslodex in Recurrent or Metastatic Breast Cancer» (CONFIRM) [49], в котором сравнивали фулвестрант 500 мг и фулвестрант 250 мг у пациентов с ER+/PgR+ распространенным РГЖ, у которых прогрессирование заболевания наступило на фоне эндокринной терапии. В исследовании CONFIRM было показано, что ВБП и общая выживаемость (ОВ) были больше для фулвестранта 500 мг по сравнению с таковым в дозе 250 мг. Далее будет рассмотрен ряд исследований, которые демонстрируют преимущество фулвестранта 500 мг относительно эффективности терапии как по сравнению с фулвестрантом 250 мг, так и по сравнению с ведущим представителем класса ингибиторов ароматазы наравне с приемлемым профилем безопасности и переносимостью [50–52].
Исследование CONFIRM: Фазлодекс 500 увеличивает общую выживаемость
Известно, что фулвестрант снижает уровень ER в клетках дозозависимым образом [16, 53, 54]. В то же время более ранние клинические исследования эффективности применения фулвестранта 250 мг по сравнению с анастрозолом у пациентов с гормонзависимым РГЖ в период постменопаузы, которые предварительно получали тамоксифен, показали, что оба препарата характеризуются одинаковой эффективностью и приемлемым профилем безопасности с низкой частотой отмены препарата [34, 36]. Анализ результатов упомянутых исследований позволил предположить, что повышение дозы фулвестранта (Фазлодекс) позволит повысить эффективность лечения [34–37, 54, 55], это и было показано в ходе исследования CONFIRM [49].
CONFIRM — это двойное слепое многоцентровое клиническое исследование III фазы с параллельными группами, в котором оценивали эффективность двух различных доз фулвестранта — одобренной на тот момент (250 мг каждые 28 сут) и более высокой (500 мг на 0-, 14- и 28-е сутки и каждые 28 сут после этого). В исследовании принимали участие женщины с ER+ распространенным РГЖ, у которых было отмечено прогрессирование заболевания после ранее назначенного лечения. Первичной конечной точкой исследования была выбрана ВБП.
Согласно полученным результатам, фулвестрант 500 мг значительно продлевает ВБП по сравнению с фулвестрантом 250 мг (относительный риск (ОР) 0,80; 95% доверительный интервал (ДИ) 0,68–0,94; р=0,006) (рис. 1). Медиана времени ВБП составляла 6,5 и 5,5 мес в группах, получавших 500 и 250 мг фулвестранта соответственно. Через 12 мес 34 и 25% пациентов, получавших данный препарат в дозе 500 и 250 мг соответственно, остались живы и у них не было отмечено прогрессирования заболевания. Аналогичные показатели составили 16 и 11% соответственно через 24 мес лечения.
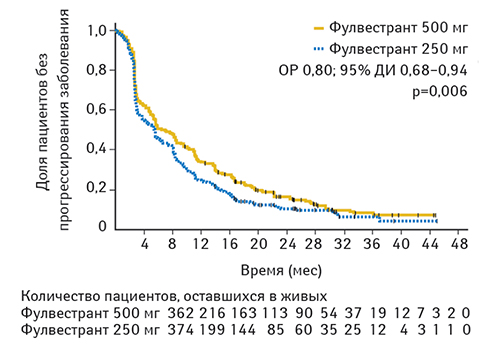
Медиана продолжительности клинического эффекта составила 16,6 и 13,9 мес в группах, получавших фулвестрант в дозе 500 и 250 мг соответственно. На момент первичного анализа ОВ (50% пациентов оставались живыми) медиана времени до смерти составляла 25,1 и 22,8 мес для пациентов, получавших фулвестрант в дозе 500 и 250 мг соответственно (ОР 0,84; 95% ДИ 0,69–1,03; р=0,091) (рис. 2).
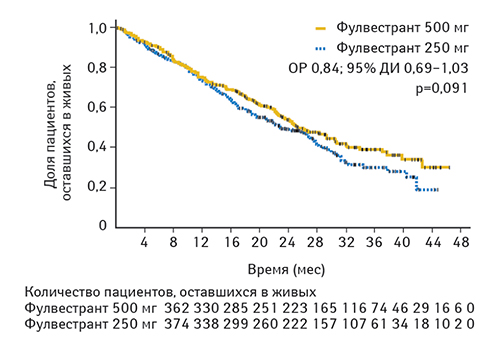
По информации обновленного анализа данных исследования CONFIRM (25% пациентов оставались живы), медиана ОВ при применении фулвестранта в дозе 500 мг на 4,1 мес больше, чем при применении фулвестранта в дозе 250 мг (26,4 мес в сравнении с 22,3 мес соответственно, ОР 0,81; 95% ДИ 0,69–0,96; номинальный р=0,016) [56].
При этом профили безопасности применения фулвестранта в дозе 500 и 250 мг были сопоставимыми [49].
Таким образом, эти результаты демонстрируют, что режим применения фулвестранта 500 мг внутримышечно (на 0-, 14- и 28-е сутки и каждые 28 сут после этого) более целесообразен с позиций клинической эффективности в медицинской практике по сравнению с фулвестрантом в дозе 250 мг. Благодаря тому что фулвестрант подтвердил эффективность в отношении повышения показателей ОВ в исследовании CONFIRM, пациенты с распространенным РГЖ имеют более высокие шансы прожить дольше, получая фулвестрант во 2‐ или 3‐й линии после тамоксифена.
Исследование FIRST: преимущества применения Фазлодекса по сравнению с ингибитором ароматазы третьего поколения
Клиническая эффективность фулвестранта была первоначально продемонстрирована в двух исследованиях III фазы, в которых сравнивали фулвестрант в дозе 250 мг/мес с анастрозолом по 1 мг/сут в качестве второй линии терапии распространенного РГЖ [34, 36]. Комбинированный анализ этих исследований показал, что время до прогрессирования (ВДП) для пациентов, получавших фулвестрант в дозе 250 мг, не уступало таковому в группе, получавшей анастрозол [35]. Таким образом, после успешного проведения исследования CONFIRM логичным было сравнить эффективность фулвестранта в повышенной дозе 500 мг с анастрозолом. Именно такая цель была поставлена при проведении исследования «Fulvestrant First-Line Study Comparing Endocrine Treatments» (FIRST).
FIRST — рандомизированное открытое многоцентровое исследование II фазы, в котором сравнивали эффективность и профиль безопасности фулвестранта в дозе 500 мг (на 0-, 14-, 28-е сутки и каждые 28 сут после этого) с анастрозолом 1 мг (ежедневно) в качестве первой линии терапии у женщин в период постменопаузы с ER+/PgR+ местно-распространенным/метастатическим РГЖ [52].
Ключевыми критериями включения в исследование были: женщины в период постменопаузы с ER+ или рецептор прогестерона (progesterone receptor — РgR) положительным местно-распространенным или метастатическим РГЖ, ранее не получавшие эндокринную терапию или получавшие эндокринную терапию за >12 мес до рандомизации по поводу ранних стадий РГЖ. Основными критериями исключения были: наличие метастазов, угрожающих жизни, и предшествующее лечение неодобренным препаратом. В качестве первичной конечной точки были выбраны частота клинического эффекта и медиана ВДП.
В общей сложности 205 пациентов были случайным образом распределены для получения фулвестранта 500 мг (n=102) или анастрозола 1 мг (n=103) в 62 центрах 9 стран (Бразилия, Болгария, Чешская Республика, Франция, Италия, Польша, Испания, США и Великобритания). Базовые и демографические характеристики пациентов в группах лечения были схожими [50]. Доля пациентов, которые ранее не получали эндокринную терапию на ранних стадиях заболевания, была одинаковой для участников, получавших фулвестрант в дозе 500 мг и анастрозол (71,6 и 77,7% пациентов в начале исследования соответственно). Среди тех, кто ранее получал терапию, большинству назначался тамоксифен.
Первый анализ был выполнен, когда 79,5% пациентов прекратили исследуемое лечение [51]. На момент первого анализа только у 36% пациентов отмечалось прогрессирование заболевания и медиана ВДП не была достигнута для фулвестранта. Согласно полученным результатам, при применении фулвестранта ВДП увеличивалось более чем на 10 мес по сравнению с применением анастрозола. Так, медиана ВДП составила 23,4 мес для фулвестранта против 13,1 мес для анастрозола, а снижение риска прогрессирования составило 34% (ОР 0,66; 95% ДИ 0,47–0,92; p=0,01). Частота клинического эффекта составила 72,5 и 67,0% для фулвестранта в дозе 500 мг и анастрозола соответственно.
Оценка показателя ОВ изначально не была запланирована в протоколе, и впоследствии в него были внесены поправки для оценки ОВ после того, как в живых осталось около 35% пациентов. Следует отметить, что не все больные участвовали в дальнейшем наблюдении для оценки ОВ. Влияние лечения на ОВ было изучено в нескольких подгруппах.
На момент проведения последующего анализа ОВ 63 из 102 пациентов в группе фулвестранта в дозе 500 мг (61,8%) и 74 из 103 пациентов в группе анастрозола (71,8%) умерли. Показатели первичного анализа ОВ улучшились в группе фулвестранта в дозе 500 мг по сравнению с анастрозолом 1 мг; ОР составил 0,70 (95% ДИ 0,50–0,98; логранговый критерий р=0,04; медиана ОВ — 54,1 мес против 48,4 мес; рис. 3). Было установлено, что ОВ для фулвестранта в дозе 500 мг по сравнению с анастрозолом в целом совпадает во всех подгруппах.
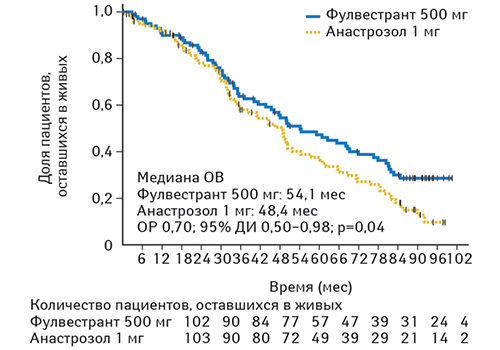
Большинство побочных реакций были расценены исследователями как не связанные с лечением. Были зарегистрированы две побочные реакции, ассоциированные с терапией (один случай артериальной гипертензии и один случай легочной эмболии, оба в группе лечения фулвестрантом в дозе 500 мг).
Таким образом, в исследовании FIRST показано улучшение ОВ при лечении фулвестрантом в дозе 500 мг по сравнению с анастрозолом в качестве первой линии терапии при ER+ распространенном РГЖ, со снижением риска смерти приблизительно на 30%. Так, улучшение ВДП привело к улучшению ОВ примерно на 6 мес при применении фулвестранта в дозе 500 мг (54,1 мес) по сравнению с анастрозолом (48,4 мес), что согласуется с данными относительно улучшения ОВ при применении фулвестранта в дозе 500 мг по сравнению с 250 мг во второй линии терапии, согласно данным, полученным в исследовании CONFIRM [57]. Кроме того, не было зарегистрировано каких-либо новых особенностей профиля безопасности или проблем переносимости на этапе наблюдения в этом исследовании, что согласуется с ранее полученными данными о безопасности [50, 51]. Улучшение ОВ при применении фулвестранта в дозе 500 мг (54,1 мес) по сравнению с анастрозолом (48,4 мес) наблюдалось даже несмотря на то, что медиана ОВ для группы, получавшей анастрозол, в этом исследовании была выше, чем сообщалось ранее. Например, ОВ при применении анастрозола в качестве эндокринной терапии первой линии при распространенном РГЖ в комбинированном анализе двух исследований III фазы составила 39,2 мес [58], а при монотерапии анастрозолом в комбинированном исследовании III фазы — 41,3 мес [59]. Кроме того, соответствующие средние значения ОВ 34,0 мес (летрозол) [8] и 37,2 мес (экземестан) [36] были зарегистрированы для других ингибиторов ароматазы. Поэтому маловероятно, что в настоящем анализе переоценивается степень улучшения выживаемости при применении фулвестранта в дозе 500 мг по сравнению с анастрозолом, что могло бы быть возможным, если бы лечение в контрольной группе (анастрозол) было бы недостаточно эффективным. Таким образом, применение фулвестранта в дозе 500 мг связано с улучшением OВ по сравнению с анастрозолом в первой линии терапии ER+ распространенного РГЖ. Так, впервые было продемонстрировано, что эндокринная монотерапия обладает более высокой эффективностью по сравнению с ингибиторами ароматазы третьего поколения.
FALCON: фулвестрант увеличивает ВБП еще на 2,8 мес по сравнению с ингибиторами ароматазы
Исследование «Fulvestrant and Anastrozole Compared in Hormonal Therapy Naive Advanced Breast Cancer» (FALCON) было разработано после получения положительных результатов в ходе II фазы исследования FIRST [60]. Дизайн исследования исключал возможные источники систематической ошибки, такие как применявшаяся ранее эндокринная терапия, в результате которой может развиться приобретенная эндокринная резистентность. Целью исследования FALCON стало сравнить эффективность фулвестранта и анастрозола по показателю ВБП и избежать при этом влияния на результат предшествующей эндокринной или гормональной терапии.
FALCON — рандомизированное двойное слепое клиническое исследование III фазы, в котором приняли участие более 100 медицинских центров в 20 странах. В исследование FALCON были включены женщины в период постменопаузы с ER+ и/или PgR+ местно-распространенным или метастатическим РГЖ, которые ранее не получали эндокринную терапию. Это было сделано с целью избежать снижения эффективности в контрольной группе путем воздействия адъювантной эндокринной терапии. Первичной конечной точкой была выбрана ВБП.
В исследование было включено 524 пациента, из них 462 были рандомизированы на две группы: 230 пациентов получали фулвестрант и 232 — анастрозол.
На момент анализа полученных данных было зарегистрировано 309 случаев прогрессирования заболевания, из них 143 (62%) из 230 имели место в группе, получавшей фулвестрант, а 166 (72%) из 232 — в группе анастрозола. Применение фулвестранта ассоциировалось со статистически значимым улучшением ВБП по сравнению с анастрозолом (ОР 0,797; 95% ДИ 0,637–0,999; р=0,0486; рис. 4). Медиана ВБП составила 16,6 мес (95% ДИ 13,83–20,99) при применении фулвестранта и 13,8 мес (11,99–16,59) в группе, получавшей анастрозол (разница 2,8 мес).
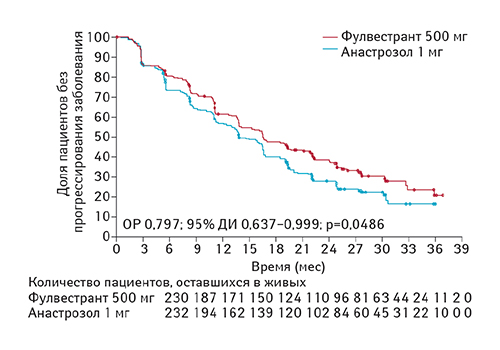
Средняя продолжительность ответа на лечение была больше в группе, получавшей фулвестрант (20,0 мес, 95% ДИ 15,90–27,63), по сравнению с группой, получавшей анастрозол (13,2 мес, 95% ДИ 10,64–16,72).
Частота клинического эффекта составила 78% (180/230) при применении фулвестранта и 74% (172/232) — в группе, получавшей анастрозол (ОР 1,25; 95% ДИ 0,82–1,93; p=0,3045). Медиана продолжительности клинического эффекта составила 22,1 мес (95% ДИ 18,46–24,97) при применении фулвестранта и 19,1 мес (16,53–20,47) в группе, получавшей анастрозол.ОВ в исследовании FALCON была вторичной конечной точкой. На момент проведения анализа медиану ОВ невозможно было рассчитать из-за недостаточного времени наблюдения (31% зрелости данных).
Эффективность лечения в отношении ВБП была в основном одинаковой во всех подгруппах пациентов, за исключением некоторых из них.
О серьезных побочных эффектах сообщили 30 (13%) из 228 пациентов, получавших фулвестрант, и 31 (13%) из 232 пациентов, которым был назначен анастрозол. Неблагоприятные явления 3-й степени или выше были зарегистрированы у 51 (22%) из 228 пациентов, получавших фулвестрант, и у 41 (18%) из 232 пациентов группы анастрозола.
Первичная конечная точка этого исследования была достигнута: ВБП пациентов, получавших фулвестрант, значительно превышает таковую у пациентов из группы анастрозола, подтверждая гипотезу о том, что фулвестрант является более эффективным препаратом для терапии, чем анастрозол, у женщин в период постменопаузы с ER+/PgR+ местно-распространенным или метастатическим РГЖ, которые ранее не получали эндокринную терапию. Фулвестрант обеспечивает дополнительное увеличение медианы ВБП по сравнению с ингибитором ароматазы анастрозолом еще на 2,8 мес у пациентов с ER+ распространенным РГЖ в период постменопаузы. При этом показатель ОР для ВБП, полученный в этом исследовании (0,797), аналогичен улучшению, продемонстрированному ингибиторами ароматазы третьего поколения по сравнению с тамоксифеном [5–8]. Оба препарата обладают сопоставимым профилем безопасности и переносимостью.
В заключение
Приведенные выше исследования обеспечивают прямое сравнение терапевтической эффективности селективного деградатора ER фулвестранта и ингибитора ароматазы третьего поколения, в том числе без влияния предыдущего воздействия адъювантной эндокринной терапии любого типа, доказывая преимущества Фазлодекса (фулвестранта) относительно эффективности лечения, превышающей таковую для ингибиторов ароматазы третьего поколения, и демонстрируя приемлемый профиль безопасности. Тем самым Фазлодекс открывает новые возможности эффективной терапии ER+/PgR+ местно-распространенного или метастатического РГЖ у пациентов в период постменопаузы.
Список использованной литературы
- National Comprehensive Cancer Network. (2016). NCCN Clinical Practice Guidelines in Oncology Version.2.2015: Breast Cancer. 2015. Retrieved from http://www.nccn.org/professionals/physician_gls/PDF/breast.pdf.
- Rugo, H. S., Rumble, R. B., Macrae, E., Barton, D. L., Connolly, H. K., Dickler, M. N., …& Johnston, S. R. (2016). Endocrine therapy for hormone receptor-positive metastatic breast cancer: American Society of Clinical Oncology Guideline. Journal of Clinical Oncology, 34(25), 3069–3103. doi: 10.1200/JCO.2016.67.1487.
- Cardoso, F., Costa, A., Norton, L., Senkus, E., Aapro, M., Andre, F., …& Cardoso, M. J. (2014). ESO-ESMO 2nd international consensus guidelines for advanced breast cancer (ABC2). Annals of oncology, 25(10), 1871–1888. doi: 10.1093/annonc/mdu385.
- Burstein, H. J., Temin, S., Anderson, H., Buchholz, T. A., Davidson, N. E., Gelmon K. E., …& Griggs, J. J. (2014) Adjuvant endocrine therapy for women with hormone receptor-positive breast cancer: American Society of Clinical Oncology Clinical Practice Guideline Focused Update. Journal of Clinical Oncology, 32: 2255–2269. doi: 10.1200/JCO.2013.54.2258.
- Nabholtz, J. M., Buzdar, A., Pollak, M., Harwin, W., Burton, G., Mangalik, A., …& Von Euler, M. (2000). Anastrozole is superior to tamoxifen as first-line therapy for advanced breast cancer in postmenopausal women: results of a North American multicenter randomized trial. Journal of Clinical Oncology, 18(22), 3758–3767. Retrieved from https://www.mcgill.ca /pollak-lab /files/pollak-lab /anastrazole_is_ superior_to_ tamoxifen_ as_first-line_therapy_for_advanced_breast_cancer_in_postmenopausal_women.pdf.
- Bonneterre, J., Buzdar, A., Nabholtz, J. M., Robertson, J. F., Thürlimann, B., von Euler, M., …& Arimidex Writing Committee on behalf of the Investigators Committee Members. (2001). Anastrozole is superior to tamoxifen as first‐line therapy in hormone receptor positive advanced breast carcinoma: results of two randomized trials designed for combined analysis. Cancer, 92(9), 2247–2258. doi: 10.1002/1097- 0142 (20011101)92:9<2247::AID-CNCR1570>3.0.CO;2-Y.
- Mouridsen, H., Gershanovich, M., Sun, Y., Pérez-Carrión, R., Boni, C., Monnier, A., …& Pluzanska, A. (2001). Superior efficacy of letrozole versus tamoxifen as first-line therapy for postmenopausal women with advanced breast cancer: results of a phase III study of the International Letrozole Breast Cancer Group. Journal of Clinical Oncology, 19(10), 2596–2606. Retrieved from http://citeseerx.ist.psu.edu /viewdoc/ download?doi=10.1.1. 466.9741&rep=rep1&type=pdf.
- Mouridsen, H., Gershanovich, M., Sun, Y., Pérez-Carrión, R., Boni, C., Monnier, A., …& Pluzanska, A. (2003). Phase III study of letrozole versus tamoxifen as first-line therapy of advanced breast cancer in postmenopausal women: analysis of survival and update of efficacy from the International Letrozole Breast Cancer Group. Journal of Clinical Oncology, 21(11), 2101–2109. doi: 10.1200/JCO.2003.04.194.
- Paridaens, R. J., Dirix, L. Y., Beex, L. V., Nooij, M., Cameron, D. A., Cufer, T., …& Therasse, P. (2008). Phase III study comparing exemestane with tamoxifen as first-line hormonal treatment of metastatic breast cancer in postmenopausal women: the European Organisation for Research and Treatment of Cancer Breast Cancer Cooperative Group. Journal of clinical oncology, 26(30), 4883–4890. doi: 10.1200/JCO.2007.14.4659.
- Osborne, C. K., & Schiff, R. (2005). Estrogen-receptor biology: continuing progress and therapeutic implications. Journal of Clinical Oncology, 23(8), 1616–1622. doi: 10.1200/JCO.2005.10.036.
- Jordan, V. C., & O’Malley, B. W. (2007). Selective estrogen-receptor modulators and antihormonal resistance in breast cancer. Journal of clinical oncology, 25(36), 5815–5824. doi: 10.1200/JCO.2007.11.3886.
- Osborne, C. K., Wakeling, A., & Nicholson, R. I. (2004). Fulvestrant: an oestrogen receptor antagonist with a novel mechanism of action. British journal of cancer, 90(1), S2. https://doi.org/10.1038/sj.bjc.6601629.
- Kumar, V., Green, S., Stack, G., Berry, M., Jin, J. R., & Chambon, P. (1987). Functional domains of the human estrogen receptor. Cell, 51(6), 941–951. https://doi.org/10.1016/0092-8674(87)90581-2.
- Kato, S., Endoh, H., Masuhiro, Y., Kitamoto, T., Uchiyama, S., Sasaki, H., …& Metzger, D. (1995). Activation of the estrogen receptor through phosphorylation by mitogen-activated protein kinase. Science, 270(5241), 1491–1494. doi: 10.1126/science.270.5241.1491.
- Robertson, J. F. (2007). Fulvestrant (Faslodex®) — how to make a good drug better. The oncologist, 12(7), 774–784. doi: 10.1634/theoncologist.12-7-774.
- Wakeling, A. E., Dukes, M., & Bowler, J. (1991). A potent specific pure antiestrogen with clinical potential. Cancer research, 51(15), 3867–3873. Retrieved from http://cancerres.aacrjournals.org/content/51/15/3867.short.
- Wakeling, A. E. (2000). Similarities and distinctions in the mode of action of different classes of antioestrogens. Endocrine-related cancer, 7(1), 17–28. Retrieved from https://erc.bioscientifica.com/content/7/1/17.full.pdf.
- Wakeling, A. E. (1995). Use of pure antioestrogens to elucidate the mode of action of oestrogens. Biochemical pharmacology, 49(11), 1545–1549. https://doi.org/10.1016/0006-2952(94)00528-T.
- Morales, L., Neven, P., Timmerman, D., Wildiers, H., Konstantinovic, M. L., Christiaens, M. R., …& Paridaens, R. (2009). Prospective assessment of the endometrium in postmenopausal breast cancer patients treated with fulvestrant. Breast cancer research and treatment, 117(1), 77. https://doi.org/10.1007/s10549-008-0248-2.
- Peekhaus, N. T., Chang, T., Hayes, E. C., Wilkinson, H. A., Mitra, S. W., Schaeffer, J. M., & Rohrer, S. P. (2004). Distinct effects of the antiestrogen Faslodex on the stability of estrogen receptors-alpha and-beta in the breast cancer cell line MCF-7. Journal of molecular endocrinology, 32(3), 987–995. https://doi.org/10.1677/jme.0.0320987.
- Mishra, A. K., Abrahamsson, A., & Dabrosin, C. (2016). Fulvestrant inhibits growth of triple negative breast cancer and synergizes with tamoxifen in ERα positive breast cancer by up-regulation of ERβ. Oncotarget, 7(35), 56876. doi: 10.18632/oncotarget.10871.
- Dębska-Szmich, S., Zięba, A., & Potemski, P. (2017). Fulvestrant in hormonal treatment of breast cancer. Oncology in Clinical Practice, 13(1), 14–23. doi: 10.5603/OCP.2017.0003.
- McClelland, R. A., Gee, J. M. W., Francis, A. B., Robertson, J. F. R., Blarney, R. W., Wakeling, A. E., & Nicholson, R. I. (1996). Short-term effects of pure anti-oestrogen ICI 182780 treatment on oestrogen receptor, epidermal growth factor receptor and transforming growth factor-alpha protein expression in human breast cancer. European Journal of Cancer, 32(3), 413–416. https://doi.org/10.1016/0959-8049(95)00517-X.
- Inoue, A., Yoshida, N., Omoto, Y., Oguchi, S., Yamori, T., Kiyama, R., & Hayashi, S. (2002). Development of cDNA microarray for expression profiling of estrogen responsive genes. Journal of Molecular Endocrinology, 29(2), 175–192. http://citeseerx.ist.psu.edu/viewdoc/download?doi=10.1.1.887.2620&rep =rep1&type=pdf.
- Garcia Dos Santos, E., Dieudonne, M. N., Pecquery, R., Le Moal, V., Giudicelli, Y., & Lacasa, D. (2002). Rapid nongenomic E2 effects on p42/p44 MAPK, activator protein-1, and cAMP response element binding protein in rat white adipocytes. Endocrinology, 143(3), 930–940. https://doi.org/10.1210/endo.143.3.8678.
- Hu, X. F., Veroni, M., De Luise, M., Wakeling, A., Sutherland, R., Watts, C. K. W., & Zalcberg, J. R. (1993). Circumvention of tamoxifen resistance by the pure anti‐estrogen ICI 182, 780. International journal of cancer, 55(5), 873–876. https://doi.org/10.1002/ijc.2910550529.
- Lykkesfeldt, A. E., Madsen, M. W., & Briand, P. (1994). Altered expression of estrogen-regulated genes in a tamoxifen-resistant and ICI 164,384 and ICI 182,780 sensitive human breast cancer cell line, MCF-7/TAMR-1. Cancer research, 54(6), 1587–1595. https://cancerres.aacrjournals.org/content/54/6/1587.short.
- de Cupis, A., Noonan, D., Pirani, P., Ferrera, A., Clerico, L., & Favoni, R. E. (1995). Comparison between novel steroid‐like and conventional nonsteroidal antioestrogens in inhibiting oestradiol‐and IGF‐I‐induced proliferation of human breast cancer‐derived cells. British journal of pharmacology, 116(5), 2391–2400. https://doi.org/10.1111/j.1476-5381.1995.tb15085.x.
- Lykkesfeldt, A. E., Larsen, S. S., & Briand, P. (1995). Human breast cancer cell lines resistant to pure anti‐estrogens are sensitive to tamoxifen treatment. International journal of cancer, 61(4), 529–534. https://doi.org/10.1002/ijc.2910610417.
- Osborne, C. K., Coronado-Heinsohn, E. B., Hilsenbeck, S. G., McCue, B. L., Wakeling, A. E., McCleland, R. A., …& Nicholson, R. I. (1995). Comparison of the effects of a pure steroidal antiestrogen with those of tamoxifen in a model of human breast cancer. Journal of the National Cancer Institute, 87(10), 746–750. https://doi.org/10.1093/jnci/87.10.746.
- Dowsett, M., Nicholson, R. I., & Pietras, R. J. (2005). Biological characteristics of the pure antiestrogen fulvestrant: overcoming endocrine resistance. Breast cancer research and treatment, 93(1), 11–18. doi: https://doi.org/10.1007/s10549-005-9037-3.
- Rocca, A., Maltoni, R., Bravaccini, S., Donati, C., & Andreis, D. (2018). Clinical utility of fulvestrant in the treatment of breast cancer: a report on the emerging clinical evidence. Cancer management and research, 10, 3083. doi: 10.2147/CMAR.S137772.
- Howell, A., Robertson, J. F., Quaresma Albano, J., Aschermannova, A., Mauriac, L., Kleeberg, U. R., …& Morris, C. (2002). Fulvestrant, formerly ICI 182,780, is as effective as anastrozole in postmenopausal women with advanced breast cancer progressing after prior endocrine treatment. Journal of Clinical Oncology, 20(16), 3396–3403. doi: 10.1200/JCO.2002.10.057.
- Osborne, C. K., Pippen, J., Jones, S. E., Parker, L. M., Ellis, M., Come, S., …& Webster, A. (2002). Double-blind, randomized trial comparing the efficacy and tolerability of fulvestrant versus anastrozole in postmenopausal women with advanced breast cancer progressing on prior endocrine therapy: results of a North American trial. Journal of Clinical Oncology, 20(16), 3386–3395. doi: 10.1200/JCO.2002.10.058.
- Robertson, J. F., Nicholson, R. I., Bundred, N. J., Anderson, E., Rayter, Z., Dowsett, M., …& Morris, C. (2001). Comparison of the short-term biological effects of 7α-[9-(4, 4, 5, 5, 5-pentafluoropentylsulfinyl)-nonyl] estra-1, 3, 5,(10)-triene-3, 17β-diol (Faslodex) versus tamoxifen in postmenopausal women with primary breast cancer. Cancer research, 61(18), 6739–6746. Retrieved from http://cancerres.aacrjournals.org/content/61/18/6739.short.
- DeFriend, D. J., Howell, A., Nicholson, R. I., Anderson, E., Dowsett, M., Mansel, R. E., …& Baum, M. (1994). Investigation of a new pure antiestrogen (ICI 182780) in women with primary breast cancer. Cancer Research, 54(2), 408–414. Retrieved from http://cancerres.aacrjournals.org/content/54/2/408.short.
- Howell, A., DeFriend, D. J., Robertson, J. F. R., Blamey, R. W., Anderson, L., Anderson, E., …& Walton, P. (1996). Pharmacokinetics, pharmacological and anti-tumour effects of the specific anti-oestrogen ICI 182780 in women with advanced breast cancer. British Journal of Cancer, 74(2), 300. https://doi.org/10.1038/bjc.1996.357.
- AstraZeneca. Faslodex (fulvestrant) injection, for intramuscular use: US prescribing information. 2017. https://www.accessdata.fda.gov. Accessed 11 Dec 2017.
- AstraZeneca UK Limited. Faslodex 250 mg solution for injection: EU summary of product characteristics. 2017. http://www.ema.europa.eu/ema. Accessed 11 Dec 2017.
- Belagali, Y. R., Barkate, H. V., Sejpal, J. J., & Parekh, B. B. (2016). Therapeutic place of fulvestrant in the management of hormone-receptor positive breast cancer. Eur Oncol Haematol, 12(1), 44–50. http://doi.org/10.17925/EOH.2016.12.01.44.
- Deeks, E. D. (2018). Fulvestrant: a review in advanced breast cancer not previously treated with endocrine therapy. Drugs, 78(1), 131–137. https://doi.org/10.1007/s40265-017-0855-5.
- Cardoso, F., Costa, A., Senkus, E., Aapro, M., André, F., Barrios, C. H., …& Carey, L. (2017). 3rd ESO–ESMO international consensus guidelines for advanced breast cancer (ABC 3). Annals of Oncology, 28(1), 16–33. https://doi.org/10.1093/annonc/mdw544.
- National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology (NCCN Guidelines). Breast cancer version 3.2017. 2017. http://www.nccn.org. Accessed 11 Dec 2017.
- Robert, N. J., & Denduluri, N. (2018). Patient case lessons: endocrine management of advanced breast cancer. Clinical breast cancer, 18(3), 192–204. https://doi.org/10.1016/j.clbc.2017.05.014.
- Boér, K. (2017). Fulvestrant in advanced breast cancer: evidence to date and place in therapy. Therapeutic advances in medical oncology, 9(7), 465–479. https://doi.org/10.1177/1758834017711097.
- Telford, C., Takyar, S., Joshi, P., Ekman, M., & Jones, N. (2017). A network meta-analysis of fulvestrant vs alternative first-line endocrine therapies for endocrine therapy-naive postmenopausal hormone receptor-positive advanced or metastatic breast cancer. doi: 10.1200/JCO.2017.35.15_suppl.e12545.
- Zhang, J., Huang, Y., Wang, C., He, Y., Zheng, S., & Wu, K. (2017). Efficacy and safety of endocrine monotherapy as first-line treatment for hormone-sensitive advanced breast cancer: a network meta-analysis. Medicine, 96(33). doi: 10.1097/MD.0000000000007846.
- Інструкція для медичного застосування лікарського засобу № UA/5440/01/01 від 19.07.2016 до 19.07.2021.
- Di Leo, A., Jerusalem, G., Petruzelka, L., Torres, R., Bondarenko, I. N., Khasanov, R., … & Pendergrass, K. (2010). Results of the CONFIRM phase III trial comparing fulvestrant 250 mg with fulvestrant 500 mg in postmenopausal women with estrogen receptor-positive advanced breast cancer. J Clin Oncol, 28(30), 4594–4600. doi: 10.1200/JCO.2010.30.6266.
- Robertson, J. F., Llombart-Cussac, A., Rolski, J., Feltl, D., Dewar, J., Macpherson, E., …& Ellis, M. J. (2009). Activity of fulvestrant 500 mg versus anastrozole 1 mg as first-line treatment for advanced breast cancer: results from the FIRST study. Journal of Clinical Oncology, 27(27), 4530–4535. doi: 10.1200/JCO.2008.21.1136.
- Robertson, J. F., Lindemann, J. P., Llombart-Cussac, A., Rolski, J., Feltl, D., Dewar, J., …& Ellis, M. J. (2012). Fulvestrant 500 mg versus anastrozole 1 mg for the first-line treatment of advanced breast cancer: follow-up analysis from the randomized «FIRST» study. Breast cancer research and treatment, 136(2), 503–511. doi: https://doi.org/10.1007/s10549-012-2192-4.
- Ellis, M. J., Llombart-Cussac, A., Feltl, D., Dewar, J. A., Jasiówka, M., Hewson, N., …& Robertson, J. F. (2015). Fulvestrant 500 mg versus anastrozole 1 mg for the firstline treatment of advanced breast cancer: overall survival analysis from the phase II FIRST study. Journal of Clinical Oncology, 33(32), 3781. doi: 10.1200/JCO.2015.61.5831.
- Howell, A., Robertson, J. F., Quaresma Albano, J., Aschermannova, A., Mauriac, L., Kleeberg, U. R., …& Morris, C. (2002). Fulvestrant, formerly ICI 182,780, is as effective as anastrozole in postmenopausal women with advanced breast cancer progressing after prior endocrine treatment. Journal of Clinical Oncology, 20(16), 3396–3403. doi: 10.1200/JCO.2002.10.057.
- Robertson, J. F., Osborne, C. K., Howell, A., Jones, S. E., Mauriac, L., Ellis, M., …& Buzdar, A. (2003). Fulvestrant versus anastrozole for the treatment of advanced breast carcinoma in postmenopausal women: a prospective combined analysis of two multicenter trials. Cancer, 98(2), 229–238. doi: 10.1002/cncr.11468.
- Kuter, I., Hegg, R., Singer, C., Badwe, R., & Lowe, E. (2007). Fulvestrant 500 mg vs 250 mg: first results from NEWEST, a randomized, phase II neoadjuvant trial in postmenopausal women with locally advanced, estrogen receptor-positive breast cancer. Breast Cancer Research and Treatment, 106. doi: 10.1007/s10549-007-9793-3.
- Di Leo, A., Jerusalem, G., Petruzelka, L., Torres, R., Bondarenko, I. N., Khasanov, R., …& Pendergrass, K. (2012). Abstract S1-4: Final analysis of overall survival for the Phase III CONFIRM trial: fulvestrant 500 mg versus 250 mg. doi: 10.1158/0008-5472.SABCS12-S1-4.
- Leo, A. D., Jerusalem, G., Petruzelka, L., Torres, R., Bondarenko, I. N., Khasanov, R., …& Pendergrass, K. (2013). Final overall survival: fulvestrant 500 mg vs 250 mg in the randomized CONFIRM trial. Journal of the National Cancer Institute, 106(1), djt337. doi: 10.1093/jnci/djt337.
- Nabholtz, J. M., Bonneterre, J., Buzdar, A., Robertson, J. F. R., Thürlimann, B. (2003). Anastrozole (Arimidex™) versus tamoxifen as first-line therapy for advanced breast cancer in postmenopausal women: survival analysis and updated safety results. European Journal of Cancer, 39(12), 1684–1689. doi: 10.1016/S0959-8049(03)00326-5.
- Mehta, R. S., Barlow, W. E., Albain, K. S., Vandenberg, T. A., Dakhil, S. R., Tirumali, N. R., …& Hortobagyi, G. N. (2012). Combination anastrozole and fulvestrant in metastatic breast cancer. New England Journal of Medicine, 367(5), 435–444. doi: 10.1056/NEJMoa1201622.
- Robertson, J. F., Bondarenko, I. M., Trishkina, E., Dvorkin, M., Panasci, L., Manikhas, A., …& Ruiz-Borrego, M. (2016). Fulvestrant 500 mg versus anastrozole 1 mg for hormone receptor-positive advanced breast cancer (FALCON): an international, randomised, double-blind, phase 3 trial. The Lancet, 388(10063), 2997–3005. doi: 10.1016/S0140-6736(16)32389-3.
Евгения Гончарук














Leave a comment