Неоад’ювантна хіміотерапія в лікуванні резектабельного раку шлунка
Резюме. Мета дослідження. Рак шлунка (РШ) відноситься до пухлин з поганим прогнозом і незадовільними результатами лікування, навіть при І стадії хвороби. Неоад’ювантна хіміотерапія (НАХТ) може бути одним зі шляхів покращення результатів лікування пацієнтів із резектабельним РШ. Однак наявні пілотні дослідження ефективності НАХТ засновані на обмеженій кількості даних. Нами було проведено оцінку впливу НАХТ на довгострокову виживаність пацієнтів з аденокарциномою шлунка шляхом рандомізованого дослідження. Матеріали та методи. Протягом 2007–2017 рр. в дослідження було включено 257 пацієнтів з I-III стадією РШ, що отримали радикальне лікування в клініці Національного інституту раку. Усіх пацієнтів було рандомізовано на 2 групи після уточнення стадії шляхом цитологічного дослідження змиву черевної порожнини. Пацієнтам I групи (104 пацієнти) проводилася НАХТ (3 цикли за схемою ECF) з подальшою хірургічною операцією, у той час як пацієнтам II групи (153 пацієнти) проводилося хірургічне лікування. Подальший життєвий статус «живий/помер» та дату останнього спостереження було отримано з бази даних Національного канцер-реєстру України станом на кінець 2017 р. Оцінка кривих виживаності проводилася з використанням методу Каплана — Мейєра. Проведено порівняння безпосередніх результатів хірургічного лікування та довгострокової виживаності між двома групами. Результати. Аналіз безпосередніх результатів не виявив достовірної різниці в кількості днів перебування в стаціонарі, часу проведення операції (188 проти 182,5 хв, р<0,001), частоті ранніх і пізніх хірургічних ускладнень в обох групах (26 (25,0%) проти 36 (23,5%), p=0,891 ранніх та пізніх 8 (9,5%) проти 19 (12,4%), p=0,986). Загальна виживаність статистично значущо відрізнялася, показник 5-річної виживаності в І групі дорівнював 54,2% (95% довірчий інтервал (ДІ) 43,1-68,2) та 40,5% (95% ДІ 31,4-52,1; p=0,02) — для ІІ групи відповідно. НАХТ не призводила до подовження виживаності у пацієнтів з І стадією захворювання (87,5±11,7 проти 86,3±7,7, р=0,82). Висновки. НАХТ при РШ покращує довгострокову виживаність без збільшення післяопераційних ускладнень у хворих з II і III стадією РШ. НАХТ може бути рекомендована пацієнтам з місцево-поширеними Т3-Т4 пухлинами з метою покращення резектабельності, а також хворим з I стадією захворювання, враховуючи низьку точність променевої діагностики при встановленні стадії захворювання. Для остаточної оцінки ефективності комбінованого лікування РШ з використанням НАХТ рекомендовано проведення подальших рандомізованих досліджень.
Одержано: 10.09.2019
Прийнято до друку: 07.10.2019
DOI: 10.32471/clinicaloncology.2663-466X.38.22924
Вступ
Рак шлунка (РШ) займає верхні сходинки в структурі смертності від онкологічних захворювань. РШ — п’ята за частотою локалізація раку в світі, злоякісні утворення шлунка посідають третє місце в структурі смертності від онкологічної патології [4]. РШ відносять до пухлин з поганим прогнозом. У більшості хворих з уперше виявленою патологією вона є неоперабельною, ризик рецидивів є високим навіть при лікуванні на ранніх стадіях. Захворюваність на РШ в Україні залишається високою, щороку діагностують близько 8000 нових випадків, смертність до року становить 59,8% [29].
При РШ стандартом хірургічного лікування є гастректомія або субтотальна резекція шлунка з обов’язковим обсягом лімфодисекції D2 [16]. Неоад’ювантна хіміотерапія (НАХТ) може покращити результати хірургічного лікування, що було показано в пілотних дослідженнях за останні 2 десятиріччя [6, 27]. Вплив ад’ювантної хіміотерапії на 5-річну виживаність не перевищує 5–10% [3, 20].
У лікуванні місцево-поширеного РШ (Т3–Т4) не було досягнуто суттєвих успіхів, і результати лікування не відрізняються від результатів 50-х років минулого сторіччя [28]. Рандомізовані контрольовані дослідження показали, що майже в третини хворих зі стадією ІІІВ виявляють метастази РШ протягом першого року після радикальних (R0) хірургічних втручань з лімфодисекцією D2 [17, 20]. Таким чином, комбіноване лікування і мультидисциплінарний підхід для пацієнтів з РШ набуває все більшого значення. НАХТ є перспективним напрямком досліджень.
У цьому дослідженні ми провели оцінку впливу передопераційної хіміотерапії на хірургічні результати і довгострокові показники виживаності пацієнтів із РШ.
Матеріали та методи
Рандомізоване дослідження НАХТ у порівнянні із лише хірургічним лікуванням хворих на РШ проведено на базі науково-дослідного відділення пухлин органів черевної порожнини та заочеревинного простору Національного інституту раку. Кінцевою метою дослідження було покращення віддалених результатів лікування та безрецидивної виживаності хворих на аденокарциному шлунка.
Встановлені критерії включення: 1) пацієнти віком від 18 до 70 років з вперше виявленим нелікованим РШ; 2) біопсія пухлини із морфологічним підтвердженням аденокарциноми шлунка; 3) клінічна стадія I–III (T1-4N0-1M0) захворювання відповідно до 7-го видання класифікації TNM [8]; 4) Задовільний загальний стан онкологічного хворого 0–1 за Шкалою оцінки загального стану онкологічного хворого (Eastern Cooperative Oncology Group (ECOG) Scale of Performance Status). Відповідь пухлини на НАХТ оцінювали відповідно до критеріїв RECIST 1.1 (Response evaluation criteria in solid tumors) [24]. У цьому дослідженні клінічну оцінку критеріїв T та N проводили шляхом комп’ютерної томографії із внутрішньовенним контрастуванням, регіональні лімфовузли визначали як «клінічно-позитивні» (cN1) при перевищенні діаметра в 10 мм [11].
Усім пацієнтам групи НАХТ для уточнення стадії проводили діагностичну лапароскопію із цитологічним дослідженням змиву черевної порожнини, відповідне дослідження робили в групі первинного хірургічного лікування перед мобілізацією пухлини. Пацієнти обох груп, у яких виявили канцероматоз, віддалені метастази або позитивні дані при цитологічному дослідженні змиву черевної порожнини (M1-MCY1), були виключені з дослідження.
Пацієнти І групи отримували 3 цикли НАХТ за схемою ECF: епірубіцин 50 мг/м внутрішньовенно в перший день, цисплатин 60 мг/м внутрішньовенно в перший день, 5-фторурацил у добовій дозі 200 мг/м — постійна внутрішньовенна інфузія (дні 1–21-й).
Радикальну операцію з D2-лімфодисекцією виконували через 21 добу після закінчення НАХТ. В обох групах вибір резекції шлунка та визначення зон D2 лімфодисекції здійснювали відповідно до японських рекомендацій з лікування РШ [23]. Ад’ювантну хіміотерапію проводили в обох групах при підтвердженні II або III стадії відповідно до рекомендацій Національної комплексної онкологічної мережі (National Comprehensive Cancer Network — NCCN) [3].
Морфологічну характеристику пухлин виконували за класифікацією Всесвітньої організації охорони здоров’я [1]. Для визначення клінічної і патологічної стадії захворювання використовували 7-му версію класифікації TNM Об’єднаного американського комітету раку (American Joint Committee on Cancer — AJCC) [22]. Післяопераційні ускладнення оцінювалися за шкалою Clavien — Dindo [7].
Подальше спостереження в обох групах включало езофагогастродуоденоскопію та комп’ютерну томографію із внутрішньовенним контрастуванням, що проводили кожні 6 міс протягом 3 років, потім щорічно протягом 2 років відповідно до рекомендацій NCCN [16].
При статистичній обробці даних для порівняння категоріальних характеристик використовували критерій хі-квадрат з рівнем значущості p<0,05. Подальший життєвий статус «живий/помер» та дату останнього спостереження було отримано з бази даних Національного канцер-реєстру України станом на 2019 р. Оцінку кривих виживаності проводили з використанням методу Каплана — Мейєра, для порівняння виживаності між групами та за стадіями захворювання використовували лог-ранк критерій з рівнем значущості p<0,05. Обробка статистичних даних проводилася в програмі R version 2.12.1 (R Project for Statistical Computing, Vienna, Austria; www.r-project.org).
Результати
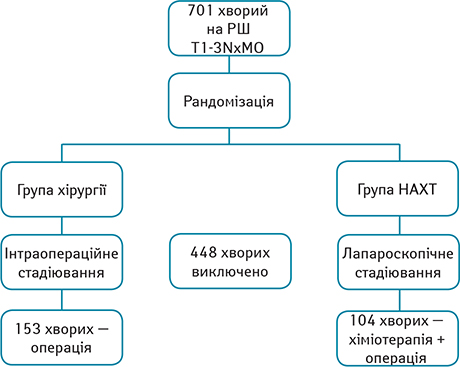
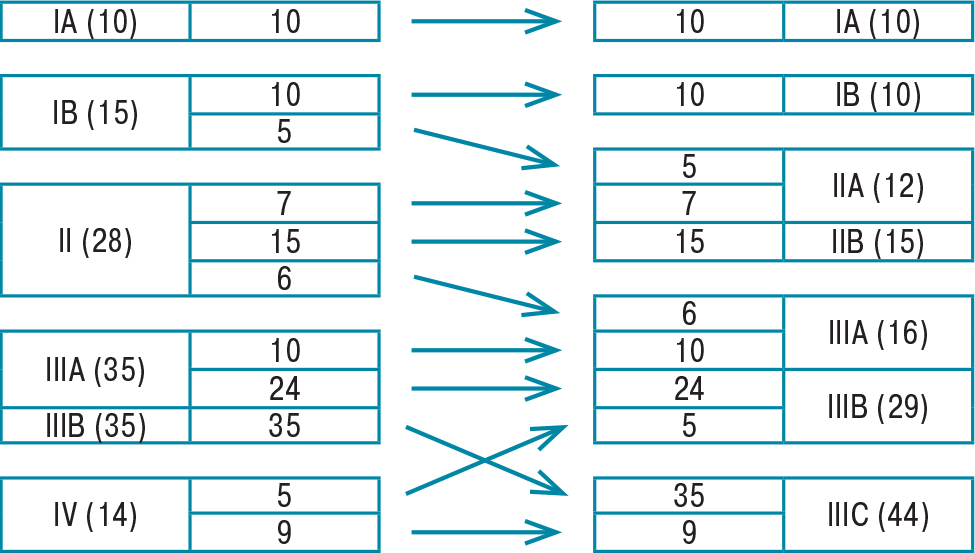
За 2007–2017 рр. в дослідження були включені 705 хворих, що відповідали вищезазначеним критеріям. Усі хворі були поінформовані про участь в клінічному дослідженні, підписали відповідну інформовану згоду за рішенням лікарсько-експертної комісії від 25.04.2007 р. № 6. Після розподілення на групи подальше рестадіювання під час хірургічного втручання або діагностичної лапароскопії призвело до виключення сумарно 448 хворих з обох груп.
Таким чином, остаточно в І групу (НАХТ) увійшли 104 хворих, у ІІ групу (первинна хірургія) — 153 хворих (рис. 1, табл. 1).
| Характеристики | Група І | Група ІІ | р |
| Вік (роки) | 0,1 | ||
| <35 | 5 | 6 | |
| 35–55 | 23 | 19 | |
| >55 | 76 | 128 | |
| Співвідношення статей (чоловіки/жінки) | 58/46 | 95/58 | 0,38 |
| Співвідношення померлі/живі | 36/68 | 65/88 | 0,25 |
| Стадія | 0,0002 | ||
| I | 8 | 38 | |
| II | 24 | 44 | |
| III | 72 | 71 | |
| Середній час виконання операції | 188 (153–225) | 182,5 (143–237) | <0,001 |
| Середня кількість днів перебування в стаціонарі | 12 (10–14) | 12 (9–15) | 0,188 |
У пацієнтів, що були включені в дослідження до 2012 р. (136 хворих), було здійснено переоцінку стадії РШ відповідно до 7-ї версії класифікації TNM AJCC [22] (табл. 2).
Не відмічено статистичної різниці між групами за показниками віку, статі чи загальним статусом пацієнта. Групи відрізнялися за структурою стадії захворювання: до II групи пацієнтів, що отримали первинне хірургічне лікування, потрапило більше хворих із І–ІІ стадією захворювання (30,8 проти 53,6, p=0,0002).
Проведення НАХТ призвело до зниження стадії захворювання більше ніж у половини хворих. Оцінку відповіді пухлини на НАХТ у 104 хворих І групи за критеріями RECIST 1.1 наведено в табл. 3. При цьому прояви токсичності ІІІ–IV ступеня становили лише 15%. Майже 8% хворих змогли пройти повні 3 цикли запланованої хіміотерапії.
| Відповідь на НАХТ | Кількість хворих | |
|---|---|---|
| n | % | |
| Повний регрес | 1 | 1,0 |
| Частковий регрес | 62 | 59,6 |
| Стабілізація | 33 | 31,7 |
| Прогресування | 8 | 7,7 |
Під час аналізу безпосередніх результатів хірургічних втручань не було відмічено різниці в тривалості операцій в обох групах (188 (153–225) проти 182,5 (143–237) хв, р<0,001).
Частота ранніх і пізніх хірургічних ускладнень не відрізнялася між двома групами (табл. 4). Частота ускладнень за шкалою Clavien — Dindo III ступеня або вище також значно не відрізнялася (ранні післяопераційні ускладнення: 5,77% хворих у І групі проти 11,76% хворих у ІІ групі, p=0,754, пізні післяопераційні ускладнення: 4,81% хворих у І групі проти 3,27% хворих у ІІ групі, p=0,607). Від ускладнень помер 1 хворий групи НАХТ та 2 хворих у групі хірургічного лікування, що відповідно становило 0,96 і 1,3% без статистичної відмінності.
| Ускладнення | Група хворих | р | |
|---|---|---|---|
| НАХТ (n=104) | Хірургія (n=153) | ||
| Ранні післяопераційні ускладнення | 0,891 | ||
| Кровотеча | 2 (1,9) | 3 (2,0) | |
| Неспроможність анастомозу | 1 (1,0) | 2 (1,3) | |
| Рідинні відмежування в черевній порожнині | 3 (2,9) | 7 (4,6) | |
| Ілеус | 0 (0,0) | 1 (0,7) | |
| Нагноєння рани | 7 (6,7) | 9 (5,9) | |
| Пневмонія | 9 (8,7) | 8 (5,2) | |
| Інші | 4 (3,8) | 6 (3,9) | |
| Загалом | 26 (25,0) | 36 (23,5) | |
| Пізні післяопераційні ускладнення | 0,986 | ||
| Стеноз анастомозу | 4 (3,8) | 7 (4,6) | |
| Ілеус | 2 (1,9) | 4 (2,6) | |
| Вентральна кила | 4 (3,8%) | 8 (5,2) | |
| Загалом | 8 (9,5) | 19 (12,4) | |
| Рівень ранніх післяопераційних ускладнень за шкалою Clavien — Dindo | 0,754 | ||
| Cтупінь I | 4 (3,8) | 7 (4,6) | |
| Cтупінь II | 4 (3,8) | 6 (3,9) | |
| Cтупінь IIIA | 2 (1,9) | 10 (6,5) | |
| Cтупінь IIIB | 3 (2,9) | 5 (3,7) | |
| Cтупінь IV | 1 (1,0) | 3 (2,0) | |
| Cтупінь V | 0 (0,0) | 0 (0,0) | |
| Рівень пізніх післяопераційних ускладнень за шкалою Clavien — Dindo | 0,607 | ||
| Cтупінь I | 1 (1,0) | 4 (2,6) | |
| Cтупінь II | 1 (1,0) | 4 (2,6) | |
| Cтупінь IIIA | 2 (1,9) | 1 (0,7) | |
| Cтупінь IIIB | 2 (1,9) | 2 (1,3) | |
| Cтупінь V | 1 (1,0) | 2 (1,3) | |
У групах не було виявлено статистично достовірної різниці в кількості днів перебування в стаціонарі після операції (середній ліжко-день 12 (10–14) проти 12 (9–15), р=0,188).
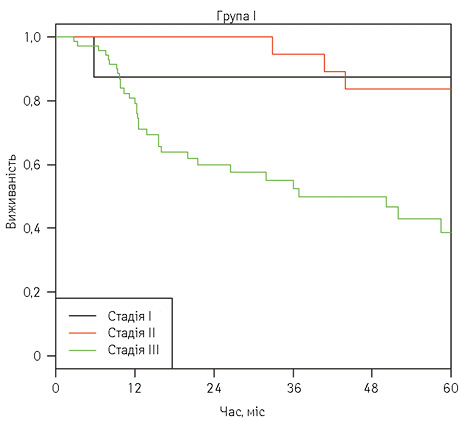
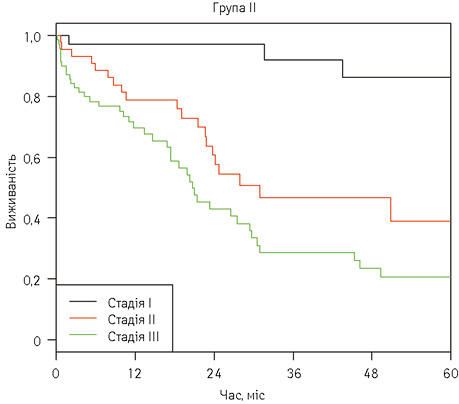
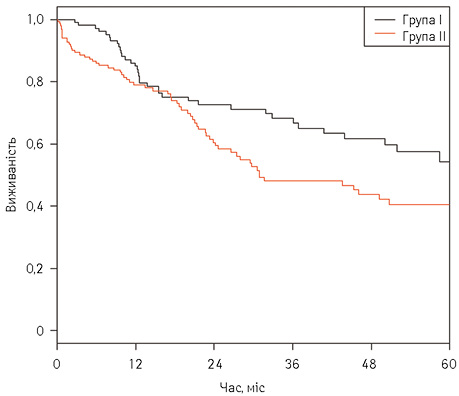
Мінімальна тривалість спостереження після оперативних втручань становила 2,7 міс у І групі проти 0,1 міс у ІІ групі. При аналізі 5-річної виживаності в 2 групах відмічено статистично значущу перевагу комбінації НАХТ над лише хірургічним лікуванням (рис. 2, 3). Показник 5-річної виживаності у І групі дорівнював 54,2% (95% довірчий інтервал (ДІ) 43,1–68,2) та 40,5% (95% ДІ 31,4–52,1) — для ІІ групи відповідно. Таким чином, різниця в 5-річній виживаності пацієнтів між групами становила 13,7% (рис. 4, табл. 5). 5-річна безрецидивна виживаність становила 48,1 і 36,4% у І і ІІ групах відповідно (рис. 5). Водночас НАХТ не мала значної переваги у пацієнтів з І стадією захворювання (87,5±11,7 проти 86,3±7,7, р=0,82).
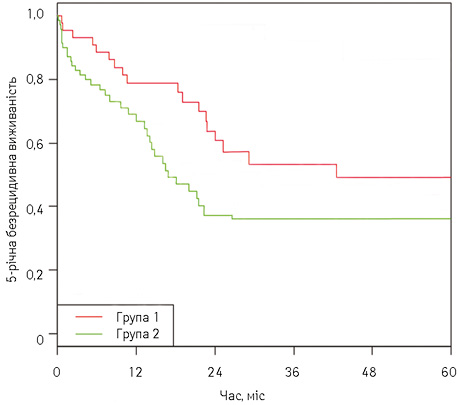
| Характеристики | Група І | Група ІІ | р |
|---|---|---|---|
| Виживаність, % | 0,02 | ||
| 12 міс | 85,0±4 | 79,0±3 | 0,2256 |
| 24 міс | 72,5±5 | 60,5±5 | 0,065 |
| 36 міс | 68,1±5 | 48,1±5 | 0,005 |
| 60 міс | 54,2±6 | 40,5±5 | 0,096 |
| Стадія | |||
| I | 87,5±11,7 | 86,3±7,7 | 0,82 |
| II | 83,6±8,7 | 38,9±10,2 | 0,0006 |
| III | 38,7±7,9 | 20,5±6,5 | 0,0126 |
| Медіана, міс | 31,0±3,2 | ||
| I* | –* | –* | –* |
| II* | –* | 31,0±4,2 | –* |
| III | 36,9±7,9 | 20,8±3,4 | 0,458 |
*Неможливо підрахувати (не досягається 50% померлих)
Дискусія
Вірогідність одужання у хворих на РШ пов’язана із можливістю проведення радикального (R0) хірургічного втручання, проте результати радикальних операцій на сьогодні слід визнати незадовільним. При лікуванні місцево-поширеного (T3–4) РШ більше ніж у половини хворих діагностують повернення захворювання протягом 1-го року, навіть при комбінації радикального втручання із післяопераційною хіміотерапією. Покращення результатів виживаності у пацієнтів на РШ можливе шляхом поєднання хірургічних методів з передопераційною хіміотерапією.
У більшості проведених рандомізованих досліджень НАХТ, у тому числі найвідоміших — MAGIC та CROSS, основну увагу приділяють компоненту хіміотерапії, у той час як вибір обсягу хірургічної резекції, а також лімфодисекції залишається поза межами обговорення [15, 18]. У нашому дослідженні особливу увагу було приділено ретельному виконанню адекватної лімфатичної дисекції в обох групах в обсязі D2, що виконувалася відповідно до схем, наведених у японській класифікації РШ [23]. Адекватне видалення всіх лімфатичних вузлів, що відповідають обсягу D2, — незалежний прогностичний чинник віддаленої виживаності хворих на РШ, що не може бути «виправлений» шляхом проведення НАХТ або післяопераційної хіміотерапії [13]. Отримані задовільні результати у вищезгаданих дослідженнях свідчать про ефективність цього підходу, незважаючи на неоднорідність груп, до яких також увійшли хворі на плоскоклітинний рак стравоходу.
Кінцева мета проведеного дослідження — подовження загальної тривалості життя хворих — була досягнута. Різниця в тривалості життя між основною та контрольною групами становила 13,7%. Особливим фактором, що міг стати обмеженням для проведення радикальних операцій, була токсичність НАХТ, що в нашому дослідженні становила незначний відсоток. На відміну від попередніх публікацій нами не було отримано збільшення кількості післяопераційних ускладнень, а також летальності у групі НАХТ. Відповідно, тривалість перебування в стаціонарі після хірургічного лікування не відрізнялися в обох групах [19]. Значний відсоток післяопераційних ускладнень, а особливо неспроможності анастомозу (більше 25%), на що звертали особливу увагу в попередніх дослідженнях [19], свідчить про необхідність застосування цього підходу тільки в центрах із великим досвідом як проведення операцій при РШ, так і поєднання їх із потужною хіміотерапією.
Однією зі значних труднощів у лікуванні РШ залишається низька чутливість та специфічність променевих методів діагностики при встановленні стадії захворювання на доопераційному етапі [2, 10]. Точність ендоскопії, ендоскопічної ультрасонографії і комп’ютерної томографії може варіювати від 67 до 87%, від 66 до 94% і від 33 до 92% відповідно [5, 12, 14, 25] та бути ще нижчою для пацієнтів із невеликими T1–2 пухлинами [10]. У нашому дослідженні рестадіювання шляхом лапароскопії та цитологічного дослідження змиву черевної порожнини дозволило додатково до передопераційних методів діагностики виявити віддалені метастази більше ніж у половини хворих. Таким чином, остаточне встановлення стадії шляхом діагностичної лапароскопії при РШ є одним з найважливіших етапів діагностики перед визначенням оптимального лікування.
Враховуючи значну кількість повних та часткових регресій пухлин у групі НАХТ (60,6%), цей підхід може підвищити радикальність резекції, що було відмічено i в попередніх дослідженнях [9, 21, 26]. На сьогодні можливість зниження стадії захворювання на доопераційному етапі є фактором сприятливого прогнозу, що дозволяє застосувати технології малоінвазивної хірургії, а також проводити органозберігаючі операції. Беручи до уваги невелику кількість пацієнтів із І стадією РШ в нашому дослідженні і відсутність рандомізованих контрольованих досліджень для цієї групи хворих, НАХТ при ранніх стадіях потребує подальшого вивчення.
Висновки
НАХТ при РШ покращує довгострокову виживаність без збільшення кількості післяопераційних ускладнень у хворих з II і III стадією РШ. НАХТ може бути рекомендована пацієнтам з місцево-поширеними Т3–Т4 пухлинами з метою покращення резектабельності. Для остаточної оцінки ефективності комбінованого лікування РШ з використанням НАХТ рекомендоване проведення подальших рандомізованих досліджень.
Список використаної літератури
- Aaltonen, L. A., & Hamilton, S. R. (2000). Pathology and Genetics of Tumours of the Digestive System. Lyon: IARC Press.
- Ahn, H. S., Lee, H. J., Yoo, M. W., Kim, S. G., Im, J. P., Kim, S. H.,… Yang, H. K. (2009). Diagnostic accuracy of T and N stages with endoscopy, stomach protocol CT, and endoscopic ultrasonogra- phy in early gastric cancer. J Surg Oncol; 99(1), 20–27. doi: 10.1002/jso.21170.
- Bang, Y. J., Kim, Y. W., Yang, H. K., Chung, H. C., Park, Y. K., Lee, K. H.,… Noh, S. H. (2012). Adjuvant capecitabine and oxaliplatin for gastric cancer a er D2 gastrectomy (CLASSIC): a phase 3 open-label, randomised controlled trial. Lancet, 379(9813), 315–321. doi: 10.1016/S0140-6736(11)61873-4.
- Bray, F., Ferlay, J., Soerjomataram, I., Siegel, R. L., Torre, L. A., & Jemal, A. (2018). Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. Cancer Journal for Clinicians, 68(6), 394–424. doi.org/10.3322/caac.21492.
- Chen, J., Cheong, J. H., Yun, M. J., Kim, J., Lim, J. S., Hyung, W. J., & Noh, S. H. (2005). Improvement in preoperative staging of gastric adenocarcinoma with positron emission tomography. Cancer, 103(11), 2383–2390. doi: 10.1002/cncr.21074.
- Cunningham, D., Allum, W. H., Stenning, S. P., Thompson, J. N., Van de Velde, C. J., Nicolson, M., … Chua, Y. J. (2006). Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. The New England Journal of Medicine, 355(1), 11–20. doi:10.1056/NEJMoa055531.
- Dindo, D., Demartines, N., & Clavien, P. A. (2004). Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey. Ann Surg, 240(2), 205–213. doi: 10.1097/01.sla.0000133083.54934.ae.
- Edge, S. B., & Compton, C. C. (2010). The American Joint Committee on Cancer: the 7 edition of the AJCC cancer staging manual and the future of TNM. Annals of Surgical Oncology, 17(6), 1471–1474. doi: 10.1245/s10434-010-0985-4.
- Ge, L., Wang, H. J., Yin, D., Dong, Y., Cheng, L., Jin-Feng, Z.,… Guo-Qing Z. (2012). Effectiveness of 5-flurouracil-based neoadjuvant chemotherapy in locally-advanced gastric/gastroesoph- ageal cancer: a meta-analysis. World J Gastroenterol, 18(48), 7384–7393. doi: 10.3748/wjg.v18.i48.7384.
- Kienle, P., Buhl, K., Kuntz, C., Düx, M., Hartmann, C., Axel, B., Herfarth, C., & Lehnert T. (2002). Prospective comparison of endoscopy, endosonography and computed tomography for staging of tumours of the oesophagus and gastric cardia. Digestion, 66(4), 230–236. doi: 10.1159/000068360.
- Kim, S. K., Kang, K. W., Lee, J. S., Kim, H. K., Chang, H. J., Choi, J. Y.,… Bae, J. M. (2006). Assessment of lymph node metastases using 18F-FDG PET in patients with advanced gastric cancer. Eur J Nucl Med Mol Imaging, 33(2), 148–155. doi: 10.1007/s00259-005-1887-8.
- Lim, J. S., Yun, M. J., Kim, M. J., Hyung, W. J., Park, M. S., Choi, J. Y.,… Kim, K. W. (2006). CT and PET in stomach cancer: preoperative staging and monitoring of response to therapy. Radio-graphics, 26(1), 143–156. doi: 10.1148/rg.261055078.
- Markar, S. R., Noordman, B. J., Mackenzie, H., Findlay, J. M., Boshier, P. R., Ni, M.,… Hanna, G. B. (2017). Multimodality treatment foresophageal adenocarcinoma: multi-center propensity-score matched study. Ann Oncol, 28(3), 519–527. doi: 10.1093/annonc/mdw560.
- Matsumoto, Y., Yanai, H., Tokiyama, H., Nishiaki, M., Higaki, S., & Okita, K. (2000). Endoscopic ultrasonography for diagnosis of submucosal invasion in early gastric cancer. J Gastroenterol, 35(5), 326–331. doi: 10.1007/s005350050356.
- Menges, M., & Hoehler, T. (2014). Neoadjuvant therapy of gastric cancer: a decisive step forward. Gastrointest Tumors, 1(2), 99–104. doi: 10.1159/000362577.
- National Comprehensive Cancer Network (2018). Clinical practice guidelines in oncology: gastric cancer. Version 2.2018. Retrived from https://www.nccn.org/professionals/physician_gls/default.aspx.
- Noh, S. H., Park, S. R., Yang, H. K., Chung, H. C., Chung, I. J., Kim, S. W., Bang, Y. J. (2014). Adjuvant capecitabine plus oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC): 5-year follow-up of an open-label, randomised phase 3 trial. Lancet Oncology, 15(12), 1389–1396. doi: 10.1016/S1470-2045(14)70473-5.
- Raigani, S., Hardacre, J. M., Kim, J., & Ammori, J. B. (2014). Trends in the surgical treatment of gastric adenocarcinoma. Ann Surg Oncol, 21(2), 569–574. doi: 10.1245/s10434-013-3314-x.
- Reynolds, J. V., Preston, S. R., O’Neill, B., Baeksgaard, L., Griffin, S. M., Mariette, C.,… Dermott, R. M. (2017). ICORG 10–14:NEOadjuvant trial in Adenocarcinoma of the oesophagus and oesophagogastric junction International Study (Neo-AEGIS). BMC Cancer, 17(1), 401. doi: 10.1186/s12885-017-3386-2.
- Sasako, M., Sakuramoto, S., Katai, H., Kinoshita, T., Furukawa, H., Yamaguchi, T.,… Ohashi, Y. (2011). Five-year outcomes of a randomized phase III trial comparing adjuvant chemotherapy with S-1 18 versus surgery alone in stage II or III gastric cancer. Journal of Clinical Oncology, 29(33), 4387–4393. doi: 10.1200/JCO.2011.36.5908.
- Schuhmacher, C., Gretschel, S., Lordick, F., Reichardt, P., Hohenberger, W., Eisenberger, C. F., … Schlag, P. M. (2010). Neoadjuvant chemo-therapy compared with surgery alone for locally advanced cancer of the stomach and cardia: European Organisation for Research and Treatment of Cancer randomized trial 40954. J Clin Oncol, 28(35), 5210–5218. doi: 10.1200/JCO.2009.26.6114.
- Sobin, L. H., Gospodarowicz, M. K., & Wittekind, Ch. (2009). TNM Classification of Malignant Tumours, 7 ed. New York: Wiley-Blackwell.
- Takeshi Sano & Yasuhiro Kodera (2011). Japanese Gastric Cancer Association. Japanese Gastric Cancer Treatment Guidelines 2010 (ver. 3). Gastric Cancer, 14(2), 113–123. doi: 10.1007/s10120-011-0042-4.
- Therasse, P., Arbuck, S. G., Eisenhauer, E. A., Wanders, J., Kaplan, R. S., Rubinstein, L.,… Gwyther, S. G. (2000). New guidelines to evaluate the response to treatment in solid tumors. European Organization for Research and Treatment of Cancer, National Cancer Institute of the United States, National Cancer Institute of Canada. J Natl Cancer Inst, 92(3), 205–216. doi: 10.1093/jnci/92.3.205.
- Tsendsuren, T., Jun, S. M., & Mian, X. H. (2006). Usefulness of endoscopic ultrasonography in preoperative TNM staging of gastric cancer. World J Gastroenterol, 12(1), 43–47. doi: 10.3748/wjg.v12.i1.43.
- Xiong, B. H., Cheng, Y., Ma, L., & Zhang, C. Q. (2014). An updated meta-analysis of randomized controlled trial assessing the effect of neoadjuvant chemotherapy in advanced gastric cancer. Cancer Invest, 32(6), 272–284. doi: 10.3109/07357907.2014.911877.
- Ychou, M., Boige, V., Pignon, J. P., Conroy, T., Bouche, O., Lebreton, G.,… Rougier, P. (2011). Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: an FNCLCC and FFCD multicenter phase III trial. Journal of Clinical Oncology, 29(13), 1715–1721. doi: 10.1200/JCO.2010.33.0597.
- Yoon, H. M., Ryu, K. W., Nam, B. H., Cho, S. J., Park, S. R., Lee, J. Y.,… Kim, Y. W. (2012). Is the new seventh AJCC/UICC staging system appropriate for patients with gastric cancer? Journal of the American College of Surgeons, 214(1), 88–96. doi: 10.1016/j.jamcollsurg.2011.09.018.
- Федоренко, З. П., Михайлович, Ю. Й., Гулак, Л. О., Горох, Е. Л., Рижов, А. Ю., Сумкіна, О. В., & Куценко, Л. Б. (2018). Рак в Україні 2016–2017. Захворюваність, смертність, показники діяльності онкологічної служби. Бюлетень Національного канцер-реєстру України. Київ.
Неоадъювантная химиотерапия в лечении резектабельного рака желудка
Национальный институт рака, Киев
Резюме. Цель исследования. Рак желудка (РЖ) относится к опухолям с плохим прогнозом и неудовлетворительными результатами лечения, даже при I стадии заболевания. Неоадъювантная химиотерапия (НАХТ) может быть одним из путей улучшения результатов лечения пациентов с резектабельными РЖ. Однако существующие пилотные исследования эффективности НАХТ основаны на ограниченном количестве данных. Нами была проведена оценка влияния НАХТ на долгосрочную выживаемость пациентов с аденокарциномой желудка путем рандомизированного исследования. Материалы и методы. В течение 2007–2017 гг. в исследование было включено 257 пациентов с I–III стадией РЖ, получивших радикальное лечение в клинике Национального института рака. Все пациенты были рандомизированы в 2 группы после уточнения стадии путем цитологического исследования смыва брюшной полости. Пациентам I группы (104 пациента) проводили НАХТ (3 цикла по схеме ECF) с последующей хирургической операцией, в то время как пациентам II группы (153 пациента) проводили хирургическое лечение. Дальнейший жизненный статус «живой/умер» и дата последнего наблюдения были получены из базы данных Национального канцер-реестра Украины по состоянию на конец 2017 г. Оценка кривых выживаемости проводилась с использованием метода Каплана — Мейєра. Проведено сравнение непосредственных результатов хирургического лечения и долгосрочной выживаемости между двумя группами. Результаты. Анализ непосредственных результатов не выявил достоверной разницы в количестве дней пребывания в стационаре, времени проведения операции (188 против 182,5 мин, р<0,001), частоте ранних и поздних хирургических осложнений в обеих группах (26 (25,0%) против 36 (23,5%), p=0,891 ранних и поздних 8 (9,5%) против 19 (12,4%), p=0,986). Общая выживаемость статистически значимо отличалась, показатель 5-летней выживаемости в І группе был равен 54,2% (95% доверительный интервал (ДИ) 43,1–68,2) и 40,5% (95% ДИ 31,4–52,1, p=0,02) — для ІІ группы соответственно. НАХТ не приводила к увеличению выживаемости у пациентов с I стадией заболевания (87,5±11,7 против 86,3±7,7, р=0,82). Выводы. НАХТ при РЖ улучшает долгосрочную выживаемость без увеличения количества послеоперационных осложнений у больных со II и III стадией РЖ. НАХТ может быть рекомендована пациентам с местно-распространенными Т3–Т4 опухолями с целью улучшения резектабельности, а также больным с I стадией заболевания, учитывая низкую точность лучевой диагностики при установлении стадии заболевания. Для окончательной оценки эффективности комбинированного лечения РЖ с использованием НАХТ рекомендовано проведение дальнейших рандомизированных исследований.
рак желудка, неоадъювантная химиотерапия, комбинированное лечение.
Адреса:
Бойко Артем Володимирович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: artboymed@gmail.com
Correspondence:
Boiko Artem
33/43 Lomonosova Str., Kyiv 03022
National Cancer Institute
E-mail: artboymed@gmail.com














Leave a comment