Клінічний досвід використання радіочастотної гіпертермії у лікуванні злоякісних трофобластичних пухлин
Ціп Н.П., Воробйова Л.І., Орел В.Е., Кліманов М.Ю.
Резюме. Позитивні результати використання радіочастотної гіпертермії, ініційованої неоднорідним електромагнітним полем радіохвиль, у лікуванні хворих із злоякісними трофобластичними пухлинами свідчать про перспективність проведення подальших поглиблених клінічних досліджень.
 Вступ
Вступ
Трофобластичні пухлини — це збірне поняття, що включає групу доброякісних та злоякісних новоутворень трофобласту з різною здатністю до інвазії та метастазування. ВООЗ включає в це поняття такі нозологічні форми: повний міхуровий занос, частковий міхуровий занос, інвазивний міхуровий занос, хоріокарциному (ХК), пухлину плацентарного ложа, епітеліоїдну трофобластичну пухлину, непухлинні трофобластичні ураження [1].
Основним методом спеціального лікування даного контингенту хворих є хіміотерапія (ХТ). Вибір режиму ХТ ґрунтується на визначенні групи ризику розвитку резистентності пухлини до лікування. У свою чергу, група ризику визначається за прогностичною бальною шкалою FIGO-ВООЗ, прийнятою у 2002 р.[2].
Хворі з низьким ризиком (≤6 балів за прогностичною бальною шкалою FIGO-ВООЗ) підлягають монохіміотерапії. Ефективність монохіміотерапії 1-ї лінії досягає 89,6–94% [3].
Хворим з високим ризиком розвитку резистентності пухлини до лікування (≥7 балів згідно з прогностичною бальною шкалою FIGO-ВООЗ) показані агресивні режими поліхіміотерапії (ПХТ) [2].
При проведенні монохіміотерапії 2,3–15% хворих потребують зміни режиму лікування у зв’язку з токсичністю [3], а у 20–30% хворих розвивається резистеність до протипухлинної медикаментозної терапії [4]. У зв’язку з рідкістю захворювання (1% злоякісних новоутворень жіночих статевих органів) всі протоколи протипухлинної медикаментозної терапії трофобластичних пухлин мають тільки ІІІ рівень доказовості [5]. Основною проблемою клініцистів є розробка нових ефективних режимів хіміотерапії та пошук шляхів зниження частоти резистентності трофобластичних пухлин.
Саме ці факти змушують шукати шляхи підвищення ефективності медикаментозного лікування хворих з трофобластичними пухлинами.
Відомо, що для злоякісних пухлин характерна тенденція до зниження швидкості кровотоку, що частково обумовлено патофізіологічними змінами кровоносних судин пухлини [6]. Внаслідок цих змін суттєво знижується інтерстиціальний тиск біологічних рідин, що погіршує проникнення хіміопрепарату в злоякісні клітини [7]. На подолання цієї проблеми направлена дія класичної гіпертермії, що дозволяє підвищити температуру в пухлині до 42–46°С.
Однак доведено, що вже при температурі 38–42°С в тканинах організму підвищується мікроциркуляція біологічних рідин [8]. Тому в останні роки поряд із достатньо широким використанням в онкологічній практиці класичної гіпертермії почали застосовувати і помірну, фізіологічну радіочастотну гіпертермію (РГТ), коли температура в пухлині підвищується до 38–42°С [8, 9].
Даних літератури про використання РГТ у лікування хворих із трофобластичними пухлинами ми не знайшли. Однак результати експериментального дослідження I. Wiest та співавторів [10] про можливість ініціювання апоптозу у культурі трофобластичних пухлинних клітин людини (BeWo) за допомогою білка галектин-1 (gal-1) та гіпертермії теоретично обґрунтовують доцільність використання РГТ у лікуванні хворих зі злоякісними трофобластичними пухлинами.
Про попередні результати використання РТГ, ініційованої неоднорідним електромагнітним полем радіохвиль, у лікуванні 7 хворих із трофобластичними пухлинами ми повідомлювали раніше [11].
Мета роботи — оцінити результати використання РГТ, ініційованої неоднорідним електромагнітним полем радіохвиль, у лікуванні хворих зі злоякісними трофобластичними пухлинами.
Робота виконана в рамках НДР ВН 14.01.07.103-07 та схвалена етичним комітетом Національного інституту раку.
Матеріали та методи дослідження
Обстежено та проліковано 27 жінок із морфологічно верифікованими злоякісними трофобластичними пухлинами. В основну групу увійшли 13 пацієнток (табл. 1): I стадію захворювання діагностовано в 1 (7,7%) хворої, III — у 11 (84,6%) хворих, IV — у 1 (7,7%) хворої. Вік хворих коливався від 20 до 48 років (середній вік — 27,4±1,3 роки). Низький ризик розвитку резистентності пухлини до лікування діагностовано у 11 (84,6%) хворих, високий — у 2 (15,4%). Розвитку трофобластичної пухлини у 10 хворих передував повний міхуровий занос, у 1 — медичний аборт, у 2 — фізіологічні пологи. Латентний період коливався від 1 до 12,5 міс. Загальний стан пацієнток оцінювали за шкалою Карновського (табл. 2). Більшість хворих (30,8%) були здатні до самообслуговування, але не здатні до активної роботи. Індекс Карновського (ІК) становив 70–80%.
| Характеристики хворих | |||||||
|---|---|---|---|---|---|---|---|
| Вік, роки | Пологи | Аборт | Завмерла вагітність |
Попередня вагітність |
Латентний період, міс |
Локалізація метастазів |
Група ризику |
| 23 | 0 | 0 | 2 | Міхуровий занос | 1,5 | Обидві легені | Низька |
| 22 | 0 | 0 | 0 | Міхуровий занос | 12,5 | Легені, переднє та заднє середостіння, міометрій |
Висока |
| 24 | 1 | 3 | 0 | Міхуровий занос | 6 | Права легеня | Низька |
| 26 | 0 | 0 | 0 | Міхуровий занос | 3 | Обидві легені | Низька |
| 20 | 0 | 0 | 0 | Міхуровий занос | 1 | Права легеня | Низька |
| 29 | 1 | 3 | 0 | Міхуровий занос | 1 | Міометрій | Низька |
| 22 | 1 | 0 | 0 | Пологи | 6,5 | Легені, мозок, печінка | Висока |
| 21 | 0 | 1 | 0 | Медичний аборт | 2 | Легені | Низька |
| 38 | 2 | 1 | 0 | Пологи | 3 | Легені, яєчник | Низька |
| 44 | 2 | 1 | 0 | Міхуровий занос | 2 | Права легеня | Низька |
| 48 | 0 | 1 | 0 | Міхуровий занос | 1,5 | Легені, міометрій | Низька |
| 17 | 0 | 0 | 0 | Міхуровий занос | 1 | Легені, міометрій | Низька |
| 32 | 2 | 3 | 0 | Міхуровий занос | 2 | Легені, міометрій | Низька |
| ІндексКарновського,% | До лікування | |
|---|---|---|
| Абсолютна кількість хворих |
% | |
| 20≤ІК<40 | 1 | 7,7 |
| 40≤ІК<50 | 1 | 7,7 |
| 50≤ІК<60 | 2 | 15,4 |
| 60≤ІК<70 | 2 | 15,4 |
| 70≤ІК<80 | 4 | 30,8 |
| 80≤ІК<90 | 3 | 23,0 |
| Всього | 13 | 100,0 |
Контрольну групу (ретроспективний аналіз) становили 14 пацієнток з морфологічно верифікованими злоякісними трофобластичними пухлинами віком від 18 до 45 років (середній вік — 28,5±1,4 роки). I стадію захворювання діагностовано у 2 (14,3%) жінок, III стадію — у 11 (78,6%), IV — у 1 (7,1%)хворої. Більшість хворих (85,7%) складали групу низького ризику розвитку резистентності до лікування.
Основним методом лікування всіх хворих була ХТ. Вибір режиму ХТ здійснювали згідно зі стандартами лікування, затвердженими наказом Міністерства охорони здоров’я України «Про затвердження протоколів надання медичної допомоги за спеціальністю «онкологія» від 17.09.2007 р. № 554.
Лікування хворих з низьким ризиком розвитку резистентності пухлини до лікування (≤6 балів) передбачало монохіміотерапію: метотрексат (МТХ) у дозі 50 мг/м довенно у 1-й день щотижня, актиноміцин Д (Да) у дозі 0,3 мг/м довенно на1–5 день з інтервалом між блоками 14 днів.
Лікування хворих з високим ризиком розвитку резистентності пухлини до лікування (≥7 балів) передбачало системну ПХТ за протоколом ЕМА-ЕР.
Курс 1 EMA:
1-й день:
Да 0,5 мг в/в болюсно;
етопозид 100 мг/м в/в протягом 30 хв;
МТХ 100 мг/м в/в болюсно;
МТХ 200 мг/м в/в 12-годинна інфузія.
У хворої з метастазами в мозок системне введення МТХ (1000 мг/м) доповнювалося інтратекальним введенням 12,5 мг МТХ.
2-й день:
Да 0,5 мг в/в болюсно;
етопозид 100 мг/м в/в протягом 30 хв;
лейковорин 30 мг в/в кожні 12 год (6 доз) через 24 год після початку введення МТХ.
Курс 2 EР:
8-й день:
етопозид 100 мг/м в/в протягом 30 хв;
цисплатин 60 мг/м в/в.
6-денна перерва.
За відсутності мукозитів кожний курс розпочинався у той самий день тижня.
Хворим основної групи ХТ проводилася на фоні РГТ. Сеанси РГТ проводили під час інфузіі цитостатика (у хворих з високим ризиком розвитку резистентності пухлини до лікування під час інфузії цисплатину). Всього проведено від 1 до 6 сеансів РГТ.
РГТ проводили на апараті «Магнітерм» (Радмір, Україна) за допомогою індуктивного аплікатора, який випромінював просторово неоднорідне електромагнітне поле з максимальною напруженістю електричного поля — 1624 В/м та магнітного поля — 97,5 А/м. Просторова неоднорідність електромагнітного поля для електричної компоненти становила 60%, а для магнітної —122%. Опромінення проводили протягом 30 хв при вихідній потужності апарата 50 та 75 Вт та частоті 27,12 МГц.
В якості локального біоіндикаційного тесту впливу електромагнітного опромінення на хворих використовували температурні характеристики на поверхні шкіри в зонах опромінення, в порожнині матки та в піхві, як це прийнято в більшості промислових гіпертермічних апаратах.
Температуру шкіри на поверхні зони опромінення вимірювали за допомогою інфрачервоного термометра FTD (Medisana, Німеччина). Температуру в порожнині матки та в піхві вимірювали волоконно-оптичним термометром ТМ-4 (Радмір, Україна).
Аплікатор апарата «Магнітерм» при проведенні сеансу РГТ розміщували в проекції патологічної зони: у хворої з I стадією захворювання аплікатор розміщували в надлобковій області; у пацієнток з метастазами в легенях та середостінні електромагнітний вплив здійснювався на легені із 4 полів (рис. 1).
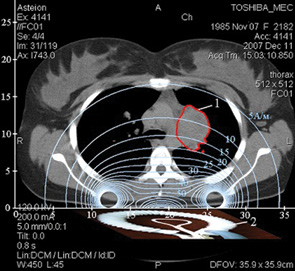
Результати та їх обговорення
Температура на поверхні шкіри істотно не змінювалася і коливалася від 36,3±0,04ºС (до сеансу РГТ) до 37,45±0,07ºС (після сеансу РГТ). Лікування переносилося хворими задовільно. Більшість побічних явищ були 0–1 ступеня. Найчастішими проявами 0 ступеня токсичності були порушення функції печінки, що характеризувалися підвищенням рівня білірубіну та трансаміназ у сироватці крові, та периферійна нейротоксичність. Найчастішим проявом I ступеня токсичності була нефротоксичність. Лейкопенія III ступеня зареєстрована у 54,5% випадків, однак підстав для припинення терапії не було. Ознаки токсичності лікування наведено в табл. 3.
| Побічні явища | Ступені токсичності (кількість випадків у %) | ||||
|---|---|---|---|---|---|
| 0 | 1 | 2 | 3 | 4 | |
| Лейкопенія | 36,4% | 9,1% | – | 54,5% | – |
| Тромбоцитопенія | 45,4% | 27,3% | 27,3% | – | – |
|
Порушення функції печінки (білірубін/трансамінази) |
90,9% | 9,1% | – | – | – |
| Порушення функції нирок | 9,1% | 90,9% | – | – | – |
| Блювання | — | 54,5% | 45,5% | – | – |
| Діарея | 54,5% | 45,5% | – | – | – |
| Стоматит | 45,5% | 54,5% | – | – | – |
| Периферійна нейротоксичність | 90,9% | 9,1% | – | – | – |
| Алопеція | 27,3% | 9,1% | 63,6% | – | – |
У 10 пацієнток групи низького ризику діагностовано повну регресію пухлини, у 1 — часткову (табл. 4). Повна регресія досягнута після проведення в середньому 5 (лікувальних та консолідуючих) циклів ХТ та РГТ. Лікування контрольної групи передбачало проведення 6–8 (лікувальних та консолідуючих) циклів ХТ.
| Ефект лікування | Кількість хворих | |
|---|---|---|
| Абсолютна кількість | % | |
| Повна регресія | 10 | 77 |
| Часткова регресія | 3 | 23 |
| Стабілізація | 0 | 0 |
| Прогресування | 0 | 0 |
| Всього | 13 | 100 |
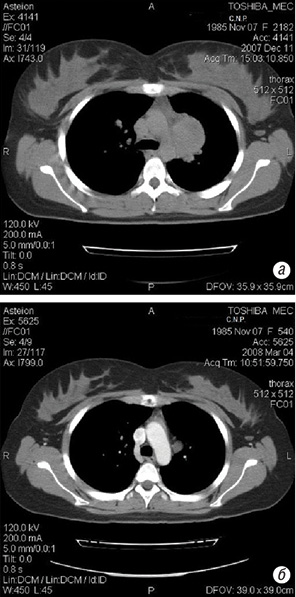
У обох пацієнток групи високого ризику досягнута часткова регресія після проведення 4 (лікувальних та консолідуючих) циклів ПХТ. Після 3 циклів ПХТ на фоні РГТ (на легені з 4 полів) розмір метастазів у легенях та середостінні зменшився у 8,5 разів (рис. 2).
Складною проблемою лікування хворих групи низького ризику є наявність пухлинних вузлів у міометрії. Даних літератури про частку таких пацієнток серед хворих з трофобластичними пухлинами в Європі та Америці немає, хоча відомо, що на Далекому Сході у 50% випадків при I стадії захворювання діагностують глибоку інвазію міометрія [2]. Системна ХТ, як правило, неефективна для цих жінок, що зумовлює пошук нових, ефективніших способів лікування. S. Tsukihara та співавтори [12] пропонують локальне введення МТХ у пухлинний вузол під сонографічним контролем. Однак цей інвазивний метод поки що не знайшов послідовників.
В описаному в даній роботі клінічному випадку повна регресія пухлинного вузла в міометрії у хворої з I стадією захворювання була досягнута після 5 блоків МТХ на фоні РГТ.
Для непрямого підтвердження зміни температури у субмукозному пухлинному вузлі під впливом РГТ було визначено температуру в порожнині матки та піхві до та після сеансу РГТ. Суттєвого (p > 0,05) підвищення температури не виявлено. Разом з тим за даними сонографії та кольорового допплерівського картування, систолічний кровотік (S/S0) у пухлинному вузлі під впливом РГТ посилювався і становив 1,50±0,13 відносних одиниць, а гетерогенність ультразвукового зображення (G/G0) пухлини знижувалася до 0,89±0,04 відносних одиниць (рис. 3).
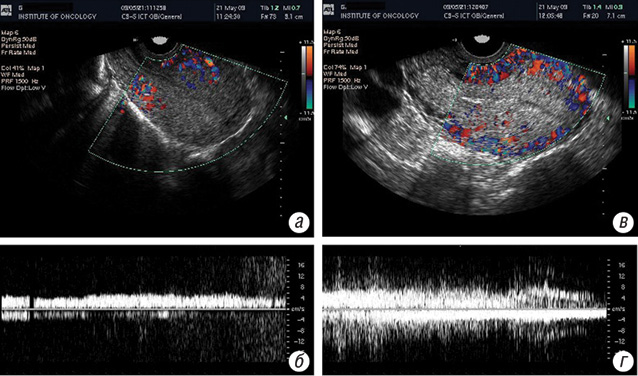
У процесі лікування трофобластичний вузол поступово зменшувався в розмірах (за даними сонографії з кольоровим допплерівським картуванням). Структура пухлини ставала гомогенною, зникала чітка межа між вузлом та незміненим міометрієм. Через тиждень після консолідуючого циклу ХТ пухлина в міометрії не візуалізувалася.
Загальноприйнятою вимогою диспансерного спостереження за хворими зі злоякісними трофобластичними пухлинами є планування вагітності не раніше ніж через 12 міс після завершення лікування. У нашому спостереженні 3 пацієнтки з групи низького ризику розвитку резистентності пухлини до лікування (з метастазами в легені) виносили вагітність, що наступила через 6 міс після завершення лікування, і народили здорових дітей. Відхилень у фізичному розвитку дітей немає, даних про рецидив захворювання у пацієнток не виявлено. Строк спостереження — 36 міс після лікування.
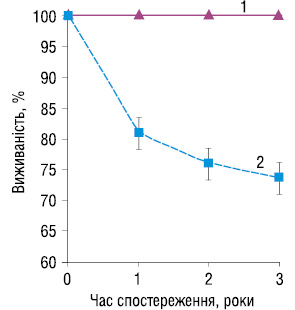
У всіх хворих основної групи досягнута стійка ремісія. Строк спостереження — 36 міс. Загальна 3-річна виживаність хворих основної групи на 25% вища, ніж у групі контролю (рис. 4).
Висновок
Отримані попередні результати використання радіочастотної гіпертермії, ініційованої неоднорідним електромагнітним полем радіохвиль, у лікуванні хворих із злоякісними трофобластичними пухлинами обнадійливі. Подальше поглиблене вивчення ефективності ХТ на фоні радіочастотної гіпертермії може у перспективі сприяти удосконаленню лікувальних програм даної категорії пацієнтів. Однак об’єктивні висновки можливі тільки після ретельного аналізу достатньої кількості клінічних спостережень.
Література
1. Berkowitz R.S., Goldstein D.P. (2009) Current management of gestational trophoblastic diseases. Gnecol. Oncol., 112: 654–662.
2. Kohorn E.I. (2006) Staging and risk factor scoring of gestational trophoblastic disease. Int. J. Gynecol. Cancer, 16(3): 611.
3. Matsui H., Suzuka K., Yamazawa K. et al. (2005) Relapse rate of patients with low-risk gestational trophoblastic tumor initially treated with single-agent chemotherapy. Gynecol. Oncol., 96: 616–620.
4. Feng F., Xiang Y., Li L., Wan X., Yang X. (2009) Clinical parameters predicting therapeutic response to surgical management in patients with chemotherapy-resistant gestational trophoblastic neoplasia. Gynecol. Oncol., 113: 312–315.
5. Feng F., Xiang Y., Wan X., Zhou Y. (2010) Prognosis of patients with relapsed and chemoresistant gestational trophoblastic neoplasia transferred to the Peking Union Medcal College Hospital. BJOG, 117(1): 47–52.
6. Ellegala D.B., Leong-Poi H., Carpenter J. E. (2003) Imaging tumor angiogenesis with contrast ultrasound and microbubbles targeted to alpha(v)beta3. Circulation, 108(3): 336–341.
7. Baish J.W., Stylianopoulos T., Lanning R.M. (2011) Scaling rules for diffusive drug delivery in tumor and normal tissues. Proc. Natl Acad. Sci. U S A, 108(5): 1799–803.
8. Song C.W., Park H.J., Lee C.K., Griffin R. (2005) Implications of increased tumor flow and oxygenation caused by mild tempreture hyperthermia in tumor treatment. Int. J. of Hyperthermia, 21(8): 761–767.
9. Orel V.E., Romanov, A.V. (2010) The Effect of Spatially Inhomogeneous Electromagnetic Field and Local Inductive Hyperthermia on Nonlinear Dynamics of the Growth for Transplanted Animal Tumors. T. Evans (еd), Nonlinear Dynamics., Intech, Сhroatia, 285–308.
10. Wiest I., Seliger C., Walzel H. et al. (2005) Induction of apoptosis in human breast cancer and trophoblast tumor cells by galectin-1. Anticancer Res., 25(3A):1575-1580.
11. Ціп Н.П., Воробйова Л.І., Орел В.Е., Кліманов М.Ю. (2008) Попередні результати використання індуктотермії, ініційованої неоднорідним електромагнітним полем радіохвиль, у лікуванні трофобластичних пухлин. Променева діагностика, променева терапія, 2: 80-82.
12. Tsukihara S., Harada T., Terakawa N. (2004) Ultrasound-guided local injection of methotrexate to treat an invasive hydatidiform mole. Gynaecol. Res.,30(3): 202-204.
Клинический опыт использования радиочастотной гипертермии в лечении злокачественных трофобластических опухолей
Национальный институт рака, Киев
Резюме. Положительные результаты использования радиочастотной гипертермии, инициируемой неоднородным электромагнитным полем радиоволн, в лечении больных со злокачественными трофобластическими опухолями свидетельствуют о перспективности проведения дальнейших углубленных клинических исследований.
злокачественные трофобластические опухоли, химиотерапия, радиочастотная гипертермия.
malignant trophoblastic tumours, chemotherapy, radiofrequency hyperthermia.














Leave a comment