Вплив неоад’ювантної таргетної терапії на якість життя у хворих на локалізований нирково-клітинний рак
Войленко О.А., Кононенко О.А., Семко С.Л., Пікуль М.В., Стаховський О.Е., Вітрук Ю.В., Стаховський Е.О.
Резюме. Мета. Визначити вплив неоад’ювантної таргетної терапії (ТТ) на компоненти якості життя у хворих на локалізований нирково-клітинний рак (НКР). Матеріали і методи. Проаналізовано дані 75 пацієнтів з локалізованим НКР, яким у період 2017–2019 рр. проведено 2 блоки неоад’ювантної ТТ препаратами першої лінії з визначенням якості життя за допомогою опитувальника Short Form (SF)-36 до та під час ТТ. Результати. Виявлено статистично значуще зниження більшості компонентів якості життя: PF (фізичного функціонування), RP (фізично-рольового функціонування), GH (загального здоров’я), VT (життєвої сили), SF (соціального функціонування) та RE (емоційно-рольового функціонування) (р<0,05), що є результатом впливу побічної дії ТТ на фізичний та психологічний стан, що призвело до обмеження соціальної активності пацієнтів. З іншого боку, ТТ не супроводжувалася падінням медіани BP (інтенсивності болю) (р=0,51) та MH (психічного здоров’я) (р=0,6). Висновки. Проведення неоад’ювантної ТТ при локалізованому НКР призводить до статистично значущого зниження більшості показників як фізичного, так і психічного компонентів здоров’я (SF-36) (р<0,05), що пов’язано з побічними ефектами таргетних препаратів, окрім інтенсивності болю (р=0,51) та депресивних розладів (р=0,6), що зумовлено відсутністю прогресування та перспективою органозберігаючого лікування.
Отримано: 10.09.2019
До друку: 11.10.2019
DOI: 10.32471/clinicaloncology.2663-466X.40.23148
Вступ
Протягом останнього десятиліття стандарти лікування локалізованого нирково-клітинного раку (НКР) змінилися [1]. Приводом для цього стали когортні дослідження, засновані на обробці бази даних пацієнтів, що включала понад 1 млн хворих. Було доведено, що проведення нефректомії асоціюється з підвищеним ризиком продовження тривалості госпіталізації, розвитку серцево-судинних захворювань та смерті пацієнтів [2].
Внаслідок цього було переглянуто ставлення до органозберігаючої тактики лікування хворих на локалізований НКР, і резекція нирки стала операцією вибору [3, 4]. У подальшому ефективність такої тактики була доведена багаточисленними клінічними дослідженнями, які демонстрували більшу тривалість життя пацієнтів, мінімальну кількість випадків хронічної ниркової недостатності та значно кращу якість життя хворих [5, 6]. Однак у переважній більшості випадків, якщо розмір пухлини більше 4 см або у разі її локалізації у воротах нирки, проводиться нефректомія, а значна частина світових публікацій повідомляють про середній розмір резектованих пухлин у межах 2–3 см.
Однією з потенційних переваг передопераційної таргетної терапії (ТТ) є можливість зменшення розміру пухлини нирки і перетворення нерезектабельних пухлин на резектабельні. Існують нечисленні дослідження такого підходу в літературі на невеликих серіях, у яких відмічається значна неоднорідність груп, що аналізуються [7, 8]. Незважаючи на гетерогенні дані, початкові результати свідчать про те, що цей підхід може мати деякі переваги у пацієнтів з проміжними показаннями до резекції або нефректомії.
Враховуючи вищеперелічене, з 2017 р. в науково-дослідному відділенні пластичної та реконструктивної онкоурології Національного інституту раку проводиться дослідження з вивчення ефективності неоад’ювантної ТТ в лікуванні локалізованого НКР. Одним з фрагментів роботи є вивчення якості життя пацієнтів, шо є другим після виживаності фактором, що визначає результативність та перспективність запропонованої методики лікування в онкології.
Мета
Визначити вплив неоад’ювантної ТТ на компоненти якості життя у хворих на локалізований НКР.
Клінічний матеріал
Проаналізовано дані 75 пацієнтів з локалізованим НКР (Т1–Т2 N0 M0), яким у період 2017–2019 рр. в науково-дослідному відділенні пластичної та реконструктивної онкоурології Національного інституту раку проведено 2 блоки неоад’ювантної ТТ препаратами першої лінії з подальшим оперативним лікуванням.
Клінічна характеристика хворих: чоловіків — 51 (68%), жінок — 24 (32%), вік пацієнтів коливався від 26 до 79 років, його медіана (Me [25%; 75%]) — 58 [50; 63] років, статус за шкалою оцінки загального стану онкологічного хворого (Eastern Cooperative Oncology Group (ECOG) Scale of Performance Status)(Me [25%; 75%]) — 0 [0; 1] балів. Розміри пухлинного ураження становили від 16 до 113 мм, у середньому (M±SD (95% CI)) 61,3±19,5 (56,5–65,7) мм. Загальна швидкість клубочкової фільтрації становила (M±SD (95% CI)) 90,2±25,5 (79,2–101,2) мл/хв/1,73 м, а на стороні ураження — 38,2±11,7 (26,7–42,5) мл/хв/1,73 м. Майже у половини пацієнтів основної групи, а саме 34 (45,3 %), відмічали супутню патологію, серед них: ожиріння у 30 (40%), артеріальна гіпертензія — у 29 (38,7 %), кісти контралатеральної нирки — у 9 (12 %), цукровий діабет — у 7 (9,3 %), сечокам’яна хвороба — у 6 (8%) пацієнтів, перенесений в анамнезі інфаркт міокарда мав місце у 4 (5,3%) хворих.
Усі пацієнти зі світло-клітинним типом НКР. Діагноз підтверджено за допомогою пункційної біопсії, виконаної до проведення ТТ.
ТТ проводили за стандартною схемою: пазопаніб 800 мг щоденно перорально протягом 2 міс; сунітиніб по 50 мг щоденно протягом 28 діб, з перервою в прийомі препарату протягом 14 діб та повторним 28-денним курсом терапії. Побічні ефекти ТТ оцінювали за класифікацією Common Terminology Criteria for Adverse Events (CTCAE), п’ята версія [9], враховували протягом усього періоду лікування та за необхідності проводили їх медикаментозну курацію. У разі виникнення значних побічних ефектів (G3–4) здійснювали корекцію дози препарату або відміняли його.
Проведено комплексну оцінку побічних ефектів, що включала повне фізикальне обстеження та лабораторні аналізи впродовж 2 міс прийому препаратів. Побічною реакцією вважалася подія, що була клінічно значущою та потребувала консультації профільного спеціаліста, корекції дози або відміни препарату.
Для оцінки якості життя використовували опитувальник SF-36, розроблений у Центрі вивчення медичних результатів США (Medical Outcomes Study), який на сьогодні широко розповсюджений і розцінюється як золотий стандарт оцінки якості життя, пов’язаної зі здоров’ям. Її проводили до лікування та під час ТТ. Опитувальник представлений як багатоцільова коротка форма медичного обстеження, що включає 36 запитань. Результати оцінки різних складових здоров’я подаються в балах за кожною із 8 шкал:
- PF — фізичне функціонування (Physical Functioning), відображає ступінь, у якому фізичний стан обмежує виконання фізичних навантажень (самообслуговування, ходіння, підйом сходами, перенесення вантажу тощо). Низький показник за цією шкалою свідчить про те, що фізична активність пацієнта значно обмежена станом його здоров’я;
- RP — фізично-рольове функціонування (Role — Physical), вплив фізичного стану на повсякденну рольову діяльність (робота, виконання повсякденних обов’язків). Низький показник за цією шкалою свідчить про те, що повсякденна діяльність значно обмежена фізичним станом хворого;
- BP — інтенсивність болю (Bodily pain) і її вплив на здатність займатися повсякденною діяльністю, що включає роботу по дому та поза його межами. Низький показник свідчить, що біль значно обмежує активність пацієнта;
- GH — загальний стан здоров’я (General Health), оцінка хворим свого стану здоров’я в теперішній час та перспектив лікування. Чим нижчі бали за цією шкалою, тим нижчою є оцінка стану здоров’я;
- VT — життєва активність (Vitality), мається на увазі відчуття себе повним сил та енергії або, навпаки, знесиленим. Низькі бали свідчать про втому пацієнта, зниження життєвої активності;
- SF — соціальне функціонування (Social Functioning) визначається ступенем, у якому фізичний або емоційний стан обмежує соціальну активність (спілкування). Низький бал свідчить про значне обмеження соціальних контактів, зниження рівня спілкування у зв’язку з погіршенням фізичного та емоційного стану;
- RE — емоційно-рольове функціонування (Role — Emotional), це оцінка ступеня, у якому емоційний стан заважає виконанню роботи чи іншої повсякденної діяльності (включаючи великі затрати часу, зменшення обсягу роботи, зниження її якості). Низькі показники трактуються як обмеження у виконанні повсякденної роботи, зумовлене погіршенням емоційного стану;
- MH — психічне здоров’я (Mental Health), характеризує настрій, наявність депресії, тривоги, показник позитивних емоцій. Низький показник свідчить про наявність тривожних переживань, психічне неблагополуччя.
Сума балів за кожною шкалою коливається від 0 до 100 балів, де 100 відповідає повному здоров’ю пацієнта, вони вираховуються за спеціальною методикою. Шкали об’єднані в 2 сумарних показники, що відображають фізичне та емоційне здоров’я осіб. Даний опитувальник пройшов процес валідації, культурної і мовної адаптації в Україні.
Статистична обробка отриманих результатів проводилася за допомогою програмного забезпечення SPSS. Оцінку розподілу неперервних даних у групі проводили за допомогою побудови діаграм розподілу за критерієм Lilliefors. Описова статистика включала обчислення середньої величини зі стандартним відхиленням або медіани з 25–75 процентилями. Порівняння кількісних показників у групах проводили з використанням U-критерію Манна — Уітні, статистично значущими відмінностями вважали вірогідності помилки 1-го роду менше 5%, р<0,05.
Результати
На якість життя пацієнтів впродовж проведення ТТ в першу чергу впливали побічні ефекти, які мали різнорідний характер. Слід відмітити, що їх кількість та інтенсивність були нижчими, ніж у наявних літературних джерелах з дослідження ТТ у пацієнтів з розповсюдженим та метастатичним НКР [10–12]. Так, загалом побічні ефекти виникли у 51 (68 %) пацієнта, а 3–4 ступеня — у 28 (37,3%) відповідно. Найбільш часто відмічали: астенію — у 40 (53,3%) пацієнтів, артеріальну гіпертензію — у 36 (48%), діарею — у 30 (40%), нудоту — у 28 (37,3%), зміну кольору волосся — у 18 (24%) та головний біль — у 15 (20%) хворих. Ускладнення 3 та 4 ступеня за CTCAE здебільшого проявлялися у вигляді діареї — у 12 (16%) хворих, артеріальної гіпертензії — у 8 (10,7%) та астенії — у 6 (8%), у зв’язку з чим проводилася корекція дози препарату. Відміна ТТ у зв’язку з наявністю побічних проявів 3–4 ступеня, що не коригувалися консервативно та залишалися навіть після зниження дози препарату, відмічена у 2 (2,7%) пацієнтів групи неоад’ювантної ТТ.
Слід зазначити, що побічні ефект при проведенні ТТ відмічалися в усіх опублікованих дослідженнях, однак їх вплив на якість життя пацієнтів було вивчено лише в одному [12] та лише за допомогою примітивної 10-бальної оцінки. Нами було проведено детальний аналіз впливу ТТ на якість життя пацієнтів за опитувальником SF-36. Порівняльний аналіз якості життя пацієнтів до та під час ТТ представлений в таблиці.
| Показники якості життя | До ТТ, бали | Під час ТТ, бали | Статистична оцінка, U-критерій Манна — Уітні |
|---|---|---|---|
| PF — фізичне функціонування, Me [25%; 75%] | 85 [70; 90] | 80 [60; 85] | р<0,005 |
| RP — фізично-рольове функціонування, Me [25%; 75%] | 75 [50; 100] | 75 [50; 75] | р<0,05 |
| BP — інтенсивність болю, Me [25%; 75%] | 100 [100; 100] | 100 [100; 100] | р=0,51 |
| GH — загальне здоров’я, Me [25%; 75%] | 57 [50; 70] | 55 [45; 60] | р<0,05 |
| VT — життєва сила, Me [25%; 75%] | 75 [60; 80] | 65 [55; 75] | р<0,001 |
| SF — соціальне функціонування, Me [25%; 75%] | 75 [75; 75] | 75 [62,5; 75] | р<0,001 |
| RE — емоційно-рольове функціонування, Me [25%; 75%] | 100 [66,7; 100] | 66,7 [66,7; 100] | р<0,005 |
| MH — психічне здоров’я, Me [25%; 75%] | 68 [60; 88] | 68 [60; 88] | р=0,6 |
До проведення неоад’ювантної ТТ отримано низькі показники GH (загального здоров’я), медіана якого Me [25%; 75%] досягала лише 57 [50; 70] балів зі 100 можливих, що відповідає за оцінку хворим стану свого здоров’я на час опитування і перспектив лікування (чим нижчий бал за цією шкалою, тим нижчою є оцінка стану здоров’я хворим). Дещо вищою була медіана показника VT (життєвої сили), яка становила 75 [60; 80] балів і передбачала відчуття пацієнтом себе повним сил і енергії або, навпаки, знесиленим (низькі бали свідчать про підвищену втому пацієнта, зниження життєвої активності). Показник медіани SF (соціального функціонування) не перевищував 75 [75; 75] балів, що визначає ступінь, у якому фізичний або емоційний стан обмежує соціальну активність (спілкування). Низькі бали за даним показником свідчать про значне обмеження соціальних контактів, зниження рівня спілкування у зв’язку з погіршенням фізичного та емоційного стану. Медіана MH (психічне здоров’я) досягала лише 68 [60; 88] балів і характеризувала настрій, наявність депресії, тривоги, загальний показник позитивних емоцій. Низькі показники свідчили про наявність депресивних, тривожних переживань, психічного неблагополуччя.
Водночас такі показники фізичного компонента здоров’я, як PF (фізичне функціонування) 85 [70; 90], що відображає ступінь, у якому фізичний стан обмежує виконання фізичних навантажень (самообслуговування, ходьба, підйом сходами, перенесення вантажів та ін.); RP (рольове функціонування) 75 [50; 100], що характеризує вплив фізичного стану на повсякденну рольову діяльність (роботу, виконання повсякденних обов’язків); та BP (інтенсивність болю) 100 [100; 100], що відображає вплив больових відчуттів на здатність займатися повсякденною діяльністю, включаючи роботу по дому і поза домом, мають досить високі значення, що пов’язано з відсутністю класичних симптомів захворювання, таких як біль, кровотеча у хворих на локалізований НКР, які могли б обмежувати повсякденний режим фізичних навантажень, включаючи роботу по дому та поза ним.
Крім того, RE (емоційно-рольове функціонування) передбачає оцінку ступеня, у якому емоційний стан заважає виконанню роботи або іншої повсякденної діяльності (включаючи великі витрати часу, зменшення обсягу роботи, зниження її якості та ін.), і на початку дослідження його медіана була достатньо високою і становила 100 [66,7; 100] балів.
Порівняння результатів визначення якості життя за опитувальником SF-36 до та під час проведення ТТ графічно представлено на рисунку.
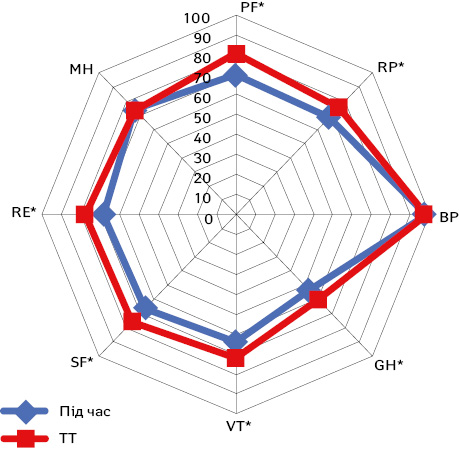
Аналіз впливу ТТ на якість життя пацієнтів показав статистично значуще зниження за більшістю компонентів: PF (фізичне функціонування) — з 85 [70; 90] до 80 [60; 85] (р<0,005), RP (фізично-рольове функціонування) — з 75 [50; 100] до 75 [50; 75] (р<0,05), GH (загальне здоров’я) — з 57 [50; 70] до 55 [45; 60] (р<0,05), VT (життєва сила) — з 75 [60; 80] до 65 [55; 75] (р<0,001), SF (соціальне функціонування) — з 75 [75; 75] до 75 [62,5; 75] (р<0,001); та RE (емоційно-рольове функціонування) — з 100 [66,7; 100] до 66,7 [66,7; 100] (р<0,005), що є результатом побічної дії таргетних препаратів (артеріальна гіпертензія, діарея, нудота, зниження апетиту, підвищена втома та ін.) на фізичний та психологічний стан хворого і, як результат, призвело до обмеження соціальної активності пацієнтів. З іншого боку, прийом таргетних препаратів не супроводжувався зниженням медіани BP (інтенсивності болю) (100 [100; 100] проти 100 [100; 100]; р=0,51) та MH (психічного здоров’я) (68 [60; 88] проти 68 [60; 88]; р=0,6). Інтенсивність болю була стабільною через її відсутність у пацієнтів з локалізованим НКР та відсутність прогресування захворювання. Стабільний рівень МН вказує на відсутність депресивних розладів в зв’язку з проходженням лікування і відображає віру пацієнта в проведення органозберігаючого лікування після закінчення передопераційного курсу ТТ.
Обговорення
Клінічна ефективність ТТ у лікуванні пухлин нирок розширює спектр напрямків її застосування. Згідно з рекомендаціями Національної комплексної онкологічної мережі (National Comprehensive Cancer Network — NCCN) та Європейської асоціації урологів (European Association of Urology — EAU) використання ТТ в лікуванні НКР показане при метастатичній хворобі [3, 4]. Новим перспективним напрямком використання ТТ може бути застосування неоад’ювантного режиму при локалізованому та місцево-поширеному НКР з метою зменшення первинної пухлини та полегшення перебігу оперативного втручання. Окремими клінічними дослідженнями показано ефективність використання вказаної схеми, що дозволило підвищити вірогідність проведення органозберігаючого лікування [7, 13].
Незважаючи на ефективність ТТ, такий метод лікування супроводжується значною кількістю побічних ефектів, яка сягає 50–80% [14]. Враховуючи вищезгадане, вкрай важливим елементом терапії є адекватне динамічне спостереження за пацієнтом та запобігання ймовірним побічним реакціям [15]. Звичайні та унікальні токсичності, що виникають в результаті прийому ТТ, були добре визначені в окремих клінічних випробуваннях, і встановлені алгоритми щодо курації таких ускладнень.
Одним з основних критичних моментів в передопераційній ТТ при локалізованому НКР є стурбованість пацієнтів, що пов’язана, з одного боку, з можливістю виникнення як побічних ефектів самої ТТ, так і надією на зменшення об’єму пухлини та підвищення вірогідності збереження нирки — з іншого боку. Це, у свою чергу, може забезпечити високий рівень якості життя після завершення лікування.
Головна мета всієї системи медичної допомоги в онкології — це відновлення та/або збереження якості життя. У рамках цього визначення якість життя є другим за значимістю критерієм оцінки результатів протипухлинної терапії після виживаності та не менш важливим, ніж відповідь пухлини на лікування, тривалість ефекту, токсичність та ін. [16].
Якість життя — це сукупність параметрів, що відображають оцінку перебігу життя з урахуванням фізичного стану, психологічного благополуччя, соціальних відносин і функціональних здібностей у період розвитку захворювання і його лікування [17].
Представлений у нашій роботі аналіз впливу ТТ при локалізованому НКР на якість життя пацієнтів показав статистично значуще зниження окремих показників фізичного і психічного компонентів здоров’я, що пов’язано з побічними ефектами таргетних препаратів. При цьому передопераційна ТТ в короткотривалому режимі (2–3 міс) не викликає депресивних розладів та больових проявів у пацієнтів.
Важливим є також той факт, що використання неоад’ювантного лікування в онкології направлене на зменшення кількості побічних ефектів та покращення переносимості обраної терапії завдяки наявності двох функціонуючих нирок при максимальному об’ємі функціонуючої паренхіми, що значно підвищує дезінтоксикаційні можливості організму в цілому [7, 8].
Висновки
Проведення неоад’ювантної ТТ при локалізованому НКР призводить до статистично значимого зниження більшості показників як фізичного, так і психічного компонентів здоров’я (SF-36) (U-критерій Манна — Уітні; р<0,05), що пов’язано з побічними ефектами таргетних препаратів, окрім інтенсивності болю (U-критерій Манна — Уітні; р=0,51) та депресивних розладів (U-критерій Манна — Уітні; р=0,6), що зумовлено відсутністю прогресування захворювання та перспективою проведення органозберігаючого лікування.
Фінансування: це дослідження фінансувалося в межах науково-дослідної роботи «Визначити шляхи зменшення інвалідизації хворих з локалізованим раком нирки на основі розробки та оптимізації інноваційних методів діагностики, неоад’ювантної таргетної терапії та хірургічного лікування», що виконується в Національному інституті раку, шифр теми ВН.14.01.07.178-18, номер держрeєстрації 0118U003727.
Конфлікт інтересів: автори О.А. Войленко, О.Е. Стаховський та Е.О. Стаховський отримували гонорари доповідачів від компаній Pfizer, Roсhe та Novartis.
Список використаної літератури
- Ljungberg, B., Hanbury, D. C., Kuczyk, M. A., Merseburger, A. S., Mulders, P. F., Patard, J. J., & Sinescu, I. C. (2007). EAU Renal Cell Carcinoma Guideline. Eur Urol, 51(6), 1502–1510. doi: 10.1016/j.eururo.2007.03.035.
- Smith, D. H., Thorp, M. L., Gurwitz, J. H., McManus, D. D., Goldberg, R. J., Allen, L. A., … Go, A. S. (2013). Chronic Kidney Disease and Outcomes in Heart Failure With Preserved Versus Reduced Ejection Fraction. Circ Cardiovasc Qual Outcomes, 6(3), 333–342. doi: 10.1161/CIRCOUTCOMES.113.000221.
- NCCN Guidelines Version 2.2019. (2019). Kidney Cancer. Retrieved from https://www.nccn.org/professionals/physician_gls/pdf/kidney.pdf.
- EAU. (2018). Guidelines on Renal Cell Carcinoma. Retrieved from https://uroweb.org/guideline/renal-cell-carcinoma.
- Go, A. S., Chertow, G. M., Fan, D., McCulloch, C. E., & Hsu, C. Y. (2004). Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. N Engl J Med, 351(13), 296–305. doi: 10.1056/NEJMoa041031.
- Herzog, C. A., Asinger, R. W., Berger, A. K., Charytan, D. M., Díez, J., Hart, R. G.,… Ritz, E. (2011). Cardiovascular disease in chronic kidney disease. A clinical update from Kidney Disease: Improving Global Outcomes. Kidney Int, 80(6), 572–586. doi: 10.1038/ki.2011.223.
- Silberstein, J. L., Millard, F., Mehrazin, R., Kopp, R., Bazzi, W., DiBlasio, C. J.,… Derweesh, I. H. (2010). Feasibility and efficacy of neoadjuvant sunitinib before nephron- sparing surgery. BJU Int, 106(9), 1270–1276. doi: 10.1111/j.1464-410X.2010.09357.x.
- Rini, B. I., Plimack, E. R., Takagi, T., Elson, P., Wood, L. S., Dreicer, R.,… Campbell, S. C. (2015). A phase II study of pazopanib in patients with localized renal cell carcinoma to optimize preservation of renal parenchyma. J Urol, 194(2), 297–303. doi: 10.1016/j.juro.2015.03.096.
- National Institutes of Health. U.S. Department of Health and Human Services. (2017). Common Terminology Criteria for Adverse Events (CTCAE) v5.0. Retrieved from https://ctep.cancer.gov /protocolDevelopment /electronic_applications /docs/CTCAE_v5_Quick_Reference_8.5×11.pdf.
- Motzer, R. J., Hutson, T. E., Tomczak, P., Michaelson, M. D., Bukowski, R. M., Oudard, S.,… Figlin, R. A. (2009). Overall survival and updated results for sunitinib compared with interferon alfa in patients with metastatic renal cell carcinoma. J Clin Oncol, 27(22), 3584–3590. doi: 10.1200/JCO.2008.20.1293.
- Sternberg, C. N., Davis, I. D., Mardiak, J., Szczylik, C., Lee, E., Wagstaff, J.,… Hawkins, R. E. (2010). Pazopanib in locally advanced or metastatic renal cell carcinoma: results of a randomized phase III trial. J Clin Oncol, 28(6), 1061–1068. doi: 10.1200/JCO.2009.23.9764.
- Motzer, R. J., Hutson, T. E., Cella, D., Reeves, J., Hawkins, R., Guo, J.,… Choueiri, M. D. (2013). Pazopanib versus sunitinib in metastatic renal-cell carcinoma. N Engl J Med, 369(8), 722–731. doi: 10.1056/NEJMoa1303989.
- Lane, B. R., Derweesh, I. H., Kim, H. L., O’Malley, R., Klink, J., Ercole, C. E.,… Campbell, S. C. (2015). Presurgical sunitinib reduces tumor size and may facilitate partial nephrectomy in patients with renal cell carcinoma. Urol Oncol, 33(3), 112.e15–21. doi: 10.1016/j.urolonc.2014.11.009.
- Margulis, V., Matin, S. F., Tannir, N., Tamboli, P., Swanson, D. A., Jonasch, E., & Wood, C. G. (2008). Surgical morbidity associated with administration of targeted molecular therapies before cytoreductive nephrectomy or resection of locally recurrent renal cell carcinoma. Journal of Urology, 180(1), 94–98. doi: 10.1016/j.juro.2008.03.047.
- Kamba, T., & McDonald, D. M. (2007). Mechanisms of adverse effects of anti-VEGF therapy for cancer. Br J Cancer, 96(12), 1788–1795. doi: 10.1038/sj.bjc.6603813.
- Sprangers, M. A., Cull, A., Groenvold, M., Bjordal, K., Blazeby, J., & Aaronson, N. K. (1998). The European Organization for Research and Treatment of Cancer approach to developing questionnaire modules: an update and overview. EORTC Quality of Life Study Group. Qual Life Res, 7(4), 291–300.
- Shinohara, N., Harabayashi, T., Sato, S., Hioka, T., Tsuchiya, K., & Koyanagi, T. (2001). Impact of nephron-sparing surgery on quality of life in patients with localized renal cell carcinoma. Eur Urol, 39, 114–119. doi: 10.1159/000052422.
Влияние неоадъювантной таргетной терапии на качество жизни у больных локализованным почечно-клеточным раком
Национальный институт рака, Киев
Резюме. Цель. Определить влияние неоадъювантной таргетной терапии (ТТ) на компоненты качества жизни у больных локализованным почечно-клеточным раком (ПКР). Материалы и методы. Проанализированы данные 75 пациентов с локализованным ПКР, которым в период 2017–2019 гг. проведено 2 блока неоадъювантной ТТ препаратами первой линии с определением качества жизни с помощью опросника Short Form (SF)-36 до и во время ТТ. Результаты. Выявлено статистически значимое снижение большинства компонентов качества жизни: PF (физического функционирования), RP (физически-ролевого функционирования), GH (общего здоровья), VT (жизненной силы), SF (социального функционирования) и RE (эмоционально-ролевого функционирования) (р<0,05), что является результатом влияния побочных эффектов ТТ на физическое и психологическое состояние, что привело к ограничению социальной активности пациентов. С другой стороны, ТТ не сопровождалась снижением медианы BP (интенсивности боли) (р=0,51) и MH (психического здоровья) (р=0,6). Выводы. Проведение неоадъювантной ТТ при локализованном ПКР приводит к статистически значимому снижению большинства показателей как физического, так и психического компонентов здоровья (SF-36) (р<0,05), что связано с побочным действием таргетных препаратов, кроме интенсивности боли (р=0,51) и депрессивных расстройств (р=0,6), что обусловлено отсутствием прогрессирования и перспективой органосберегающего лечения.
почечно-клеточный рак; неоадъювантная таргетная терапия; качество жизни.
Адреса:
Войленко Олег Анатолійович
03022, вул. Ломоносова, 33/43
Національний інститут раку
Тел.: +38 (050) 501-19-03
E-mail: voilenko@rambler.ru
Correspondence:
Voylenko Oleg
33/43 Lomonosova Str., Kyiv 03022
National Cancer Institute
Tel.: +38 (050) 501-19-0
3E-mail: voilenko@rambler.ru














Leave a comment