Самарій 153Sm оксабіфор в комплексній терапії метастатичного ураження кісток
Сукач Г.Г., Саган Д.Л., Солодянникова О.И., Войт Н.Ю.
Резюме. У роботі проаналізовано дані літератури щодо стану проблеми радіонуклідної терапії метастатичного ураження кісток при різних злоякісних новоутвореннях. Проведено історичний екскурс використання радіофармпрепаратів у лікуванні вторинного ураження кісток, визначено переваги та обмеження різних радіонуклідів. Більш глибоко розглянуто питання використання препарату останньої генерації Самарію 153Sm оксабіфору, який за даними різних авторів, володіє більш вираженою анальгезуючою дією та мінімальними побічними ефектами.
Резюме. В работе проанализированы данные литературы о состоянии проблемы радионуклидной терапии метастатического поражения костей при различных злокачественных новообразованиях. Проведен исторический экскурс использования радиофармпрепаратов в лечении вторичного поражения костей, определены преимущества и ограничения различных радионуклидов. Более глубоко рассмотрены вопросы использования препарата последней генерации Самария 153Sm оксабифора, который, по данным различных авторов, обладает наиболее выраженным анальгезирующим действием и минимальными побочными эффектами.

Метастатическое поражение костей — одно из самых распространенных осложнений солидного рака. По данным литературы, частота метастатического поражения костной системы при раке молочной железы (РМЖ) на разных этапах заболевания колеблется от 47 до 85%, при раке предстательной железы (РПЖ) — от 33 до 85%, при раке легких — от 30 до 60%, почки — от 33 до 40%, щитовидной железы — от 28 до 60% [1, 12, 16].
На начальных стадиях метастатическое поражение костей часто клинически протекает бессимптомно, однако позже проявляется злокачественной гиперкальциемией, переломами и болевым синдромом, что значительно снижает качество жизни пациентов [3, 4, 15, 27].
Патофизиология процесса поражения костей и связанных с этим осложнений характеризуется повышением остеолитической активности, остеокластной резорбцией на фоне стимулирующего влияния фактора роста на деление опухолевых клеток и гиперсекрецию цитокинов. Эти факторы приводят к остеопении и повышенному риску патологических переломов. Кальций, выделяющийся в процессе резорбции костной ткани, является причиной злокачественной гиперкальциемии [8, 11, 20].
Болевой синдром при поражении костной системы нарастает по мере прогрессирования болезни и становится ведущей проблемой в течение продолжительного периода времени. Следовательно, основной задачей терапии этих пациентов является адекватное паллиативное лечение с целью подавления болевого синдрома.
Современные методы лечения костных метастазов включают радиочастотную абляцию, лучевую терапию, хирургию при наличии единичных очагов метастазирования, химио-, гормоно-, радионуклидную терапию, введение бисфосфонатов при диффузном множественном поражении скелета. Однако даже на фоне комплексного применения доступных терапевтических модальностей нередко выявляют прогрессирование метастатического процесса и усиление болевого синдрома. В этой связи проблема поиска новых методов лечения такой категории пациентов остается актуальной.
Радионуклидная терапия множественного метастатического поражения скелета получила широкое распространение в мире с конца 80-х гг. прошлого века [1, 18, 19]. Наибольший опыт успешного применения радионуклидов в паллиативной терапии накоплен при РПЖ и РМЖ, что объясняется характером поражения костной системы (наличие выраженного бластического компонента) [13, 22].
В мировой практике для паллиативной терапии костных метастазов активно используются изотопы 32P, 89Sr, 186Re, 188Re, 153Sm и 177Lu [1, 2, 6, 12, 15] (табл. 1).
Таблица 1 Основные характеристики РФП, применяющихся для лечения костных метастазов
| РФП | Т½ | Энергия β-излучения (MeV) (max/min) |
Энергия γ-излучения (MeV) (%) |
Проникающая способность в мягких тканях (mm) (max/min) |
| 32P | 14,3 | 1,71/0,695 | — | 8/3 |
| 89Sr/Cl2 | 50,5 | 1,46/0,58 | 0,91 (0,01) | 2,4 |
| 186Re-HEDP | 3,7 | 1,07/0,349 | 0,137 (9) | 2,4 |
| 188Re-HEDP | 0,7 | 2,12 | — | 3 |
| 153Sm-EDTMP | 1,9 | 0,81/0,23 | 0,103 (28) | 0,6 |
| 177Lu-EDTMP | 6,7 | 0,497 | 0,208 (11) | — |
| 117mSn-DTPA | 13,6 | — | — | Конверсия электронов 0,3/0,2 |
Применение радионуклидной терапии для лечения костных метастазов обусловлено способностью некоторых β-излучающих изотопов к избирательному накоплению в патологических очагах с усиленной минерализацией и повышенным метаболизмом костной ткани. Локальное «внутреннее» облучение β-частицами в равной степени воздействует как на манифестирующие, так и на субклинические очаги костной деструкции, что позволяет достичь редукции опухолевой инфильтрации и обеспечить обезболивание [2, 7, 11].
В Украине список радиофармпрепаратов (РФП), применяемых при лечении костных метастазов, ограничен двумя препаратами: 89Sr и 32P.
32Р является реакторным радионуклидом, чистым β-излучателем, который принадлежит к препаратам первой генерации и был одним из первых специфических изотопов, используемых в ядерной медицине. Препарат активно применяли до начала 80-х годов. Несмотря на высокую эффективность терапии 32Р при РМЖ и РПЖ (59–94%), выраженная гематологическая токсичность и высокая энергия излучения послужили причинами отказа от дальнейшего использования этого препарата в ряде стран [17, 22, 27].
С начала 90-х годов в большинстве стран применяют препарат второй генерации — 89SrCl2. По своим физико-химическим характеристикам он является β-излучателем, аналогом кальция. Препарат активно включается в участки костной ткани с повышенной остеобластической активностью. Положительный ответ на терапию наблюдается у 60–84% пациентов и развивается в промежутке от 7-го до 21-го дня с момента введения РФП. Эффект лечения сохраняется и длится от 3 до 6 мес [1, 3, 29].
Последние 10 лет в ядерной медицине широко применяют препарат третьей генерации — Самарий 153Sm оксабифор. Сочетание β- и γ-излучения в спектре препарата, относительно короткий период полураспада, составляющий 46,3 ч, а также невысокая энергия излучения 0,81 Мэв сделали его одним из самых востребованных РФП для паллиативного лечения множественного метастатического поражения скелета.
Терапевтическое действие Самария 153Sm оксабифора определяется его β-излучением, а наличие в его спектре гамма-составляющей позволяет регистрировать накопление и распределение препарата в патологических очагах при помощи гамма-камеры и таким образом осуществлять мониторинг проводимой терапии [1, 15, 26].
Клинико-дозиметрическая характеристика 153Sm.
После однократного внутривенного введения 50–90% лечебной дозы препарата обычно фиксируется в костной системе. Тропность препарата к патологическим очагам в костной системе обусловлена наличием полиметиленфосфоновых комплексов, которые обладают способностью к избирательному накоплению в зонах с усиленной потребностью в минерализации, преимущественно в метастатических и воспалительно-деструктивных очагах. Фосфатные соединения осуществляют транспортировку радионуклида самария в эти очаги, создавая в них наиболее высокую концентрацию препарата. Следовательно, в этих зонах локально создаются высокие дозы β-излучения, воздействующие на опухолевую ткань, участки перифокальной инфильтрации и воспаления, а также на остеокласты, разрушающие костную ткань [7, 9, 11, 18].
По данным литературы, в первые 6 часов накопление РФП в метастатическом участке в 6 раз превышает таковое в интактной ткани. Через 24 часа накопление в очаге поражения в 11,5 раз выше, чем в интактной ткани (рис. 1).
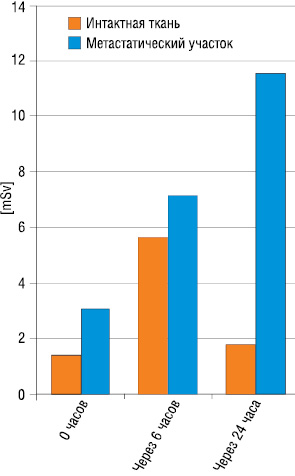
Данное явление связано не только с быстрым увеличением фиксации самария-153 в метастатическом участке, но и также с активным его выведением из интактной ткани через мочевыводящие пути. Кроме того, некоторые авторы указывают на способность 153Sm к накоплнию не только в остеобластических, но и в остеолитических очагах [1, 11]. Максимальная экскреция препарата отмечается в первые 4–8 часов после его введения. По данным разных авторов, с мочой выводится от 10 до 40% препарата. Установлена прямая корреляция между количеством очагов, степенью захвата и удержания препарата костной тканью, что объясняет разброс вышеприведенных данных [10, 15].
Таким образом, формирование максимальных доз препарата в наиболее функционально активных метастазах дают основание для достижения быстрого и эффективного подавления болевого синдрома.
Показаниями к радионуклидной терапии костных метастазов с помощью самария-153 являются:
- множественные метастазы в кости;
- болевой синдром, обусловленный ими;
- прогрессирование костных метастазов на фоне ранее проведенного лечения;
- позитивная остеосцинтиграфия (ОСГ) до начала лечения, то есть активное накопление в метастазах диагностических остеотропных препаратов, относящихся к группе фосфатов, меченых 99mTc.
Благодаря наличию гамма-квантов в спектре излучения самария, сцинтиграфическая картина, полученная с любым меченым фосфатным соединением до лечения полностью сопоставима с распределением самария в костях после его введения.
Противопоказания к лечению Самарием 153Sm оксабифором следующие:
- снижение показателей крови:
уровень тромбоцитов ниже 100×109/л;
уровень лейкоцитов ниже 2,5×109/л;
- одновременно проводимая миелосупрессивная терапия;
- острая и хроническая почечная недостаточность, которая, увеличивая клиренс препарата, может создать риск повышения токсичности радионуклидной терапии;
- тяжелое общее состояние, статус активности по Карновскому ниже 50, прогноз выживания менее 2 мес;
- тяжелая коагулопатия;
- угроза патологического перелома и компрессии спинного мозга;
- быстрое развитие внекостных метастазов (например метастазов в печень, легкие, головной мозг и т.п.);
- беременность, лактация.
Оценку эффективности лечения с помощью 153Sm проводили по нескольким критериям: степени подавления болевого синдрома, снижении потребления анальгетиков и динамике качества жизни (табл. 2).
Таблица 2 Оценка эффективности лечения больных с метастатическим поражением костей
| Оценочные шкалы | До лечения | После лечения (1 и 3 мес) |
|---|---|---|
| Шкала оценки интенсивности боли (ЛАКОМЕД, 2002) (0—9, где 0 — нет болей; 9 — интенсивные постоянные боли) | 6,8 |
4,7; 5,0 p<0,0001 |
| Шкала приема анальгетиков (1–3, где 0 — анальгетики не применяются; 4 — наркотические анальгетики применяются регулярно (ежедневно) | 1,9±0,7 |
0,2±0,4 p<0,0001 |
| Шкала Карновского (мин-10% — терминальная стадия, макс-100% — полное отсутствие каких-либо жалоб, ограничений) | 63,1±14,1 |
69,7; 67,3+15,1 p<0,0001 |
| Шкала оценки костных болей МАГАТЭ (мин-1, макс-4), где значению 4 соответствует полный эффект — полное исчезновение болей и полное сохранение дневной активности | 2,2 | 3,4±0,7 |
| Шкала ВОЗ (ECOG) для определения работоспособности онкологических больных (мин-0, макс-4), где 0 — больной сохраняет полную активность; 4 — не может выполнять самообслуживание | 1,92 | 1,16; 1,2 |
| Продолжительность болевого синдрома после введения препарата (дней) (мин-2, макс-18) | 6±4,6 | |
| Без болевого синдрома (дней) |
У 90% больных >90 У 10% больных -70 |
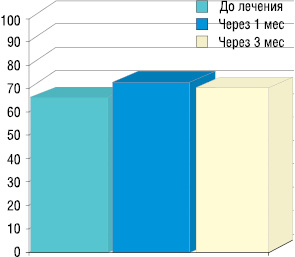
По данным проведенных исследований, общий статус пациентов, оцененный в процентах по шкале Карновского, показал рост индекса с 63,1% до лечения до 69,7% через 3 мес после однократного введения самария (рис. 2).
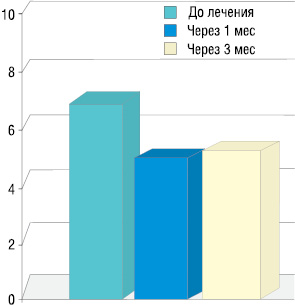
Средние значения интенсивности болевого синдрома по шкале Лакомед с 6,8 до лечения снижаются через 3 мес до 5 (рис. 3).
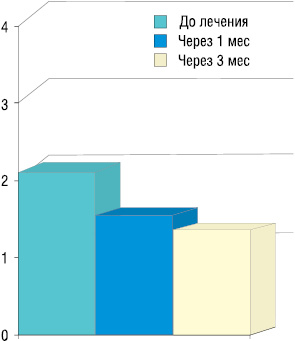
Исследования потребления анальгетиков с применением анальгетической шкалы ВОЗ указывают, что проведенная радионуклидная терапия позволяет снизить потребление анальгетиков почти на 40% через 3 мес: с 1,9 до начала лечения до 1,1 через 3 мес (рис. 4).
Таким образом, результаты паллиативной терапии самарием демонстрируют хороший терапевтический анальгетический эффект, снижают потребление анальгетиков и улучшают общее качество жизни пациентов.
Общий терапевтический эффект препарата при генерализованном очаговом поражении скелета составляет через 1 мес 88%, при этом в 45% случаев наблюдается частичный эффект лечения, у 43% — полный эффект, у 12% ответ на лечение отсутствует.
По данным литературы, для самария характерен быстрый ответ на введенную активность, что является его отличительной особенностью по сравнению с фосфором и стронцием. В среднем эффект от проведенной терапии наступает через 2–7 дней после его введения и длится в среднем от 4 до 12 нед [3, 15, 16, 24].
Общая клиническая эффективность терапии самарием-153 зависит от первичной локализаци опухолевого процесса. Оценка результатов повторных введений показала, что терапия, проводимая через 3 и 6 мес, также оказывается эффективной (табл. 3).
Таблица 3 Общая клиническая эффективность самария-153 в лечении костных метастазов при различных опухолях
| Локализация первичной опухоли | Клиническая эффективность(полный+выраженный+частичный эффект) | ||
|---|---|---|---|
| Через 1 мес | Через 3 мес | Через 6 мес | |
| РМЖ | 80,5% | 76,5% | 64,1% |
| РПЖ | 81,7% | 76,9% | 61,8% |
| Рак легкого | 62% | 46% | – |
Наиболее выраженным терапевтическим действием препарат обладает при РМЖ и РПЖ. Менее выражена его эффективность при раке легкого, где не удается достичь полного подавления болевого синдрома и отмечается быстрое прогрессирование внекостных поражений.
Среди побочных действий самария отмечается умеренная миелотоксичность в виде снижения количества лейкоцитов и тромбоцитов, которая носит преходящий характер [22, 27]. Минимальные значения показателей крови обычно регистрируются через 3–4 нед. Восстановление до исходного уровня происходит в большинстве случаев самостоятельно в течение 6–8 нед. Следует отметить, что миелотоксичность самария — наименьшая из всех доступных нам сегодня РФП, которые применяют в случае костного метастазирования. Поэтому сегодня самарий-153 — препарат выбора в случае истощенного резерва красного костного мозга в результате предшествующей химиотерапии или лучевой терапии, при которой зона облучения захватывала обширные участки костного мозга.
Оценка гематологической токсичности, проведенная по критериям СNC-NCIC, показывает, что у 95% больных миелосупрессия не превышает I–II степени токсичности. Только у незначительной части пациентов возникла миелотоксичность III степени [10, 27] (табл. 4).
Таблица 4 Гематологическая токсичность
самария-153 по критериям СNC-NCIC
| Лейкоциты | Тромбоциты | |
|---|---|---|
| Норма | 32,7% | 35,6% |
| I степень | 50% | 56% |
| II степень | 16,3% | 6,7% |
| III степень | 3% | 1% |
Преимущества Самария 153Sm оксабифора:
- высокое и селективное накопление в метастатических очагах;
- быстрое выведение из здоровых тканей;
- относительно низкая токсичность препарата;
- возможность предварительной оценки накопления при ОСГ с препаратами 99mTc;
- возможность сцинтиграфической оценки накопления и распределения самария 153Sm оксабифора;
- возможность амбулаторного применения данного препарата в радиологических отделениях, имеющих лицензию для работы с самарием 153Sm оксабифором.
Таким образом, анализ состояния проблемы эффективности радионуклидной терапии в комплексном лечении метастатического поражения костной системы при злокачественных опухолях различной локализации подтверждает необходимость внедрения новых РФП, обладающих высокой специфичностью накопления в очаге, выраженным обезболивающим эффектом, при минимальных побочных эффектах.
Литература
1. Крылов В.В. (2007) Радионуклидная терапия самарием 153Sm при метастатических поражениях костей: автореф. дисс. д-ра мед. наук. Обнинск, 40 с.
2. Лосева Н.А. (1998) Современные методы оценки состояния онкологических больных, страдающих хронической болью. Паллиат. медиц. и реабил.,1: 28–37.
3. Модников О.П., Новиков Г.А., Родионов В.В. (2004) Современные подходы к лечению множественного метастатического поражения костей. Курс лекций по паллиативной помощи онкологическим больным. Курс лекций по паллиативной помощи онкологическим больным / Под ред. Новикова Г.А. 1. Москва: 493–541.
4. Цыб А.Ф., Крылов В.В., Дроздовский Б.Я. и др. (2006) Радионуклидная терапия самарием оксабифором, 153Sm при раке молочной и предстательной железы с метастазами в кости. Сиб. онкол.журнал, 4(19): 8–17.
5. Шляпак И.П, Ярошин Е. (2004) Лечение болевого синдрома в онкологии, Издательство «ИнтелТек» Петрозаводск, 8 с.
6. Body J., Bartl R., Burckhardt P. et al. (1998) Current use of bisphosphonates in oncology: International Bone and Cancer Study Group. J. Clin. Oncol., 16: 3890–3899.
7. Choong P.F. (2003) The molecular basis of skeletal metastases. Clin. Orthop., 41: 19–31.
8. Dafermou A., Columassi P., Giganti M. et al. (2001) A multicentre observational study of radionuclide therapy in patients with painful bone metastases of prostate cancer. Eur. J. Nucl. Med., 28: 788–798.
9. Hamdy N.A., Papapoulos S.E. (2001) The palliative management of skeletal metastases in prostate cancer: use of bone-seeking radionuclides and bisphosphonates. Semin. Nucl. Med., 31: 62–68.
10. Heron D. E., Brufsky A., Beriwal S. et al. (2008) Myelotoxicity of samarium Sm 153 lexidronam in patients receiving prior treatment with chemotherapy or radiotherapy. Ann. Oncol., 19: 1639–1643.
11. Houfu Deng, Tianzhi Tan, Shuenzhong Luo (2002) Radiopharmaceutical (Sm-153-EDTMP) therapy of skeletal metastases: clinical application in 350 patients. The J. Radiol., 44: 1637–1644.
12. Hoskin P.J., Ford H.T., Harmer C.L. (1989) Hemibody irradiation (HBI) for metastatic bone pain in two histological distinct groups of patients. Clin. Oncol., 1: 67–69.
13. Hoskin P.J., Stratford M.R., Folkes L.K. et al. (2000) Effect of local radiotherapy for bone pain on urinary markers of osteoclast activity. Lancet, 355: 1428–1429.
14. Lele R.D. (2009) Principles and Practice of Nuclear Medicine and Correlative Medical Imaging. Toronto, 472 c.
15. Marcus C., Saeed S., Mlikotic A. et al. (2002) Lack of effect of a bisphosphonate (pamidronate disodium) infusion on subsequent skeletal uptake of Sm-153-EDTMP. Clin. Nucl. Med., 27: 427–430.
16. Major P., Lortholary A., Hon J. et al. (2001) Zoledronic acid is superior to pamidronate in the treatment of hypercalcemia of malignancy: a pooled analysis of two randomized, controlled clinical trials. J. Clin. Oncol., 19: 558–567.
17. McCloskey E.V., MacLennan I., Drayson M. et al. (1998) Effect of clodronate on morbidity and mortality in myelomatosis. Br. J. Haematol., 100: 317–325.
18. Menda Y., Bushnell D.L., Williams R.D. (2000) Efficacy and safety of repeated samarium-153 lexidronam treatment in a patient with prostate cancer and metastatic bone pain. Clin. Nucl. Med., 25: 698–700.
19. Newling D., Denis L., Vermeylen K. (1993) Orchiectomy versus goserelin and flutamide in the treatment of newly diagnosed metastatic prostate cancer: analysis of the criteria of evaluation used in the European Organization for Research and Treatment of Cancer-Genitourinary Group Study 30853. Cancer., 72: 3793–3798.
20. Quilty P., Kirk D., Bolger J. et al. (1994) A comparison of the palliative effects of strontium-89 and external beam radiotherapy in metastatic prostate cancer. Radiother. Oncol., 31: 33–40.
21. Palmedo H., Guhlke S., Bender H. et al. (2000) Dose escalation study with rhenium-188 hydroxyethylidene diphosphonate in prostate cancer patients with osseous metastases. Eur. J. Nucl. Med., 27: 123–130.
22. Palmedo H., Manka-Waluch A., Albers P. et al. (2003) Repeated bone-targeted therapy for hormone-refractory prostate carcinoma: randomized phase II trial with the new, high-energy radiopharmaceutical rhenium-188 hydroxyethylidenediphosphonate. J. Clin. Oncol., 21: 2869–2875.
23. Powles T.S., Paterson S., Kanis J.A. et al. (2002) Randomized, placebo-controlled trial of clodronate in patients with primary operable breast cancer. J. Clin. Oncol., 20: 3219–3224.
24. Pandit-Taskar N., Batraki M., Divgi Ch. et al. (2004) Radiopharmaceutical Therapy for Palliation of Bone Pain from Osseous Metastases. J. Nucl. Med., 45: 1358–1364.
25. Reid I.R., Brown J.P., Burckhardt P.N. et al. (2002) Intravenous zoledronic acid in postmenopausal women with low bone mineral densit. N. Engl. J. Med., 346: 653–661.
26. Russo L.P. (2001) Analysis of skeletal-related events in breast cancer and response to therapy. Semin. Oncol., 28: 22–27.
27. Silberstein E.B., Buscombe J.R., McEwans A., Taylor A.T. (2003) Society of nuclear medicine procedure guideline for palliative treatment of painful bone metastases. Society of nuclear medicine procedure guidelines manual, 145–153.














Leave a comment