Неоад’ювантна внутрішньоартеріальна хіміотерапія хворих на саркоми кісток кінцівок і таза
Югринов О.Г., Дедков А.Г., Новак Е.М., Ковальчук П.А., Бойчук С.И., Супруненко А.А.
Резюме. Серед первинних злоякісних новоутворень кісток скелета найбільш часто зустрічається остеосаркома. Хвороба частіше вражає дітей та молодь. Більш ніж у половині спостережень процес локалізується в кістках, що формують колінний суглоб. Висока частота розвитку рецидиву та ймовірність гематогенного метастазування обумовлюють необхідність застосування в передопераційний період неоад’ювантної хіміотерапії. Вона складається з системного введення цитостатиків і регіонарної внутрішньоартеріальної інфузії. Застосування методик внутрішньоартеріальної інфузії хіміопрепаратів має низку незаперечних переваг: дозволяє створити тривалу стійку концентрацію цитостатиків у зоні пухлинного ураження; забезпечує безпосередній контакт і абсорбцію цитостатиків пухлинними клітинами на всіх стадіях клітинного циклу; рання циторедуктивна хіміотерапія здатна зменшити ризик виникнення хіміорезистентності та, як наслідок цього, розвитку метастатичної стадії захворювання; безпосередній локальний клінічний ефект досягається негайно; загальнорезорбтивні побічні дії введених препаратів значно зменшуються. Мета дослідження полягає в розробці нових підходів до призначення передопераційних курсів хіміотерапії хворим із саркомами кісток для того, щоб передбачити гістологічну відповідь пухлини та індивідуалізувати тривалість курсів хіміотерапії. Лікувальний патоморфоз пухлини оцінювався на підставі інгібіції рівня пухлинної неоваскуляризації, визначеної під час послідовного серійного ангіографічного дослідження.
Резюме. Среди первичных злокачественных новообразований костей скелета наиболее часто встречается остеосаркома. Заболевание возникает в основном у детей и лиц молодого возраста. Более чем в половине наблюдений процесс локализуется в костях, формирующих коленный сустав. Высокая частота развития рецидива и вероятность гематогенного метастазирования обусловливает необходимость применения в предоперационный период неоадъювантной химиотерапии. Она включает системное введение цитостатиков и регионарную внутриартериальную инфузию. Применение методик внутриартериальной инфузии химиопрепаратов имеет ряд неоспоримых преимуществ: позволяет создать длительную стойкую концентрацию цитостатиков в зоне опухолевого поражения; обеспечивает непосредственный контакт и абсорбцию цитостатиков с опухолевыми клетками на всех стадиях клеточного цикла; ранняя циторедуктивная химиотерапия способна понизить риск возникновения химиорезистентности и, как следствие этого, развития метастатической стадии заболевания; непосредственный локальный клинический эффект достигается незамедлительно; общерезорбтивные побочные действия вводимых препаратов значительно уменьшаются. Цель исследования заключается в разработке нового подхода при назначении предоперационных курсов химиотерапии больным с саркомами костей для того, чтобы предсказать гистологический ответ опухоли и индивидуализировать продолжительность курсов химиотерапии. Лечебный патоморфоз опухоли оценивался на основании ингибиции уровня опухолевой неоваскуляризации, зарегистрированной во время серийного ангиографического исследования.
Материалы и методы

Неоадъювантная внутриартериальная химиотерапия выполнена у 104 больных с неметастатическими саркомами костей конечностей и таза. Опухоли локализовались у 75 больных в длинных трубчатых костях нижних и у 15 — верхних конечностей. Кроме того, у 1 больного опухоль исходила из пяточной кости и у 1 — из костей запястья. У 12 больных опухоли были тазовой локализации, у 10 — они исходили из подвздошной кости с вовлечением в процесс крестцово-подвздошного сочленения и у 2 — из лонной кости.
Исследование было проведено с использованием усиленной дозы цисплатина в виде внутриартериальной химиотерапии в сочетании с внутривенным введением адрибластина, метотрексата.
Предварительно у всех больных была осуществлена диагностическая периферическая ангиография или тазовая артериография. На артериограммах оценивали интенсивность неоваскуляризации в опухоли и уровень ингибиции ее в процессе лечения.
Артериографическая реакция являлась отправной точкой для перехода к хирургическому этапу лечения.
Введения химиопрепаратов проводили с 3-недельным интервалом. В среднем количество неоадъювантных курсов химиотерапии было равно 4, максимально — 6. Внутриартериальная доза цисплатина повышалась, если после 4-го курса сочетанной химиотерапии на ангиограммах регистрировали уменьшение уровня опухолевой неоваскуляризации меньше чем на 90%.
Методики катетеризации и ангиографии периферических артерий. Селективная тазовая артериография.
Для катетеризации периферических артерий в зависимости от локализации опухоли кости применяли следующие методики:
- антеградная катетеризация бедренных артерий;
- контралатеральная катетеризация подвздошных и бедренных артерий;
- антеградная катетеризация подвздошных и бедренных артерий доступом через подмышечную артерию;
- антеградная катетеризация подключичных, плечевых артерий доступом через бедренную артерию.
Антеградная катетеризация бедренных артерий применялась при опухолях:
- дистального отдела бедренной кости (рис. 1.);
- большеберцовой и малоберцовой костей;
- костей стопы.
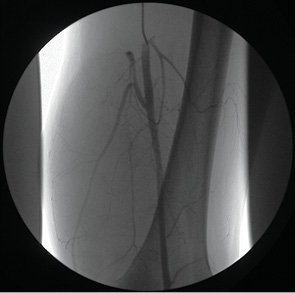
Бедренную артерию пунктировали антеградным доступом под контролем рентгеновского экрана. Направление хода пункционной иглы должно совпадать с проекцией верхнемедиального отдела головки бедренной кости. Продвижение проводника в подколенную артерию убеждало в правильности катетеризации искомого сосуда.
Контралатеральная катетеризация подвздошных и бедренных артерий применялась при опухолях:
- костей таза (рис. 2.);
- проксимального отдела бедренной кости;
- костей голени или стопы при вынужденном положении конечности.
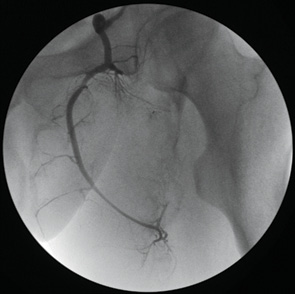
Последовательность выполнения прецизионных манипуляций катетером во время контралатеральной катетеризации состояла из следующих этапов:
- пункции бедренной артерии с контралатеральной стороны и установки катетера «Соrdis» «Соbra»-3, F-5 в абдоминальный отдел аорты;
- формирования длинной свободной петли в дистальном отделе катетера путем установки в одну из почечных артерий и продвижения созданной конструкции в краниальном направлении;
- низведения сформированной петли катетера до бифуркации аорты с последующим проведением выходного отдела его в контралатеральную наружную подвздошную артерию;
- доставки катетера на проводнике в порядковые ветви контралатеральной внутренней подвздошной артерии или в бедренную артерию.
Антеградная катетеризация подвздошных и бедренных артерий доступом через подмышечную артерию.
Показанием к выполнению антеградной катетеризации сосудов нижних конечностей и таза являлась невозможность чрескожной пункции бедренных артерий из-за распространенности патологического процесса, выраженности болевого синдрома, вынужденного положения больного.
При антеградной катетеризации возможно исследование подвздошных и бедренных артерий как на правой, так и на левой стороне. Преимуществом выбранного подхода также является отсутствие необходимости соблюдения больным постельного режима. К числу отрицательных моментов антеградной катетеризации относится большая частота осложнений при чрескожной пункции подмышечной артерии вследствие спазма искомого сосуда, травматизации волокон плечевого нервного сплетения.
Для антеградной катетеризации сосудов таза выбирали обычно левую руку. Ее отводили за голову на 90°. Подмышечную артерию фиксировали путем прижатия к плечевой кости. Под контролем телеэкрана пункционную иглу продвигали под углом 30–45° в направлении медиального отдела головки плечевой кости. После получения пульсирующей струи крови вводили проводник до уровня дуги аорты. По проводнику низводили диагностический катетер и устанавливали в афферентный сосуд опухоли.
Антеградная катетеризация подключичных и плечевых артерий доступом через бедренную артерию.
Чрескожно пунктировали правую бедренную артерию и заводили катетер JR, 3,5 F-5 «Terumo». Его продвигали в краниальном направлении и оставляли в дуге аорты, где отыскивали устье левой подключичной артерии или плечеголовного ствола и проводили ангиографическое исследование (рис. 3). Если имела место опухоль плечевой кости, то идентифицировали артерию, огибающую головку плечевой кости и катетер оставляли в устье. При наличии опухоли костей предплечья или кисти катетер низводили в дистальный отдел плечевой артерии и выполняли длительную инфузию цисплатина.
Проще выполнить катетеризацию левой подключичной артерии, отходящей самостоятельно от дуги аорты. На правой стороне катетеризацию подключичной артерии лучше проводить катетером на проводнике.
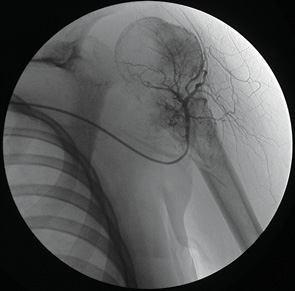
Селективная тазовая артериография доступом через бедренную артерию на стороне опухолевого поражения.
Показанием к катетеризации тазовых артерий, участвующих в кровоснабжении опухоли подвздошной кости доступом через бедренную артерию на стороне поражения было главным образом желание не подвергать травме здоровую конечность (рис. 4).
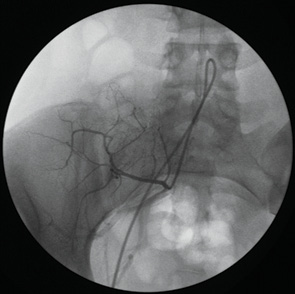
Пунктировали бедренную артерию на стороне опухолевого поражения. Вводили катетер «Соrdis» «Соbra»-3, F-5 и формировали в просвете аорты длинную незамкнутую петлю. Профилированный катетер низводили в общую подвздошную артерию на стороне поражения и отыскивали устье внутренней подвздошной артерии. После артериографии искомой артерии идентифицировали ствол афферентной артерии опухоли и выполняли селективную инфузию цитостатика.
Режим комбинированной неоадъювантной химиотерапии.
Использовали повторяющиеся инфузии эффективных для сарком костей цитостатиков в определенной последовательности внутривенно и внутриартериально. Системную химиотерапию обеспечивали посредством имплантации специального устройства центрального венозного доступа (порта). Длительную инфузию цисплатина проводили по утвержденному протоколу.
Первый курс комбинированной неоадъювантной химиотерапии:
- 1 и 2 дни по 60 мг/м² цисплатина в виде внутриартериальной инфузии (суммарно 120 мг/м²) в течение 6 ч;
- 3 и 4 дни по 30 мг/м² доксорубицина в виде внутривенной инфузии (суммарно 60 мг/м²) в течение 6 ч.
Второй курс неоадъювантной химиотерапии (через 3 нед):
- 1200 мг/м² метотрексата в виде 4-часовой внутривенной инфузии.
Третий курс неоадъювантной химиотерапии (через 3 нед):
- 1200 мг/м² метотрексата в виде 4-часовой внутривенной инфузии.
Четвертый курс комбинированной неоадъювантной химиотерапии (через 3 нед):
- 1 и 2 дни по 60 мг/м² цисплатина в виде внутриартериальной инфузии (суммарно120 мг/м²) в течение 6 ч;
- 3 и 4 дни по 30 мг/м² доксорубицина в виде внутривенной инфузии (суммарно 60 мг/м²) в течение 6 ч.
После 4-го курса неоадъювантной химиотерапии во время ангиографического исследования определяли динамику уровня ингибиции опухолевой неоваскуляризации. После оценки ангиографического ответа опухоли пациентов разделяли на 2 группы для дальнейшего индивидуального лечения.
В группе больных, у которых на ангиограммах имелось снижение уровня опухолевой неоваскуляризации более чем 90% по сравнению с исходным, через 2 нед проводили оперативное вмешательство.
В другой группе больных, у которых сохранились признаки опухолевой неоваскуляризации больше чем на 10% от предшествующего уровня, неоадъювантную химиотерапию продолжали в интенсивном режиме повышенными дозами цисплатина.
Пятый курс неоадъювантной химиотерапии (через 3 нед):
- 1 и 2 дни по 75 мг/м² цисплатина в виде внутриартериальной инфузии (суммарно 150 мг/м²) в течение 6 ч.
Шестой курс неоадъювантной химиотерапии (через 3 нед):
- 1 и 2 дни по 75 мг/м² цисплатина в виде внутриартериальной инфузии (суммарно 150 мг/м²) в течение 6 ч.
Настоящей категории больных после завершения индивидуального протокола лечения через 2 нед проводили оперативное вмешательство.
В послеоперационный период пациенты обеих групп получали адъювантную химиотерапию в течение 4–12 мес.
Диагностическая ангиография при опухолях костей конечностей и таза.
Диагностическое ангиографическое исследование проводили с целью выявления нарушения ангиоархитектоники предсуществующих сосудов, признаков опухолевой неоваскуляризации и определения уровня контрастирования паренхимы новообразования. Детально изучались источники кровоснабжения опухоли и их порядковые ветви. Обязательной задачей являлась также оценка состояния магистральных сосудов, уточнение размеров зоны опухолевого поражения и в частности внутрикостного и внекостного (мягкотканного) компонента опухоли (рис. 5).
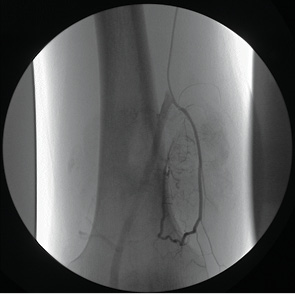
Диагностическая ангиография включала проведение периферической артериографии верхней или нижней конечности, тазовой артериографии, а также селективной и суперселективной артериографии стволов внутренней подвздошной артерии. Применяли армированные катетеры F-5 типа «Cobra», Hedhanter, Judkins Right 3,5, фирм «Тerumo» и «Сordis».
Методика имплантации инфузионного катетера в афферентные сосуды опухолей конечностей и таза.
Для внутриартериальной инфузии химиопрепаратов в опухоли костей конечностей и таза применяли инфузионные катетеры специального назначения Super Angiograph Catheter REF 532–420 T Open Ed 8 Side F-4 «Cordis».
Указанные катетеры имели в дистальном отделе от 2 до 8 боковых отверстий на разном расстоянии друг от друга, располагаясь по спирали. Для равномерного распределения химиопрепарата и исключения нежелательного поступления его в артериальные ветви, не принимающие участия в кровоснабжении зоны опухолевого поражения, обязательным являлся постоянный контроль положения катетера. Это в первую очередь касалось больных с опухолями костей верхних и нижних конечностей.
Если несмотря на пробное контрастирование опухоли в начале инфузии цисплатина развилась боль и парестезия конечности, пациента транспортировали в рентгеноперационную и проводили репозицию катетера. Если не развилось химико-токсическое локальное изменение кожи после инфузии цисплатина, то следующая курсовая инфузия производилась в той же позиции катетера по отношению к афферентным артериям опухоли, что и на исходной ангиограмме.
Все артериальные инфузии цисплатина проводили посредством капельного вливания с помощью автоматического дозатора лекарственных веществ фирмы B|Braun со скоростью 50 мл/ч.
Техника серийного ангиографического исследования сарком костей конечностей и таза.
Настоящее рентгеноконтрастное исследование сосудов опухолей костей конечностей и таза проводили в условиях использования автоматической системы визуализации в режиме цифровой субтракционной ангиографии.
Для серийного ангиографического исследования использовали исключительно неионные низкомолекулярные водорастворимые рентгеноконтрастные вещества (ультравист, омнипак). Количество его изменялось в зависимости от величины просвета катетеризированного сосуда. Для контрастирования общей или наружной подвздошной артерии его количество составляло 25 мл, бедренной артерии — 21 мл, подколенной артерии, артерий стопы — 20 мл. Для суперселективной артериографии обычно использовали 7–10 мл рентгеноконтрастного средства, введенного вручную. Для того, чтобы обеспечить «плотный» артериальный болюс рентгеноконтрастного средства продолжительность инъекции была строго ограничена 3 секундами. Скорость съемки была равной 2 кадрам в секунду.
Обычно получали 8–10 последовательных изображений сосудов для регистрации признаков опухолевой неоваскуляризации.
В артериальную фазу исследования наблюдали «тугое» заполнение рентгеноконтрастным веществом афферентных артерий опухоли.
В капиллярную фазу ангиографии имело место заполнение рентгеноконтрастным веществом сети новообразованных сосудов (опухолевая неоваскуляризация).
В паренхиматозную фазу исследования появлялось «окрашивание» паренхимы опухоли.
Методика оценки уровня ингибиции опухолевой неоваскуляризации во время серийного ангиографического исследования.
Чтобы устранить артефакты при текущем ангиографическом исследовании и для полноты сопоставления ангиографических картин, все изображения и параметры введения рентгеноконтрастного вещества, проведенные во время исходного исследования, были тщательно зарегистрированы и воспроизводились при каждом последующем исследовании.
Перед назначением каждой курсовой дозы цисплатина проводили серийное ангиографическое исследование по стандартной методике. Интенсивность опухолевой неоваскуляризации на исходной серийной ангиограмме рассматривалась и представлялась в виде 3 уровней:
- низкий (+)
- умеренный (++)
- высокий (+++)
Последующие артериограммы сравнивали с первичными, чтобы оценить изменения в уровне опухолевой неоваскуляризации как показатель ангиографического ответа опухоли на проведенное лечение.
Внутриартериальные курсы химиотерапии продолжали проводить до достижения одного из трех ангиографических критериев:
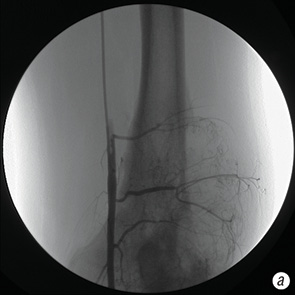
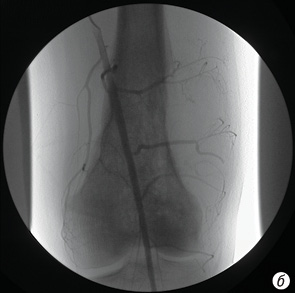
- фактически полное (более 90%) исчезновение опухолевой неоваскуляризации (рис. 6, а, б);
- начальный ангиографический ответ трансформировался в эффект плато (рис. 7, а, б, в);
- отсутствие эффекта или прогрессирование заболевания, когда имело место незначительное снижение уровня неоваскуляризации (не более 25%) или, соответственно, увеличение территории контрастирования патологических сосудов.
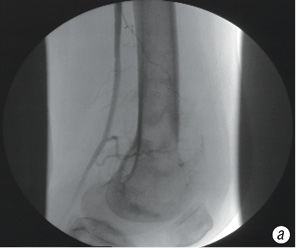
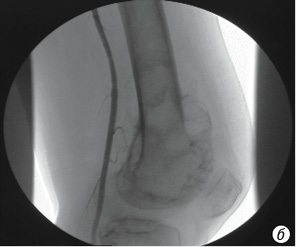
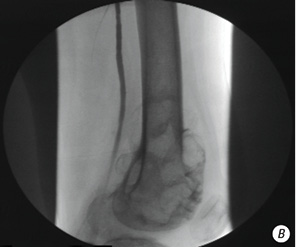
Эффект плато определялся как отсутствие какого-либо дальнейшего уменьшения опухолевой неоваскуляризации на последней ангиограмме после того, как на начальном этапе наблюдалось ее уменьшение.
Локальные осложнения, развивающиеся после проведения неоадъювантной внутриартериальной химиотерапии.
У 4 пациентов развился болезненный артериальный спазм во время введения рентгеноконтрастного вещества, который был устранен симптоматической терапией. У 3 пациентов возникла незначительная гематома в месте артериальной пункции, не потребовавшая большего вмешательства, чем создания локальной компрессии.
Инфузия цисплатина вызвала некроз мягких тканей в 3 наблюдениях. Эти пациенты требовали анальгезирующей терапии. У них была неотложно выполнена репозиция положения катетера. В последующем зона некроза была удалена во время радикальной операции. Ни у одного из пациентов не возник повторный эпизод некроза кожи при последующих инфузиях цисплатина. У 2 больных возник тромбоз глубоких вен голени на стороне, где проводили внутриартериальную химиотерапию. Симптомы воспаления сосудов в виде отека голени, болезненности при ходьбе появились через 10 дней после инфузионной процедуры. Была назначена и с успехом проведена антикоагулянтная и противовоспалительная терапия.
Результаты неоадъювантной внутриартериальной химиотерапии больных саркомами костей конечностей и таза.
Технический успех катетеризации и ангиографии периферических артерий и сосудов таза наблюдался у всех обследованных больных. При серийном ангиографическом исследовании изначально гиперваскулярная картина очага поражения выявлена у 58%, умеренно васкуляризированная — у 22% и гиповаскулярная — у 24% больных.
Отклонение хода магистрального ствола на уровне расположения мягкотканного компонента саркомы было зарегистрировано у 5 больных. Однако признаков непосредственного вовлечения в опухолевый процесс сосудистой стенки не было выявлено.
Всего 104 больных получили 583 ангиографические процедуры, сопровождаемые серийной ангиографией и инфузией цисплатина. 43 пациентам было назначено 4 минимальных курса инфузии цитостатика. 53 больным проведено по 5 и 16 — по 6 курсов комбинированной химиотерапии.
Хороший артериографический ответ, определенный как 90% уменьшение опухолевой неоваскуляризации, был достигнут у 86% больных.
Хороший гистологический ответ, определенный как 90% опухолевый некроз, был зарегистрирован у 82% больных.
Серийная артериография позволила прогнозировать хороший гистологический ответ с точностью до 89% и чувствительностью до 91%.
У 12 больных не был зарегистрирован полный артериографический ответ на неоадъювантную химиотерапию. После начального снижения опухолевой неоваскуляризации имел место эффект плато на уровне менее 90%.
В 3 случаях ангиографический прогноз не коррелировал с результатами патогистологического исследования. 1 пациент по прогнозам артериографии должен быть хорошим респондентом, но при гистологическом исследовании определили 20% остаточной жизнеспособной ткани опухоли. В 2 других случаях, по данным артериографии, процент некроза опухоли был оценен ниже 90%, но при гистологическом исследовании он превышал эту границу.
Обсуждение
Значимость серийных ангиографических исследований остеогенных сарком для оценки ответа опухоли во время неоадъювантной химиотерапии впервые была продемонстрирована в ряде научных работ в 80–90-х годах прошлого века [7, 8, 5, 4].
Были описаны ангиографические, патоморфологические и фармакологические эффекты внутриартериальной химиотерапии с цисплатином. Однако ангиографический показатель для перехода к хирургическому лечению выделен не был. Ангиографическое свидетельство ответа опухоли состояло в определенном снижении интенсивности неоваскуляризации, выражающейся в уменьшении количества, размера, извитости патологических сосудов или сокращении площади «затемнения» паренхимы на последовательных ангиограммах.
Фармакологические исследования продемонстрировали одинаковые уровни цисплатина в периферической крови при внутриартериальном и внутривенном введении. Однако концентрация препарата была в 2–5 раз выше в вене, дренирующей опухоль [10, 11].
В результате селективности воздействия обеспечивался так называемый эффект первого прохождения, когда примерно 40–50% препарата оставалось в данном регионе и только 50% попадало в общий кровоток. Чем селективнее (ближе к опухоли) установлен катетер, тем сильнее противоопухолевый эффект и меньше отрицательное действие на окружающие ткани.
Уточненную информацию в отношении описания ангиографического ответа на неоадъювантную химиотерапию приводят ряд авторов [12, 6]. Они считают, что идеальный положительный предоперационный терапевтический ответ представляет уменьшение опухолевой «тени» и неоваскуляризации на каждой последующей артериограмме до итоговой, на которой не осталось по существу никакой остаточной опухолевой неоваскуляризации (как минимум уменьшение ее на 90%). Последний серийный снимок отображает позднюю артериальную и раннюю капиллярную фазы заполнения. Эта позиция в артериографической серии оптимально представляет признаки опухолевой неоваскуляризации. Более поздние снимки в венозную фазу не показательны для характеристики опухолевого кровотока.
Выводы
1. Создана конкурентноспособная технология комбинированного лечения больных с саркомами костей конечностей и таза на основе разработки метода неоадъювантной внутриартериальной регионарной химиотерапии.
2. На исходных артериограммах опухолевая неоваскуляризация у 58% больных расценивалась как соответствующая гиперваскулярному, у 22% — как умеренно васкулярному и в 25% случаев — как гиповаскулярному очагу поражения.
3. Количество неоадъювантных курсов назначалось индивидуально и определялось артериографическим ответом. Лечение продолжали максимум до 6 курсов, затем устанавливали один из трех критериев:
- как минимум 90% уменьшение опухолевой неоваскуляризации;
- эффект плато определялся как отсутствие какого-либо дальнейшего уменьшения опухолевой неоваскуляризации на последней артериограмме после того, как на начальном этапе отмечали ее уменьшение;
- отсутствие эффекта или прогрессирование заболевания.
4. Артериографическая оценка эффекта лечения являлась отправной точкой для перехода к хирургическому этапу лечения. Операцию назначали, когда патологическая васкуляризация опухоли снизилась до минимальной на последней артериограмме.
5. Артериографический ответ, определенный как 90% уменьшение опухолевой неоваскуляризации был достигнут у 86% больных.
6. Гистологический ответ, определенный как 90% опухолевый некроз, был достигнут у 82% больных.
7. Серийные артериограммы позволяли прогнозировать хороший гистологический ответ с точностью до 89% и чувствительностью до 91%.
Заключение
«Атака» на сосуды опухоли с помощью цитостатических агентов, избирательно доставленных с использованием рентгеноэндоваскулярной технологии, составляет новое перспективное направление интервенционной онкологии. При внутриартериальной химиотерапии первичной мишенью терапевтических молекул является опухолевая неоваскуляризация. Васкулярный эндотелий представляет собой довольно уязвимый элемент опухолевой стромы, на который можно воздействовать непосредственно или опосредованно во время селективной инфузионной химиотерапии. Эндоваскулярное разрушение ангиоархитектоники опухоли предпочтительно в сравнении с другими методиками ингибиции опухолевого ангиогенеза, так как новообразованные сосуды отличаются от материнских несовершенством в строении и функции.
При ангиографическом исследовании патологические сосуды четко визуализируются, что позволяет оценить степень развития неоваскуляризации и предусмотреть подходы для применения средств и методов локальной ингибиции. Известен факт цитотоксической супрессии эндотелиальных клеток в пределах сосудистого ложа опухоли. Установлено, что некоторые цитотоксические препараты (циклофосфан, адрибластин, митоксантрон, цисплатин) не обладают антиангиогенным эффектом при болюсном их введении, но проявляют выраженные свойства ингибиции неоваскуляризации при продолжительных непрерывных инфузиях.
Литература
1. Долгушин Б.И., Виршке Э.Р., Кучинский Г.А., Мачак Г.Н. () Методические аспекты внутриартериальной регионарной химиотерапии при остеосаркомах костей конечностей. Саркомы костей, мягких тканей и опухоли кожи. Онкология, 2: 27–34.
2. Bacci G., Ferrari S., Tienghi A. et al. (2010) A comparison of methods of loco-regional chemotherapy combined with systemic chemotherapy as neoadjuvant treatment of osteosarcoma of the extremity. Eur. J. Surg. Oncology, 27: 98–104.
3. Benjamin R.S., Chawla S.P., Carrasco C.H. et al. (1992) Preoperative chemotherapy for osteosarcoma with intravenous adriamycin and intra-arterial cis-platinum. Ann. Oncology, Apr. 3. Suppl 2: 53–56.
4. Bilbao J.I., Algarra S.M. et al. (1990) Osteosarcoma: Correlation between radiological and histological changes after intra-arterial chemotherapy. Eur. J. Radiol., 11: 98–107.
5. Carrasco C.H., Charnsangavej C., Raymond A.K. et al. (1989) Osteosarcoma: angiographic assessment of response to preoperative chemotherapy. Radiology, 170 (3 Pt1): 839–842.
6. Cullen J.W., Jamroz B.A., Stevens S.L. et al. (2005) The value of serial arteriography in osteosarcoma: delivery of therapy duration, and prediction of necrosis // J. Vascular Inter. Radiol., 16: 1107–1119.
7. Jaffe N., Knapp J., Chuang V.P. et al. (1983) Osteosarcoma: Intra-arterial treatment of the primary tumor with Cis-DiammineDichloroplatinum (CDP): Aniographic, pathologic and pharmacologic studies. Cancer, 51: 402–407.
8. Jaffe N., Raymond A.K., Ayala A. et al. (1989) Effect of cumulative courses of Intraarterial cisdiaminedichloroplatin-II on the primary tumor i osteosarcoma. Cancer, 63: 63–67.
9. Rha S.Y., Chung H.C., Gong S.J. et al. (1999) Combined pre-operative chemotherapy with intra-arterial cisplatin and continuous intravenous adriamycin for high grade osteosarcoma. Oncology Rep., 6: 631–637.
10. Stewart D.J., Benjamin R.S., Zimmerman S. et al. (1983) Clinical Pharmacology of Intraarterial cis-Diamminedichloroplatinum. Cancer Research., 43: 917–920.
11. Stewart D.J. (1989) Pros and cons of intra-arterial chemotherapy. Oncology, 3: 20–26.
12. Wilkins R.M., Cullen J.W., Odom L. et al. (2003)Superior survival in treatment of primary nonmetastatic pediatric osteosarcoma of the extremity. Ann. Surg. Oncology, 10: 498–507.
13. Winkler K., Bielack S., Delling G. et al. (1990) Effect of intra-arterial versus intravenous cisplatin in addition to systemic doxorubicin, high–dose methotrexate and ifosfamide on histologic tumor response in osteosarcoma (Study OOSS–86). Cancer, 66: 1703–
1710.














Leave a comment