Дивертивная илеостома при левосторонних колоректальных резекциях: ретроспективный анализ и обзор литературы
Скорый Д.И., Ильин Е.А., Трегуб Е.С.
Резюме. Вступление. Несостоятельность колоректального анастомоза (НА) является одним из основных осложнений в хирургии ободочной и прямой кишки. Частота НА достигает 11% после передних резекций прямой кишки. Множество методик снижения риска НА было предложено для колоректальной хирургии. Одной из них является проксимальное дивертирование стула путем наложения дефункционирующей стомы. Материалы. Был проведен ретроспективный анализ историй болезни 73 пациентов, которым были выполнены различные варианты реконструктивных резекций левой половины ободочной и прямой кишки с наложением дивертивных стом по поводу злокачественной и доброкачественной патологии прямой или ободочной кишки, внутренних женских половых органов в 2018–2020 гг. в КНП «Областной центр онкологии», г. Харьков. Результаты. Частота НА составила 4,1%, клинически значимой — 2,7%. Илеостома была выбрана для дивертирования в 72 случаях. Среднее время до закрытия стомы составило 117 сут. Доля пациентов, которым были закрыты стомы на момент анализа составила 86,3%; 76,7% стом были закрыты с интервалом до 6 мес включительно. Осложнения III класса и более по Clavien — Dindo после закрытия стом развились у 6,1% пациентов. Выводы. Наложение дивертивной стомы эффективно снижает частоту клинически значимой НА при левосторонних колоректальных резекциях. Илеостома является более предпочтительной, чем колостома. Рутинное использование дивертивных илеостом в практике легко имплементируемо и позволяет достичь частоты НА, сопоставимой с результатами знаковых рандомизированных исследований и ретроспективных анализов крупных центров.
DOI: 10.32471/clinicaloncology.2663-466X.39-3.27397
Получено: 23.10.2020
Принято в печать: 10.11.2020
Вступление
Согласно определению International Study Group of Rectal Cancer, несостоятельностью колоректального анастомоза (НА)после передней резекции прямой кишки является сообщение между экстра- и интралюминальными компартментами ввиду нарушенной целостности кишечной стенки в области анастомоза между ободочной и прямой кишкой или ободочной кишкой и анусом, нарушенной целостности линии шва прямокишечного резервуара (например J-pouch), а также наличие тазового абсцесса вблизи анастомоза, без уточнения целостности последнего [1].
НА занимает одно из основных мест в структуре послеоперационных осложнений в колоректальной хирургии. Частота НА после резекций правой половины толстой кишки составляет 8% [2] и достигает 11% в хирургии рака прямой кишки, по данным метаанализа, включавшего 84 исследования [3]. Согласно упомянутому консенсусу International Study Group of Rectal Cancer, НА разделяют в зависимости от влияния на течение послеоперационного периода на 3 категории: А — не требующая вмешательств, В — требующая активных терапевтических вмешательств, но не требующая релапаротомии, С — требующая релапаротомии [1].
НА, помимо финансовой нагрузки на пациента и систему здравоохранения, связана с риском долгосрочного снижения качества жизни пациента из-за необходимости наложения постоянной колостомы или, при успешном сохранении анастомоза, с повышением риска развития синдрома низкой передней резекции (данные о последнем, однако, неоднозначны) [4, 5].
Кроме того, в хирургии рака прямой кишки НА может иметь влияние на результаты лечения пациента — послеоперационные осложнения отсрочивают или исключают возможность проведения адъювантной химиотерапии. Более того, систематический обзор и метаанализ 43 нерандомизированных исследований продемонстрировал повышение риска локального рецидива (отношение рисков (ОР) 1,90) и снижение безрецидивной и общей выживаемости (ОР 1,40 и 1,36 соответственно) у пациентов с колоректальным раком с НА, без влияния на частоту отдаленных рецидивов [6].
Проблема НА в колоректальной хирургии актуальна, было предложено множество способов снижения риска НА. Однако лишь немногие из них оказались эффективными. Условно меры по снижению риска НА можно подразделить на пред-, интра- и постоперационные.
К предоперационным мерам относится учет немодифицируемых факторов риска НА с целью тщательной селекции пациентов для реконструкции и рассмотрения целесообразности выполнения обструктивной операции, и коррекция модифицируемых факторов риска. К факторам риска НА относятся: мужской пол, курение, употребление алкоголя, ожирение, плохой нутритивный статус, гипоальбуминемия <35 г/л, анемия <80 г/л, выполнение гемотрансфузий пре- и интраоперационно, прием иммуносупрессантов, применение бевацизумаба, сопутствующие заболевания, местнораспространенный и метастатический рак, ургентный характер операции, длительность операции более 4 ч, ранний период после лучевой терапии, особенно 11–17-е сутки после короткого курса, что было показано в исследовании Stokholm III [7, 8].
Частично эти факторы риска учитываются и корригируются в программах ускоренного восстановления после операций (Enhanced recovery after surgery — ERAS). Тем не менее, нет четкого понимания, влияет ли следование ERAS-протоколам на риск возникновения НА. Несмотря на достоверное снижение частоты послеоперационных осложнений при имплементации ERAS, значимые отличия были показаны для нехирургических осложнений, а влияние на хирургические осложнения и НА предстоит изучить в будущем [9]. Предоперационная механическая подготовка (МПК) и деконтаминация кишечника (ДК) являются спорным моментом в профилактике НА. В ретроспективном анализе информации о 27 804 пациентах из базы данных ACS-NSQIP было показано достоверное снижение частоты НА при использовании как МПК+ДК (ОР 0,53), так и только ДК (ОР 0,53) [10]. Недавний метаанализ 40 исследований, из которых 28 были рандомизированными, продемонстрировал достоверное снижение риска НА при использовании МПК+ДК по сравнению только с МПК (ОР 0,62). В то же время не было отмечено разницы при сравнении групп МПК+ДК и только с ДК [11].
Таким образом, вопрос о необходимости МПК остается открытым, однако мы имеем достаточно данных о пользе пероральной ДК как для снижения риска НА, так и других послеоперационных инфекционных осложнений. К примеру, опубликованные в 2020 г. результаты рандомизированного исследования ORALEV, в ходе которого сравнивали ДК с ее отсутствием, без МПК, продемонстрировали достоверное снижение частоты инфекционных раневых осложнений в группе ДК [12].
Значение миниинвазивного подхода для снижения риска НА неоднозначно. Метаанализ Кокрэйн (2014 г.) не показал отличий в частоте НА в 10 рандомизированных исследованиях, в которых сравнивали лапароскопический и открытый подход к тотальной мезоректумэктомии по поводу рака прямой кишки [13].
Исследование ROLARR также не продемонстрировало существенных различий в частоте гастроинтестинальных послеоперационных осложнений, в том числе НА, между роботической и лапароскопической хирургией рака прямой кишки [14].
Техника наложения колоректального анастомоза, по всей видимости, так же не оказывает значимого влияния на частоту НА. Метаанализ рандомизированных исследований Кокрэйн (2012 г.) не показал различий в частоте НА при сравнении ручного и степлерного анастомоза [15].
Нет никаких убедительных данных о различиях в частоте НА между разными способами конструкции анастомоза — бок-в-конец, конец-в-конец, конец-в-бок или бок-в-бок.
Однако было отмечено, что, используя методику двойного прошивания (double-stapling technique), которая подразумевает пересечение дистальной границы резекции прямой кишки с помощью линейного степлера, с последующим заведением головки циркулярного степлера через анус и выведением стержня аппарата через или вблизи середины шовной линии, риск НА может коррелировать с количеством прошиваний, потребовавшихся для пересечения прямой кишки. В австрийском ретроспективном исследовании было показано, что использование трех и более кассет для пересечения прямой кишки было единственным фактором, связанным с повышением риска несостоятельности анастомоза [16]. Сходные данные были ранее опубликованы японскими учеными [17].
В открытой хирургии множественного прошивания культи прямой кишки зачастую удается избежать благодаря возможности использования гильотинных линейных степлеров с ограничителем.
Методы интраоперационной оценки анастомоза варьируют от простых и не затратных до новейших, основанных на технологиях дополненной реальности. Историческая методика оценки кровотока в краевой артерии в месте проксимального пересечения ободочной кишки, предложенная J. Novell и A. Lewis [18], остается широко применяемой и сегодня, поскольку не требует финансовых и временных затрат и может рутинно использоваться как при экстра-, так и интракорпоральном формировании культи низводимой кишки.
Воздушная проба на герметичность продемонстрировала в метаанализе снижение риска НА, но эта разница не достигла статистической достоверности [19]. Тем не менее, частота положительной пробы в исследованиях варьировала от 1,5% до 24,7%, а итальянская группа авторов в более позднем ретроспективном анализе продемонстрировала как наличие статистически значимой разницы в частоте НА, так и возможность менять хирургическую тактику в пользу наложения дивертивной стомы при положительном результате воздушной пробы [20].
Среди современных методов интраоперационной оценки самым популярным является тест с индоцианином зеленым. На сегодня нет данных рандомизированных исследований относительно эффективности его применения, но метаанализ нерандомизированных данных говорит о возможной пользе теста для снижения риска НА [21].
Трансанальное декомпрессионное дренирование колоректального анастомоза оказалось эффективным методом снижения риска НА после низкой передней резекции прямой кишки, по данным метаанализа (ОР 0,44) [22]. Применение трансанального дренирования продемонстрировало сходное с наложением дивертивной стомы влияние на частоту НА, однако последствия случившихся НА оказались менее серьезными при использовании дивертивной стомы в виде снижения частоты релапаротомий при развитии НА [23].
Рутинное применение абдоминальных дренажей к зоне низкого анастомоза не продемонстрировало преимущество в плане предотвращения НА ни в одном метаанализе [24–26]. Тем не менее, один метаанализ, при отсутствии разницы в частоте НА, показал значительно меньшую частоту релапаротомий и послеоперационную смертность среди дренированных пациентов (ОР 2,28) [27].
Тазовая перитонизация после резекции прямой кишки была предложена для снижения тяжести НА. На сегодня нет качественных данных, подтверждающих пользу данной методики. В одном китайском ретроспективном исследовании была продемонстрирована значимо меньшая частота НА в группе перитонизации; теоретическим основанием авторы считают снижение натяжения в анастомозе за счет механической фиксации низведенной кишки к брюшине таза [28]. В другом ретроспективном исследовании авторы, используя метод псевдорандомизации, продемонстрировали значимое снижение частоты реопераций по поводу НА и затрат на лечение в группе перитонизации, при отсутствии различий в частоте НА между группами [29]. Этой же исследовательской группой в 2018 г. было инициировано проспективное рандомизированное исследование тазовой перитонизации после роботической низкой передней резекции прямой кишки; результаты пока не опубликованы [30].
Наложение дивертивных стом для защиты колоректального анастомоза является предметом активных дискуссий. С одной стороны, имеется большое количество данных в пользу влияния дивертивной стомы как на риск развития, так и на тяжесть течения НА. С другой стороны, наложение дивертивной стомы может быть связано с риском специфических перистомальных осложнений, дегидратации, осложнениями операции по закрытию стомы. Более того, дивертивная стома никогда не будет закрыта у части пациентов — 10% дивертивных петлевых илеостом остались перманентными в шведском многоцентровом рандомизированном исследовании. Основными причинами этого стали прогрессирование первичного рака прямой кишки, аноректальная дисфункция, неудовлетворительный соматический статус пациента и другие [31].
Метаанализ Кокрэйн 2009 г., включающий 6 рандомизированных клинических исследований, продемонстрировал значительное снижение риска НА (ОР 0,33) и ургентного повторного вмешательства (ОР 0,23) без достоверного влияния на послеоперационную летальность при наложении дивертивных илеостом после низкой передней резекции по поводу рака прямой кишки [32]. В группе илеостом частота НА составила 6,3%, тогда как в группе контроля — 19,6%.
Китайский метаанализ 4 рандомизированных и 9 нерандомизированных исследований, опубликованный в 2015 г., показал аналогичные результаты: снижение риска НА (ОР 0,47) и релапаротомии (ОР 0,36) при использовании дивертивных стом при низкой передней резекции прямой кишки [33].
Снижение тяжести НА в виде уменьшения количества Grade C в пользу В и А в группах дивертивных стом было неоднократно продемонстрировано в литературе [34–36]. Y. Xu и соавторы в публикации 2017 г. продемонстрировали уменьшение времени до восстановления анастомоза при развитии нетяжелых несостоятельностей в группе пациентов с дивертивными илеостомами (20,7 дней vs 16,1 дней, p=0,031) [37].
Материалы и методы
Был проведен ретроспективный анализ 73 случаев наложения дивертивной стомы после левосторонних колоректальных резекций у пациентов со злокачественными и доброкачественными новообразованиями прямой и ободочной кишки, внутренних женских половых органов, которые находились на лечении в онкохирургическом отделении желудочно-кишечного тракта КНП «Областной центр онкологии», Харьков с 2018 по 2020 г. Мужчин было 43 (58,9%), женщин — 30 (41,1%).
В анализ вошли случаи наложения дивертивной стомы независимо от характера выполненной операции и основного заболевания. Абсолютными показаниями для наложения дивертивной стомы мы считаем низкую переднюю резекцию прямой кишки и переднюю резекцию кишки с колоректальным анастомозом ниже уровня крестцового мыса. Относительным считается субъективное мнение оперирующего хирурга, основанное на объеме хирургического вмешательства, соматическом статусе пациента и других необъективизируемых интра- и предоперационных факторах.
Были проанализированы: частота несостоятельности колоректального анастомоза, осложнения, связанные с дивертивной стомой, время до закрытия стомы. Осложнения первичной операции, не связанные с дивертивной стомой, не анализировались, поскольку находятся вне сферы интересов данного исследования.
Осложнения были стратифицированы по системе Clavien — Dindo. Случаи несостоятельности колоректального анастомоза стратифицированы по критериям International Study Group of Rectal Cancer.
Время до закрытия стомы определялось хирургом с учетом пожелания пациента в зависимости от состояния больного, необходимости проведения адъювантной химиотерапии, а также после контроля состояния колоректального анастомоза (если таковой имелся) посредством эндоскопии или КТ-проктографии.
Результаты
Из 73 случаев в 72 была наложена дивертивная илеостома, в 1 — трансверзостома. Выбор в пользу трансверзостомы в данном случае был обусловлен характером оперативного вмешательства — тотальная тазовая экзентерация с деривацией мочи по Бриккеру. В связи с забором сегмента подвздошной кишки для формирования илеокондуита по Бриккеру для предотвращения эксикоза вследствие мальабсорбции жидкости было принято решение о наложении стомы дистальнее по кишечному тракту.
51 случай наложения дивертивных стом был связан с передними и низкими передними резекциями прямой кишки; 7 случаев дивертивных стом — при выполнении тазовых экзентераций; 3 пациентам была наложена дивертивная стома в ходе реконструкции после операции Гартмана; 10 случаев — при высоких левосторонних резекциях ободочной кишки; 1 случай — при тотальной колэктомии с илеоректоанастомозом с формированием J-pouch; 1 дивертивная стома была наложена при релапаротомии по поводу несостоятельности недивертиванного анастомоза после сигмоидэктомии — дефект в последнем был ушит и защищен илеостомой (табл. 1).
Таблица 1. Характеристика наложения дивертивных стом в зависимости от вида первичной операции
| Вид оперативного вмешательства | Количество |
| Тотальная мезоректумэктомия | 38 |
| Тумор-специфическая мезоректумэктомия | 13 |
| Сигмоидэктомия | 6 |
| Реконструкция Гартмана | 3 |
| Задняя экзентерация | 5 |
| Тотальная экзентерация | 2 |
| Ушивание несостоятельности + илеостома | 1 |
| Субтотальная колэктомия | 1 |
| Тотальная колэктомия + J-pouch | 1 |
| Левосторонняя гемиколэктомия | 3 |
Характеристика состояний, по поводу которых выполнялись первичные оперативные вмешательства, представлена в табл. 2.
Таблица 2. Характеристика диагнозов, по поводу которых были выполнены оперативные вмешательства с наложением дивертивной стомы
| Диагноз | Количество |
| Рак прямой кишки | 39 |
| Рак ректосигмоидного отдела | 7 |
| Рак ободочной кишки | 22 |
| Рак яичников | 1 |
| Воспалительные заболевания малого таза | 1 |
| Реконструкция Гартмана | 3 |
Несостоятельность анастомоза развилась у 3 пациентов. 1 случай НА Grade A был выявлен при рутинной КТ-проктографии перед закрытием илеостомы, и потребовал выжидательной тактики, после чего стома была закрыта. 1 случай Grade B требовал активных терапевтических вмешательств в объеме антибактериальной терапии и трансанального дренирования, илеостома не была закрыта на момент сбора материала. 1 случай Grade C потребовал релапаротомии в связи с внутрибрюшным кровотечением из несостоявшегося анастомоза и его разобщением. Дивертивная илеостома была закрыта в спокойный период, непрерывность толстого кишечника не была восстановлена. Общая частота выявленных НА составила 4,1%, клинически значимых (Grade B и C) — 2,7%.
При анализе исключительно случаев передней, низкой передней резекции прямой кишки и тазовой экзентерации, которые являются процедурами с наивысшим риском НА, частота клинически значимых НА составила 3,4%.
Для закрытия дивертивной стомы явились 90,4% пациентов. В 2 из 7 случаев незакрытия стомы она не была закрыта по причине осложнений, связанных с колоректальным анастомозом (1 НА, 1 стриктура). Остальные пациенты были потеряны из наблюдения. Кроме того, вследствие осложнений закрытия стомы у 2 пациентов были сформированы концевые илеостомы, которые не были закрыты, и у одного вследствие НА Grade C был разобщен колоректальный анастомоз и сформирована десцендостома. У последнего, несмотря на закрытие дивертивной илеостомы, сохранилась концевая десцендостома. В целом 86,3% пациентов лишились стомы на момент сбора материала.
Среднее время от первичной операции до закрытия стомы составило 117 сут (16,7 нед), медиана — 110,5 сут (15,8 нед), минимальное и максимальное время — 20 и 356 сут соответственно. Коэффициент закрытия стом на 3-й месяц составил 38,4%, на 6-й месяц — 76,7% (рисунок).
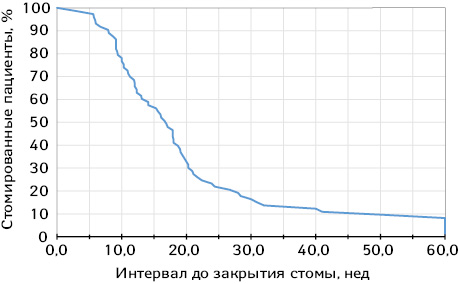
У 65 пациентов (98,4%) дивертивная стома была закрыта ручным методом, у 1 — степлерным. Развитие острого повреждения почек как осложнения, связанного с наличием дивертивных стом, наблюдали у 2 (2,7%) пациентов с илеостомами. Оба случая развились более чем через 14 сут после первичных операций, и были устранены на фоне адекватной инфузионной поддержки и коррекции дебита по илеостомам. Перистомальные дерматиты и грыжи не были качественно учтены в первичной документации, потому не стали объектом изучения.
Послеоперационные осложнения после закрытий дивертивных стом представлены в табл. 3. Большие послеоперационные осложнения (III и более по Clavien — Dindo) зарегистрированы у 4 (6,1%) пациентов — 3 несостоятельности энтеро-энтероанастомоза, 2 из которых потребовавшая релапаротомии, и 1 кровотечение из анастомоза, потребовавшее его резекции.
Таблица 3. Характеристика послеоперационных осложнений после закрытий дивертивных стом
| Степень тяжести по Clavien — Dindo | Вид осложнений (количество случаев) |
| I | Кровотечение из энтеро-энтероанастомоза (1) |
| II | Несостоятельность энтеро-энтероанастомоза (1)
Тонкокишечная непроходимость (2) |
| IIIa | Несостоятельность энтеро-энтероанастомоза (1) |
| IIIb | Кровотечение из энтеро-энтероанастомоза (1) |
| IVa | Несостоятельность энтеро-энтероанастомоза (2) |
Частота несостоятельности энтеро-энтероанастомоза после закрытия илеостом, в том числе в виде внутрибрюшного абсцесса, составила 6,1%.
Периоперационная летальность отсутствовала в нашем наблюдении.
Обсуждение
В нашем исследовании частота НА составила 4,1% в общей группе, и 3,4% в группе резекций прямой кишки. Эти показатели значительно ниже тех, что были продемонстрированы в ходе международного аудита левосторонних колоректальных резекций, инициированного Европейским обществом колопроктологии (European Society of Coloproctology) в 2017 г. — 7,3% клинически или радиологически подтвержденных НА [38]. Все реконструктивные резекции прямой кишки мы выполняем с высокой перевязкой сосудов (нижняя брыжеечная артерия в устье, нижняя брыжеечная вена у нижнего края поджелудочной железы), с контролем адекватности артериального кровотока по краевому сосуду низводимой кишки, с абдоминальным дренированием колоректального анастомоза и без ICG-контроля и воздушной пробы. Как было упомянуто, все анастомозы ниже уровня мыса крестца рутинно защищаются дивертивной стомой. Все пациенты, не имеющие признаков кишечной непроходимости перед операцией, получают механическую подготовку и деконтаминацию кишечника.
В нашем исследовании в 98,6% случаев при выборе метода дивертирования предпочтение отдавалось илеостоме. Несмотря на более выгодную физиологию колостомы для предотвращения водно-электролитных нарушений, как наложение, так и закрытие колостомы связано с большей частотой осложнений. E. Rullier в своем ретроспективном сравнении колостомии и илеостомии продемонстрировал высокую частоту формирования парастомальных абсцессов, ретракции, пролапса стомы среди пациентов с дивертивными колостомами, и высокую частоту раневых инфекций и грыж после закрытия колостом [39].
Метаанализ 2015 г., включивший 1025 пациентов, продемонстрировал значимое снижение частоты септических осложнений, пролапса стомы и формирования парастомальных грыж в группе илеостом. При этом не было найдено достоверных отличий в частоте дегидратации. После закрытия илеостом частота раневых инфекций и грыж была значимо ниже [40]. Лишь частота послеоперационного илеуса была значимо выше среди пациентов с илеостомами, что дополнительно продемонстрировано в метаанализе 2019 г., включившем практически те же исследования, что и предыдущий [41].
Потенциальным исключительным осложнением закрытия дивертивной колостомы может быть случайная травма краевого сосуда, что может стать причиной ишемии всей низведенной для анастомоза кишки.
Существует две принципиально разных методики закрытия петлевой стомы — ручное и аппаратное ушивание. Метаанализ 15 исследований, опубликованный в 2019 г., не показал различий в частоте несостоятельностей анастомоза при сравнении ручного и степлерного закрытия дивертивных илеостом, однако продемонстрировал меньшую частоту послеоперационной тонкокишечной непроходимости и большую частоту кровотечений из анастомоза при степлерном закрытии [42]. При этом не было выявлено никаких различий между пациентами, которым стому ушивали ручным методом без резекции кишки и с ней.
Стоит отметить, что частота несостоятельности энтеро-энтероанастомоза в данном метаанализе достигла 2,93% в группе ручного ушивания. Хотя в некоторых исследованиях, включенные в анализ, не считали внутрибрюшной абсцесс за несостоятельность анастомоза, эта цифра ниже, чем продемонстрированная нами.
В нашем исследовании продемонстрирована крайне низкая частота малых послеоперационных осложнений, что, вероятно, связано с неполнотой отчетов в первичной документации. Частота больших осложнений может считаться репрезентативной и составила 6,1%, что соответствует данным больших ретроспективных наблюдений [43, 44].
В среднем период до закрытия дивертивной стомы составил 16,7 нед. В выборе времени мы ориентировались на пожелания пациента, необходимость проведения адъювантной химиотерапии и наличие противопоказаний, таких как диверсионный колит или не полностью разрешившиеся послеоперационные осложнения. При необходимости проведения химиотерапии у пациента с дивертивной илеостомой, мы переводим его с пероральных форм химиопрепаратов (например капецитабин) на инъекционные. Контроль состоятельности колоректального анастомоза проводится посредством эндоскопии или/и КТ-проктографии, обычно не ранее чем через 3 нед после первичной операции.
Классическим интервалом для закрытия илеостомы считается 8–12 нед после первичной операции. J. Rodrigues и соавторы на небольшой когорте продемонстрировали значительное повышение количества осложнений при закрытии илеостомы ранее, чем 8,5 нед [45].
J. Rosenberg и соавторы, напротив, в рандомизированном исследовании продемонстрировали безопасность закрытия илеостомы на 8–13-е сутки, вместе с уменьшением количества илеостома-ассоциированных осложнений по сравнению с группой позднего закрытия (>12 нед) [46].
E. Stratilatovas и соавторы [47], инициировав схожее рандомизированное исследование, сравнивающее раннее (около 30 дней) и позднее (около 90 дней) закрытие илеостом, были вынуждены преждевременно его прервать. Причиной стало значительное повышение частоты послеоперационных осложнений в группе раннего закрытия, в том числе осложнений >III по Clavien — Dindo, за счет несостоятельностей анастомозов и внутрибрюшных абсцессов. Авторы пришли к выводу, что раннее закрытие илеостом небезопасно и не должно выполняться [47].
С учетом противоречивых данных, представленных выше, и необходимости проведения адъювантной химиотерапии у большинства пациентов, мы считаем раннее закрытие дивертивных стом неоправданным в большинстве случаев — 12,1% стом были закрыты до 8 нед, и только у 1 пациента — до 4 нед в связи с развившимся на фоне дегидратации острым повреждением почек.
Интересное замечание опубликовали E. Yavuz и соавторы касательно того, что позднее, более чем через 6 мес, закрытие стомы также приводит к повышению частоты послеоперационных осложнений за счет раневых и органо-пространственных инфекций [48].
Ретроспективный анализ данных 964 пациентов с дивертивными илеостомами, опубликованный C. Selvasekar и соавторами продемонстрировал, что у каждого четвертого пациента временная илеостома не будет закрыта [49]. В подобном исследовании A. Chiu и соавторов частота незакрытия илеостом составила 14,5% через 13 мес от первичной операции [50].
В нашем исследовании у 5 пациентов на момент анализа сохранялась стома (дивертивная или концевая колостома). В то же время 5 пациентов выбыли из наблюдения, если их учитывать как носителей постоянной стомы, доля стомированных пациентов составила 13,6%.
Качество жизни и финансовая эффективность не были предметом нашего анализа, и подлежат изучению в дальнейшем.
Выводы
По данным литературы, наложение дивертивной стомы эффективно снижает частоту клинически значимых НА при левосторонних колоректальных резекциях. Илеостома является более предпочтительной, чем колостома, из-за более низкого риска парастомальных и послеоперационных осложнений при ее закрытии. Период до закрытия илеостомы широко варьирует, но, видимо, оптимально может находиться в интервале 8 нед — 6 мес. Ручное закрытие илеостомы не уступает степлерному, за исключением более высокой частоты развития послеоперационного илеуса в первом случае. Рутинное использование дивертивных илеостом в практике легко имплементируемо и позволяет воспроизвести результаты знаковых рандомизированных исследований и ретроспективных анализов крупных центров.
Список использованной литературы
- 1. Rahbari, N., Weitz, J., Hohenberger, W., Heald, R., Moran, B., & Ulrich, A., … Büchler, M.W. (2010). Definition and grading of anastomotic leakage following anterior resection of the rectum: A proposal by the International Study Group of Rectal Cancer. Surgery, 147(3), 339–351. doi: 10.1016/j.surg.2009.10.012.
- 2. Relationship between method of anastomosis and anastomotic failure after right hemicolectomy and ileo-caecal resection: an international snapshot audit. (2017). Colorectal Disease, 19(8), e296–e311. doi: 10.1111/codi.13646.
- 3. Paun, B., Cassie, S., MacLean, A., Dixon, E., & Buie, W. (2010). Postoperative Complications Following Surgery for Rectal Cancer. Annals of Surgery, 251(5), 807–818. doi: 10.1097/sla.0b013e3181dae4ed.
- 4. Nesbakken, A., Nygaard, K., & Lunde, O. (2001). Outcome and late functional results after anastomotic leakage following mesorectal excision for rectal cancer. British Journal of Surgery, 88(3), 400–404. doi: 10.1046/j.1365-2168.2001.01719.x.
- 5. Miura, T., Sakamoto, Y., Morohashi, H., Yoshida, T., Sato, K., & Hakamada, K. (2017). Risk factor for permanent stoma and incontinence quality of life after sphincter-preserving surgery for low rectal cancer without a diverting stoma. Annals of Gastroenterological Surgery, 2(1), 79–86. doi: 10.1002/ags3.12033.
- 6. Ha, G., Kim, J., & Lee, M. (2017). Oncologic Impact of Anastomotic Leakage Following Colorectal Cancer Surgery: A Systematic Review and Meta-Analysis. Annals of Surgical Oncology, 24(11), 3289–3299. doi: 10.1245/s10434-017-5881-8.
- 7. McDermott, F., Heeney, A., Kelly, M., Steele, R., Carlson, G., & Winter, D. (2015). Systematic review of preoperative, intraoperative and postoperative risk factors for colorectal anastomotic leaks. British Journal of Surgery, 102(5), 462–479. doi: 10.1002/bjs.9697.
- 8. Pettersson, D., Cedermark, B., Holm, T., Radu, C., Påhlman, L., Glimelius, B., & Martling, A. (2010). Interim analysis of the Stockholm III trial of preoperative radiotherapy regimens for rectal cancer. British Journal of Surgery, 97(4), 580–587. doi: 10.1002/bjs.6914.
- 9. Greco, M., Capretti, G., Beretta, L., Gemma, M., Pecorelli, N., & Braga, M. (2013). Enhanced Recovery Program in Colorectal Surgery: A Meta-analysis of Randomized Controlled Trials. World Journal of Surgery, 38(6), 1531–1541. doi: 10.1007/s00268-013-2416-8.
- 10. Klinger, A., Green, H., Monlezun, D., Beck, D., Kann, B., Vargas, H., … David, M.D. (2019). The Role of Bowel Preparation in Colorectal Surgery. Annals of Surgery, 269(4), 671–677. doi: 10.1097/sla.0000000000002568.
- 11. Rollins, K., Javanmard-Emamghissi, H., Acheson, A., & Lobo, D. (2019). The Role of Oral Antibiotic Preparation in Elective Colorectal Surgery. Annals of Surgery, 270(1), 43–58. doi: 10.1097/sla.0000000000003145.
- 12. Espin Basany, E., Solís-Peña, A., Pellino, G., Kreisler, E., Fraccalvieri, D., Muinelo-Lorenzo, M., … Biondo, S. (2020). Preoperative oral antibiotics and surgical-site infections in colon surgery (ORALEV): a multicentre, single-blind, pragmatic, randomised controlled trial. The Lancet Gastroenterology & Hepatology, 5(8), 729–738. doi: 10.1016/s2468-1253(20)30075-3.
- 13. Vennix, S., Pelzers, L., Bouvy, N., Beets, G., Pierie, J., Wiggers, T., & Breukink, S. (2014). Laparoscopic versus open total mesorectal excision for rectal cancer. Cochrane Database of Systematic Reviews. doi: 10.1002/14651858.cd005200.pub3.
- 14. Collinson, F., Jayne, D., Pigazzi, A., Tsang, C., Barrie, J., Edlin, R., … Brown, J. M. (2011). An international, multicentre, prospective, randomised, controlled, unblinded, parallel-group trial of robotic-assisted versus standard laparoscopic surgery for the curative treatment of rectal cancer. International Journal of Colorectal Disease, 27(2), 233–241. doi: 10.1007/s00384-011-1313-6.
- 15. Neutzling, C., Lustosa, S., Proenca, I., da Silva, E., & Matos, D. (2012). Stapled versus handsewn methods for colorectal anastomosis surgery. Cochrane Database of Systematic Reviews. doi: 10.1002/14651858.cd003144.pub2.
- 16. Braunschmid, T., Hartig, N., Baumann, L., Dauser, B., & Herbst, F. (2017). Influence of multiple stapler firings used for rectal division on colorectal anastomotic leak rate. Surgical Endoscopy, 31(12), 5318–5326. doi: 10.1007/s00464-017-5611-0.
- 17. Ito, M., Sugito, M., Kobayashi, A., Nishizawa, Y., Tsunoda, Y., & Saito, N. (2008). Relationship between multiple numbers of stapler firings during rectal division and anastomotic leakage after laparoscopic rectal resection. International Journal of Colorectal Disease, 23(7), 703–707. doi: 10.1007/s00384-008-0470-8.
- 18. Novell, J., & Lewis, A. (1990). Peroperative observation of marginal artery bleeding: A predictor of anastomotic leakage. British Journal Of Surgery, 77(2), 137–138. doi: 10.1002/bjs.1800770206.
- 19. Wu, Z., van de Haar, R., Sparreboom, C., Boersema, G., Li, Z., … Lange, J. F. (2016). Is the intraoperative air leak test effective in the prevention of colorectal anastomotic leakage? A systematic review and meta-analysis. International Journal of Colorectal Disease, 31(8), 1409–1417. doi: 10.1007/s00384-016-2616-4.
- 20. Allaix, M., Lena, A., Degiuli, M., Arezzo, A., Passera, R., Mistrangelo, M., & Morino, M. (2018). Intraoperative air leak test reduces the rate of postoperative anastomotic leak: analysis of 777 laparoscopic left-sided colon resections. Surgical Endoscopy, 33(5), 1592–1599. doi: 10.1007/s00464-018-6421-8.
- 21. Blanco-Colino, R., & Espin-Basany, E. (2017). Intraoperative use of ICG fluorescence imaging to reduce the risk of anastomotic leakage in colorectal surgery: a systematic review and meta-analysis. Techniques in Coloproctology, 22(1), 15–23. doi: 10.1007/s10151-017-1731-8.
- 22. Yang, Y., Shu, Y., Su, F., Xia, L., Duan, B., & Wu, X. (2016). Prophylactic transanal decompression tube versus non-prophylactic transanal decompression tube for anastomotic leakage prevention in low anterior resection for rectal cancer: a meta-analysis. Surgical Endoscopy, 31(4), 1513–1523. doi: 10.1007/s00464-016-5193-2.
- 23. Wang, F., Yan, W., Yan, M., & Song, M. (2019). Comparison of anastomotic leakage rate and reoperation rate between transanal tube placement and defunctioning stoma after anterior resection: A network meta-analysis of clinical data. European Journal of Surgical Oncology, 45(8), 1301–1309. doi: 10.1016/j.ejso.2019.01.182.
- 24. Guerra, F., Giuliani, G., Coletta, D., Boni, M., Rondelli, F., Bianchi, P., & Coratti, A. (2017). A Meta-Analysis of Randomized Controlled Trials on the Use of Suction Drains Following Rectal Surgery. Digestive Surgery, 35(6), 482–490. doi: 10.1159/000485139.
- 25. Podda, M., Di Saverio, S., Davies, R., Atzeni, J., Balestra, F., Virdis, F., … Pisanu A. (2020). Prophylactic intra-abdominal drainage following colorectal anastomoses. A systematic review and meta-analysis of randomized controlled trials. The American Journal of Surgery, 219(1), 164–174. doi: 10.1016/j.amjsurg.2019.05.006.
- 26. Rondelli, F., Bugiantella, W., Vedovati, M., Balzarotti, R., Avenia, N., Mariani, E., … Becattini, C. (2014). To drain or not to drain extraperitoneal colorectal anastomosis? A systematic review and meta-analysis. Colorectal Disease, 16(2), O35-O42. doi: 10.1111/codi.12491.
- 27. Cavaliere, D., Popivanov, G., Cassini, D., Cirocchi, R., Henry, B., Vettoretto, N., … Tomaszewski, K.A. (2019). Is a drain necessary after anterior resection of the rectum? A systematic review and meta-analysis. International Journal of Colorectal Disease, 34(6), 973–981. doi: 10.1007/s00384-019-03276-4.
- 28. Wang, Z., Xu, J., Shang, C., Zhao, Y., & Zhang, S. (2018). Clinical Significance of Pelvic Peritonization in Laparoscopic Dixon Surgery. Chinese Medical Journal, 131(3), 289–294. doi: 10.4103/0366-6999.223852.
- 29. Chuan, L., Linfeng, G., Hongchang, L., Xiaosong, W., Huaxing, L., Chao, Z., … Tang B. O. (2020). Short‐term outcomes of pelvic floor peritoneum closure in endoscopic low anterior resection of rectal cancer: A propensity score matching analysis. Journal of Surgical Oncology. doi: 10.1002/jso.26238.
- 30. The Role of Pelvic Peritonization in Laparoscopic or Robotic Low Anterior Resection — Full Text View — ClinicalTrials.gov. (2020). Retrieved from https://clinicaltrials.gov/ct2/show/study/NCT03699761.
- 31. Lindgren, R., Hallböök, O., Rutegård, J., Sjödahl, R., & Matthiessen, P. (2011). What Is the Risk for a Permanent Stoma After Low Anterior Resection of the Rectum for Cancer? A Six-Year Follow-Up of a Multicenter Trial. Diseases of the Colon & Rectum, 54(1), 41–47. doi: 10.1007/dcr.0b013e3181fd2948.
- 32. Montedori, A., Cirocchi, R., Farinella, E., Sciannameo, F., & Abraha, I. (2010). Covering ileo- or colostomy in anterior resection for rectal carcinoma. Cochrane Database of Systematic Reviews. doi: 10.1002/14651858.cd006878.pub2.
- 33. Gu, W., & Wu, S. (2015). Meta-analysis of defunctioning stoma in low anterior resection with total mesorectal excision for rectal cancer: evidence based on thirteen studies. World Journal of Surgical Oncology, 13(1), 9. doi: 10.1186/s12957-014-0417-1.
- 34. Gündeş, E., Çetin, D., Aday, U., Çiyiltepe, H., Bozdağ, E., & Uzun, O. (2018). Risk Factors in Anastomotic Leaks After Low Anterior Resection for Rectal Cancer and the Effects of Diverting Stoma on Clinical Results. Turkish Journal of Colorectal Disease, 28(3), 114–120. doi: 10.4274/tjcd.57704.
- 35. Frouws, M., Snijders, H., Malm, S., Liefers, G., Van de Velde, C., Neijenhuis, P., & Kroon, H. (2017). Clinical Relevance of a Grading System for Anastomotic Leakage After Low Anterior Resection. Diseases of The Colon & Rectum, 60(7), 706–713. doi: 10.1097/dcr.0000000000000800.
- 36. Matthiessen, P., Hallböök, O., Rutegård, J., Simert, G., & Sjödahl, R. (2008). Defunctioning Stoma Reduces Symptomatic Anastomotic Leakage After Low Anterior Resection of the Rectum for Cancer: A Randomized Multicenter Trial. Annals of Surgery, 247(4), 719–720. doi: 10.1097/sla.0b013e31816a74b5.
- 37. Wu, Y., Zheng, H., Guo, T., Keranmu, A., Liu, F., & Xu, Y. (2017). Temporary Diverting Stoma Improves Recovery of Anastomotic Leakage after Anterior Resection for Rectal Cancer. Scientific Reports, 7(1). doi: 10.1038/s41598-017-16311-7.
- 38. The 2017 European Society of Coloproctology (ESCP) international snapshot audit of left colon, sigmoid and rectal resections — Executive Summary. (2018). Colorectal Disease, 20, 13–14. doi: 10.1111/codi.14391.
- 39. Rullier, E., Le Toux, N., Laurent, C., Garrelon, J., Parneix, M., & Saric, J. (2001). Loop Ileostomy versus Loop Colostomy for Defunctioning Low Anastomoses during Rectal Cancer Surgery. World Journal of Surgery, 25(3), 274–278. doi: 10.1007/s002680020091.
- 40. Geng, H., Nasier, D., Liu, B., Gao, H., & Xu, Y. (2015). Meta-analysis of elective surgical complications related to defunctioning loop ileostomy compared with loop colostomy after low anterior resection for rectal carcinoma. The Annals of The Royal College of Surgeons of England, 97(7), 494–501. doi: 10.1308/003588415×14181254789240.
- 41. Chudner, A., Gachabayov, M., Dyatlov, A., Lee, H., Essani, R., & Bergamaschi, R. (2019). The influence of diverting loop ileostomy vs. colostomy on postoperative morbidity in restorative anterior resection for rectal cancer: a systematic review and meta-analysis. Langenbeck’s Archives of Surgery, 404(2), 129–139. doi: 10.1007/s00423-019-01758-1.
- 42. Madani, R., Day, N., Kumar, L., Tilney, H., & Gudgeon, A. (2018). Hand-Sewn versus Stapled Closure of Loop Ileostomy: A Meta-Analysis. Digestive Surgery, 36(3), 183–194. doi: 10.1159/000487310.
- 43. Luglio, G. (2011). Loop Ileostomy Reversal After Colon and Rectal Surgery. Archives of Surgery, 146(10), 1191. doi: 10.1001/archsurg.2011.234.
- 44. Poskus, E., Kildusis, E., Smolskas, E., Ambrazevicius, M., & Strupas, K. (2014). Complications after Loop Ileostomy Closure: A Retrospective Analysis of 132 Patients. Viszeralmedizin, 30(4), 276–280. doi: 10.1159/000366218.
- 45. Perez, R., Habr-Gama, A., Seid, V., Proscurshim, I., Sousa, A., Kiss, D.,.. Rodrigues, J. (2006). Loop Ileostomy Morbidity: Timing of Closure Matters. Diseases of The Colon & Rectum, 49(10), 1539–1545. doi: 10.1007/s10350-006-0645-8.
- 46. Danielsen, A., Park, J., Jansen, J., Bock, D., Skullman, S., Wedin, A., … Rosenberg, J. (2017). Early Closure of a Temporary Ileostomy in Patients With Rectal Cancer. Annals of Surgery, 265(2), 284–290. doi: 10.1097/sla.0000000000001829.
- 47. Bausys, A., Kuliavas, J., Dulskas, A., Kryzauskas, M., Pauza, K., Kilius, A., … Stratilatovas, E. (2019). Early versus standard closure of temporary ileostomy in patients with rectal cancer: A randomized controlled trial. Journal of Surgical Oncology, 120(2), 294–299. doi: 10.1002/jso.25488.
- 48. Hacim, N., Akbas, A., Meric, S., Altinel, Y., Karabay, O., & Yavuz, E. (2020). Diverting Ileostomy Duration Is the Main Determinant of Ileostomy-Related Complications after Surgical Treatment of Rectum Cancer. Journal of Oncology, 2020, 1–6. doi: 10.1155/2020/4186857.
- 49. David, G., Slavin, J., Willmott, S., Corless, D., Khan, A., & Selvasekar, C. (2010). Loop ileostomy following anterior resection: is it really temporary? Colorectal Disease, 12(5), 428–432. doi: 10.1111/j.1463-1318.2009.01815.x.
- 50. Chiu, A., Chan, H., Brown, C., Raval, M., & Phang, P. (2014). Failing to reverse a diverting stoma after lower anterior resection of rectal cancer. The American Journal of Surgery, 207(5), 708–711. doi: 10.1016/j.amjsurg.2013.12.016.
Дивертивна ілеостома при лівобічних колоректальних резекціях: ретроспективний аналіз і огляд літератури
Комунальне некомерційне підприємство «Обласний центр онкології», Харків
Резюме. Вступ. Неспроможність колоректального анастомозу (НА) є одним з основних ускладнень у хірургії ободової і прямої кишки. Частота НА досягає 11% після передніх резекцій прямої кишки. Безліч методик зниження ризику НА було запропоновано для колоректальної хірургії. Однією з них є проксимальне дивертування калового струменя шляхом накладення дефункціонуючої стоми. Матеріали. Було проведено ретроспективний аналіз історій хвороби 73 пацієнтів, яким були виконані різні варіанти реконструктивних резекцій лівої половини ободової і прямої кишки з накладенням дивертивних стом з приводу злоякісної і доброякісної патології прямої або ободової кишки, внутрішніх жіночих статевих органів в 2018–2020 рр. в КНП «Обласний центр онкології», м. Харків. Результати. Частота НА становила 4,1%, клінічно значущоюї — 2,7%. Ілеостома була обрана для дивертування в 72 випадках. Середній час до закриття стоми становив 117 діб. Частка пацієнтів, стоми яких були закриті на момент аналізу, становила 86,3%; 76,7% стом були закриті з інтервалом до 6 міс включно. Ускладнення III класу і більш за Clavien — Dindo після закриття стом розвинулися у 6,1% пацієнтів. Висновки. Накладення дивертивної стоми ефективно знижує частоту клінічно значущої НА при лівосторонніх колоректальних резекціях. Ілеостомі надається перевага порівняно з колостомою. Рутинне використання дивертивних ілеостом легко імплементується в практику і дозволяє досягти частоти НА, що відповідає результатам знакових рандомізованих досліджень і ретроспективних аналізів великих центрів.
Ключові слова: неспроможність анастомозу; дивертивна стома; петлева ілеостома; резекція прямої кишки; колоректальний анастомоз.
Трегуб Евгений Сергеевич,
61070, г. Харьков, ул. Лесопарковая, 4
E-mail: yev.trehub@gmail.com
Correspondence:
Yevhenii Trehub
4 Lisoparkivska str., Kharkiv 61070.
E-mail: yev.trehub@gmail.com














Leave a comment