Віддалені результати збереження елементів зовнішнього сфінктера при нижньоампулярному раку прямої кишки Long-term results of the partial external sphincter preservation in low rectal cancer
Пикунов Д.Ю., Кашников В.Н., Джанаев Ю.А., Рыбаков Е.Г.
Резюме. На основі проведеного патоморфологічного дослідження характеру росту аденокарцином прямої кишки на рівні зубчастої лінії розроблено новий екстремально низький сфінктерзберігаючий підхід у хірургії; запропоновано виконання проктектомії зі збереженням окремих елементів зовнішнього сфінктера, доповненого формуванням товстокишкового резервуару та кінцевої гладком’язової манжети. У період з 2003 по 2010 р. з використанням методики 60 пацієнтів оперовано з приводу раку прямої кишки з локалізацією пухлини на рівні зубчастої лінії. У 32 хворих проведено курс передопераційної хіміопроменевої терапії (ХПТ). В усіх випадках виконано формування привентивної стоми. Результати: при проведенні електроміографічного дослідження в усіх пацієнтів відзначалася стабільна тенденція до підвищення фонової активності та скоротної здатності зовнішнього сфінктера протягом 1 року після закриття стоми. При профілометрії в різні строки після операції довжина зони підвищеного тиску залишалася стабільною, що зумовлено сформованим неосфінктером. Утримувати тверде випорожнення через 6 міс після закриття стоми могли 45,8% у групі пацієнтів із ХПТ і 48% хворих без неї, через 2 роки — 83,3 и 92% пацієнтів відповідно. При оцінці віддалених результатів рівень місцевих рецидивів становив 3,2% у групі пацієнтів із ХПТ і 7,1% — без ХПТ. 5-річна виживаність становила 76,6±9,5% для хворих без ХПТ і 72,4±10,3% — для пацієнтів із передопераційною ХПТ. Виконання проктектомії зі збереженням елементів зовнішнього сфінктера забезпечує адекватні онкологічні результати, проведення ХПТ знижує ризик виникнення місцевих рецидивів. Запропонована техніка аноректальної реконструкції забезпечує часткове збереження функції вольового утримання.Summary. A new extremely low sphincter preserving approach in surgery was proposed, based on pathomorphological study of adenocarcinoma growth patterns at the dentate line of the rectum. Partial preservation of the external sphincter elements, supplemented by the colonic reservoir and terminal smooth muscle cuff formation were applied. From 2003 to 2010, 60 patients with rectal cancer, localized at the level of dentate line, underwent curative treatment using this technique. 32 patients also underwent a course of preoperative chemoradiotherapy (CRT). Preventive stoma was formed in all cases. Results: the electromyographic study of all patients revealed the increasing of the background activity and the contractile ability of the stored external sphincter during 1 year after the stoma closure. 45.8% of the patients with preoperative CRT and 48% of patients without it were able to retain solid stool at 6 months after the stoma closure, and 83.3% and 92% of this patients after 2 years, respectively. In assessing the long-term results, the local recurrence rate was 3.2% in patients with CRT and 7.1% without the CRT. 5-Year survival rate was 76.6±9.5% for patients with preoperative radiochemotherapy and 72.4±10.3% for patients without it. Proktektomy with partial preserving of the external anal sphincter provides adequate oncological outcomes, CRT execution reduces the risk of local recurrence. The proposed technique of the anorectal reconstruction provides a partial preservation of the volitional stool retention function.
Резюме. На основании проведенного патоморфологического исследования характера роста аденокарцином прямой кишки на уровне зубчатой линии разработан новый экстремально низкий сфинктерсохраняющий подход в хирургии; предложено выполнение проктэктомии с сохранением отдельных элементов наружного сфинктера, дополненного формированием толстокишечного резервуара и концевой гладкомышечной манжеты. В период с 2003 по 2010 г. с использованием методики 60 пациентов оперировано по поводу рака прямой кишки с локализацией опухоли на уровне зубчатой линии. У 32 больных проведен курс предоперационной химиолучевой терапии (ХЛТ). Во всех случаях произведено формирование привентивной стомы. Результаты: при проведении электромиографического исследования у всех пациентов отмечалась стабильная тенденция к нарастанию фоновой активности и сократительной способности наружного сфинктера в течение 1 года после закрытия стомы. При профилометрии в разные сроки после операции длина зоны повышенного давления оставалась стабильной, что обусловлено сформированным неосфинктером. Удерживать твердый стул через 6 мес после закрытия стомы могли 45,8% в группе пациентов с ХЛТ и 48% больных без нее, через 2 года — 83,3 и 92% пациентов соответственно. При оценке отдаленных результатов уровень местных рецидивов составил 3,2% в группе пациентов с ХЛТ и 7,1% — без ХЛТ. 5-летняя выживаемость составила 76,6±9,5% для больных без ХЛТ и 72,4±10,3% — для пациентов с предоперационной ХЛТ. Выполнение проктэктомии с сохранением элементов наружного сфинктера обеспечивает адекватные онкологические результаты, проведение ХЛТ снижает риск возникновения местных рецидивов. Предложенная техника аноректальной реконструкции обеспечивает частичное сохранение функции волевого держания.
Введение
Вплоть до настоящего времени частота выполнения брюшно-промежностной экстирпации (БПЭ) прямой кишки при злокачественном поражении органа остается неоправданно высокой. По оценке разных авторов частота БПЭ колеблется от 18 до 60% [5, 7, 8, 15, 17] и в значительной мере зависит от опыта и предпочтений хирурга. Так, по данным R. Ricciardi и соавторов, обобщивших результаты лечения рака прямой кишки в США за период с 1988 по 2003 г., из 40 631 пациента у 60,3% была выполнена операция с утратой заднего прохода [8]. По оценке E. Morris и соавторов, изучавших частоту БПЭ в Англии, из 31 223 больных раком прямой кишки в 1998–2004 гг. экстирпация органа была выполнена у 27,3% [7]. Таким образом, как минимум ⅓ больных раком прямой кишки в мире производится калечащая операция с удалением заднего прохода и формированием постоянной колостомы на передней брюшной стенке. Несмотря на активную разработку и широкое применение современных средств ухода за стомами, качество жизни подобных пациентов значительно страдает, что связано, в первую очередь, с инвалидизирующим характером вмешательства, нарушением образа тела и психологическими ограничениями в активной жизни. Зачастую показания к выполнению БПЭ неоправданно завышены, и, производя операцию Майлса при нижнеампулярном раке [6], хирург старается выполнить «максимально радикальное вмешательство» даже в тех случаях, когда запирательный аппарат прямой кишки не вовлечен в опухолевый процесс, обрекая пациента на жизнь с постоянной колостомой. Однако у ряда пациентов существует возможность сохранить те или иные элементы анального жома, удалив опухоль в пределах адекватных дистальной и латеральной границ резекции. Так, оправданной альтернативой БПЭ при расположении опухоли в 1–2 см выше зубчатой линии служит итерсфинктерная резекция прямой кишки [2, 10–12, 16], позволяющая сохранить наружный сфинктер прямой кишки, что в совокупности с аноректальной реконструкцией дает возможность достичь неплохих функциональных результатов [2, 16].
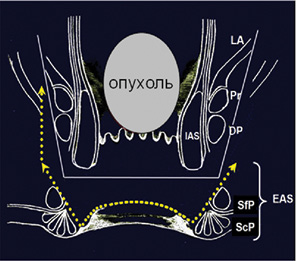
На основании проведенного патоморфологического исследования характера роста аденокарцином прямой кишки на уровне зубчатой линии [1, 3] в Государственном научном центре колопроктологии (Москва, Российская Федерация) разработан новый экстремально низкий сфинктерсохраняющий подход в хирургии рака указанной локализации: предложено выполнение проктэктомии с сохранением отдельных элементов наружного сфинктера, дополненной формированием неоректума (толстокишечного резервуара) и неосфинктера (концевой гладкомышечной манжетки) (рисунок).
Объект и методы исследования
В период с 2003 по 2010 г. в Государственном научном центре колопроктологии с использованием вышеописанной методики оперировано 60 пациентов по поводу рака прямой кишки с локализацией нижнего полюса опухоли на уровне зубчатой линии. Средний возраст оперированных больных составил 54±9,6 (29–75) года. В предоперационный период всем пациентам производили комплекс обследований, включающий колоноскопию, рентгенологическое исследование грудной клетки, гистологическое исследование биоптата из ткани опухоли, ультразвуковое исследование (УЗИ) брюшной полости и малого таза, а также эндоректальное ультразвуковое исследование (ЭРУЗИ) с четкой визуализацией степени инфильтрации опухолью кишечной стенки и взаимосвязь с элементами запирательного аппарата прямой кишки. При осмотре и ЭРУЗИ протоколировали высоту расположения нижнего полюса опухоли относительно зубчатой линии, локализацию по окружности кишки, степень инфильтрации окружающих структур, а также тонус анального жома и силу волевого сокращения. При опросе особое внимание уделялось аспектам держания кишечного содержимого и наличию/отсутствию эпизодов инконтиненции в анамнезе.
На основании результатов обследования из онкологических соображений у 32 больных проведен курс пролонгированной предоперационной химиолучевой терапии (ХЛТ) в дозе 47 Гр на фоне сенсибилизации флуороурацилом и цисплатином. У этой группы больных оперативное вмешательство было выполнено в сроки 5–7 нед после окончания ХЛТ.
Во всех случаях производилось формирование превентивной стомы, закрытие которой выполнялось в среднем через 15,5±3,4 (7–33) нед после первичной операции. Увеличение срока до реконструктивной операции у большинства пациентов было связано с необходимостью проведения послеоперационной адъювантной химиотерапии.
Все пациенты прослежены в сроки от 10 до 86 мес с медианой 38 мес после первичной операции. В плане послеоперационного наблюдения больные являлись на осмотр каждые 3 мес в течение 1-го года, 1 раз в 6 мес в течение последующих 2 лет и далее — 1 раз в год. Во время каждого визита осуществлялся опрос пациента, выявление жалоб с акцентированием на функцию держания разных компонентов кишечного содержимого, осмотр с отметками в карте о тонусе заднего прохода и силе волевых сокращений, самостоятельное заполнение больным одобренного Всемирной огранизацией здравоохранения, унифицированного опросника FIQL [9], состоящего из 29 пунктов, ответы на которые суммируются и оцениваются по 4 шкалам. Помимо этого, производился комплекс физиологических исследований, включающий компьютерную суммарную миографию в области заднего прохода, профилометрию, определение проводимости по половым нервам. Кроме того, каждые 3 мес в течение первых 2 лет и далее 1 раз в полгода производился динамический контроль уровня онкомаркеров (РЭА, СА 19-9) в крови, каждые 6 мес — УЗИ брюшной полости и малого таза, рентгенологическое исследование органов грудной клетки в течение первых 2 лет и далее — 1 раз в год.
Результаты
Ранние послеоперационные осложнения отмечены у 3 пациентов (дисфункция илеостомы, частичная ретракция низведенной кишки, длительный парез желудочно-кишечного тракта), которые не потребовали повторных хирургических вмешательств и были купированы консервативными мероприятиями. Гистологическое исследование удаленных препаратов показало, что стадия pT2N0 была у 9 больных, pT2N1 — у 2, pT3N0 — у 13, pT3N1 — у 4 больных; после предоперационной ХЛТ полная регрессия опухоли ypT0N0 зафиксирована у 3 больных, ypT2N0 — у 8, ypT3N0 — у 16, ypT3N1 — у 5 пациентов. Дистальная линия резекции составила 2,0±0,4 (1,5–2,8) см, латеральная линия резекции — 0,8±0,3 (0,1–1,4) см.
При динамической оценке показателей электромиографии отмечается стабильная тенденция к нарастанию фоновой активности и сократительной способности сохраненных порций наружного сфинктера в течение 1-го года после закрытия проксимальной стомы, в дальнейшем результаты стабилизируются на достигнутом уровне с незначительной положительной динамикой (табл. 1).
| Период | Фоновая активность, Ср. А, мкВ (норма 31–50 мкВ) |
Сократительная активность, Ср. А, мкВ(норма 154–212 мкВ) |
||
|---|---|---|---|---|
| Больные после предоперационной ХЛТ (n=32) | Больные без ХЛТ (n=28) | Больные после предоперационной ХЛТ (n=32) | Больные без ХЛТ (n=28) | |
| Перед закрытием стомы | 7,7±3,1 | 8,6±2,8 | 52,1±14,1 | 61,6±16,0 |
| Через 3 мес | 10,2±3,0 | 11,4±3,4 | 64,5±15,8 | 78,8±15,4 |
| Через 12 мес | 12,9±4,2 | 13,9±3,3 | 81,9±18,4 | 96,4±17,4 |
| Через 24 мес | 13,1±4,1 | 13,8±3,0 | 86,1±16,7 | 102,4±21,3 |
Аналогичная картина получена при анализе данных профилометрии (табл. 2) в разные сроки после операции. Как оказалось, во все сроки исследований длина зоны повышенного давления оставалась стабильной, что, на наш взгляд, обусловлено ранее сформированным неосфинктером (гладко-мышечная манжетка) из серозно-мышечного слоя низводимой кишки и его тонусом.
| Показатель | Давление в анальном канале в покое, М±σ, мм рт. ст. |
Длина зоны повышенного давления в покое, М±σ, см |
Давление в анальном канале при волевом сокращении, М±σ, мм рт. ст. |
||
|---|---|---|---|---|---|
| После ХЛТ | Без ХЛТ | После ХЛТ | Без ХЛТ | ||
| Норма | 50–70 | 2,2±0,5 | 140–180 | ||
| Перед закрытием стомы | 22,4±9,2 | 30,6±10,4 | 2,38±0,6 | 86,6±21,8 | 106,6±14,9 |
| Через 3 мес | 27,4±9,1 | 28,4±8,3 | 2,44±0,4 | 98,1±21,0 | 124,8±16,4 |
| Через 12 мес | 43,8±12,5 | 42,5±14,2 | 2,42±0,5 | 109,1±24,7 | 152,3±23,6 |
| Через 24 мес | 46,1±12,0 | 48,4±15,3 | 2,38±0,6 | 108,7±18,3 | 156,1±20,1 |
При сравнении объективных показателей физиологической деятельности оставшихся элементов запирательного аппарата прямой кишки в группе пациентов, получивших предоперационный курс ХЛТ (n=32) и перенесших только хирургическое лечение (n=28), прослеживается тенденция к более низким показателям у облученных больных, однако разница не достигает статистической достоверности (р>0,05).
Оценивая субъективное качество жизни больных, в первую очередь акцентировали внимание на жалобы, связанные с нарушением функции держания. Так, если к 6 мес после закрытия стомы почти половина пациентов могли удерживать твердый стул (45,8 и 48% в группах с предоперационной ХЛТ и без нее), то по прошествии 2 лет этот показатель вырос до 83,3% и 92% соответственно (табл. 3).
| Показатель | Через 6 мес, % |
Через 24 мес, % | ||
|---|---|---|---|---|
| После ХЛТ | Без ХЛТ | После ХЛТ | Без ХЛТ | |
|
Частота стула, ≤2 |
8,3 | 8,0 | 50,0 | 52,0 |
| 3–4 | 12,5 | 24,0 | 25,0 | 36,0 |
| ≥5 | 20,9 | 16,0 | 12,5 | 4,0 |
| Многомоментный стул | 58,3 | 52,0 | 12,5 | 8,0 |
| Дифференцируют компоненты стула | 20,9 | 28,0 | 58,3 | 64,0 |
| Удерживают твердый стул | 45,8 | 48,0 | 83,3 | 92,0 |
| Удерживают жидкий стул |
20,9 | 24,0 | 41,8 | 56,0 |
| Удерживают газы |
16,7 | 14,0 | 33,4 | 52,0 |
| Время удержания >10 мин | 12,5 | 28,0 | 25,0 | 56,0 |
| Ночные дефекации |
58,3 | 52,0 | 12,5 | 8,0 |
| Пользуются прокладками |
100 | 100 | 58,3 | 44,0 |
Результаты оценки FIQL свидетельствуют о некотором снижении качества жизни пациентов в обеих группах, особенно в первые месяцы после восстановления непрерывности кишечника, однако в дальнейшем, по мере приспособления к новым условиям, адаптации ритма питания, к окончанию 1-го года после закрытия стомы все пациенты оценивали свое состояние как хорошее и удовлетворительное. Необходимо также отметить, что значимых различий в результатах FIQL-теста в группах с предоперационной ХЛТ и без нее не получено (табл. 4). Все пациенты социально адаптированы, вернулись к ранее выполняемой работе.
| Шкала FIQL | Период | После закрытия стомы через | ||
|---|---|---|---|---|
| 3 мес | 12 мес | 24 мес | ||
| Образ жизни | После ХЛТ | 2,3±0,81 | 3,2±0,90 | 4,0±0,64 |
| Без ХЛТ | 2,12±0,46 | 3,4±0,82 | 4,1±0,76 | |
| Адаптация в обществе | После ХЛТ | 2,1±0,58 | 2,9±0,53 | 3,19±0,74 |
| Без ХЛТ | 2,0±0,62 | 2,63±0,68 | 3,04±0,62 | |
| Самовосприятие | После ХЛТ | 3,0±0,54 | 3,54±0,73 | 3,84±0,60 |
| Без ХЛТ | 3,2±0,46 | 3,71±0,63 | 3,98±0,54 | |
| Стеснительность | После ХЛТ | 2,42±0,41 | 2,88±0,53 | 3,08±0,64 |
| Без ХЛТ | 2,61±0,96 | 2,97±0,94 | 3,24±0,91 | |
Все оперированные больные прослежены в сроки от 10 до 86 мес с медианой 38 мес после первичной операции. При оценке отдаленных результатов лечения возврат заболевания выявлен у 6 пациентов в группе после ХЛТ, при этом у 1 больного через 34 мес после операции диагностирован рецидив рака в полости таза, метастазы рака в обе доли печени — больному выполнена паллиативная БПЭ низведенной кишки с дальнейшим проведением системной химиотерапии, еще у 5 больных выявлено отдаленное метастазирование рака в печень (2 пациента), лимфоузлы корня легкого (1 пациент), легкие и печень (1 пациент), легкие и головной мозг (1 пациент). В группе без ХЛТ у 5 больных диагностирован возврат заболевания — у 2 в виде местного рецидива опухоли в полости таза (обоим выполнена экстирпация низведенной кишки) и у 3 пациентов — в виде генерализации опухолевого процесса. Таким образом, уровень местных рецидивов составил 3,2 и 7,1% в группах соответственно (р=0,59). У всех остальных пациентов признаков возврата заболевания не выявлено. При расчете 5-летней актуариальной выживаемости показатели составили 76,6±9,5% для пациентов без ХЛТ и 72,4±10,3% — для пациентов с предоперационной ХЛТ (р=0,86).
Обсуждение результатов
Современные тенденции в медицине требуют поликомпонентного подхода к лечению пациентов, особенно с онкологическими заболеваниями. Если раньше основной и единственной целью лечения являлось максимально радикальное вмешательство без учета возможных последствий для социальной жизни пациента, то в настоящее время, кроме адекватного с точки зрения онкологии подхода, необходимо учитывать такой важный показатель, как качество жизни после операции. С учетом этого в хирургии рака прямой кишки появились сфинктерсохраняющие вмешательства, позволяющие избегать формирования инвалидизирующей пациента постоянной колостомы на передней брюшной стенке. Однако до настоящего времени уровень БПЭ прямой кишки остается неоправданно высоким. Представленные результаты работы свидетельствуют о технической возможности выполнения операции с сохранением естественного пассажа по кишечнику даже при расположении опухоли прямой кишки на уровне зубчатой линии, соблюдая адекватные границы резекции и достигая приемлемых отдаленных результатов.
В современной медицинской литературе, посвященной изучению результатов лечения рака нижнеампулярного отдела прямой кишки, бытует мнение о невысокой функциональной значимости сохранения лишь части запирательного аппарата прямой кишки при сфинктерсохраняющих операциях, поскольку результаты оценки качества жизни у этих пациентов сопоставимы с больными, у которых сформирована концевая колостома на передней брюшной стенке [4, 13–15]. При этом подвергается сомнению необходимость вообще сохранять задний проход [4, 14]. Однако общим недостатком приведенных работ является то, что оценка качества жизни проводится при большой выборке пациентов, без должного внимания состоянию функции держания до операции, мотивации больного на сохранение естественного пассажа по кишечнику, особенностям его социальной жизни. Кроме того, единственным способом хирургической реабилитации во время операции во многих исследованиях является формирование толстокишечного резервуара того или иного вида, а в некоторых случаях — даже прямого колоанального анастомоза. Предложенная в Государственном научном центре колопроктологии техника аноректальной реконструкции с формированием толстокишечного резервуара и гладкомышечной манжетки при низкой резекции прямой кишки с удалением части или полностью внутреннего сфинктера является физиологически обоснованной и эффективной [16]. Полученные в результате работы данные свидетельствуют о высокой функциональной значимости сохраняемых элементов запирательного аппарата вместе с техникой аноректальной реконструкции. Необходимо также отметить важность предоперационного обследования и отбора больных, социально активных и мотивированных к сохранению естественного образа тела. Все пациенты, оперированные в рамках данного исследования, имели превентивную стому и могли субъективно сравнить качество своей жизни в период со стомой и без нее. Небезынтересным выглядит тот факт, что ни один из пациентов за все время наблюдения после восстановления непрерывности кишечника не пожелал вернуться к жизни со стомой. Большинство (82%) больных, имевших постоянную работу на момент установки диагноза, вернулись к ней после окончания лечения.
Заключение
Выполнение проктэктомии с сохранением элементов наружного сфинктера обеспечивает адекватные онкологические результаты, при этом проведение ХЛТ снижает риск возникновения местных рецидивов. При выполнении предложенной операции сохраняются элементы наружного сфинктера, обладающие функциональной активностью — тоновой и сократительной способностями, что вместе с техникой аноректальной реконструкции обеспечивает частичное сохранение функции волевого держания и позволяет избежать калечащей операции с формированием постоянной колостомы на передней брюшной стенке у мотивированных больных и обеспечивает удовлетворительное качество жизни пациентов. При этом проведение предоперационной ХЛТ незначительно ухудшает функциональные показатели работы запирательного аппарата, не влияя на качество жизни оперированных больных.
литература
1. Воробьев Г.И., Шелыгин Ю.А., Еропкин П.В. и др. (2008) Проктэктомия с сохранением элементов наружного сфинктера в хирургии нижнеампулярного рака прямой кишки. Хирургия, 9: 10–15.
2. Одарюк Т.С., Царьков П.В., Талалакин А.И. и др. (1998) Новая сфинктерсохраняющая операция при нижнеампулярном раке прямой кишки. Рос. онкол. журн., 6: 16–20.
3. Шелыгин Ю.А., Одарюк Т.С., Еропкин П.В. и др. (2007) Обоснование и техника выполнения восстановительной операции с сохранением элементов наружного сфинктера у больных раком нижнеампулярного отдела прямой кишки. Колопроктология, 3: 9–14.
4. Kasparek M.S., Hassan I., Cima R.R. et al. (2010) Quality of life after rectal excision and coloanal anastomosis for distal rectal cancers: sphincter preservation versus quality of life. Colorectal Disease, Jun 8.
5. Leo E., Belli F., Miceli R. et al. (2009) Distal clearance margin of 1 cm or less: a safe distance in lower rectum cancer surgery. Int. J. Colorectal. Dis., 24(3): 317–322.
6. Miles W.E. (1908) A method of performing abdomino-perineal resection for carcinoma of the rectum and of the terminal portion of the pelvic colon. Lancet, 2: 1812–1813.
7. Morris E., Quirke P., Thomas J.D. et al. (2008) Unacceptable variation in abdominoperineal excision rates for rectal cancer: time to intervene? Gut., 57(12): 1690–1697.
8. Ricciardi R., Virnig B.A., Madoff R.D. et al. (2007) The status of radical proctectomy and sphincter-sparing surgery in the United States. Dis. Colon. Rectum., 50: 1119–1127.
9. Rockwood T.H., Church J.M., Fleshman J.W. (2000) Fecal incontinence quality of life scale: quality of life instrument for patients with fecal incontinence. Dis. Colon. Rectum., 43: 9–16.
10. Rullier E., Laurent C., Bretagnol F. et al. (2005) Sphincter-saving resection for all rectal carcinomas: the end of the 2-cm distal rule. Ann. Surg., 241: 465–469.
11. Saito N., Moriya Y., Shirouzu K. et al. (2006) Intersphincteric resection in patients with very low rectal cancer: a review of the Japanese experience. Dis. Colon. Rectum., 49: S13–S22.
12. Schiessel R., Novi G., Holzer B. et al. (2005) Technique and long-term results of intersphincteric resection for low rectal cancer. Dis. Colon. Rectum., 48: 1858–1865.
13. Sideris L., Zenasni F., Vernerey D. et al. (2005) Quality of life of patients operated on for low rectal cancer: impact of the type of surgery and patients’ characteristics. Dis. Colon. Rectum., 48(12): 2180–2191.
14. Srangers M.A., Taal B.G., Aaronson N.K. et al. (1995) Quality of life in colorectal cancer. Stoma vs. nonstoma patients. Dis. Colon. Rectum., 38(4): 361–369.
15. Stocchi L., Wolff B.G. (2000) Operative techniques for radical surgery for rectal carcinoma: can surgeons improve outcomes? Surg. Oncol. Clin. N. Am., 9(4): 785–798.
16. Vorobiev G.I., Odaryuk T.S., Tsarkov P.V. et al. (2004) Resection of the rectum and total excision of the internal anal sphincter with smooth muscle plasty and colonic pouch for treatment of ultralow rectal carcinoma. Br. J. Surg., 91: 1506–1512.
17. Wiggers T., van de Velde C.J. (2002) The circumferential margin in rectal cancer. Recommendations based on the Dutch Total Mesorectal Excision Study. Eur. J. Cancer., 38(7): 973–976.














Leave a comment