Діагностична цінність методів візуалізації токсичних ушкоджень печінки після системної поліхіміотерапії (аналітичний огляд та результати власних досліджень)
Лаврик Г.В., Головко Т.С., Сивак Л.А., Шевчук Л.А., Ашихмін А.В.
Резюме. У статті представлені й проаналізовані наукові дані численних публікацій щодо токсичних ушкоджень печінки в період проведення поліхіміотерапії (ПХТ) у пацієнтів зі злоякісними пухлинами різного генезу та локалізації. Узагальнено та порівняно результати комплексу використаних променевих (ультразвукове дослідження, магнітно-резонансна томографія та комп’ютерна томографія) методів досліджень, діагностичних зображень печінки протягом періоду хіміотерапевтичного лікування, результати якого спричинили виникнення токсичних ушкоджень при метастазах пухлин різних локалізацій та токсичні прояви без метастатичного ураження печінки. Безпосередньо розглядається основний токсичний ефект на паренхіму печінки, виявлений у результаті проведеного діагностичного моніторингу за результатами використаних методів візуальної оцінки зображень. Отримані та інтерпретовані дані свідчать, що ПХТ відіграє роль як агента прямого впливу на злоякісні новоутворення в печінці (первинні злоякісні пухлини печінки, метастатичне ураження), так і як фактора опосередкованого токсичного впливу на здорову паренхіму. Факт ушкодження печінки як результат токсичного впливу, спровокованого ПХТ (синусоїдальне ураження, стеатоз, стеатогепатит), варто розглядати в першу чергу як імітацію метастазування. Діагностичний моніторинг під час проведення ПХТ дозволяє оцінити ефективність лікування, а також візуальні зміни в паренхімі печінки упродовж лікування. Своєчасна візуальна оцінка патологічних змін у печінці із використанням та поєднанням різних діагностичних методів має значення для більш точної діагностики й подальшого унеможливлення токсичного впливу, щоб своєчасно скоригувати лікування та уникнути небажаних ускладнень.
Одержано: 17.11.2020
Прийнято до друку: 4.12.2020
DOI: 10.32471/clinicaloncology.2663-466X.39-3.27585
Переважна більшість хіміотерапевтичних препаратів для лікування різних захворювань, окрім позитивної дії, несуть загрозу для здоров’я людини, що є побічним ефектом терапії. Печінка як основний орган-мішень досить уразлива до їх токсичного впливу.
В економічно розвинених країнах прояви ураження печінки, так звані «гепатопатії», посідають значне місце в структурі захворюваності та смертності населення, більшість із них спричинені саме прийомом лікарських препаратів.
Враховуючи роль печінки в метаболізмі хімічних речовин, можна стверджувати, що не існує ліків, які б за певних умов не спричиняли ушкодження цього органа. Дані численних публікацій щодо гепатотоксичної дії багатьох препаратів підтверджують, що медикаментозне ушкодження печінки — одна з найважливіших проблем клінічної медицини [4, 6, 24].
Особливо складними є випадки гепатотоксичності терапії у пацієнтів, яким такі ліки призначені за життєвими показаннями: наприклад, курси поліхіміотерапії (ПХТ) в онкологічних хворих, оскільки відміна лікування неможлива через небезпеку прогресування основного захворювання, але і його продовження є загрозливим унаслідок розвитку тяжких ускладнень (для прикладу — виникнення токсичного гепатиту).
Важливе клінічне значення мають фактори ризику токсичного ушкодження печінки: гострі та хронічні захворювання печінки в анамнезі, генетична схильність, яка обумовлює індивідуальну чутливість до препаратів, супутні хронічні захворювання (цукровий діабет, ожиріння, ниркова недостатність), прогресуюче онкологічне захворювання [50].
Лікування злоякісних пухлин — це не тільки їх хірургічне видалення, але й довготривале застосування ПХТ, спрямованої на досягнення зниження стадії злоякісного процесу, для зменшення розміру первинної пухлини та її метастазів, для переведення умовно операбельної чи навіть неоперабельної форми пухлини в операбельну. У разі визначення операбельних метастазів у печінці (наприклад колоректального раку (КРР)) проведення нео- чи ад’ювантної ПХТ теоретично обґрунтовується зниженням ризику рецидиву та підвищенням шансів на виконання резекції R0, яка продемонструвала підвищення виживаності без прогресування на 7% за результатами дослідження EPOC [29].
Очевидно, що підвищення вірогідності виліковування чи навіть її поява у пацієнтів, яких раніше вважали невиліковними, потенційно виправдовують застосування ПХТ, у тому числі і в агресивних режимах, які є найбільш ефективними у онкологічних пацієнтів із поширеним метастатичним процесом, найчастіше саме в печінці [16, 31].
Однак інтенсивні режими ПХТ переносять далеко не всі пацієнти, у більшості вони асоційовані з тяжкими ускладненнями, насамперед з боку печінки, частота та прояви яких залежать від багатьох факторів, насамперед від властивостей препарату, стану пацієнта, стадії захворювання, кількості курсів ПХТ та ін. [1, 32].
У процесі біотрансформації і кліренсу хіміопрепаратів печінка відіграє головну роль, тому виникнення гепатотоксичності є важливим небажаним фактором, який впливає на переносимість та ефективність застосовуваної терапії [26].
Гепатотоксичний ефект протипухлинних препаратів реалізується безпосередньо прямою цитотоксичною дією на гепатоцити. Залежно від виду ураження, терміну та інтенсивності дії виділені численні морфологічні варіанти ушкоджень печінки лікувальними препаратами. В основі прозапальних морфологічних змін, які розвиваються в печінковій тканині, є надлишок накопичення жиру в цитоплазмі гепатоцита, обумовлений ушкодженням паренхіматозних клітин печінки, з подальшим виникненням жирової дистрофії, некрозом та холестазом, що спричиняє розвиток стеатогепатиту. Стеатогепатит, асоційований з хіміотерапією (chemotherapy-associated steatohepatitis), є найбільш частим ускладненням при застосуванні препаратів цитостатичної дії [5, 15].
Водночас гепатотоксичне ушкодження не завжди спровоковане дією цитотоксичних препаратів. Часто це можуть бути реакції на прийом антибактеріальних, протигрибкових, гормональних, гіпотензивних лікарських засобів та препаратів супроводу ПХТ. Прийом ліків, які знижують печінковий кровоток (гангліоблокатори, вазоконстриктори, знеболювальні та ін.), навіть у терапевтичних дозах, можуть спровокувати токсичну дію на гепатоцити унаслідок високої чутливості печінки до гіпоксії. Із цієї ж причини шок, синдром дисемінованого внутрішньосудинного згортання, гостра дихальна недостатність, в основі яких — киснева недостатність, становлять ризик та є причиною розвитку токсичного ушкодження печінки. Майже 90% гепатотоксичних реакцій клінічно проявляються гострим гепатоцелюлярним та холестатичним гепатитом, а у половини пацієнтів — їх поєднанням [23, 28].
Однак за наявності пухлинного ураження печінки (наприклад, метастатичний процес), токсичні прояви в паренхімі наявні завжди. У таких випадках ідентифікувати саме цитотоксичну дію препаратів досить складно, оскільки наявність метастазів у печінці вже передбачає її токсичне ушкодження із порушеннями багатьох функцій органу.
Перші відомості про негативну дію цитостатиків на паренхіму печінки та зміну її гістологічної структури у вигляді фіброзу з переходом у цироз з’явилися ще у 1960-х роках під час оцінки ефективності лікування метотрексатом у пацієнтів з гострим лейкозом [19].
Подібні спостереження зафіксовано і при лікуванні пацієнтів зі злоякісними лімфопроліферативними захворюваннями. Тривале застосування метотрексату може викликати пряме токсичне пошкодження здорових клітин печінки, яке може проявитися холестазом та пошкодженням печінкових вен. Частота розвитку патологічних змін у печінці становила 5% при морфологічних дослідженнях [44].
Схеми лікування, які включають препарати платини (оксаліплатин та ін.), значно покращили показники відповіді на лікування у пацієнтів із метастатичним ураженням печінки при КРР [14].
Резекція печінки є кращим варіантом лікування при метастазах КРР, навіть коли було застосовано ПХТ в передопераційний період, оскільки тільки у 15–25% пацієнтів може бути проведено таку терапію на момент першого звернення. Неоперабельне метастатичне ураження печінки потенційно може бути переведено в операбельне, що дозволить здійснити резекцію органа в безпечному обсязі завдяки застосуванню «конверсійної» ПХТ [12, 49].
Проте більшість застосовуваних препаратів поряд із цитотоксичними мають низку інших негативних ефектів на здорову паренхіму. Насамперед вони залежать від концентрації, дози та загального стану пацієнта, і в результаті призведуть до побічних реакцій, які в більшості випадків є передбачуваними.
У багатьох дослідженнях доведено, що застосування ПХТ на основі 5-фторурацилу та іринотекану спричиняє виникнення стеатозу та стеатогепатиту [25, 38, 41]
Одним з найтяжчих ускладнень ПХТ є розвиток синусоїдального обструктивного синдрому (чи вено-оклюзивної хвороби), який виникає внаслідок токсичного ураження синусоїдальних ендотеліальних клітин в неураженій паренхімі та значної синусоїдальної дилатації, що призводить до пошкодження судин та утворення перисинусоїдального фіброзу [32, 48].
Індуковане хіміотерапією синусоїдальне ураження може бути визначено як непухлинне ураження паренхіми печінки та проявлятися кількома патологічними станами: синусоїдальною дилатацією, пеліозом та вузловою регенераторною гіперплазією [10, 45].
Перші повідомлення [45] про зв’язок між ПХТ із оксаліплатином та вено-оклюзивним захворюванням печінки з’явилися ще у 1960-х роках, коли було виявлено ушкодження центральної вени при мікроскопії. Пізніше L. DeLeve та співавтори визнали, що обструкція виникає на рівні синусоїдних капілярів печінки в результаті ушкодження ендотелію стінки [10].
За результатами подальших досліджень повідомлялося, що синусоїдальний обструктивний синдром виник у 51–79% пацієнтів, які проходили ПХТ на основі оксаліплатину, порівняно з 21–30% хворих, які отримували інші схеми ПХТ [34].
Дані іншого дослідження продемонстрували, що частота синусоїдального обструктивного синдрому, спровокованого ПХТ на основі оксаліплатину, була значно вищою у пацієнтів, які отримали більше 6 курсів ПХТ, порівняно з тими, які отримали їх менше [27], при поширеному метастатичному процесі в печінці.
Застосування ПХТ із включенням іринотекану у поєднанні з 5-фторурацилом для лікування найбільш частих злоякісних захворювань — раку прямої кишки, шлунка, шийки матки та легені — призводить до розвитку стеатозу та стеатогепатиту, що має гірший прогноз для пацієнта після резекції печінки, головним чином через розвиток печінкової недостатності та затяжної регенерації [14, 37].
Хіміотерапія спричиняє значну кількість небажаних ефектів щодо здорової паренхіми печінки, які можуть знижувати чи/або ускладнювати виявлення метастатичних осередків у печінці.
Виявлені візуальні зміни в раніше ураженій паренхімі печінки першочергово розглядаються як метастатичне ураження і несуть інформацію як щодо подальшої зміни стадії захворювання, так і в цілому зміни всього плану лікування.
Навіть деякі доброякісні новоутворення (дрібні кісти, гемангіоми), які було діагностовано до виявлення злоякісної пухлини, можуть імітувати метастази на час проведення ПХТ. Візуально це може виглядати проявами судинного та тканинного ураження.
Факт ураження печінки як результат гепатопатії, спровокованої ПХТ (зокрема, синусоїдальне ураження, стеатоз, а також еозинофільний абсцес, асоційований з пухлиною), необхідно розглядати в першу чергу у якості імітатора метастазування при різних злоякісних новоутвореннях. Цілком імовірно, що вони симулюють візуальну картину ураження печінки — наявність «псевдометастазів», що частіше розцінюється як прогресування злоякісного захворювання [3, 8, 39].
Дане поняття в онкологічній/радіологічній практиці майже не дискутується, а всі виявлені осередки в печінці до проведення ПХТ, у період її проведення трактуються як осередки метастатичного характеру [3, 7, 30, 43].
Поява нових осередків у печінці в ході лікування провокує негативний подальший перебіг злоякісного процесу, тому з метою підтвердження чи спростування їх виникнення слід провести біопсію чи повторну операцію. Водночас результати багатьох досліджень показали, що виявлені в період проведення ПХТ нові ураження печінки у пацієнтів зі злоякісними новоутвореннями, не є метастази [3, 8, 17, 21, 46, 52].
Не варто нехтувати і тим фактом, що при застосуванні ПХТ є висока вірогідність появи новоутворень (метастазів) у печінці [38].
У багатьох пацієнтів, яким проводиться ПХТ, спостерігається зміна показників крові внаслідок виникнення гіпоксичного стану в печінці. Підвищення рівня білірубіну сироватки крові, аспартатамінотрансферази (АсАТ), аланінамінотрансферази (АлАТ) є маркерами розвитку гепатотоксичності.
У період лікування пацієнта зі злоякісним новоутворенням точна діагностика та інтерпретація отриманого зображення (зміна структури органа в цілому чи виявлення новоутворень, яких раніше не було в печінці) є принципово важливим моментом для досягнення оптимальних результатів проведеного курсу ПХТ.
Застосування променевих методів діагностики з метою отримання візуальних зображень печінки є актуальною та необхідною складовою в діагностичному алгоритмі, спрямованому на оцінку відповіді пухлини протягом періоду лікування, виявлення метастазів та рецидиву, а також можливості виключити/підтвердити наявність злоякісних новоутворень, яких раніше не було. Тому при контрольних радіологічних дослідженнях варто враховувати такі візуальні зміни під час інтерпретації діагностичних зображень [11, 33, 49, 51].
Ультразвукове дослідження (УЗД) дотепер залишається першочерговим методом діагностики захворювань печінки. Виявлення гепатоспленомегалії, симптомів портальної гіпертензії, змін у судинному руслі печінки можна розцінювати як появу специфічних симптомів розвитку обструктивного синдрому. Допплерометричний моніторинг печінкового кровотоку констатує обструкцію печінкових та порожнистої вен, а також аномальний кровоток від печінкових вен, що є інформативним для ранньої та диференційної діагностики, особливо при безсимптомному виникненні токсичного ушкодження [9, 11].
Візуально складно відокремити стеатоз від стеатогепатиту. При УЗД паренхіма печінки має підвищену ехогенність, при комп’ютерній томографії (КТ) — низьку щільність, порівняно зі щільністю селезінки. При магнітно-резонансній томографії (МРТ) зони локального стеатозу є гіпоінтенсивними, що вказує на знижену функцію гепатоцитів, а при підсиленні — компенсаторне підвищення сигналу від локальної зони ушкодження [40, 42].
Діагностика синусоїдальних уражень ґрунтується на клінічних критеріях з урахуванням клінічних проявів та доповненням іншими діагностичними методами.
Візуальні зображення печінки, отримані променевими методами, демонструють наявність морфологічних та структурних змін, що свідчать про її ураження [2, 20, 32].
У дослідженнях N. Han та співавторів [17, 18] повідомлено, що «постоксаліплатинова гетерогенність паренхіми печінки» проявляється у вигляді дифузної та гетерогенної гіпоатенуації на контрастно-підсилених зображеннях, що часто спостерігається у пацієнтів, котрим була проведена ПХТ на основі оксаліплатину [17, 18]. А виявлення ретикулярної гіпоінтенсивності печінки в гепатобіліарну фазу МРТ є високоспецифічною ознакою виникнення синусоїдального обструктивного синдрому [35, 36, 47].
Представлено дані, що виконання позитронно-емісійної томографії печінки забезпечує неінвазивну візуалізацію метаболізму глюкози у всьому тілі та все частіше використовується для прогнозування реакції на системну ПХТ. Пошкодження гепатоцитів призводить до зміни гемодинаміки та виникнення мікроциркуляторної обструкції з порушенням балансу вхідного та вихідного кровотоку в судинах печінки, що призводить до застою та пасивно підвищує активність індикатора глюкози в крові [21].
Застосування променевих методів дослідження в період проведення ПХТ є важливою складовою в загальному плані лікування пацієнтів зі злоякісними новоутвореннями. Поєднання різних радіологічних методів та діагностичних методик може зробити вагомий внесок для досягнення позитивних результатів лікування.
У нашому дослідженні було зроблено спробу оцінити можливості променевих методів у діагностичному моніторингу та проаналізувати зміни в печінці, які виникли в період проведення ПХТ.
Мета роботи
Метою роботи є оцінка динамічних діагностичних зображень паренхіми печінки при злоякісних новоутвореннях, отриманих за допомогою різних променевих методів у пацієнтів, які отримували курси ПХТ, та зіставлення візуальних результатів з клінічними даними та лабораторними показниками.
Матеріал та методи
Виконано дослідження, ретроспективно оцінено та порівняно результати діагностичного супроводу ПХТ, проведеної у нео- та ад’ювантному режимах у 104 пацієнтів зі злоякісними новоутвореннями різної локалізації та метастатичним ураженням печінки. Співвідношення чоловіків та жінок — 66:38 відповідно, віковий діапазон — 34,7–78,9 років, у середньому — 53,2 роки.
Критеріями включення пацієнтів у дослідження було проведення динамічних досліджень у період ПХТ, а також наявність базових досліджень (УЗД, КТ та МРТ) до початку проведення ПХТ у пацієнтів з метастатичним процесом у печінці та злоякісними пухлинами без метастатичного ураження печінки.
Контрольні КТ-дослідження виконували згідно з нормами променевого навантаження, але не частіше ніж через 6 тиж після попереднього дослідження. МРТ проводили до початку лікування, для виключення метастазів у печінці, особливо малих розмірів, при сумнівних результатах УЗД та КТ. УЗД здійснювали в період встановлення діагнозу, для визначення поширеності злоякісного процесу, а також у період проведення ПХТ через кожні 2 курси.
Критерії виключення з дослідження: множинні (>10 одиниць) метастази в печінці, де мало здорової нормальної паренхіми, що унеможливлює оцінку, осередки великих розмірів (>10 см). Наявність метастазів великих розмірів уже призводить до значущих гемодинамічних порушень, насамперед порушення перфузії та високої ймовірності появи нових осередків.
Також у дослідження не включали пацієнтів із супутніми захворюваннями: цукровим діабетом II типу, дисліпідемією, артеріальною гіпертензією, перенесеними гепатитом В та С, вживанням алкоголю (за даними опитування хворого), які обумовлюють схильність до виникнення метаболічного фону, що впливає на розвиток неалкогольного стеатогепатиту.
Проведено поліфакторний аналіз для визначення зв’язку між клінічними факторами (вік, стать, стадія злоякісного процесу, наявність метастазів у печінці, режим хіміотерапії, ферментні показники крові (АлАТ, АсАТ) до початку лікування та їх зміни в процесі терапії.
Радіологічне визначення гепатотоксичності та ремісію визначали на основі порівняння гетерогенності паренхіми печінки, за даними застосованих методів візуалізації (оцінка паренхіми печінки за результатами якісних та кількісних показників при динамічному моніторингу) та порівняння з базовими дослідженнями та лабораторними показниками. Тест рангової кореляції Спірмена (р) використовували для оцінки кореляцій між двома змінними величинами, їх вважали статистично значущими при р <0,05.
Результати та обговорення
Виконані дослідження та аналіз результатів дозволили оцінити період проведення ПХТ у пацієнтів зі злоякісними пухлинами різних локалізацій та токсичні прояви в печінці. Важливим завданням радіологічного дослідження є оцінка результатів лікування та своєчасне виявлення ушкоджень, зокрема гепатотоксичного ефекту як одного з небажаних ускладнень. У табл. 1 наведено результати поліфакторного аналізу обстежених пацієнтів.
Таблиця 1. Демографічні та клінічні характеристики популяції пацієнтів
| Характеристика | Показник, n=104 | |
| n | % | |
| Вік, медіана (діапазон) | 20–80 53,2
(34,7–78,9) |
|
| Стать (чоловік/жінка) | 66/38 | 63,5/36,5 |
|
Злоякісні пухлини:
|
104
69 13 7 4 5 11 |
100
66,3 12,5 6,7 3,8 4,8 10,5 |
| Метастази в печінці (колоректальний рак, рак шлунка, рак підшлункової залози) | 59 | 56,7 |
| Інтервал поміж проведеними курсами ПХТ та повторними (УЗД, КТ, МРТ) дослідженнями (тиж) | (6,6±3,0) | |
| Показники активності ферментів крові | ||
АлАТ (ммоль/л)
|
12
27 |
12,5
25,9 |
АсАТ (ммоль/л)
|
9
21 |
8,6
20,1 |
|
Білірубін
|
17 | 16,3 |
| Кількість проведених курсів ПХТ | (6,3±4,2) | |
| Кількість проведених динамічних (УЗД, КТ, МРТ) досліджень (враховуючи базові дослідження) | (9,3±3,6) | |
Системні хіміотерапевтичні препарати першої лінії при метастазах КРР, зокрема FOLFOX-6 (комбінацяя 5-фторурацилу/лейковоріну [5-FU / LV] і оксаліплатину) і FOLFIRI (комбінація 5-FU/LV і іринотекану) у більшості випадків проявлялися гепатотоксичністю у вигляді дифузної зміни паренхіми печінки. Під час співставлення з лабораторними показниками відмічено підвищення в крові пацієнтів рівня АлАТ, АсАТ та білірубіну щодо верхньої межі норми до початку ПХТ. Тому одночасна зміна гетерогенності паренхіми печінки та підвищення рівня трансаміназ розцінювалася як маркер гепатотоксичності.
Лабораторні дослідження показали підвищення рівня печінкових трансаміназ (АлАТ, АсАТ) у 38,4% пацієнтів, причому тільки у 12,5% ці дані було виявлено після 2 перших курсів ПХТ. У подальшому (після 6 курсів ПХТ) ще у 14,4% хворих було виявлено підвищення рівня трансаміназ в 2, а у 11,5% — в 3 рази.
Рівні білірубіну в сироватці крові були підвищеними у 16,3 % пацієнтів, це було констатовано після 6 курсів ПХТ, у більшості досліджень разом з підвищеними рівнями трансаміназ.
У 59 (56,7%) пацієнтів було виявлено метастази в печінці в період встановлення діагнозу та стадіювання злоякісного процесу. При подальшому аналізі вагомий відсоток змін в паренхімі печінки та в лабораторних показниках спостерігався саме у пацієнтів з метастазами в печінці.
Результати моніторингу в період проведення хіміотерапевтичного лікування. У проведених УЗД, КТ та МРТ-дослідженнях виявлені ознаки, які з’явилися в період проведення лікування, а саме: гепатомегалія, спленомегалія, помірний асцит та недостатність портального кровотоку (табл. 2). Такі дані були очікуваними [13, 22] та підтверджені.
Таблиця 2. Ознаки гепатотоксичності за результатами діагностичного моніторингу
| Ознака | n | % | р* |
| Гепатомегалія | 87 | 83,6 | <0,05 |
|
Переважна локалізація в печінці:
|
24
37 67 |
23,1
35,5 64,4 |
|
| Спленомегалія | 23 | 22,1 | <0,05 |
|
Зміна портального кровотоку:
|
36
17 8 12 9 13 2 7 |
34,6
16,3 7,7 11,5 8,6 12,5 1,9 6,7 |
<0,05 |
| Асцит | 11 | 10,5 | <0,05 |
| Зміна структури при УЗ/КТ/МРТ дослідженнях | 79 | 75,9 | <0,05 |
|
Наявність додаткових новоутворень в печінці:
|
24
18 |
23,1
17,3 |
<0,05 |
*Усі оцінювані ознаки порівнювалися з базовими даними, до проведення ПХТ. Показник вираженості радіологічних симптомів корелював із даними лабораторних досліджень.
Основною радіологічною ознакою була зміна структури паренхіми печінки в період проведення ПХТ, яка виявлялася всіма діагностичними методами.
Результати контрольних досліджень надали інформацію щодо динаміки зображень печінки в період лікування, особливо при безсимптомному перебігові. Такі дані включали збільшення розмірів печінки у переважної (87 (83,6%) більшості хворих та спленомегалію — у 23 (22,1%). Виникнення хоча б 2 ознак, які характерні для портальної гіпертензії — у більшості хворих, поява асциту — у 11 (10,5%) пацієнтів, були нами визначені як прояви гепатотоксичності.
У режимі ультразвукової допплерометрії визначено зміни в судинному руслі печінки у третини (36 (36,4%) пацієнтів, а саме: уповільнення ворітного кровотоку (<10 см/с) — у 13 (12,5%), зі зниженням його спектральної щільності — у 9 (8,6%) хворих. Ці дані характеризують синусоїдальне пошкодження ендотелію, хоча в базових та перших динамічних дослідженнях, уже після декількох курсів ПХТ, по ворітній вені підтримувався нормальний кровоток. Однак по мірі розвитку гепатотоксичності та негативного перебігу кровоток уповільнювався, а при тяжких пошкодженнях виникав поступовий рефлюкс — у 2 (1,9%) хворих.
Важливими допоміжними симптомами було визначено втрату фазності відтоку по печінкових венах — у 7 (6,7%) пацієнтів, звуження діаметра печінкових вен – у 8 (7,7 %) хворих та появу монофазного, низькоамплітудного потоку — у 7 (6,7%), що характеризувало втрату еластичності печінки, спровокованої венозним стазом. Ці гемодинамічні зміни були тісно пов’язані з негативним перебігом та проявами гепатотоксичності.
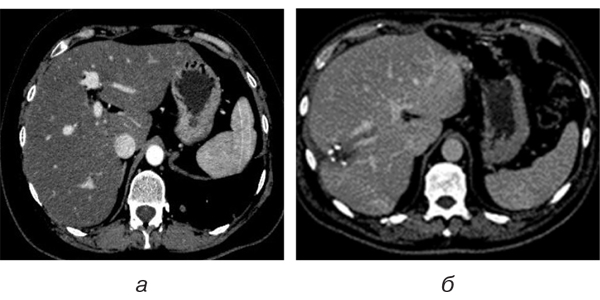
Під час виконання динамічних КТ, перш за все спрямованих на визначення ефективності лікування та можливого прогресування, головними симптомами була зміна паренхіматозного підсилення при контрастуванні, порівняно з базовими дослідженнями, яка проявлялася зниженою щільністю паренхіми печінки в ранню артеріальну фазу (в межах +20… – +40 од. Х), відсутністю чи мінімальним підсиленням (до 60 од. Х) у портальну фазу та вираженою неоднорідністю, чи гетерогенністю паренхіми, яка зберігалася і під час відстроченого сканування. Такі дані були отримані у 75,9% проведених досліджень.
Змінена паренхіма частіше локалізована в периферичних (64,4%) зонах печінки та в правій частці. Гетерогенне підсилення в портальну фазу сканування при КТ свідчить про виникнення синусоїдального обструктивного синдрому, який може бути дифузним, периферичним чи багатоосередковим, залежно від локалізації.
Групування синусоїд та переповнення їх кров’ю обумовлює затримку розподілу контрасту. Звідси й латеральна гетерогенність. Виконання дослідження в режимі ангіографії дозволило виявити та оцінити порушення анатомічного ходу інтрапечінкових судин; недостатньо контрастовані дрібні артерії та на межі визначення печінкові вени, збільшення діаметра печінкової артерії та дольових гілок, що є типовими ознаками токсичних проявів ПХТ (рис. 1).
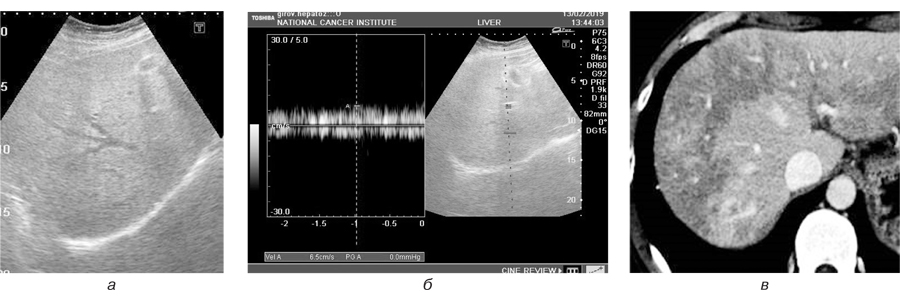
Вищенаведені візуальні дані є результатом патологічного прояву синдрому синусоїдальної обструкції, котрий показує неоднорідність печінкової паренхіми, яка представлена периферичними зонами ураження та нормальною паренхімою.
Виявлені зміни при динамічних МРТ-дослідженнях пояснюються тим, що обструкція та високий тиск у синусоїдах змінюють напрямок печінкового кровотоку. У результаті відбувається пошкодження гепатоцитів та зниження інтенсивності ретикулярного сигналу при візуалізації гепатобіліарної фази унаслідок порушеного поглинання контрасту дисфункціональними гепатоцитами та зміненого портального кровотоку (рис. 2).
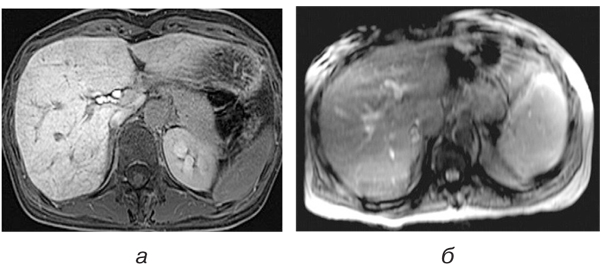
Окрім того, відомо, що ретикулярна гетерогенність паренхіми печінки є типовою при виникненні осередкового синусоїдального ураження, спровокованого ПХТ, що гістопатологічно пов’язано. При динамічних МР-дослідженнях тривалий час зберігалася гетерогенність паренхіми у вигляді локальних зон гіперінтенсивності.
Важливим завданням є діагностика новоутворень у печінці, що виникли в період проведення ПХТ, які імітують метастази під час динамічних досліджень.
Результати візуалізації осередкового синусоїдального ураження, спровокованого хіміотерапією, імітували метастазування, оскільки візуально проявлялися як осередки в печінці, що нещодавно виникли. Результати досліджень оцінювалися як прогресування захворювання. Такі дані були отримані майже в половини (44,2%) пацієнтів у дослідженні.
При УЗ-дослідженнях у паренхімі визначалися новоутворення неправильної форми, без чітких контурів, переважно зниженої ехогенності. На КТ із довенним підсиленням такі новоутворення проявлялися гіподенсивними (іноді гетерогенними) та слабо підсилювалися в портальну та відстрочену фази, але специфічної картини при підсиленні не було виявлено (рис. 3).
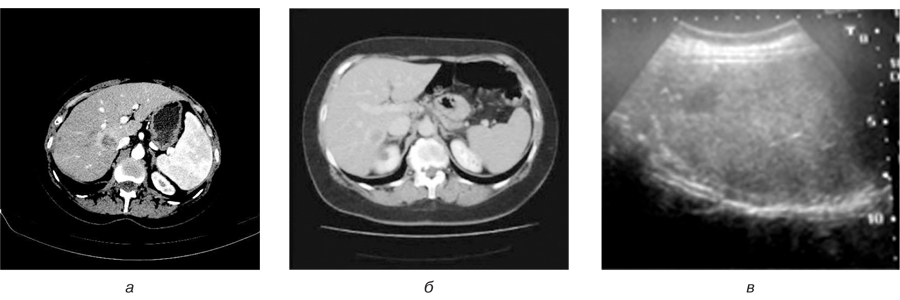
Наші результати показали, що ці візуальні дані відрізняються від результатів, що характеризують метастатичне ураження, а саме: несферична форма, нерівний та нечіткий контур новоутворення, відсутність підсилення контрастом в артеріальну фазу, або двозначність підсилення на КТ-зображеннях у вигляді зон підвищеної/зниженої щільності. Під час МРТ-досліджень в псевдоосередку також відмічається поєднання ізоінтенсивного з гіперінтенсивним сигналом на Т2-зважених зображеннях.
Фокусно-акцентована форма синусоїдального ураження, спровокованого ПХТ, мала незначно виражені та нечіткі ознаки метастатичного ураження (недостатньо чітких ознак для трактування жодним променевим методом), але поява таких нових локальних осередків у пацієнтів зі злоякісними новоутвореннями розцінювалася як прогресування захворювання на фоні лікування (рис. 4).
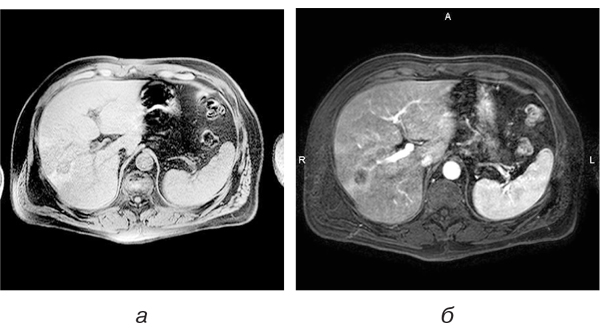
Аналізуючи зображення, які були отримані застосованими методами, слідує вважати, що нечіткість меж псеводоосередка та неправильність форми є найбільш цінними симптомами для диференційної діагностики.
Результати динамічного променевого моніторингу пацієнтів, яким проводилася ПХТ, свідчать про те, що в середньому час досягнення максимального прояву зміни гетерогенності печінкової паренхіми становив приблизно 2,5–3 міс (діапазон 30–200 днів) після дати першого курсу ПХТ. В окремих випадках значущі видимі прояви гетерогенності паренхіми відмічали після 2 наступних курсів ПХТ, що вкладалося у термін 30 днів.
Виявити чіткі зворотні зміни в ході динамічних досліджень у пацієнтів, які закінчили ПХТ, було досить складно. У подальших дослідженнях середній термін досягнення радіологічної ремісії (відновлення паренхіми та її однорідності) становив у середньому 3–4 міс (85,5± 48,8 днів) після останнього курсу ПХТ.
Вирівнювання однорідності паренхіми печінки при підсиленні розцінювали як ознаку її нормалізації. У деяких наших дослідженнях виникнення фіброзу та портальної гіпертензії зберігалися протягом тривалого часу (рис. 5).
Вищенаведені діагностичні зображення демонструють моніторинг лікування протягом 4 років.
Висновок
Хіміотерапевтичне лікування пацієнтів зі злоякісними новоутвореннями є вагомою складовою в лікувальному алгоритмі. Виникнення гепатотоксичності може бути причиною порушення протоколів лікування, оскільки виникає необхідність у зниженні дози препарату, відтермінуванні курсів ПХТ, що призводить до погіршення результатів терапії.
Структурні та функціональні зміни, які розвиваються в паренхімі печінки в період проведення ПХТ, залишаються в полі зору та активно вивчаються. Вагомий інтерес до цієї проблеми проявляється багатьма фахівцями, у тому числі й радіологами. Проведення моніторингу досліджень та аналіз отриманих результатів дозволили зробити висновки, що поєднання та використання комплексу радіологічних методів діагностики, визначення найбільш значимих симптомів та порівняння результатів із лабораторними показниками може сприяти перегляду призначеного хіміотерапевтичного лікування.
Вивчення механізмів розвитку токсичного ураження печінки, правильна оцінка клінічного перебігу, співставлена з лабораторними та радіологічними даними, дозволить унеможливити її виникнення або зменшити прояви, що покращить безпосередні та віддалені результати лікування онкологічних хворих.
Список використаної літератури
- 1. Кляритская, И. Л., & Максимова, Е. В. (2010). Токсические поражения печени у онкобольных при химиотерапии. Кримский терапевтический журнал,1: 26–31.
- 2. Abadia Barno, M., Marin Serrano, E., & Ruiz Fernandez, G. (2017). Use of abdominal ultrasound in the diagnosis of hepatic sinusoidal obstruction syndrome (SOS) in a patient receiving a hematopoietic-cell transplant. Revista espanola de enfermedades digestivas, 109, 608–609. doi: 10.17235/reed.2017.4823/2017.
- 3. Arakawa, Y., Shimada, M., Utsunomya, T., Imura, S, Morine, Y., Ikemoto, T, … Bando, Y. (2013). Oxaliplatin-related sinusoidal obstruction syndrome mimicking metastatic liver tumors. Hepatology Research, 43, 685–689. doi: 10.1111/j.1872-034X.2012.01114.x.
- 4. Bjornsson, E. S. (2014). Epidemiology and risk factors for idiosyncratic drug-induced liver injury. Seminars in Liver Disease, 34(2),115–112. doi: 10.1055/s-0034-1375953.
- 5. Brunt, E. M. (2004). Nonalcoholic steatohepatitis. Seminars in Liver Disease, 24, 3–20. doi: 10.1055/s-2004-823098.
- 6. Chalasani, N. P., Hayashi, P. H., Bonkovsky, H. L., Navarro, V. J., Lee, W. M., & Fontana, R. J. (2014). ACG Clinical Guideline: the diagnosis and management of idiosyncratic drug-induced liver injury. The American Journal of Gastroenterology, 109(7), 950–966. doi: 10.1038/ajg.2014.131.
- 7. Choi, J. H., Won, Y. W., Kim, H. S., Oh, Y. H., Lim, S., & Kim, H. J. (2016). Oxaliplatin-induced sinusoidal obstruction syndrome mimicking metastatic colon cancer in the liver. Oncology Letters, 11, 2861–2864. doi: 10.3892/ol.2016.4286.
- 8. Choi, J. S., & Kim, M. J. (2011). Education and imaging: hepatobiliary and pancreatic: focal steatohepatitis mimicking a metastasis. Journal of Gastroenterology & Hepatology, 26, 415. doi: 10.1111/jgh.12960.
- 9. Corvino, A., Sandomenico, F., Corvino, F., Campanino M. R., Verde F., Giurazza F., … Catalano O. (2019). Utility of a gel stand-off pad in the detection of Doppler signal on focal nodular lesions of the skin. Journal of Ultrasound, 23(1), 45–53. doi: 10.1007/s40477-019-00376-3.
- 10. DeLeve, L. D., McCuskey, R. S., Wang, X., Hu, L., McCuskey, M. K., Epstein, R. B., Kanel, G. C. (1999). Characterization of a reproducible rat model of hepatic veno-occlusive disease. Hepatology, 29, 1779–1791. doi: 10.1002/hep.510290615.
- 11. Dietrich, C. F., Trenker, C., & Fontanilla, T. (2018). New Ultrasound Techniques Challenge the Diagnosis of Sinusoidal Obstruction Syndrome. Ultrasound in Medicine and Biology, 44, 2171–2182. doi: 10.1016/j.ultrasmedbio.2018.06.002.
- 12. Duwe G., Knitter S., Pesthy S., Beierle A.S., Bahra M., Schmelzle M., … Andreou, A. (2017). Hepatotoxicity following systemic therapy for colorectal liver metastases and the impact of chemotherapy-associated liver injury on outcomes after curative liver resection. European Journal of Surgical Oncology, 43: 1668–1681. doi: 10.1016/j.ejso.2017.05.008.
- 13. Erturk, S. M., Mortelé, K. J., Binkert, C. A., Glickman, J. N., Oliva, M. R., Ros, P. R., & Silverman, S. G. (2006). CT features of hepatic venoocclusive disease and hepatic graft-versus-host disease in patients after hematopoietic stem cell transplantation. AJR American Journal of Roentgenology, 186: 497–1501. doi: 10.2214/AJR.05.0539.
- 14. Fernandez, F. G., Ritter, J., Goodwin, J. W., Linehan, D. C., Hawkins, W. G., & Strasberg, S. M. (2005). Effect of steatohepatitis associated with irinotecan or oxaliplatin pretreatment on resectability of hepatic colorectal metastases. Journal of the American College of Surgeons, 200, 845–853. doi: 10.1016/j.jamcollsurg.2005.01.024.
- 15. Fong, Y., & Bentrem, D. J. (2006). CASH (Chemotherapy-associated steatohepatitis) costs. Annals of Surgery, 243: 8–9. doi: 10.1097/01.sla.0000193599.57858.9.
- 16. Fuchs, C. S., Marshall, J., & Mitchell, E. (2007). Randomized, controlled trial of irinotecan plus infusional, bolus, or oral fluoropyrimidines in first-line treatment of metastatic colorectal cancer: results from the BICC – C Study. Journal of Clinical Oncology, 25(30): 4779 – 4786. doi: 10.1200 / JCO. 2007.11.3357.
- 17. Han, N. Y., Park, B. J., Kim, M. J., Sung, D. J., & Cho, S. B. (2015). Hepatic parenchymal heterogeneity on contrast-enhanced CT scans following oxaliplatin-based chemotherapy: natural history and association with clinical evidence of sinusoidal obstruction syndrome. Radiology, 276: 766–774. doi: 10.1148/radiol.2015141749.
- 18. Han, N. Y., Park, B. J., Sung, D. J., Kim, M. J., Cho, S. B., Lee ,C. H., … Yang, K. S. (2014). Chemotherapy-induced focal hepatopathy in patients with gastrointestinal malignancy: gadoxetic acid — enhanced and diffusion-weighted MR imaging with clinical-pathologic correlation. Radiology, 271, 416-425. doi: 10.1148/radiol.13131810.
- 19. Hutter, R. V. P., Shipkey, F. H., Tan, C. T. C. Murphy, ML, & Chowdhury, M. (1960). Hepatic fibrosis in children with acute leukemia: a complication of therapy. Cancer, 13, 288–307. doi: 10.1002/1097-0142(196003/04)13:2<288::aid-cncr2820130213>3.0.co;2-l.
- 20. Jones, R. J., Lee, K. S., & Beschorner, W. E. (1987). Venoocclusive disease of the liver following bone marrow transplantation. Transplantation, 44: 778–783. doi: 10.1097/00007890-198712000-00011.
- 21. Kim, H., Baek, S. E., Moon, J., Roh, Y. H., Lee, N., & Cho, A. (2016). Increased hepatic FDG uptake on PET/CT in hepatic sinusoidal obstructive syndrome. Oncotarget, 7: 69024–69031. doi: 10.18632/oncotarget.11816.
- 22. Lassau, N., Leclère, J., Auperin, A., Bourhis, J. H., Hartmann, O., Valteau-Couanet, D., … Roche, A. (1997). Hepatic veno-occlusive disease after myeloablative treatment and bone marrow transplantation: value of gray-scale and Doppler US in 100 patients. Radiology, 204: 545–552. doi: 10.1148/radiology.204.2.9240551.
- 23. Lee, W. M. (2013). Drug-induced acute liver failure. Clinics in Liver Disease, 17:575–586. doi: 10.1016/j.cld.2013.07.001
- 24. Licata, A. (2016). Adverse drug reactions and organ damage: The liver. European Journal of Internal Medicine, 28, 9–16. doi: 10.1016/j.ejim.2015.12.017.
- 25. McCullough, A. J. (2006). Pathophysiology of Nonalcoholic Steatohepatitis. Journal of Internal Medicine, 40(1), S17–S29. doi: 10.1097/01.mcg.0000168645.86658.22.
- 26. McDonnell М. Е. (2006). Drug-related hepato-toxicity. The New England Journal of Medicine, 354, 2191–2193.
- 27. Nakano, H., Oussoultzoglou, E., Rosso, E., Casnedi, S., Chenard-Neu, M. P., Dufour, P., … Jaeck, D. (2008). Sinusoidal injury increases morbidity after major hepatectomy in patients with colorectal liver metastases receiving preoperative chemotherapy. Annals of Surgical, 247, 118–124. doi: 10.1097/SLA.0b013e31815774de.PMID: 18156931.
- 28. Navarro. V. J., & Senior, J. R. (2006). Drug-related hepatotoxicity. The New England Journal of Medicine, 354, 731–739. doi: 10.1056/NEJMra052270.
- 29. Nordlinger, B., Sorbye, H., Glimelius, B., Poston, G. J., Schlag, P. M., Rougier, P., … Gruenberger, T. (2008). Perioperative chemotherapy with FOLFOX4 and surgery versus surgery alone for resectable liver metastases from colorectal cancer (EORTC Intergroup trial 40983): a randomised c ontrolled trial. The Lancet, 371, 1007 –10 16. doi: 10.1016/S1470-2045(13)70447-9.
- 30. Pawlik, T. M., Olino, K., Gleisner, A. L., Torbenson, M., Schulick, R., & Choti, M. A. (2007). Preoperative chemotherapy for colorectal liver metastases: impact on hepatic histology and postoperative outcome. Journal of Gastrointestinal Surgery, 11: 860–868. doi: 10.1007/s11605-007-0149-4.
- 31. Petrelli, F., & Barni, S. (2012). Resectability and outcome with anti-EGFR agents in patients with KRAS wild-type colorectal liver-limited metastases: a meta-analysis. International Journal of Colorectal Disease, 27 (8), 997 – 1004. doi: 10.1007/s00384-012-1438-2.
- 32. Robinson, S. M., Wilson, C. H., Burt, A. D., Manas, D. M., & White, S. A. (2012). Chemotherapy-associated liver injury in patients with colorectal liver metastases: a systematic review and meta-analysis. Annals of Surgical Oncology, 19, 4287–4299. doi: 10.1245/s10434-012-2438-8.
- 33. Ravaioli, F., Colecchia, A., Alemanni, L. V., Vestito, A., Dajti, E., Marasco, G., … Festi, D. (2019). Role of imaging techniques in liver veno-occlusive disease diagnosis: recent advances and literature review.Expert Review of Gastroenterology & Hepatology, 13(5): 463–484. doi: 10.1080/17474124.2019.1588111.
- 34. Rubbia-Brandt, L., Audard, V., Sartoretti, P., Roth, A. D., Brezault, C., Le Charpentier, M., … Terris, B. (2004). Severe hepatic sinusoidal obstruction associated with oxaliplatin-based chemotherapy in patients with metastatic colorectal cancer. Annals of Oncology, 15: 460–466. doi: 10.1093/annonc/mdh095.
- 35. Shin, N. Y., Kim, M. J., Lim, J. S., Park, M. S., Chung, Y. E., Choi, J. Y., … Park, Y. N. (2012). Accuracy of gadoxetic acid-enhanced magnetic resonance imaging for the diagnosis of sinusoidal obstruction syndrome in patients with chemotherapy-treated colorectal liver metastases. European Radiology, 22, 864–871. doi: 10.1007/s00330-011-2333-x.
- 36. Smith, J. T., Ward, J., Guthrie, J. A., Sheridan, M.B., Boyes, S., Wilson, D., … Robinson, P. J. (2012). Detection of colorectal metastases in patients being treated with chemotherapy utilising SPIO-MRI: a radiological-pathological study. Magnetic Resonance Imaging, 30,1446–1453. doi: 10.1016/j.mri.2012.04.016.
- 37. Sommer, J., Mahli, A., Freese, K., Schiergens, T. S., Kuecuekoktay, F. S., Teufel, A., … Hellerbrand, C. (2017). Analysis of molecular mechanisms of 5-fluorouracil-induced steatosis and inflammation in vitro and in mice. Oncotarget, 8(8):13059–13072. doi: 10.18632/oncotarget.14371.
- 38. Torrisi, J. M., Schwartz, L. H., Gollub, M. J., Ginsberg, M. S., Bosl, G. J., & Hricak, H. (2011). CT findings of chemotherapy-induced toxicity: what radiologists need to know about the clinical and radiologic manifestations of chemotherapy toxicity. Radiology, 258, 41–56. doi: 10.1148/radiol.10092129.
- 39. Uchino, K., Fujisawa, M., Watanabe, T., Endo, Y., Nobuhisa, T., Matsumoto, Y., … Matsukawa, A. (2013). Oxaliplatin-induced liver injury mimicking metastatic tumor on images: a case report. Japanese Journal of Clinical Oncology, 43, 1034–1038. doi: 10.1093/jjco/hyt113.
- 40. Unal, E., Karaosmanoglu, A. D., Ozmen, M. N., Akata, D., & Karcaaltincaba, M. (2018). Hepatobiliary phase liver MR imaging findings after Oxaliplatin-based chemotherapy in cancer patients. Abdominal Radiology (NY), 43, 2321–2328. doi: 10.1007/s00261-018-1482-7.
- 41. Vauthey, J. N., Pawlik, T. M., Ribero, D., Wu, T. T., Zorzi, D., Hoff, P.M., … Abdalla, E.K. (2006). Chemotherapy regimen predicts steatohepatitis and an increase in 90-day mortality after surgery for hepatic colorectal metastases. Journal of Clinical Oncology, 24: 2065–2072. doi: 10.1200/JCO.2005.05.3074.
- 42. Viswanathan, C., Truong, M. T., Sagebiel, T. L., Bronstein, Y., Vikram, R., Patnana, M., … Bhosale, P. R. (2014). Abdominal and pelvic complications of nonoperative oncologic therapy. Radiographics, 34: 941–61. doi: 10.1148/rg.344140082.
- 43. Ward, J., Guthrie, J. A., Sheridan, M. B., Boyes, S., Smith, J. T., Wilson, D., … Robinson, P. J. (2008). Sinusoidal obstructive syndrome diagnosed with superparamagnetic iron oxide-enhanced magnetic resonance imaging in patients with chemotherapy-treated colorectal liver metastases. Journal of Clinical Oncology, 26: 4304–4310. doi: 10.1200/JCO.2008.16.1893.
- 44. Whiting-O’Keefe, Q. E., Fye, K. H., & Sack, K. D. (1991). Methotrexate and histologic hepatic abnormalities: а meta-analysis. The American Journal of Medicine, 90(1), 711–716.
- 45. Willmot, F. C., & Robertson, G. W. (1920). Senecio disease, or cirrhosis of the liver due to senecio poisoning. The Lancet, 196, 848–849.
- 46. Xiong, W. J., Hu, L. J., Jian, Y. C., He, Y., Zhou, W., & Guo, X. L. (2012). Focal peliosis hepatis in a colon cancer patient resembling metastatic liver tumor. World Journal of Gastroenterology, 18, 5999–6002. doi: 10.3748/wjg.v18.i41.5999.
- 47. Yoneda, N., Matsui, O., Ikeno, H., Inoue, D., Yoshida, K., Kitao, A., … Ohta, T. (2015). Correlation between Gd-EOB-DTPA-enhanced MR imaging findings and OATP1B3 expression in chemotherapy-associated sinusoidal obstruction syndrome. Abdominal Imaging, 40, 3099–3103. doi: 10.1007/s00261-015-0503-z.
- 48. Yoo, S. Y., Han, J. K., Kim, Y. H., Kim, T. K., Choi, B. I., & Han, M. C. (2003). Focal eosinophilic infiltration in the liver: radiologic findings and clinical course. Abdominal Imaging, 28, 326–332. doi: 10.1007/s00261-002-0050-2.
- 49. You, S-H., Park, B. J., & Kim, Y. H. (2017). Hepatic Lesions that Mimic Metastasis on Radiological Imaging during Chemotherapy for Gastrointestinal Malignancy: Recent Updates. Korean Journal of Radiology, 18, 413–26. doi: 10.3348/kjr.2017.18.3.413.
- 50. Zoppini, G., Fedeli, U., Gennaro, N., Saugo, M., Targher, G., & Bonora, E. (2014). Mortality from chronic liver diseases in diabetes. The American Journal of Gastroenterology, 109(7), 1020–1025. doi: 10.1038/ajg.2014.132.
- 51. Zhang, Y., Yan, Y., & Song, B. (2019). Noninvasive imaging diagnosis of sinusoidal obstruction syndrome: a pictorial review. Insights Imaging, 10(1), 110. doi: 10.1186/s13244-019-0791-x.
- 52. Zhou, B., Yan, S., & Zheng, S. (2013). Peliosis hepatis: a mimicker of hepatic tumors. Surgical Practice, 7, 124–126. doi.org/10.1111/j.1744-1633.2012.00640.x.
Диагностическая ценность методов визуализации токсических повреждений печени после системной полихимиотерапии (аналитический обзор публикаций и результаты собственных исследований)
Национальный институт рака, Киев
Резюме. В статье представлены и проанализированы научные данные многочисленных публикаций по токсичным повреждениям печени в период проведения полихимиотерапии (ПХТ) у пациентов со злокачественными опухолями различного генеза и локализации. Обобщены и сравнены результаты комплекса используемых лучевых (ультразвуковое исследование, магнитно-резонансная томография и спиральная компьютерная томография) методов исследований, диагностических изображений печени в период химиотерапевтического лечения, результаты которого вызвали возникновение токсических повреждений при метастазах опухолей различных локализаций и токсические проявления без метастатического поражения печени. Непосредственно рассматривается основной токсический эффект на паренхиму печени, выявленный в результате проведенного диагностического мониторинга по результатам использованных методов визуальной оценки изображений. Полученные и интерпретированы данные свидетельствуют, что ПХТ играет роль как агента прямого влияния на злокачественные новообразования в печени (первичные злокачественные опухоли печени, метастатическое поражение), так и как фактора опосредованного токсического воздействия на здоровую паренхиму. Факт поражения печени как результат токсического влияния, спровоцированного ПХТ (синусоидальное поражения, стеатоз, стеатогепатит), следует рассматривать в первую очередь как имитацию метастазирования. Диагностический мониторинг при проведении ПХТ позволяет оценить эффективность лечения, а также визуальные изменения в паренхиме печени в течение терапии. Своевременная визуальная оценка патологических изменений в печени с использованием и сочетанием различных диагностических методов имеет значение для более точной диагностики и дальнейшего предотвращения токсического воздействия, чтобы своевременно скорректировать лечение и избежать нежелательных осложнений.
Ключевые слова: химиотерапия; токсическое поражение печени; гепатопатия; стеатоз; стеатогепатит; синусоидальный обструктивный синдром; оксалиплатин; лучевые методы диагностики.
Лаврик Галина Василівна,
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: g.lavryk@gmail.com
Correspondence:
Lavryk Galyna
33/43 Lomonosova Str., Kyiv
National Cancer Institute
E-mail : g.lavryk@gmail.com














Leave a comment