Ішемічно-реперфузійне пошкодження печінки та його профілактика при великих резекціях печінки (огляд літератури)
Колеснік О.О.1, Бурлака А.А.1, Васильєв О.В.1, Тіунова І. А.2
Резюме. Маневр Прінгла, що передбачає перетиснення гепатодуоденальної зв’язки, є основним способом контролю крововтрати під час великих резекцій печінки. Ця методика на патофізіологічному рівні зумовлює короткочасні періоди ішемії/реперфузії (І/Р), а тому часто стає причиною пошкодження гепатоцитів та виникнення гострої печінкової недостатності (ГПН) у післяопераційний період. Нашою метою було вивчення світового досвіду щодо способів запобігання ГПН при виконанні великих резекцій печінки. Актуальним питанням гепатобіліарної хірургії є дослідження патогенетичних механізмів виникнення адаптації печінки до І/Р-пошкодження та способів профілактики останнього. На сьогодні активно досліджуються два види ішемічної адаптації та можливість використання фармакологічних препаратів з метою адаптації печінки. За результатами проведеного огляду літератури встановлено, що програми ішемічного запобігання слід виконувати при великих резекціях печінки для профілактики ішемічно-реперфузійного пошкодження печінки та зниження ризику виникнення в післяопераційний період ГПН. Використання трансплантологічних технологій в онкохірургії дозволить розширити показання до радикального лікування пацієнтів з пухлинами печінки.
Одержано 13.11.2017
Прийнято до друку 29.01.2018
ВСТУП
Резекція печінки є золотим стандартом лікування хворих на метастатичний колоректальний рак (мКРР). Такі фактори, як кількість метастазів у печінці, наявність метастатичного ураження інших органів/сайтів, необхідність резекції магістральних судин і суміжних органів, нині є відносними протипоказаннями до оперативного лікування. Провідні спеціалізовані хірургічні центри рутинно виконують резекцію та реконструкцію судин (портальної вени, нижньої порожнистої вени (НПВ), печінкових артерій/вен (ПВ)) та жовчних протоків [1].
Критерієм резектабельності при метастатичному ураженні печінки є можливість залишити достатній об’єм здорової паренхіми печінки з адекватним притоком та відтоком крові. Вважається, що об’єм умовно здорової паренхіми має становити ≥30%, тоді як при патології тканини печінки (цироз, постхіміотерапевтичні пошкодження, стеатоз) ≥40% [2]. Розвиток технологій дозволив проводити вимірювання об’єму печінки, визначати точне розташування метастатичних вогнищ відносно ПВ та глісонових структур. Впровадження методик штучної гіпертрофії печінки (емболізація ворітної вени, двохетапні резекції, асоційоване розділення печінки та лігування портальної вени — ALPPS) дозволило розширити показання до проведення резекцій печінки.
У 1908 р. австралійський хірург J.H. Pringle запропонував перетискати гепатодуоденальну зв’язку для зменшення інтраопераційної крововтрати при резекції печінки [3]. Ця методика була названа на честь автора маневром Прінгла (МП) та до цього часу залишається основним способом контролю крововтрати під час маніпуляцій на печінці. Оскільки МП передбачає короткочасні періоди ішемії/реперфузії (І/Р) печінкової тканини та зниження центрального венозного тиску, то часто стає причиною пошкодження гепатоцитів та виникнення гострої печінкової недостатності (ГПН) у післяопераційний період [4]. Крім того, дослідження в галузі патофізіології печінки показали, що ішемія при виконанні МП викликає виснаження енергетичних резервів гепатоцитів, внутрішньоклітинне накопичення натрію та кальцію, генерування активних форм кисню та оксиду азоту, спричиняючи пошкодження життєво важливих органел клітин [5]. Тоді як реперфузія зумовлює морфофункціональні зміни на молекулярному рівні, спрямовані на утилізацію ішемізованої тканини. Гепатоцити продовжують продукувати високі рівні активних форм кисню, підвищується проникність мітохондріальної мембрани, знижується рН. Активація продукції цитокінів, системи комплементу, накопичення вільних радикалів, виснаження антиоксидантних систем внаслідок І/Р є пусковим механізмом апоптозу та некрозу гепатоцитів, який, як наслідок, призводить до ГПН [6, 7].
Таким чином, однією з основних неподоланих проблем при технічно складних резекціях печінки є ГПН внаслідок І/Р. Нашою метою було вивчення світового досвіду щодо можливості запобігання ГПН при резекціях печінки.
Програми адаптації печінки до І/Р. Незважаючи на той факт, що перша успішна гемігепатектомія з приводу онкологічного захворювання була виконана Lortad-Jacob та Robert у Парижі в 1953 р., патогенетичні механізми виникнення адаптації печінки до І/Р-пошкодження ще не з’ясовані [8]. За даними низки метааналізів, безпечна тривалість ішемії печінки, тобто при якій ризик розвитку ГПН у післяопераційний період є мінімальним, становить 120 хв та, згідно з різними джерелами, може бути подовжена до 300 хв для здорової паренхіми та до 200 хв для патологічно зміненої печінки [9]. Ризик виникнення пошкодження печінки та пострезекційної ГПН прямо пропорційний загальному часу ішемії та підвищений у пацієнтів із супутніми захворюваннями печінки. У літературі описано застосування різних схем І/Р: 20/5, 15/5, 12/3, 30/5 хв відповідно, однак до сьогодні не визначеними залишаються оптимальний час та кількість таких циклів [10].
Розуміючи зазначену проблему, провідні центри гепатобіліарної хірургії почали розробляти способи профілактики патологічного ефекту І/Р у хворих онкологічного профілю. Програми ішемічного запобігання застосовують для підготовки тканини печінки до тривалої подальшої інтраопераційної ішемії та зниження рівня пошкодження гепатоцитів [11]. На сьогодні, окрім двох видів ішемічної адаптації (віддалене ішемічне запобігання (ВІЗ) та модифікований маневр Прінгла (ММП)), відомі спроби фармакологічної адаптації печінки до І/Р-пошкодження [9].
Методика ММП передбачає інтраопераційне створення коротких циклів І/Р печінки з подальшою довготривалою ішемією. В онкології ефективність використання ММП доведена на етапі експерименту. K. Sun та співавтори отримали достовірно нижчі показники апоптотичного індексу та вищу концентрацію білків антиоксидантної системи в досліджуваній групі з відновленням кровотоку гепатодуоденальною зв’язкою на 2/3/5 та 7 хв, причому функціональний стан мітохондрій був наближений до норми, тоді як в контрольній групі структурне пошкодження органел було значним [12]. З використанням ММП W.-X. Zhang та співавтори досягли нижчих показників аланінамінотрансферази (АлАТ) та аспартатамінотрансферази (АсАТ), NF-kB p65, індексу апоптозу, цитохрому с, TUNEL та Bcl-2 протеїну порівняно із застосуванням класичного МП [13]. У низці публікацій описано підвищення експресії антиапоптотичних білків при використанні ММП [14].
В експериментальній трансплантології протективний ефект ММП також активно досліджується [15]. За даними опублікованих праць, післяопераційні показники амінотрансфераз, частота виникнення ГПН, післяопераційні ускладнення (у тому числі й реакція відторгнення трансплантата) та однорічна виживаність істотно не відрізнялися між групами. Проте під час оцінки морфологічних показників виявлено нижчий ступінь пошкодження печінкової тканини в групі із застосуванням ММП, що мало пряму залежність зі сприятливими посттрансплантаційними результатами. Такий ефект використання ММП пояснюють підвищенням активації аутофагів в перипортальних зонах та додаткових шляхів відновлення внутрішньоклітинного аденозинтрифосфату (АТФ). A.R. Knudsen та співавтори продемонстрували зменшення кількості некротичних клітин на 30% після резекцій печінки з використанням цієї методики [16].
Ще одним напрямком запобігання патологічному впливу І/Р є доопераційна адаптація печінки, або ВІЗ, що передбачає короткі періоди І/Р віддаленого органа чи тканини до початку резекції печінки [17]. ВІЗ застосовується з метою збереження графту печінки, нирки та міокарда під час трансплантації, проте до цього часу активно досліджуються доцільність та безпека використання такого підходу при розширених резекціях печінки в онкохірургії. Характеристика результатів застосування ВІЗ в експериментальній онкології наведена в табл. 1.
| Автор | Експериментальні тварини | Схема ВІЗ | Час ішемії, хв | Час реперфузії, хв | Оцінка маркерів | Результат | Механізм захисної дії |
| J. Lloris-Carsi et al., 1993 [18] | Кролі | 3 (5 І+10 Р) | 90 | 90 | АлАТ, АсАТ | Нижчі рівні АлАТ, АсАТ | Не досліджували |
| C. Peralta et al., 1997 [19] | Кролі | 10 І+10 Р | 90 | 90 | АлАТ, АсАТ, печінкова мікроциркуляція | Нижчі рівні АлАТ, АсАТ та лактатдегідрогенази (ЛДГ) | Активація аденозин- та NO-залежних шляхів |
| T. Yoshizumi et al., 1997 [20] | Кролі | 5 І+10 Р | 40 | 120 | АлАТ, АсАТ, TNF, загальна виживаність | Нижчі рівні трансаміназ та ЛДГ, TNF та ↑ рівня АТФ | Не досліджували |
| H. Nakayama et al., 1999 [21] | Щури | 10 І+10 Р | 45 | 40 хв–24 год | АлАТ, АсАТ, тканинний АТФ, оцінка гістопрепарату | Нижчі рівні АлАТ, АсАТ, ↑ рівня аденозину, ↓ пошкодження тканини | Активація аденозинзалежних шляхів |
| J. Howell et al., 2000 [22] | Миші | 5 І+10 Р | 30 | 30 хв–24 год | АлАТ, АсАТ, лейкоцитарна інфільтрація | Нижчі рівні АлАТ, АсАТ, лейкоцитарної інфільтрації | Активація аденозинзалежних шляхів |
| R. Ricciardi et al., 2001 [23] | Свині | 15 І+15 Р | 120 | 240 | АлАТ, АсАТ, функція графту, оцінка кровотоку | Нижчі рівні АлАТ, АсАТ, ↑ функціональної спроможності графту | Не досліджували |
| S. Ishii et al., 2001 [24] | Щури | 10 І+10 Р | 40 | 6–48 год | Трансамінази, ЛДГ, рівень некрозу, апоптозу | Нижчі рівні трансаміназ, ЛДГ, рівня некрозу та апоптозу | Не досліджували |
| C. Peralta et al., 2002 [25] | Щури | 10 І+10 Р | 90 | 90 | Ксантин, ксантиноксидаза, глутатіон, супероксиддисмутаза, ліпідпероксидаза, трансамінази | ↓ рівня ксантину, ксантиноксидази із ↓ нейтрофільної інфільтрації, рівня оксидативного стресу | Активація ксантин- та ксантиноксидантних шляхів ПОЛ |
| H. Ajamiеh et al., 2002 [26] | Щури | 10 І+10 Р | 90 | 90 | Трансамінази, рівень оксидативного стресу, дослідження гістопрепаратів | Нижчі рівні трансаміназ, ↓ ступеня пошкодження гепатоцитів та рівня оксидативного стресу | Не досліджували |
| A. Serafin et al., 2002 [27] | Щури | 10 І+10 Р | 60 | 2–24 год | Мікроциркуляторні зміни, активація нейтрофілів, активація перекисного окиснення ліпідів (ПОЛ) | ↓ ступеня пошкодження гепатоцитів та гепатоцитів, що зазнали жирової дистрофії | Активація NO-залежних шляхів |
| R. Koti et al., 2002 [28] | Щури | 5 І+10 Р | 45 | 120 | Трансамінази, NO, рівень оксигенації гепатоцитів | Нижчі рівні АлАТ, АсАТ, ↑ рівня оксигенації гепатоцитів | Активація NO-залежних шляхів |
| Y. Iwasaki et al., 2002 [29] | Щури | 10 І+10 Р | 15 по 3 чи 45 хв |
До 180 хв | Трансамінази, TNF, дослідження гістопрепарату | Нижчі рівні амінотрансфераз в групі з використаннням 3 коротких циклів І/Р порівнянно з одним тривалим | Активація NO-залежних шляхів |
І — ішемія; Р — реперфузія; TNF — tumor necrosis factor — фактор некрозу пухлини.
За аналізом опрацьованих джерел літератури в досліджуваній групі з використанням ВІЗ продемонстровано нижчі показники амінотрансфераз, TNF, інтерлейкіну-6, ксантину, ксантиноксидази, ЛДГ, нижчий ступінь лейкоцитарної інфільтрації та рівня пошкодження ендотелію, вищі рівні клітинного АТФ порівняно з контрольною групою.
Актуальним залишається вивчення патофізіологічних шляхів впливу ВІЗ на виникнення адаптації печінки до І/Р-пошкодження. Відомо, що провідним фактором активації адаптації є аденозин, який стимулює синтез NO та, cтимулюючи протеїнкіназу C та p38 MAP, активує каскад сигнальних шляхів регенерації печінки. Застосування ВІЗ стимулює синтез білків теплового шоку, що пригнічують прозапальні транскрипційні фактори і таким чином послаблюють запальну відповідь. Також доведено, що ефект адаптації тканин печінки відбувається завдяки активації білків родини гемоксигенази, зокрема гемоксигенази-1, що зменшують рівень пошкодження гепатоцитів [30].
На сьогодні активно досліджується можливість використання ряду фармакологічних агентів з метою досягнення адаптації оперованої печінки до ефекту І/Р [31, 32]. T. Toyoda та співавтори оцінювали ефект внутрішньовенного введення мілринону та продемонстрували нижчі рівні АсАТ, АлАТ, ЛДГ у досліджуваній групі [33]. Автори повідомили, що мілринон активує захисні механізми шляхом інгібування PI3K-Akt, NOS сигнальних шляхів. Також доведена ефективність використання діоксину, пропофолу, севофлюрану, агоністів до рецептора аденозину A2A для запобігання І/Р-пошкодженню печінки [34].
Усе більше публікацій демонструють ідентичні шляхи виникнення адаптації при використанні ВІЗ та ММП. Z.-Q. Zhao та співавтори (2003) довели, що активація захисних механізмів, спрямованих на адаптацію клітини до біохімічних та ішемічних змін при застосуванні ВІЗ та ММП, відбувається впродовж декількох хвилин після настання реперфузії. В експериментальній онкології при застосуванні ММП на фоні ВІЗ отримано нижчі рівні печінкових трансаміназ, підвищення толерантності гепатоцитів до гіпоксії, швидкості клітинної проліферації порівняно з використанням лише одного з методів [35].
Досліджуючи ефективність ВІЗ та ММП S. Feyzizadeh та співавтори одержали однакові показники АлАТ, АсАТ, супресії цитокінів, а також ступеня підвищення активності антиоксидантних ферментів в обох групах [36]. B.Q. Wu та співавтори отримали ідентичні рівні генерування супероксидних радикалів [37]. Отже, аналіз ефективності ВІЗ та ММП не показав статистично значимої переваги застосування одного методу над іншим.
Низка хірургічних центрів, що вивчають проблеми печінкової недостатності (ПН), почали проводити експериментальні дослідження ефективності застосування ВІЗ у людей [38] (табл. 2). Метод передбачає ішемію однієї нижньої кінцівки на рівні верхньої третини стегна за допомогою манжетки. Процедуру виконують під загальним знеболенням на операційному столі під контролем основних показників життєдіяльності. Тривалість 1-го періоду ішемії становить 10 хв та передбачає виконання трьох циклів із 10-хвилинною перервою без ішемії кінцівки. По завершенню ВІЗ розпочинається оперативне втручання. Результати досліджень демонструють зниження показників трансаміназ, зменшення кількості клітин, що зазнали апоптозу з використанням цієї методики. Ефект адаптації найкраще виражений у молодих пацієнтів, у хворих зі стеатозом та при загальній тривалості інтраопераційної ішемії ≥40 хв. У пацієнтів старше 60 років ефект адаптації виражений незначно [39].
| Автор | Кількість пацієнтів (контрольна група/досліджувана група) | Лабораторні показники | Позитивний результат | Негативний результат |
| D. Azoulay et al., 2005 [39] | 91 (45/46) | Нижчі рівні трансаміназ | Краща толерантність до ішемії | Зниження функціональної можливості графту в ранній післяопераційний період |
| W. Jassem et al., 2006 [40] | 23 (14/9) | Нижчі рівні трансаміназ | Краща толерантність до ішемії, ↓ нейтрофільної та тромбоцитарної інфільтрації в печінкову тканину | |
| M. Cescon et al., 2006 [41] | 47 (24/23) | Нижчі рівні трансаміназ, загального білірубіну | ↓ кількості некротизованих гепатоцитів, відсутність інфільтрації в печінкову тканину | |
| A. Amador et al., 2007 [42] | 60 (30/30) | Нижчі рівні трансаміназ | ↓ кількості апоптотичних клітин та кількості повторних операцій |
Еx vivo, ante situm та in situ резекції печінки. Пацієнти з інвазією пухлини в кавальні ворота, НПВ та/чи ПВ становлять групу підвищеного операційного ризику. Використання стандартних прийомів судинної оклюзії не дозволяє запобігти таким тяжким інтраопераційним ускладненням, як масивна крововтрата, повітряна емболія, ретроградна кровотеча з НПВ та ПВ при виконанні МП, а також ГПН у ранній післяопераційний період внаслідок тривалої теплової ішемії [43].
З метою профілактики масивної крововтрати при резекції печінки з приводу пухлини, що поширюється на кавальні ворота, з інвазією в підпечінковий сегмент НПВ або в устя ПВ, провідні хірургічні центри рекомендують виконувати резекцію печінки в умовах тотальної судинної оклюзії печінкового кровотоку шляхом перетискання гепатодуоденальної зв’язки та НПВ у піддіафрагмальному та підпечінковому відділі. Недоліками цієї методики є гемодинамічна нестабільність внаслідок зупинки кровообігу через НПВ та ПН, спричинена І/Р-ефектом [44].
Доведено, що ризик виникнення ГПН при тривалості нормоішемії 60–85 хв за відсутності супутньої патології печінки є мінімальним. Виконання технічно складних операцій з резекцією, реконструкцією, протезуванням НПВ та/або ПВ перевищує час безпечної теплової ішемії печінки, тому для сповільнення метаболізму печінки та подовження часу ішемії запропоновано охолодження органа в умовах тотальної судинної оклюзії [45]. Відомо, що при зниженні температури на кожні 10 °С швидкість метаболізму гепатоцитів зменшується в 1,5–2 рази. Оскільки охолодження також індукує пошкодження гепатоцитів, оптимальна температура гіпотермії органа становить 2–4 °С. Через 4 год гіпотермічної перфузії печінка використовує майже 95% енергетичних запасів, що й визначає толерантність органа до ішемії [46].
Застосування консервуючих розчинів гістидин-триптофан-кетоглутарату та Вісконсинського університету дозволяє збільшити час безпечної тривалості ішемії, зменшити побічні ефекти І/Р та гіпотермії, знизити ризик виникнення ГПН, поліорганної недостатності, інфекційних ускладнень у післяопераційний період, а також є джерелом енергетичних речовин в анаеробних умовах [47].
На сьогодні відомо три методики резекції печінки в умовах тотальної судинної оклюзії з гіпотермічною перфузією, які почали застосовувати в умовах хірургії печінки при мКРР із 1988 р. Ці операції є окремими етапами трансплантації печінки: ex vivo, ante situm та in situ [48].
J.G. Fortner та співавтори у 1974 р. вперше застосували іn situ резекцію в умовах тотальної судинної оклюзії з гіпотермічною перфузією [49]. Ця методика вважається технічно найменш складною із трьох вищезгаданих. Першим етапом мобілізують печінку, виділяють над- та підпечінкові сегменти НПВ, ворітну вену, загальну печінкову артерію, печінкову протоку гепатодуоденальної зв’язки та накладають на зазначені структури судинні затискачі. Наступним етапом виконують венотомію НПВ для відтоку та катетеризують ворітну вену для перфузії гіпотермічним консервуючим розчином (рис. 1).
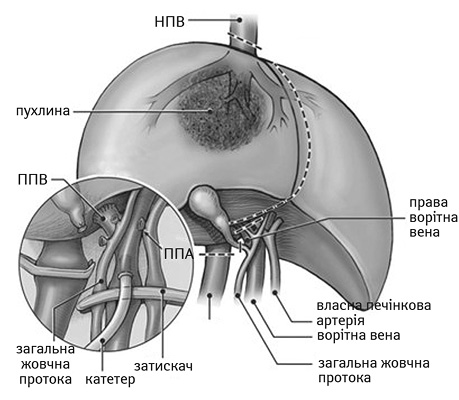
ПВ — права печінкова вена
Місцеву гіпотермію забезпечують шляхом поміщення печінки в холодний консервуючий розчин або за допомогою обкладання органа стерильним льодом (рис. 2).
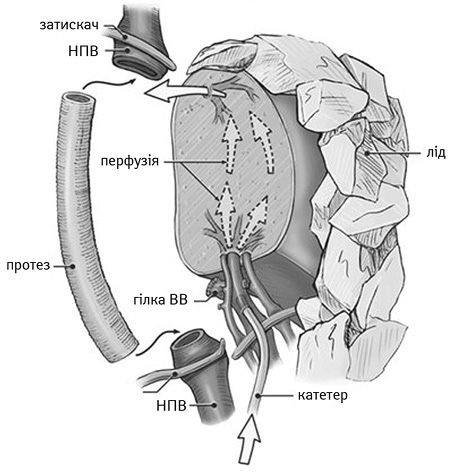
ВВ — ворітна вена
По завершенню основного етапу операції печінку промивають від консервуючого розчину 5% розчином альбуміну або 300–500 мл крові хворого з наступним ушиттям отвору НПВ та ворітної вени. На заключному етапі виконують судинну реконструкцію для відновлення печінкового кровотоку [51].
Методика іn situ з гіпотермічною перфузією забезпечує обмежену мобільність печінки, що ускладнює доступ до пухлин паракавальної зони, особливо при інвазії НПВ та/або ПВ. Оскільки печінка залишається в черевній порожнині, температуру органа вдається знизити тільки до 13–20 °С, що обмежує безпечний час ішемії до 2 год.
У літературі застосування іn situ резекцій представлено окремими клінічними випадками. Для запобігання можливим післяопераційним ускладненням методики іn situ з гіпотермічною перфузією деякі спеціалізовані центри надають перевагу виконанню транссекції паренхіми без застосування ішемії, а тотальну зупинку кровообігу в печінці виконувати тільки на етапі судинної резекції та реконструкції [52]. Низка хірургічних центрів рекомендують відмовитися від рутинного застосування тотальної оклюзії печінкового кровообігу, а резекцію та реконструкцію ворітної вени проводити в умовах затискання ворітної вени зі збереженим артеріальним кровотоком. І навпаки, при маніпуляції на печінковій артерії зберігати венозний кровотік через ворітну вену [53].
Хід операції ex situ резекції печінки до накладання судинних затискачів на НПВ та ворітну вену, загальну печінкову артерію, печінкову протоку є аналогічним з технікою іn situ. За методикою еx situ наступним етапом пересікають НПВ чи/та устя головних ПВ, структури гепатодуоденальної зв’язки та вилучають печінку з лапаротомної рани для виконання резекції. На заключному етапі печінковий графт реімплантують з реконструкцією судин та печінкових проток. Етап аутотрансплантації є ідентичним відповідному етапу ортотопічної трансплантації печінки [52].
На рис. 3 схематично зображено основні різновиди судинної резекції та реконструкції НПВ.
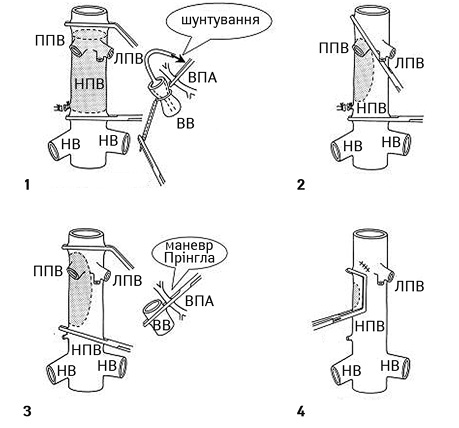
ППВ — права печінкова вена; ЛПВ — ліва печінкова вена; НВ — ниркова вена; ВВ — ворітна вена; ЗПА — загальна печінкова артерія
З 1988 по 2011 р. виконано 52 ex situ резекції печінки, у 45 випадках оперативне втручання проведено за онкологічними показаннями (гепатоцелюлярна карцинома (ГЦК), холангіокарцинома, лейоміосаркома, метастази колоректального раку) (табл. 3).
| Автор | Кількість випадків | Гістологічний тип | Внутрішньолікарняна летальність | Кількість видалених сегментів | Час операції, год | Агепатична фаза, хв | Ускладнення | Післяопераційний період |
| K. Yanaga et al., 1993 [54] | 2 | мКРР | 0 | Усі >2 | У середньому 14,5 | У середньому 232 | Відсутні | Рецидив (n=1) |
| T. Yagyu et al., 1994 [55] | 1 | ГЦК | 0 | 6 | 16 | Кровотеча | Без особливостей | |
| K. Hamazaki et al., 1994 [56] | 1 | мКРР | 1 | 4 | 13 | Кровотеча, ПН | ІВ | |
| E. Forni et al., 1995 [57] | 3 | мКРР | 1 | 3 | 14 | Кровотеча | ІВ | |
| Y. Shimahara et al., 1998 [58] | 2 | ГЦК | 1 | Усі >2 | У середньому 10,4 | У середньому 215 | ПН | Без особливостей |
| K. Oldhafer et al., 2000 [59] | 22 | мКРР (n=9), лейоміосаркома (n=3), ГЦК (n=3), холангіоцелюлярний рак (n=2), пухлина Клацкіна (n=4), нодулярна гіперплазія (n=2) | 6 | У 17 випадків >2; у 5 ≤2 | У середньому 13,5 | У середньому 338 | ПН (n=6),сепсис (n=6) | Алогенна трансплантація печінки (n=4), рецидив (n=10) |
| J. Lodge et al., 2000 [60] | 4 | мКРР | 1 | Усі >2 | Інформація відсутня (ІВ) | У середньому 222,5 | Дихальна та печінкова недостатність (n=1) | Рецидив |
| D. Lechaux et al., 2002 [61] | 1 | ГЦК | 4 | 12 | 330 | Немає | Без особливостей | |
| A.K. Chui et al., 2003 [62] | 1 | Холангіокарцинома | 0 | 6 | 15,5 | 330 | Асцит | Без особливостей |
| S. Gruttadauria et al., 2005 [63] | 2 | мКРР | 0 | Усі >2 | В середньому 14 | У середньому 240 | Без особливостей | |
| G. Fusai et al., 2006 [64] | 1 | Феохромоцитома | 0 | 1 | 7 | 120 | Немає | Без особливостей |
| U. Boggi et al., 2006 [65] | 1 | Травма печінки | 1 | ІВ | 168 | Дихальна недостатність | ІВ | |
| A. Hemming, M.S. Cattral, 1999 [66] | 3 | мКРР | 0 | Усі >2 | ІВ | У середньому 225 | Немає | Без особливостей |
| T. Ikegami et al., 2008 [67] | 1 | Гемангіоми | 0 | 6 | 16 | 351 | Тромбоз портальної вени | Без особливостей |
| K. Sugimachi et al., 2010 [68] | 1 | ГЦК | 0 | 4 | 19,3 | 364 | Немає | Без особливостей |
| Публікації китайскою мовою, 2005–2011 [69–71] | 5 | ГЦК (n=2), гемангіома (n=1), холангіоцелюлярний рак (n=1), гематома (n=1) | 0 | Усі >2 | У середньому 12,5 | У середньому 270 | Кровотеча (n=1), плевральний випіт (n=2) | Без особливостей |
K.J. Oldhaver та співавтори з 1988 по 1998 р. виконали 52 екстракорпоральні резекції печінки, 22 з яких за методикою ex situ, післяопераційна смертність становила 22,5%. Усім пацієнтам виконували ало- або аутовенозне протезування. Середній час операції сягав 10 год (7–21 год). Основний етап тривав близько 450 хв [74].
Основною причиною післяопераційної летальності при ex situ резекції була ГПН (6 випадків), також реєстрували легеневу тромбоемболію, кровотечу, дихальну недостатність (табл. 4).
| № | Вік (років)/стать |
Діагноз | Час операції, год | Агепатична фаза, хв | Об’єм резекції печінки (Seg) | Причина смерті |
| 1 | 63/Ч | мКРР | 13 | 184 | I–V | Кровотеча |
| 2 | 53/Ч | мКРР | 14 | 243 | II–V | Кровотеча |
| 3 | 47/Ч | ГЦК | ІВ | 225 | II–IV, V, VIII | ГПН |
| 4 | 58/Ч | мКРР | 11 | 420 | I/IV–VIII | ГПН, сепсис |
| 5 | 48/Ж | Пухлина Клацкіна | 16 | 180 | I–V | ГПН, сепсис |
| 6 | 62/Ч | Пухлина Клацкіна | 18 | 540 | Резекція печінково-кавального конфлюєнса | ГПН, сепсис |
| 7 | 62/Ч | Пухлина Клацкіна | 18 | 540 | Резекція печінково-кавального конфлюєнса | ГПН, сепсис |
| 8 | 55/Ж | Пухлина Клацкіна | 13 | 240 | IV–VIII | ГПН |
| 9 | 52/Ч | мКРР | 12 | 300 | I, IV | Пневмонія |
| 10 | 42/Ж | мКРР | ІВ | 240 | II, IV–VIII | Дихальна та ниркова недостатність |
| 11 | 16/Ч | Травма печінки | ІВ | 168 | Судинна резекція та реконструкція | Респіраторний дистрес-синдром |
Медіана виживаності хворих після ex situ резекцій становила 21 міс, двоє хворих перебували під спостереженням 5 та 9 років після операції відповідно. У дослідженні A.W. Hemming та M.S. Cattral (1999) описано 7-річну безрецидивну виживаність хворого на ГЦК після ex situ резекції [66].
Таким чином, виконання ex situ резекції з гіпотермічною перфузією супроводжується високим ризиком (близько 30%) післяопераційних ускладнень. Рівень післяопераційної летальності досягає 25%, а основною причиною смерті є розвиток ГПН. Загальна 5-річна виживаність оперованих хворих за методикою ex situ з реконструкцією НПВ становить 22% та без реконструкції НПВ — 27% [73].
З метою зниження рівня післяопераційних ускладнень T. Hannoun та співавтори (1991) запропонували технологію аnte situm резекції печінки. Згідно з публікацією відносними показаннями до застосування цієї методики є інвазія пухлини одночасно в головні ПВ та НПВ [74].
Зазначена методика передбачає пересічення надпечінкової НПВ та/або ПВ, діафрагмальних вен з наступним вивихуванням печінки з лапаротомної рани для покращення умов для маніпуляції на судинних структурах (рис. 4).
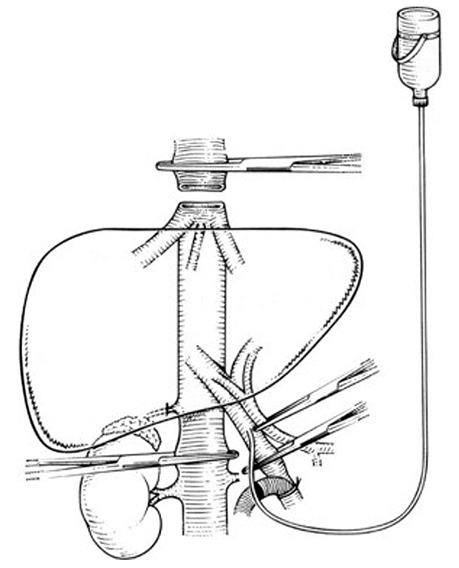
Після налагодження перфузії гіпотермічним розчином виконують резекцію печінки з подальшим формуванням кава-кавального анастомозу на заключному етапі операції. Методика аnte situm не передбачає пересічення печінкової протоки та артерії з наступним формуванням протокових та артеріальних анастомозів, а тому дозволяє суттєво знизити рівень післяопераційних ускладнень та смертності порівняно з ex situ резекцією.
ВИСНОВОК
Програми ішемічного запобігання дозволяють адаптувати тканину печінки до інтраопераційної ішемії та знизити ризик виникнення в післяопераційний період ГПН при великих резекціях печінки.
Активна розробка та впровадження трансплантологічних технологій в онкохірургії дозволила збільшити когорту радикально оперованих хворих на мКРР із метастатичним ураженням печінки.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Cauchy F., Aussilhou B., Dokmak S. et al. (2012) Reappraisal of the risks and benefits of major liver resection in patients with initially unresectable colorectal liver metastases. Ann. Surg., 256: 746–752.
2. Sanei B., Sheikhbahaei S., Sanei M. et al. (2017) Associating liver partition and portal vein ligation for staged hepatectomy: A surgical technique for liver resections. J. Res. Med. Sci., 26(4): 22–52.
3. Pringle J.H. (1908) V. Notes on the Arrest of Hepatic Hemorrhage Due to Trauma. Ann. Surg., 48(4): 541–549.
4. Stokfisz K., Ledakowicz-Polak A., Zagorski M. et al. (2017) Ischaemic preconditioning — Current knowledge and potential future applications after 30 years of experience. Adv. Med. Sci., 62(2): 307–316.
5. Ko H.M., Joo S.H., Jo J.H. et al. (2017) Liver-Wrapping, Nitric Oxide-Releasing Nanofiber Downregulates Cleaved Caspase-3 and Bax Expression on Rat Hepatic Ischemia-Reperfusion Injury. Transplant. Proc., 49(5): 1170–1174.
6. Hu C., Li L. (2017) Preconditions for eliminating mitochondrial dysfunction and maintaining liver function after hepatic ischaemia reperfusion. J. Cell. Mol. Med., 20(10): 1–13.
7. Yue S., Zhou H., Wang X. et al. (2017) Prolonged Ischemia Triggers Necrotic Depletion of Tissue-Resident Macrophages To Facilitate Inflammatory Immune Activation in Liver Ischemia Reperfusion Injury. J. Immunol., 198(9): 3588–3595.
8. Robertson F.P., Fuller B.J., Davidson B.R. et al. (2017) An Evaluation of Ischaemic Preconditioning as a Method of Reducing Ischaemia Reperfusion Injury in Liver Surgery and Transplantation. J. Clin. Med., 6(7): 69.
9. van Riel W.G., van Golen R.F., Reiniers M.J. et al. (2016) How much ischemia can the liver tolerate during resection? Hepatobiliary Surg. Nutr., 5(1): 58–71.
10. van Golen R.F., Reiniers M.J., Heger M. et al. (2015) Solutions to the discrepancies in the extent of liver damage following ischemia/reperfusion in standard mouse models. J. Hepatol., 62: 975–989.
11. Ricca L., Lemoine A., Cauchy F. et al. (2015) Ischemic postcon-ditioning of the liver graft in adult liver transplantation. Transplantation, 99(8): 1633–1643.
12. Sun K., Liu Z.-S., Sun Q. (2004) Role of mitochondria in cell apoptosis during hepatic ischemia-reperfusion injury and protective effect of ischemic postconditioning. World J. Gastroenterol., 10(13): 1934–1938.
13. Zhang W.-X., Yin W., Zhang L. et al. (2009) Preconditioning and postconditioning reduce hepatic ischemia-reperfusion injury in rats. Hepatobiliary Pancreat. Dis. Int., 8(6): 586–590.
14. Yoon S.-Y., Kim C.Y., Han H.J. et al. (2015) Protective effect of ischemic postconditioning against hepatic ischemic reperfusion injury in rat liver. Ann. Surg. Treat. Res., 88(5): 241–245.
15. Theodoraki K., Karmaniolou I., Tympa A. et al. (2016) Beyond Preconditioning: Postconditioning as an Alternative Technique in the Prevention of Liver Ischemia-Reperfusion Injury. Oxid. Med. Cell. Long., 21 p.
16. Knudsen A.R., Andersen K.J., Hamilton-Dutoit S. et al. (2016) Correlation between liver cell necrosis and circulating alanine aminotransferase after ischaemia/reperfusion injuries in the rat liver. Int. J. Exp. Pathol., 97(2): 133–138.
17. Kanori S., Robertson F.P., Mehta N.N. et al. (2016) Effect of Remote Ischaemic Preconditioning on Liver Injury in Patients Undergoing Major Hepatectomy for Colorectal Liver Metastasis: A Pilot Randomised Controlled Feasibility Trial. World J. Surg. DOI 10.1007/s00268-016-3823-4.
18. Lloris-Carsi J.M., Cejalvo D., Toledo-Pereyra L.H. et al. (1993) Preconditioning: Effect upon lesion modulation in warm liver ischemia. Transplant. Proc., 25: 3303–3304.
19. Peralta C., Hotter G., Closa D. et al. (1997) Protective effect of preconditioning on the injury associated to hepatic ischemia-reperfusion in the rat: Role of nitric oxide and adenosine. Hepatology, 25: 934–937.
20. Yoshizumi T., Yanaga K., Soejima Y. et al. (1998) Amelioration of liver injury by ischaemic preconditioning. Br. J. Surg., 85: 1636–1640.
21. Nakayama H., Yamamoto Y., Kume M. et al. (1999) Pharmacologic stimulation of adenosine A2 receptor supplants ischemic preconditioning in providing ischemic tolerance in rat livers. Surgery, 126: 945–954.
22. Howell J.G., Zibari G.B., Brown M.F. et al. (2000) Both ischemic and pharmacological preconditioning decrease hepatic leukocyte/endothelial cell interactions. Transplantation, 69: 300–303.
23. Ricciardi R., Schaffer B.K., Kim R. et al. (2001) Protective effects of ischemic preconditioning on the cold-preserved liver are tyrosine kinase dependent. Transplantation, 72: 406–412.
24. Ishii S., Abe T., Saito T. et al. (2001) Effects of preconditioning on ischemia/reperfusion injury of hepatocytes determined by immediate early gene transcription. J. Hepatobiliary Pancreat. Surg., 8: 461–468.
25. Peralta C., Bulbena O., Xaus C. et al. (2002) Ischemic preconditioning: A defense mechanism against the reactive oxygen species generated after hepatic ischemia reperfusion. Transplantation, 73: 1203–1211.
26. Ajamieh H., Merino N., Candelario-Jalil E. et al. (2002) Similar protective effect of ischaemic and ozone oxidative preconditionings in liver ischaemia/reperfusion injury. Pharmacol. Res., 45: 333–339.
27. Serafin A., Rosello-Catafau J. et al. (2002) Ischemic preconditioning increases the tolerance of fatty liver to hepatic ischemia-reperfusion injury in the rat. Am. J. Pathol., 161: 587–601.
28. Koti R., Yang W., Dashwood M. et al. (2002) Effect of ischemic preconditioning on hepatic microcirculation and function in a rat model of ischemia reperfusion injury. Liver Transpl., 8: 1182–1191.
29. Iwasaki Y., Tagaya N., Hattori Y. et al. (2002) Protective effect of ischemic preconditioning against intermittent warm-ischemia-induced liver injury. J. Surg. Res., 107: 82–92.
30. Sheng-Chih Kuo, Yueh-Wei Liu, Ching-Hua Tsai (2016) Ischemic preconditioning in hepatic ischemic-reperfusion injury. Formosan Journal of Surgery, 49(5): 169–173.
31. Tian Y.S., Rong T.Z., Hong Y.L. et al. (2013) Pharmacological postconditioning with diazoxide attenuates ischemia/reperfusion-induced injury in rat liver. Exp. Ther. Med., 5(4): 1169–1173.
32. Beck-Schimmer B., Breitenstein S., Bonvini J. et al. (2012) Protection of pharmacological postconditioning in liver surgery: results of a prospective randomized controlled trial. Ann. Surg., 256(5): 837–845.
33. Toyoda T., Tosaka S., Tosaka R. et al. (2014) Milrinone-induced postconditioning reduces hepatic ischemia-reperfusion injury in rats: the roles of phosphatidylinositol 3-kinase and nitric oxide. J. Surg. Res., 186(1): 446–451.
34. Yamanaka K., Houben P., Bruns H. et al. (2015) A systematic review of pharmacological treatment options used to reduce ischemia reperfusion injury in rat liver transplantation. PLoS ONE, 10(4): 122–214.
35. Zhao Z.-Q., Corvera J.S., Halkos M.E. et al. (2003) Inhibition of myocardial injury by ischemic postconditioning during reperfusion: comparison with ischemic preconditioning. Am. J. Physiol. Heart Circ. Physiol., 285: 579.
36. Feyzizadeh S., Badalzadeh R. (2017) Application of ischemic postconditioning’s algorithms in tissues protection: response to methodological gaps in preclinical and clinical studies. J. Cell. Mol. Med., 21(10): 2257–2267.
37. Wu B.Q., Chu W.W., Zhang L.Y. et al. (2007) Protection of preconditioning, postconditioning and combined therapy against hepatic ishemia/reperfusioninjury. Chin. J. Traumatol., English Edition, 10(4): 223–227.
38. Kanori S., Robertson P., Naimish N. et al. (2016) Effect of Remote Ischaemic Preconditioning on Liver Injury in Patients Undergoing Major Hepatectomy for Colorectal Liver Metastasis: A Pilot Randomised Controlled Feasibility Trial. World J. Surg., 41(5): 1332–1330.
39. Azoulay D., Del Gaudio M., Andreani P. et al. (2005) Effects of 10 minutes of ischemic preconditioning of the cadaveric liver on the graft’s preservation and function: the ying and the yang, 242: 133–139.
40. Jassem W., Fuggle S.V., Cerundolo L. et al. (2006) Ischemic preconditioning of cadaver donor livers protects allografts following transplantation. Transplantation, 81: 169–174.
41. Cescon M., Grazi G.L., Grassi A. et al. (2006) Effect of ischemic preconditioning in whole liver transplantation from deceased donors. A pilot study. Liver Transpl., 12: 628–635.
42. Amador A., Grande L., Marti J. et al. (2007) Ischemic pre-conditioning in deceased donor liver transplantation: a prospective randomized clinical trial. Am. J. Transplant., 7: 2180–2189.
43. Wentao W., Lunan Y., Jianyong L. et al. (2016) Ex Vivo Liver Resection and Autotransplantation. Operative Techniques in Liver Resection: 331–335.
44. Cauchy F., Brustia R., Perdigao F. et al. (2016) In situ hypothermic perfusion of the liver for complex hepatic resection: surgical refinements. World J. Surg., 40(6): 1448–1453.
45. Li D.-Y., Shi X.-J., Li W. et al. (2016) Ischemic preconditioning and remote ischemic preconditioning provide combined protective effect against ischemia/reperfusion injury. Life Sci., 150: 76–80.
46. Olthof P.B., Reiniers M.J., Dirkes M.C. et al. (2015) Protective Mechanisms of Hypothermia in Liver Surgery and Transplantation. Mol. Med., 21(1): 833–846.
47. Hameed A.M., Laurence J.M., Lam V.W. et al. (2017) A systematic review and meta-analysis of cold in situ perfusion and preservation of the hepatic allograft: working towards a unified approach. Liver Transpl., 23(12): 1615–1627.
48. Azoulay D., Maggi U., Lim C. et al. (2014) Liver resection using total vascular exclusion of the liver preserving the caval flow, in situ hypothermic portal perfusion and temporary porta-caval shunt: a new technique for central tumors. Hepatobiliary Surg. Nutr.; 3(3): 149–153.
49. Fortner J. G., Shiu M. H., Kinne D. W. et al. (1974) Major Hepatic Resection Using Vascular Isolation and Hypothermic Perfusion. Ann Surg.; 180(4): 644–651.
50. McGilvray I.D., Hemming A.W. (2015) Ex vivo and in situ hypothermic hepatic resection (https://clinicalgate.com/ ex-vivo-and-in-situ-hypothermic-hepatic-resection/).
51. Lodge P.J.A., Ammori B.J., Rajendra Prasad K., Bellamy M.C. (2000) Ex Vivo and In Situ Resection of Inferior Vena Cava With Hepatectomy for Colorectal Metastases. Ann. Surg., 231(4): 471–479.
52. Cauchy F., Brustia R., Perdigao F. et al. (2016) In situ hypothermic perfusion of the liver for complex hepatic resection: surgical refinements. World J. Surg., 40(6): 1448–1453.
53. Azoulay D., Pascal G., Salloum C. (2013) Vascular reconstruction combined with liver resection for malignant tumours. Br. J. Surg., 100(13): 1764–1775.
54. Yanaga K., Kishikawa K., Shimada M. et al. (1993) Extracorporeal hepatic resection for previously unresectable neoplasms. Surgery, 113: 637–643.
55. Yagyu T., Shimizu R., Nishida M. et al. (1994) Reconstruction of the hepatic vein to the prosthetic inferior vena cava in fight extended hemihepatectomy with ex situ procedure. Surgery, 115: 740–744.
56. Hamazaki K., Yagi T., Inagaki M. et al. (1994) Hepatectomy with extracorporeal circulation for liver metastasis from colon carcinoma located at the confluence of the major hepatic vein: a case report. Hepatogastroenterology, 41: 150–153.
57. Forni E., Meriggi F. (1995) Bench surgery and liver autotransplantation. Personal experience and technical considerations. G. Chir, 16: 407–413.
58. Shimahara Y., Yamaoka Y., Morimoto T. et al. (1998) Surgical treatment for hepatocellular carcinoma: liver resection using transplantation techniques (in Japanese). Nihon Geka Gakkai Zasshi, 99: 208–213.
59. Oldhafer K., Lang H., Schlitt H. et al. (2000) Long-term experience after ex situ liver surgery. Surgery, 127: 520–527.
60. Lodge J.P., Ammori B.J., Prasad K.R. et al. (2000) Ex vivo and in situ resection of inferior vena cava with hepatectomy for colorectal metastases. Ann. Surg., 4: 471–479.
61. Lechaux D., Megevand J.M., Raoul J.L. et al. (2002) Ex vivo right trisegmentectomy with reconstruction of inferior vena cava and ‘flop’ reimplantation. J. Am. Coll. Surg., 194: 842–845.
62. Chui A.K., Rao A.R. (2003) Ex situ ex vivo liver resection, partial liver autotransplantation for advanced hilar cholangiocarcinoma: a case report. Transplant. Proc., 35: 402–403.
63. Gruttadauria S., Marsh J.W., Bartlett D.L. et al. (2005) Ex situ resection techniques and liver autotransplantation: last resource for otherwise unresectable malignancy. Digest. Dis. Sci., 50: 1829–1835.
64. Fusai G., Steinberg R., Prachalias A. et al. (2006) Ex vivo liver surgery for extraadrenal pheochromocytoma. Pediatr. Surg. Int., 22: 282–285.
65. Boggi U., Vistoli F., Del Chiaro M. et al. (2006) Extracorporeal repair and liver autotransplantation after total avulsion of hepatic veins and retrohepatic inferior vena cava injury secondary to blunt abdominal trauma. J. Trauma, 60: 405–406.
66. Hemming A.W., Cattral M.S. (1999) Ex vivo liver resection with replacement of the inferior vena cava and hepatic vein replacement by transposition of the portal vein. J. Am. Coll. Surg., 189: 523–526.
67. Ikegami T., Soejima Y., Taketomi A. et al. (2008) Extracorporeal hepatic resection for unresectable giant hepatic hemangiomas. Liver Transpl., 14: 115–117.
68. Sugimachi K., Shirabe K., Taketomi A. et al. (2010) Successful curative extracorporeal hepatic resection for far-advanced hepatocellular carcinoma in an adolescent patient. Liver Transpl., 16: 685–687.
69. Yang Z.Y., Lu Q., Liu X.D. et al. (2010) Ex-vivo liver resection combined with partial liver autotransplantation for hepatocellular carcinoma located at critical site (in Chinese). Chin. J. Dig. Surg., 9: 18–20.
70. Wen H., Huang J.F., Zhang J.H. et al. (2006) Extracorporeal hepatectomy and autotransplantation for intrahepatic cholangiocarcinoma: a case report (in Chinese). Chin. J. Surg., 44: 642–644.
71. Mo Y.W., Wang T.C., Sun Z.W. et al. (2008) Extracorporeal hepatectomy and autotransplantation of residual liver for hepatic space-occupying lesion (in Chinese). Chin. J. Pract. Surg., 28: 880–882.
72. Oldhafer K.J., Lang H., Schlitt H.J. et al. (2000) Long-term experience after ex situ liver surgery. Surgery, 127: 520–527.
73. Tuxun T., Aini A., Li Y. (2016) Systematic review of feasibility, safety and efficacy of ex situ liver resection and autotransplantation. Zhonghua Yi Xue Za Zhi, 96(28): 2251–2257.
74. Hannoun T., Borie D., Balladur P. et al. (1991) Ex situ-in vivo hepatic resection. Technique and initial results. Chirurgie, 118(5): 292–296.
Ишемически-реперфузионное повреждение печени и его профилактика при больших резекциях печени (обзор литературы)
Национальный институт рака, Киев
Донецкий национальный медицинский университет, Краматорск
Резюме. Маневр Прингла предполагает пережатие печеночно-двенадцатиперстной связки и является основным способом контроля кровотечения во время резекции печени. Данная методика на патофизиологическом уровне вызывает кратковременные периоды ишемии/реперфузии (И/Р), поэтому часто становится причиной повреждения гепатоцитов и возникновения острой печеночной недостаточности (ОПН) в послеоперационный период. Нашой целью являлось изучение способов профилактики ОПН при выполнении больших резекций печени. Актуальным вопросом гепатобилиарной хирургии является изучение патогенетических механизмов возникновения адаптации гепатоцитов к И/Р-повреждению и способы его профилактики. Передовые хирургические центры изучают эффективность двух видов ишемической адаптации, а также возможность использования фармакологических препаратов с данной целью. По результатам проведенного обзора литературы установлено, что программы ишемической адаптации рекомендуется использовать при планировании больших резекций печени для профилактики И/Р-повреждения печени и снижения риска возникновения ОПН в послеоперационный период. Использование трансплантологических технологий в онкохирургии позволит расширить показания к радикальному лечению пациентов с опухолями печени.
резекция печени; ишемическая адаптация; печеночная недостаточность; in situ резекции; радикальные формы кислорода и оксида азота.
Бурлака Антон Анатолійович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
Burlaka Anton
33/43 Lomonosova str., Kyiv 03022
National Cancer Institute














Leave a comment