Радіотерапія онкогінекологічних хворих в умовах сучасних технологій
Іванкова В.С.1, Дьоміна Е.А.2, Хруленко Л.Т.1, Барановська Л.М.1, Гринченко О.О.2
- 1Національний інститут раку МОЗ України, Київ
- 2Інститут експериментальної патології, онкології і радіобіології ім. Р.Е. Кавецького НАН України, Київ
Резюме. Вступ. Незважаючи на інтенсивний розвиток технологій, суттєвий прогрес у створенні нової радіотерапевтичної техніки упродовж останнього десятиріччя, пошук оптимальних моделей контактної променевої терапії, методу брахітерапії з джерелами з високою потужністю дози (high dose rate (HDR) — вище 12 Гр/год) з метою підвищення ефективності хіміопроменевої терапії у хворих онкогінекологічного профілю продовжує залишатися предметом широкої дискусії. У цьому контексті необхідні більш поглиблені наукові дослідження в галузі клінічної радіобіології, проведення порівняння фізико-дозиметричних характеристик і біологічних ефектів 192Ir з ефектами еталонного гамма-випромінювання 60Со, враховуючи різницю їх енергій. Матеріали та методи дослідження. Нами проведено комплексне консервативне лікування 94 онкогінекологічним хворим з II-ІІІ стадіями, T2-3N0-1M0, яких залежно від методу брахітерапії було розділено на 2 досліджувані групи (28 хворим проводилася 192Ir HDR брахітерапія і 30 пацієнткам — 60Со HDR) та контрольна група — 36 пацієнток, яким брахітерапія була проведена джерелами 60Со середньої потужності (medium dose rate (МDR) — 2–12 Гр/год). Сумарні осередкові дози від поєднаної променевої терапії становили до 80-90 Гр на пухлинний осередок і 44–46 Гр на зони регіонарного метастазування, при разовій осередковій дозі — 1,8–2 Гр. Брахітерапію проводили в режимі 6 Гр 2 рази на тиждень. Частині хворих проводили радіобіологічні дослідження з використанням тест-систем лімфоцитів периферичної крові онкогінекологічних хворих та з наступним метафазним аналізом спонтанних і радіаційно-індукованих аберацій хромосом. Результати та їх обговорення. Аналіз безпосередніх результатів ефективності використання джерел 60Со або 192Ir при HDR брахітерапії і даних динамічного спостереження протягом 3 міс показав, що позитивна відповідь пухлини (повна + часткова регресія) у онкогінекологічних хворих досліджуваних груп після курсу хіміопроменевої терапії збільшилася на 20,1 % та 16,6 % в порівнянні із застосуванням 60Со МDR при брахітерапії. Токсичні ефекти лікування за кількістю і ступенем їх проявів в досліджуваних групах хворих не відрізнялися від контрольної і не перевищували ІІ ступеня. Результати проведених радіобіологічних досліджень корелювали з клінічними. Прослідкована чітка дозова залежність частоти індукованих аберацій хромосом та специфічність радіаційного впливу (квадратична дозова залежність індукції променевих маркерів) в лімфоцитах крові первинних хворих, що є базовими критеріями для визнання їх в якості предикторів радіочутливості умовно здорових клітин, що потрапляють у зону терапевтичного опромінення. Висновки. Високоенергетичні сучасні технології брахітерапії із застосуванням джерел 192Ir HDR і 60Со HDR при поєднаній променевій терапії онкогінекологічних хворих дозволяють концентрувати за короткий часовий проміжок високі дози енергії іонізуючого випромінювання в обмеженому обсязі тканин, що призводить до посилення терапевтичного ефекту променевої терапії з мінімальними ризиками виникнення важких променевих реакцій або пошкоджень. Висока точність передпроменевої підготовки, коректне планування при використанні джерел випромінювання 192Ir HDR і 60Со HDR дає можливість істотно поліпшити безпосередні результати лікування онкогінекологічних хворих без збільшення проявів токсичності (загальної та місцевої), кількості і ступеня можливих ранніх і пізніх місцевих променевих ускладнень з боку критичних органів. Характер дозової залежності променевих маркерів слугуватиме базовим критерієм для визнання дицентриків цитогенетичними предикторами підвищеної радіочутливості немалігнізованих клітин з оточення та ложа пухлини.Ключові слова: брахітерапія HDR; брахітерапія МDR; джерела іонізуючого випромінювання 192Ir та 60Со.
Одержано 18.11.2021
Прийнято до друку 2.12.2021
DOI: 10.32471/clinicaloncology.2663-466X.43-3.28535
ВСТУП
Доведено, що радіотерапія є успішним методом лікування пацієнтів з раком передміхурової залози, шийки та тіла матки, стравоходу, голови і шиї, а також деякими іншими онкологічними захворюваннями. На сьогодні цей метод вважається одним із найдієвіших для лікування хворих на рак у розвинених країнах [1]. Останнє десятиріччя характеризується інтенсивним розвитком технологій, суттєвим прогресом у створенні нової радіотерапевтичної техніки. У зв’язку із цим радіотерапія в онкології виходить на якісно новий рівень. Поєднання зовнішнього променевого лікування з внутрішнім — брахітерапією (БТ) використовується для підвищення дози, що припадає на пухлину, і зниження дози, яка потрапляє на органи ризику, тобто для більш високоточного опромінення осередку [2]. Втілення у практику дозиметричного планування, використання нових технологій (комп’ютерна томографія (КТ), магніто-ядерно-резонансна томографія (МРТ) при плануванні дає можливість точного визначення форми, розмірів і розташування пухлини, для чого використовуються спіральні КТ [3, 4].
БТ включає розміщення радіоактивних джерел всередині пухлини або дуже близько до неї. Таке розташування дозволяє доставляти високу дозу променевої терапії (ПТ) до пухлини, зберігаючи при цьому оточуючі нормальні тканини. З часом методи БТ помітно змінилися: нові радіоактивні джерела роблять доставку більш безпечною, методи керування зображеннями дозволяють більш точно розмістити джерела, а передові системи планування роблять БТ дійсно адаптивною [5, 6].
БТ з високою потужністю дози (high dose rate (HDR) — вище 12 Гр/год) широко застосовується для лікування хворих онкогінекологічного профілю. При серйозних онкологічних станах потрібні підвищені дози опромінення, що найкраще досягається за допомогою БТ, захищаючи при цьому оточуючі нормальні органи від надмірної токсичності [7]. Однією з його переваг перед лікуванням з низькою потужністю дози (low dose rate (LDR) — 0,4–2 Гр/год) є можливість лікувати більше пацієнтів, що є перевагою у центрах з більшою їх кількістю, але з обмеженими можливостями [8]. Джерело 192Іридій (192Ir) широко використовується для БТ HDR. Це пов’язано з тим, що для БТ краще виготовляти менші розміри. Такий розмір джерел дозволяє провести інтерстиціальну обробку і оптимізувати дозу [9]. За останній час застосування джерел 60Кобальт (60Co) збільшилося, зважаючи на його довший період напіврозпаду і доступність у мініатюрній формі (з розмірами, близькими до розмірів джерел 192Ir HDR). Більш довгий період напіврозпаду (5,26 року) джерела 60Co в порівнянні з 192Ir (73,8 дні) означає, що замість того, аби змінювати джерела 192 Ir кожні 3–4 міс, джерела 60Co можна замінити через 6–8 років. Це набагато економічніше і зручніше для держав з обмеженими ресурсами з урахуванням інфраструктури, особливо у країнах, що розвиваються. Через високу енергію 60Co (середня енергія = 1,25 МеВ) порівняно з 192Ir (середня енергія = 0,38 МеВ), апарати для БТ на основі 60Co потребують більшого захисту. Джерела 60Co пропонують логістичні і економічні переваги у порівнянні з джерелами 192Ir, що приводить до зниження експлуатаційних витрат [10–12].
Дослідження вчених [10, 13] показали, що з точки зору клінічних аспектів у джерел 60Co у порівнянні з джерелами 192Ir немає ніяких переваг чи недоліків. Проте існують потенційні логістичні переваги джерел 60Co, оскільки для одержання еквівалентної потужності дози потрібно лише 33% активності джерел 192Ir. З дозиметричної точки зору для 60Co також немає переваг чи недоліків у порівнянні з джерелами 192Ir. Проте, значення параметрів навантаження на сечовий міхур і пряму кишку не виявилися статистично значущими [14–16]. Розподіл ізодози для 60Co більший у краніально-каудальному напрямку в порівнянні з 192Ir. Ці відмінності можна зменшити за допомогою методів оптимізації планування лікування. Мініатюрне джерело 60Co може використовуватися для внутрішньопорожнинної БТ HDR, враховуючи логістичні і фінансові переваги і довший період напіврозпаду. Оцінка клінічного плану в кожному зрізі і площині необхідна для вивчення переваг джерел 60Co у порівнянні з джерелами 192Ir HDR [17, 18].
Результати інших досліджень [8, 19, 20] щодо БТ з використанням джерел 60Co показали, що запланований об’єм дози поступово збільшується від меншого кроку джерела до більшого його розміру. Це приводить до підвищення дози, що потрапляє на сечовий міхур і пряму кишку, що може призвести до підвищення токсичності і зниження якості життя. За результатами досліджень рекомендується не використовувати розмір кроку більш 5 мм для внутрішньопорожнинного введення у шийку матки при використанні джерел 60Co.
За останній час у нашій країні з’явилися нові апарати для БТ із джерелом випромінювання 192Ir, тому виникла необхідність у вивченні та удосконаленні методів лікування онкологічних хворих за допомогою цього джерела випромінювання [5, 21].
Крім того, необхідні більш поглиблені наукові дослідження і розробки фізико-дозиметричних характеристик терапевтичних джерел гамма-випромінювання 192Ir, а особливо в галузі клінічної радіобіології. Слід провести порівняння біологічних ефектів 192Ir з ефектами еталонного гамма-випромінювання 60Со, враховуючи різницю їх енергій. Найбільш коректною моделлю для виконання таких досліджень є лімфоцити периферичної крові (ЛПК) людини, що визнані профільними міжнародними організаціями — ВООЗ, Міжнародною агенцією з атомної енергії та Науковим комітетом Організації об’єднаних націй з дії атомної радіації інформативними біодозиметрами/біоіндикаторами опромінення. Аналіз радіаційно-індукованих хромосомних перебудов у цих клітинах дозволяє не тільки визначати залежність «доза — ефект», але й умови та ефективність цілеспрямованої радіомодифікації, моделювати реакцію клітин залежно від їх радіочутливості/радіорезистентності (залежність «стадія клітинного циклу — ефект»). Вважаємо, що цей шлях спрямований на подолання так званого «радіобіологічного дефіциту» і, таким чином, на удосконалення сучасної БТ злоякісних новоутворень [21, 22].
Результати аналізу даних літератури свідчать про те, що пошук оптимальних моделей контактної ПТ з метою підвищення ефективності хіміопроменевої терапії (ХПТ) хворих онкогінекологічного профілю продовжує залишатися предметом широкої дискусії.
МАТЕРІАЛИ І МЕТОДИ
Протягом останніх років у Національному інституті раку проводяться дослідження з вивчення та удосконалення методів лікування онкогінекологічних хворих за допомогою джерел випромінювання 60Со і 192Ir, їх ефективності та токсичності, а також з метою вивчення і порівняння біологічних ефектів 192Ir з ефектами еталонного гамма-випромінювання 60Со. У дослідженні було розглянуто результати обстеження і променевого лікування 94 онкогінекологічних хворих з II–ІІІ стадій, T2–3N0–1M0. Вік пацієнтів становив 28–72 років, середній вік — 57,3±5,2 року. З 27 (29,3%) хворих репродуктивного віку у 19 пацієнток (20,7 %) вік не перевищував 35 років. У віці 36–55 років була 31 (33,7%) хвора, старше 56 років — 44 (45,6%). За морфологічною структурою у 57% хворих діагностовано епідермоїдний рак різного ступеня диференціації, переважно низькодиференційований, у 31,5% — аденокарциному, у 11% — недиференційовані форми.
При обстеженні у 47,8 % хворих з метастатичною пухлиною піхви було визначено екзофітну форму, у 20,7% — змішану з вираженим екзофітним компонентом, у 31,5% відмічали ендофітні пухлини. Загальний стан пацієнток відповідав 1–2 балам за шкалою Performance status Східної об’єднаної онкологічної групи (Eastern Cooperative Oncology Group — ECOG)/WHO [5, 21].
З метою визначення меж пухлинного процесу, його особливостей, стану критичних органів, наявності/відсутності супутньої патології усіх хворих було ретельно та комплексно обстежено. Після морфологічної ідентифікації пухлини проводилося планування консервативного лікування вторинного раку вагіни (ВРВ) [23].
При проведенні планування променевої терапії хворих на ВРВ враховували дози променевої енергії від раніше проведеного променевого лікування. Поєднану променеву терапію (ППТ) ВРВ, локалізованого у верхній 1/3 піхви та куксі піхви, проводили, як при лікуванні хворих на рак кукси шийки матки. При ХПТ хворих на ВРВ середньої та нижньої 1/3 піхви мішень опромінювання включала вагіну по всій її довжині, паракольпальну клітковину, регіональні лімфатичні вузли залежно від локалізації процесу. Разові, сумарні осередкові дози (РОД, СОД) та режим їх застосування визначали шляхом комп’ютерного планування з урахуванням індивідуальних параметрів пухлинного вогнища [23, 24].
Залежно від методу HDR БТ були сформовані 2 досліджувані групи. У 1-шу групу увійшли 28 хворих, яким проводилася HDR БТ з використанням джерела 192Ir на установці «Gamma Med plus». 2-гу досліджувану групу склали 30 пацієнток, яким проводили HDR БТ джерелом для гамма-терапії 60Со HDR на шланговому апараті «Gyne Source». Контрольну групу становили 36 пацієнток, яким БТ було проведено джерелами 60Со середньої потужності (medium dose rate (МDR) — 2–12 Гр/год) на гамма-терапевтичному апараті АГАТ-ВУ.
СОД від ППТ становила до 80–90 Гр на пухлинний осередок і 44–46 Гр — на зони регіонарного метастазування, РОД від дистанційної променевої терапії становила 1,8–2 Гр. БТ проводили в режимі РОД 6 Гр 2 рази на тиждень. Конформну дистанційну променеву терапію здійснювали на апараті Лінійний прискорювач електронів Clinac 2100 з обов’язковою передпроменевою 3D-топометричною підготовкою на КТ з функцією віртуальної симуляції за допомогою системи комп’ютерного планування Eclipse та генеруванням тривимірної моделі пацієнта. За допомогою спеціальних фіксуючих пристроїв (маски, підставки під ноги) усім пацієнтам виконували фіксування з подальшим винесенням референтних міток на імобілізуючу маску [25, 26].
Променеве лікування у хворих усіх груп (включаючи контрольну) проводили на тлі хіміосенсібілізуючих засобів (оральні фторпіримідини, препарати платини) [27].
Частині хворих проводили радіобіологічні дослідження, які передбачали використання тест-системи ЛПК онкологічних хворих та метафазного аналізу спонтанних і радіаційно-індукованих аберацій хромосом. При цьому досліджували хромосоми головних функціональних клітин імунної системи, а саме — Т-лімфоцити, що відповідають за протипухлинний захист організму.
Для виконання досліджень використовували цільну венозну кров хворих онкологічного профілю до та після першої фракції терапевтичного опромінення (ТО). Дослідження проводили з дотриманням положень Гельсінської декларації Всесвітньої медичної асоціації (2008), згідно з якою необхідна інформована згода хворих на участь у дослідженні, а також, прийняті на Першому національному конгресі України з біоетики загальні етичні принципи [5].
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
Безпосередні результати ХПТ хворих на ВРВ оцінювали за ступенем регресії первинного пухлинного вогнища та наявності/відсутності токсичних проявів лікування. Регресію пухлини визначали, згідно з рекомендаціями ВООЗ, за динамікою клінічних показників пухлинного процесу у співставленні з даними, отриманими за допомогою сучасних засобів візуалізації (комплексне сонографічне обстеження, КТ, МРТ) [28].
У результаті дослідження встановлено, що реакція на проведену антинеопластичну терапію безпосередньо після завершення повного курсу лікування (сумарний позитивний ефект) була більш вираженою у хворих досліджуваних груп. Так, аналіз безпосередніх результатів ефективності використання джерел 60Со або 192Ir при HDR БТ і даних динамічного спостереження протягом курсу ППТ показав, що позитивна відповідь пухлини (повна + часткова регресія) у хворих на ВРВ після повного курсу ХПТ збільшилася на 16,3% в 1-й досліджуваній групі та на 13,9% у 2-й групі порівняно із застосуванням 60Со МDR при БТ. Зважаючи на відстрочену дію ПТ, ефективність лікування хворих аналізували за даними комплексного обстеження через 3 міс після завершення консервативної терапії. Після 3-місячного спостереження у динаміці позитивну відповідь пухлини зареєстровано у 69,8% пацієнток, що входили до 1-ї групи та у 66,3% з 2-ї групи і в контрольній групі — 49,7%, що на 20,1% і 16,6% більше в порівнянні з контрольною групою. Упродовж 6 міс при динамічному спостереженні ознак прогресування пухлинного процесу не виявлено у жодної хворої.
Токсичність променевого лікування оцінювали за класифікацією RTOG/EORTC (1995) [5, 21]. Так, токсичні ефекти розроблених методів лікування за кількістю і ступенем їх проявів у досліджуваних групах хворих не відрізнялися від контрольної і не перевищували ІІ ступеня. З проявів загальної токсичності у переважної більшості хворих ВРВ всіх груп протягом лікування спостерігали незначну нудоту, яка не потребувала медикаментозної корекції. Виражених нейтропеній та тромбоцитопеній не відмічено. Після завершення лікування протягом місяця стан хворих нормалізувався. Через 6 міс після лікування проявів пізньої загальної токсичності під час обстеження у жодної хворої не спостерігали.
Крім того, нами було проаналізовано місцеві реакції на цитотоксичну терапію ВРВ з боку критичних органів, до яких належать: пряма кишки, уретра, сечовий міхур. У результаті аналізу встановлено, що у хворих 1-ї групи променеві реакції ІІ ступеня практично були відсутні. Через рік спостерігалися поодинокі пізні реакції (пізній ерозивний цистит, променевий ерозивний проктит) у хворих із хронічними захворюваннями сечового міхура і прямої кишки. Суттєвих розбіжностей у проявах та частоті пізніх променевих реакцій при амбулаторному спостереженні протягом 6 міс у хворих основних та контрольної груп не виявлено. Жодного випадку токсичності ІІІ–V ступеня також не було відмічено.
Разом з тим відомо, що ПТ злоякісних новоутворень супроводжується опроміненням оточуючих тканин та циркулюючої крові і за певних радіаційних навантажень створює ризики віддалених ускладнень. Особливої уваги заслуговує ПТ пацієнток онкогінекологічного профілю, внаслідок якої можуть виникати променеві ураження органів малого тазу (цистит, уретрит, проктит), а також вторинні пухлини [22]. Показано, що вторинні пухлини вагіни частіше виникають при променевому лікуванні пацієнток з раком шийки матки (6–33%) та раком тіла матки (8–10%) [20, 29].
Отже, проблемою не тільки сучасної радіаційної онкології, але й клінічної радіобіології залишається подолання ранніх та пізніх променевих ускладнень, що потребує визначення предикторів радіочутливості тканин з оточення пухлини [21]. У зв’язку із цим нещодавно колективом радіобіологів Інституту експериментальної патології, онкології і радіобіології Національної академії наук України виконано комплексне обстеження онкогінекологічних хворих, які проходили БТ в клініці Національного інституту раку МОЗ України [5].
Із використанням тест-системи ЛПК хворих онкогінекологічного профілю (група дослідження) та донорів (група умовно здорового контролю) та тест-опромінення в діапазоні доз 0,5–3,0 Гр виявлено, що найбільш об’єктивними предикторами радіочутливості немалігнізованих клітин є цитогенетичні показники, а серед них променеві маркери — дицентричні хромосоми (рисунок).
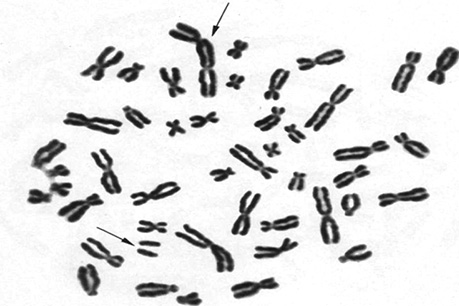
Нами зареєстровано, що в спектрі хромосомних перебудов ЛПК хворих переважають аберації хроматидного типу, а саме делеції та обміни, які становлять близько 66% від загального числа аберацій хромосом. Переважання в спектрі хромосомних аномалій Т-лімфоцитів хворих онкогінекологічного профілю аберацій хроматидного типу свідчить, що до початку БТ в здорових клітинах (моделлю яких обрані ЛПК) формується генетична нестабільність, яка може бути наслідком онкогенезу, низької ефективності репараційних процесів в немалігнізованих клітинах із оточення пухлини. Крім того, відповідно до сучасних уявлень, хромосомна нестабільність в соматичних клітинах, які контактують з пухлиною, може бути також пов’язана із фрагментами пухлинної ДНК, що вільно циркулюють у крові пацієнтів, тобто з «bystander-effect». Слід відмітити, що загальна частота променевих маркерів, а саме дицентричних хромосом, у групі онкологічних хворих до початку ПТ становить 0,12±0,08, тоді як в умовно здорових осіб (УЗО) цей тип аберацій хромосом не реєструвався (таблиця). Отримані дані однозначно свідчать про те, що Т-лімфоцити крові онкогінекологічних хворих ще до початку ПТ «скомпроментовані» за рахунок сформованої генетичної нестабільності.
| Групаобстеження | Доза, Гр | ||||
| 0 | 0,5 | 1,0 | 2,0 | 3,0 | |
| Хворі онкогінекологічного профілю | 0,12±0,08 | 1,0±0,0 | 2,25±0,25 | 4,75±0,47 | 12,5±2,47 |
| Донори | – | 1,0±0,0 | 3,6±0,24 | 8,6±1,29 | 26,25±4,71 |
p ≤ 0,05 — порівняно з контролем (донори).
Показано, що ТО зразків крові онкогінекологічних хворих в діапазоні доз 0,5–3,0 Гр призводить до зростання частоти аберацій хромосом у 2,1–5,6 раза відповідно. Характер дозової залежності цитогенетичного ефекту апроксимується лінійно-квадратичним рівнянням з перевагою значення α-коєфіцієнта, тобто лінійної компоненти: α = 9,52 проти β = 0,5. Залежність «доза — ефект» для променевих маркерів (дицентричних хромосом) апроксимується рівнянням лінійно-квадратичної регресії з перевагою значення квадратичного коєфіцієнта (β = 1,39), тоді як лінійний коєфіцієнт має від’ємне значення (α = −0,25). З дозою ТО частота дицентричних хромосом в діапазоні доз 0,5–3,0 Гр підвищується від 1,0 до 12,5±2,46/100 метафаз відповідно.
Таким чином, чітка дозова залежність частоти індукованих аберацій хромосом та специфічність радіаційного впливу (квадратична дозова залежність індукції променевих маркерів) в лімфоцитах крові первинних хворих є базовими критеріями для визнання їх в якості предикторів радіочутливості умовно здорових клітин, що потрапляють у зону ТО. Розроблену методологію визначення радіочутливості ЛПК та її екстраполяцію на клітини з оточення пухлини доцільно впроваджувати з метою персоніфікованого планування курсів ТО онкогінекологічних хворих.
Враховуючи загрозливу небезпеку поширення COVID-19 серед різних верств населення, нами вперше у світі запропонована гіпотеза можливого впливу SARS-CoV-2 на радіочутливість людини [30, 31]. Ключовим етапом гіпотези є інтерференція цитокінового «шторму» під впливом вірусу SARS-CoV-2 та запалення тканин, яке супроводжує опромінення. Не можна виключати, що підвищена системно-запальна активність тканин онкологічних хворих внаслідок дії SARS-CoV-2 може внести суттєві корективи у підвищення їх індивідуальної радіочутливості та впливати на ефективність ПТ.
ВИСНОВКИ
Високоенергетичні сучасні технології брахітерапії із застосуванням джерел високої потужності (HDR) 192Ir і 60Со при поєднаній променевій терапії онкогінекологічних хворих дозволяють концентрувати за короткий часовий проміжок високі дози енергії іонізуючого випромінювання в обмеженому обсязі тканин, що призводить до посилення терапевтичного ефекту променевої терапії з мінімальними ризиками виникнення важких променевих реакцій або пошкоджень.
Висока точність передпроменевої підготовки, коректне планування при використанні джерел випромінювання 192Ir HDR і 60Со HDR дає можливість істотно поліпшити безпосередні результати лікування онкогінекологічних хворих без збільшення проявів токсичності (загальної та місцевої), кількості і ступеня можливих ранніх і пізніх місцевих променевих ускладнень з боку критичних органів.
Характер дозової залежності променевих маркерів — дицентриків — при тест-опроміненні лімфоцитів периферичної крові онкогінекологічних хворих в діапазоні доз 0,5–3,0 Гр апроксимується рівнянням лінійно-квадратичної регресії. Це слугуватиме базовим критерієм для визнання дицентриків цитогенетичними предикторами підвищеної радіочутливості немалігнізованих клітин з оточення та ложа пухлини.
Список використаної літератури
1. Федоренко, З. П., Гулак, Л. О., Михайлович, Ю. Й., Горох, Є. Л., Рижов, А. Ю., Сумкіна, О. В., & Куценко, Л. Б. (2020). Рак в Україні, 2018–2019. Захворюваність, смертність, показники діяльності онкологічної служби. Бюлетень Національного канцер-реєстру України, 21. Кропивницький: Поліум.
2. Mobit. P. N., Nguyen. A., Packianathan. S., He. R., & Yang. C. C. (2016). Dosimetric comparison of brachytherapy sources for high-dose-rate treatment of endometrial cancer: (192)Ir, (60)Co and an electronic brachytherapy source. The British Journal of Radiology, (1059), 20150449. doi: 10.1259/bjr.20150449.
3. Palmer, A., Hayman, O., & Muscat, S. (2012). Treatment planning study of the 3D dosimetric differences between Co-60 and Ir-192 sources in high dose rate (HDR) brachytherapy for cervix cancer. Journal of Contemporary Brachytherapy, (1), 52–59. doi: 10.5114/jcb.2012.27952.
4. Yadav, S., Singh, O. P., Choudhary, S., Saroj, D. K., Yogi, V., & Goswami, B. (2021). Estimation and comparison of integral dose to target and organs at risk in three-dimensional computed tomography image-based treatment planning of carcinoma uterine cervix with two high-dose-rate brachytherapy sources: 60Co and 192Ir. Journal of Cancer Research, 17(1), 191–197. doi: 10.4103/jcrt.JCRT_199_19.PMID: 33723154.
5. Ivankova, V. S., Domina, E. A., Khrulenko, T. V., Makovetska, L. I., Hrinchenko, O. O, & Baranovska, L. M. (2021). Effects of brachytherapy on cytogenetic parameters and oxidative status in peripheral blood lymphocytes of gynecologic cancer patients. Experimental Оncology, 43 (3), Р. 242–246. doi: 10.32471/exp-oncology.2312-8852.vol-43-no-3.16514.
6. Suryadevara, A., Kumar, M. V., Vasundhara, E., Alluri, K. R., Ahamed, S., & Guduru, S. (2018). A dosimetric comparison between applicators used for brachytherapy in carcinoma cervix — A single-institute prospective study. Indian Journal of Cancer, 55(3), 230–232. doi: 10.4103/ijc.IJC_659_17. PMID: 30693884.
7. Kim, Y., Kim,Y. J., Kim, J. Y., Lim, Y. K., Jeong, C., Jeong, J., …, Park, S. Y. (2017). Toxicities and dose-volume histogram parameters of MRI-based brachytherapy for cervical cancer. Brachytherapy, 16(1), 116–125. doi: 10.1016/j.brachy.2016.10.005. Epub 2016 Nov 18.PMID: 27876378.
8. Shukla, A. K., Rana, B. S., Singh, N. P., & Kuma,r S. (2019). Dosimetric study of CO-60 source step size in uterine cervix intracavitary HDR brachytherapy. Brachytherapy, 18(2),180–185. doi: 10.1016/j.brachy.2018.12.006. Epub 2019 Jan 5. PMID: 30616914.
9. Zaman, Z. K., Ung, N. M., & Malik, R. A. (2014). Comparison of planned and measured rectal dose in vivo during high dose rate Cobalt-60 brachytherapy of cervical cancer. European Journal of Medical Physics, 30, 980–984. doi: 10.1016/j.ejmp.2014.07.002.
10. Shukla, A. K., Jangid, P. K., Rajpurohit, V. S., Verma A., Dangayach, S. K., Gagrani, V., & Rathore, N. K. (2019). Dosimetric comparison of 60Co and 192Ir high dose rate source used in brachytherapy treatment of cervical cancer. Journal of Cancer Research and Therapeutics, 15(6), 1212–1215. doi: 10.4103/jcrt.JCRT_372_19.
11. Ntekim, A., Adenipekun, A., & Akinlade, B. (2010). High dose rate brachytherapy in the treatment of cervical cancer: Preliminary experience with cobalt-60 radionuclide sourced-A prospective study. Clinical Medicine Insights: Oncology, 4, 89–94. doi: 10.4137/cmo.s5269.
12. Toossi, T. B., & Ghorbani, M. (2010). Air Kerma strength characterization of a GZP6 Cobalt-60 brachytherapy source. Reports of Practical Oncology and Radiotherapy, 15, 190–194. doi: 10.1016/j.rpor.2010.10.002.
13. Fumagalli, I., Haie-Méder, C., & Chargari, C. (2018). 3D brachytherapy for cervical cancer: New optimization ways. Cancer Radiotherapy, 22(4), 345–351. doi: 10.1016/j.canrad.2017.11.010. PMID: 29776831.
14. Jangid, P. K., Shukla, A. K., Rathore, N. K., Rajpurohit, V. S., Verma, A., & Dangayach, S. K. (2020). Dosimetric Effects of CO-60 and IR-192 Source Step Size in Intra Luminal Brachytherapy. Journal of Medical Physics and Applied Sciences, 5 (2), 5–8. doi: 10.36648/2574-285X.5.2.9.
15. Bhola, S., Selvam, T. P., Sridhar, S., & Vishwakarma, R. S. (2012). An analytic approach to the dosimetry of a new BEBIG 60Co high dose- rate brachytherapy source. Journal of Medical Physics, 37, 129–137. doi: 10.4103/0971-6203.99228.
16. Strohmaier, S., & Zwierzchowski, G. (2011). Comparison of (60)Co and (192)Ir sources in HDR brachytherapy. Journal of Contemporary Brachytherapy, 3(4), 199–208 . doi: 10.5114/jcb.2011.26471.
17. Andrássy, M., Niatsetsky, Y., & Pérez-Calatayud, J. (2012). Co-60 vs Ir 192 in HDR brachytherapy: scientific and technological comparison. Revista de Física Médica, 13(2),125–130.
18. Mobit, P. N., Packianathan, S., He R., & Yang, C. C. (2015). Comparison of Axxent-Xoft, (192)Ir and (60)Co high-dose-rate brachytherapy sources for image-guided brachytherapy treatment planning for cervical cancer. Вritish Journal of Radiology, (1052), 20150010. doi: 10.1259/bjr.20150010.
19. Bassi, S., Berrigan, L., Zuchora, A., Fahy, L., & Moore, M. (2020). End-to-end dosimetric audit: A novel procedure developed for Irish HDR brachytherapy centres. Physica medica, 80, 221–229. doi: 10.1016/j.ejmp.2020.10.005.
20. Eifel, P. J., Berek, J. S., & Markman, M. A. (2011). Cancer of the cervix, vagina, and vulva. Cancer: Principles and Practice of Oncology. Philadelphia, Pa: Lippincott Williams & Wilkins.
21. Дьоміна, Е. А., & Іванкова, В. С. (2018). Предиктори радіочутливості немалігнізованих клітин онкологічних хворих. Український радіологічний журнал, 2, 39–40.
22. Domina, E., Philchenkov, A., & Dubrovska, A. (2018). Individual response to ionizing radiation and personalized radiotherapy. Critical Reviews in Oncology, 23(1–2), 69–92. doi: 10.1615/CritRevOncog.2018026308.
23. Otter, S. J., Stewart, A. J., & Devlin, P. M. (2019). Modern Brachytherapy. Hematology/Oncology Clinics of North America, 33(6), 1011–1025. doi: 10.1016/j.hoc.2019.08.011.
24. Alam, N., Akram, M., Siddiqui, S. A., & Hussain, M. A. B. (2019). Interdigitated versus sequential high-dose-rate intracavitary brachytherapy with external beam radiotherapy in locally advanced carcinoma cervix. Journal of Cancer Research and Therapeutics, 15(6), 1254–1259. doi: 10.4103/jcrt.JCRT_301_17.
25. Kim, H., Beriwal, S., Houser, C., & Huq, M. S. (2011). Dosimetric analysis of 3D image-guided HDR brachytherapy planning for the treatment of cervical cancer: is point A-based dose prescription still valid in image-guided brachytherapy? Medical Dosimetry, 36(2), 166–70. doi: 10.1016/j.meddos.2010.02.009.
26. Wang, X., Fan, L., Yan, W., Bao, S., & Liu, L. (2020). Comparison of accuracy and long-term prognosis between computed tomography-based and magnetic resonance imaging-based brachytherapy for cervical cancer: A meta-analysis. Journal of Medical Imaging and Radiation Oncology, 64(1), 151–162. doi: 10.1111/1754-9485.12984.
27. Ma, Y., Zhao, G., Qi, J., Sun, P., Liu, C., Qu, P., & Chan K. К. L. (2018). Neoadjuvant brachytherapy and chemotherapy followed by radical surgery for stage IB2 and IIA cervical cancer: A retrospective comparison with chemoirradiation. Molecular and Clinical Oncology, 8(4), 617–622. doi: 10.3892/mco.2018.1580.
28. Mathews, S., Azariah, M. B., Mohandas, S., Menon, S. V., George, P., & Jayaprakash, P. G. (2019). Comparison of volume doses from conventional two-dimensional brachytherapy with corresponding doses from three-dimensional magnetic resonance imaging-based brachytherapy in carcinoma cervix. Journal of Cancer Research and Therapeutics, 15(6), 1332–1337. doi: 10.4103/jcrt.JCRT_992_17. PMID: 31898669.
29. Розенко, Л. Я., Варзер, Е. А., & Юдина, Л. В. (2014). Способ внутриполостной терапии при лечении больных с метастазами рака во влагалище. Вестник онкологического научного центра, 3, 30.
30. Domina, E. (2020). Radiosensitivity of professinals and COVID-19, Матеріали науково-практичної конференції «Актуальні питання радіаційної онкології в Україні». Одеса.
31. Chekhun, V. F., & Domina, E. A. (2021). Can SARS-CoV-2 change individual radiation sensitivity of the patients recovered from COVID-19? (Experimental and theoretical background). Experimental Оncology, 43(3), 277–280. doi: 10.32471/exp-oncology.2312-8852.vol-43-no-3.16554.
Адреса:
Іванкова Валентина Степанівна
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
Е-mail: valentina_ivankova@ukr.net
Сorrespondence:
Ivankova Valentina
33/43 Lomonosova Str., Kyiv 03022
National Cancer Institute
E-mail: valentina_ivankova@ukr.net














Leave a comment