Сучасні технології брахітерапії раку шийки матки
Іванкова В.С., Шевченко Г.М., Хруленко Т.В., Барановська Л.М., Столярова О.Ю., Галяс Г.В.
Резюме. Проведено хіміопроменеву терапію 105 хворим на місцево-поширений рак шийки матки IIB–IIIB стадії пухлинного процесу (T2b-3bN0-1M0) за розробленими методами комплексної консервативної терапії з урахуванням індивідуального планування курсу 60Co HDR (високої потужності дози — high dose rate) брахітерапії. Було оцінено ефективність хіміопроменевої терапії (регресія пухлинного вогнища та вираженість загальних і місцевих променевих реакцій з боку «критичних» органів та систем). Токсичні ефекти лікування за кількістю та ступенем вираженості у досліджених групах не відрізнялися від контрольної та не перевищували ІІ ступеня.
Вступ
 Метою брахітерапії (БТ) є деструктивний вплив безпосередньо на первинне пухлинне вогнище. Головними факторами, що визначають відповідь біологічного об’єкта на дію іонізуючого випромінювання при БТ, як і при дистанційній променевій терапії (ДПТ), є: репарація сублетальних ушкоджень дезоксирибонуклеїнової кислоти (ДНК), репопуляція об’єкта та рівень його кисневої насиченості. Відмінність цих методів променевої терапії (ПТ) полягає у особливостях розподілу поглинутої енергії у просторі та часі. Градієнт дози навколо імплантованого радіаційного джерела набагато вищий, ніж при ДПТ, що дозволяє концентрувати енергію іонізуючого випромінювання в опромінюваній мішені з суттєвим зменшенням променевого навантаження на суміжні органи. Чинниками ефективності БТ є значення потужності дози при контактному опромінюванні низькою дозою (0,4–2 Гр/год — low dose rate — LDR) і модель фракціонування при використанні променевої енергії високої потужності (більше 12 Гр/год — high dose rate — HDR) [7, 15–17].
Метою брахітерапії (БТ) є деструктивний вплив безпосередньо на первинне пухлинне вогнище. Головними факторами, що визначають відповідь біологічного об’єкта на дію іонізуючого випромінювання при БТ, як і при дистанційній променевій терапії (ДПТ), є: репарація сублетальних ушкоджень дезоксирибонуклеїнової кислоти (ДНК), репопуляція об’єкта та рівень його кисневої насиченості. Відмінність цих методів променевої терапії (ПТ) полягає у особливостях розподілу поглинутої енергії у просторі та часі. Градієнт дози навколо імплантованого радіаційного джерела набагато вищий, ніж при ДПТ, що дозволяє концентрувати енергію іонізуючого випромінювання в опромінюваній мішені з суттєвим зменшенням променевого навантаження на суміжні органи. Чинниками ефективності БТ є значення потужності дози при контактному опромінюванні низькою дозою (0,4–2 Гр/год — low dose rate — LDR) і модель фракціонування при використанні променевої енергії високої потужності (більше 12 Гр/год — high dose rate — HDR) [7, 15–17].
Упродовж багатьох років у Національному інституті раку досліджували ефективність БТ раку шийки матки (РШМ) джерелами гамма-випромінювання Со, Сs та нейтронного — Cf. Визначено оптимальні технології БТ РШМ інкапсульованими джерелами Со та Cf низької активності у режимі ручного введення (LDR) та на шлангових гамма-терапевтичних установках АГАТ-В, АГАТ-ВУ (Со) і Селектрон (Сs) з енергією випромінювання в межах 2–12 Гр/год — середня потужність дози — middle dose rate (MDR). Для сучасної радіоонкології характерним є використання шлангової радіотерапевтичної апаратури з джерелами Со та Ir, що продукують енергію гамма-випромінення потужністю більше 12 Гр/год (HDR). Вибір ефективних моделей контактної ПТ РШМ все ще залишається предметом наукового пошуку. Не існує переконливого радіобіологічного обґрунтування переваг HDR БТ для хворих на початкові, радіочутливі форми РШМ. Переорієнтація на сучасні високоенергетичні установки для БТ мотивується переважно чинниками економічного характеру, ступенем комфорту та радіологічної безпеки для пацієнтів і медичного персоналу. Більш інтенсивних, порівняно з LDR БТ, деструктивних процесів у пухлині слід очікувати у хворих з місцево-поширеними (МП) формами РШМ, карциномами аденогенного походження, які відрізняються відносною радіорезистентністю. Фактором, що регламентує дозове навантаження є толерантність органів і тканин, які межують з опромінюваною мішенню, тобто розташовані у зоні ризику. Обираючи модель HDR БТ необхідно враховувати вірогідність пізніх променевих ефектів з боку критичних органів. У зарубіжній літературі репрезентовані результати двох рандомізованих досліджень ретроспективного порівняльного аналізу ефективності фракціонованої HDR і пролонгованої LDR внутрішньопорожнинної (ВП) БТ у хворих на РШМ. Вивчали наступні режими: ВП БТ HDR разова вогнищева доза (РВД) 10 Гр на т. А, 3 фракції, сумарна вогнищева доза (СВД) на т. А 30 Гр та LDR БТ — пролонговане опромінення СВД 35 Гр до 37,5 Гр на т. А за 1–2 сеанси. Ретроспективний аналіз включав комплексне дослідження і протоколювання впливу експозиції малих доз радію при пролонгованих експозиціях тривалістю 70–77 год. За результатами цих досліджень запатентовано мінімальні та максимальні дози опромінення для використання у медичній практиці [2–4, 8, 14].
Дослідження Л.А. Мар’їної та співавторів, 2009 р. (Російський Онкологічний Науковий Центр), засвідчили, що при поєднаній променевій терапії (ППТ) РШМ застосування БТ за 4 фракції 1 раз на тиждень РВД 9,8 Гр (D=600 Гр/год) або 9,9 Гр (D=30 Гр/год) відповідає 9% ймовірності ранніх променевих реакцій з боку сечового міхура, а РВД 8,1 Гр (D=600 Гр/год) та 8,3 Гр (D= 30 Гр/год) — 7% ймовірності пізніх променевих уражень. Для прямої кишки при подібному режимі фракціонування поглинуті дози 9,4 Гр (D=600 Гр/год) та 9,8 Гр (D=30 Гр/год) з 12% ймовірністю прогнозовані ранні променеві реакції, а 9,1 Гр (D=600 Гр/год) і 9,3 Гр (D=30 Гр/год) — 7% прогноз пізніх ускладнень. За даними літератури, при високоенергетичній БТ застосування РВД понад 7 Гр призводить до більш значного, порівняно з пухлиною, деструктивного впливу на оточуючі неушкоджені тканини. Подовження курсу ПТ сприяє зменшенню ранніх місцевих проявів токсичності, суттєво не впливаючи на чисельність пізніх променевих ускладнень. Стосовно відповіді пухлини: клінічно доведено, що подовження терміну лікування негативно позначається на терапевтичному ефекті [1, 6, 10–12].
Класичні рівні толерантності нормальних тканин дійсні лише при ДПТ за умови стандартного режиму фракціонування (РВД 1,8–2 Гр 5 разів на тиждень). Параметри, що визначають толерантність:
- здатність біологічного об’єкта до репарації та особливості кінетики репаративних процесів;
- вид опромінення, його потужність (темпи репарації сублетальних ушкоджень безпосередньо у процесі опромінювання);
- СВД;
- кількість фракцій (репарація сублетальних ушкоджень найближчим часом після кожного сеансу опромінювання);
- поглинальна доза за фракцію (РВД), враховуючи відмінності кривої виживаності клітин різного тканинного походження;
- інтервали між фракціями та перерви під час курсу ПТ (відновлення клітинного складу тканини і проліферація клітин);
- опромінюваний об’єм через розбіжності у компенсаторних можливостях різних органів та систем;
- фактори, що впливають на кінетику репаративних процесів хворої (наявність/відсутність супутньої патології та ін.) [3, 5].
Дослідження розподілу доз у тканинно-еквівалентних середовищах в діапазоні від 7 до 30 мм (зона зацікавленості) свідчать, що відмінності у БТ з використанням радіоактивних джерел Co, Cs та Ir пояснюються переважно потужністю енергії іонізуючого опромінення, яку вони генерують. Збільшення потужності дози еквівалентне збільшенню дози за фракцію, а вибір моделі фракціонування (значення дози за фракцію) здебільшого позначається на реакціях з боку пізно реагуючих тканин. Проблемою є визначення інтервалу потужностей доз, при якому варіанти біологічної ефективності мають клінічне значення. Застосування БТ різної потужності (LDR, MDR та HDR) потребує визначення еквівалентних дозових навантажень — СВД та оптимального режиму її фракціонування. Розробка нових і оптимізація існуючих технологій БТ є одним із ефективних напрямків удосконалення ППТ МП форм РШМ. Оснащення радіоонкологічних відділень України високоенергетичними шланговими гамма-терапевтичними установками є мотивувальною підставою для розробки радіобіологічно обґрунтованих, ефективних та безпечних вітчизняних стандартів HDR БТ РШМ [5, 8, 9, 13].
Матеріал та методи
З 2009 р. у відділенні клінічної радіоонкології з блоком БТ Національного інституту раку України функціонує комплекс для проведення HDR БТ, до складу якого входять: п’ятиканальний апарат Gyne Source (Eckert and Ziegler, Bebig) з джерелом Со активністю 52,14 ГБк (активна довжина — 3,5 мм, активний діаметр — 0,6 мм, загальний зовнішній — 1 мм), що генерує енергію гамма-випромінювання потужністю 28,6 Гр/год; рентгенівський апарат із S-дугою (Phillips BV Libra); мобільний стіл з можливістю регулювання положення пацієнтки, адаптований до рентгенівського апарата; система індивідуального дозиметричного планування Plus; обладнання для дозиметричного контролю джерела.
Сучасна методологія розрахунку дозових навантажень при ВП БТ в онкогінекології викладена у рекомендаціях Міжнародної комісії з радіаційних одиниць і вимірів (МКРО — ICRU). Основні положення цього документу визначають системний підхід до планування БТ гінекологічного раку. Перш за все, це можливість симуляції лінійних джерел кількома точковими, розташованими на однаковій відстані один від одного, та імітація пересування точкового джерела. Змінюючи тип пересування (безперервне чи стрибкоподібне), швидкість і час перебування джерела у різних позиціях можна формувати об’єми ізодоз необхідної конфігурації та розмірів. Об’єм поглинутої дози при БТ визначається за розмірами обраної референтної ізодози, що має обмежувати референтний терапевтичний об’єм — referent treatment volume (RTV), у якому міститься безпосередньо мішень опромінювання — target volume (TAV). TAV визначається індивідуально, залежно від розміру пухлинного вогнища та анатомічних структур хворої. Органами ризику є сечовий міхур і пряма кишка, що межують з TAV і впливають на вибір вогнищевої дози [1, 8, 10, 11].
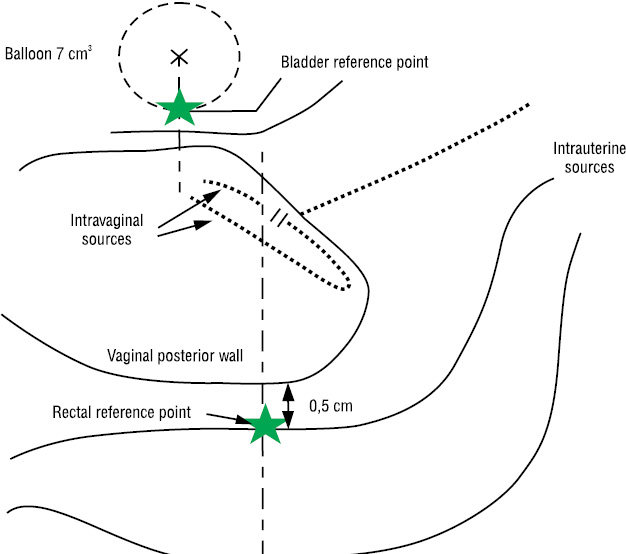
Планування конвенційної БТ у режимі LDR проводиться за референтною ізодозою, що відповідає СВД 60 Гр. Для MDR та HDR БТ запланована СВД має бути біологічно еквівалентною 60 Гр LDR. Референтний об’єм, класичної грушоподібної форми, розраховується індивідуально, відносно джерела, таким чином, аби референтна ізодоза проходила через точку нормування — т. А з максимальними значеннями на референтний об’єм і мінімальним — на органи ризику (рис. 1). Референтна точка сечового міхура визначається за рентгенограмами у центрі зображення балона катетера Фалея, у ділянці його максимального наближення до мішені опромінення. Референтною точкою прямої кишки є точка, розташована на відстані 5 мм від місця контакту овоїдів із задньою стінкою піхви. Розподіл ізодоз розраховується як мінімум у двох площинах — фронтальній і сагітальній [1, 8, 9].
Мотивуючою підставою для використання ефекту потужності дози є явище репарації. Сучасний підхід до кількісної оцінки впливу фракціонованого опромінення базується на клітинно-кінетичних моделях, які дозволяють розрахувати відносну кількість репарованих (відновлених) клітин і тим самим оцінити ізоефективність різних режимів фракціонування. В основу математичного моделювання покладено поняття про біологічні об’єкти, які реагують рано та пізно, що виражається коефіцієнтом α/β. Пухлини належать до систем, які рано реагують, з коефіцієнтом α/β=10, тканини критичних органів переважно є об’єктами, що пізно реагують, з α/β в межах 2–3 Гр. Тканини, які рано реагують, майже не чутливі до зменшення дози за фракцію поза межами 2–3 Гр, у той час як толерантність кишечнику, особливо у сенсі пізніх радіоепітеліїтів, драматично залежать від РВД за фракцію у подібному інтервалі. Це пояснюється їх відмінністю відносно здатності до репарації сублетальних ушкоджень, що виникають внаслідок впливу іонізуючого випромінювання, і є підставою для різного ефекту фракціонування для тканин, що реагують рано чи пізно [9, 17].
Враховуючи дані провідних клінік світу відповідно до документів, що регламентують терапевтичне застосування іонізуючого випромінювання, з допомогою математичного моделювання нами розроблено наступні методики НDR БТ МП РШМ на апараті Gyne Source:
I — РВД на т. А — 5 Гр 1 раз на 5–6 діб, СВД — 30–35 Гр за 6–7 фракцій;
II — РВД на т. А — 7 Гр 1 раз на тиждень, СВД — 28–35 Гр за 4–5 фракцій.
Мішень опромінення визначали шляхом зіставлення клінічних даних із зображеннями, отриманими за допомогою комплексного ультразвукового дослідження (УЗД), а також магнітно-резонансної томографії (МРТ).
Перед кожним сеансом ВП БТ хворим проводили топометричну підготовку з контрастуванням сечового міхура та прямої кишки за допомогою рентгенівського апарата за загальноприйнятою методикою. Рентгенівські знімки у фронтальній і сагітальній проекціях передавали по комп’ютерній мережі DICOM у двохвимірному форматі на планувальну систему, після чого розпочинали безпосередньо планування лікувального процесу (рис. 2).
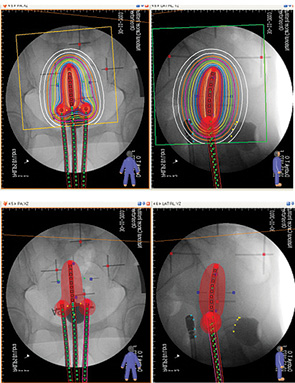
Індивідуальне планування кожного сеансу ВПБТ здійснювали лікар-радіоонколог та медичний фізик за допомогою двовимірної системи дозиметричного планування HDR ВП БТ Plus згідно з розробленими моделями (рис. 3).
Результати та їх обговорення
Проведено обстеження та лікування 105 хворих на РШМ IIB–IIIB стадії (T2b-3bN0-1M0) віком від 29 до 70 років. За морфологічною структурою у 63 хворих (60,0%) діагностовано епідермоїдний рак різного ступеня диференціації (високодиференційований у 7 пацієнток (11,1%), помірнодиференційований — у 37 (58,7%), низькодиференційований — у 19 (30,2%)); у 25 хворих (23,8%) виявлено пухлини аденогенного походження; у 6 (5,7%) — карциноми інших гістологічних форм (світлоклітинні, дрібноклітинний та ін.), у 11 пацієнток (10,5%) — недиференційовані пухлини. Cпостерігалися лише змішані форми МП РШМ. Екзо-ендофітні карциноми епідермоїдного походження різного ступеня диференціації з вираженим екзофітним компонентом виявлено у 34 хворих (32,4%). Пухлини шийки матки змішаного характеру з більш вираженим ендофітним компонентом — у 29 пацієнток (27,6%).
Залежно від методу БТ хворих було розподілено на 3 групи (2 досліджувані і 1 контрольну):
I група — 35 хворих на МП РШМ, яким проводили НDR БТ у наступному режимі: РВД на т. А — 5 Гр 1 раз на 5–6 діб, СВД — 30–35 Гр за 6–7 фракцій;
II — 30 хворих: 7 Гр 1 раз на тиждень, СВД — 28–35 Гр за 4–5 фракцій.
До III, контрольної групи, входили 40 хворих на МП РШМ, яким БТ проводили на апараті АГАТ-ВУ (потужність дози — 7,6 Гр/год — МDR): РВД на т. А – 8 Гр 1 раз на 6–7 діб, СВД — 40–48 Гр за 5–6 фракцій.
Відбір хворих у досліджувані та контрольну групи проводили за методом випадкових чисел. Вибір режиму фракціонування НDR БТ зумовлювався параметрами пухлини та анатомічними особливостями пацієнтки. Вирішальним критерієм було дозове навантаження на органи зони ризику. Відомо, що оптимальним є розподіл енергії гамма-опромінювання з максимальними його значеннями у пухлинному осередку і мінімальними на критичні органи. Граничним значенням РВД на референтні точки прямої кишки та сечового міхура є 5 Гр за сеанс.
ДПТ проводили на апараті ТЕРАТРОН енергією 1,25 МеВ за стандартною методикою. СВД від ДПТ становила 20–30 Гр на т. ОАВ (2 Гр 5 разів на тиждень) на першому етапі лікування, 44 Гр на т. В — на другому етапі (РВД 2 Гр 4 рази на тиждень).
Ефективність лікування визначали за регресією первинного пухлинного вогнища та наявністю/відсутністю токсичних проявів.
Відповідь пухлини на ПТ оцінювали за допомогою клінічних показників у зіставленні з динамікою зображень, отриманих за допомогою МРТ та даних комплексного УЗД, у процесі лікування та через 3 міс після його завершення (зважаючи на відстрочений ефект ПТ).
Аналіз власних безпосередніх результатів ППТ з HDR БТ на установці Gyne Source не виявив достовірних розбіжностей у відповіді пухлин шийки матки та реакції з боку критичних органів, залежно від методики БТ. Повну регресію первинного пухлинного утворення відзначено у 8 (22,9%) пацієнток I групи, у 7 (23,3%) — II та у 9 (22,5%) — III, часткова, відповідно, у 14 (40%) хворих I групи, у 11 (36,7%) — II та у 17 (42,5%) — III групи.
Токсичність НDR БТ визначали за частотою та ступенем місцевих мукозитів (променеві епітеліїти верхньої третини піхви, ранні променеві цистити, ректити). У цьому контексті слід зазначити, що ранні променеві реакції I–II ступеня з боку верхньої третини піхви є практично невід’ємною складовою ППТ МП РШМ за радикальною методикою. Їх повна відсутність до певної міри може розглядатись як свідчення того, що не вичерпані усі можливі ресурси ПТ. Катаральні променеві епітеліїти піхви у вигляді гіперемії спостерігалися у 20 (57,1%) пацієнток I групи, у 18 (60,0%) — II та у 23 (57,5%) — III, катаральні ексудативні епітеліїти — у 4 (11,4%) I групи, у 3 (10,0%) — II та у 4 (10,0%) — III. Променеві цистити I та II ступеня відзначено у 6 (17,1%) хворих I групи, у 5 (16,7%) — II та у 6 (15,0%) — III, ректити I ступеня токсичності у 5 (14,3%) пацієнток I групи, у 4 (13,3%) — II та у 5 (12,5%) III групи.
Місцевих променевих реакцій, що перевищують II ступінь токсичності, не спостерігали у жодної хворої.
Висновки
У результаті проведеного дослідження удосконалено топометричну підготовка хворих на МП РШМ до БТ.
Розроблено методики застосування НDR БТ у хворих на МП РШМ на апараті Gyne Source за допомогою математичного моделювання з урахуванням досвіду провідних клінік світу та відповідно до документів, що регламентують терапевтичне застосування іонізуючого випромінювання.
Проведено клінічну апробацію розроблених методик НDR БТ на апараті Gyne Source. Отримані результати свідчать про ефективність та відсутність надмірної токсичності розроблених режимів фракціонування НDR БТ за умови якісної допроменевої підготовки пацієнток.
Література
1. Андреева Ю.В., Кравец О.А., Марьина Л.А., Нечушкин М.И. и др. (2008) Дозиметрическое планирование брахитерапии. Материалы V съезда онкологов и радиологов СНГ, Ташкент, 14–16 мая, С. 488.
2. Киселева М.В., Крикунова Л.И. (2000) Сочетанная лучевая терапия рака шейки матки. Материалы 5-го Всерос. съезда онкологов «Высокие технологии в онкологии», Казань, Т.2: 344—345.
3. Кравец О.А., Андреева Ю.В., Козлов О.В., (2009) Клиническое и радиобиологическое планирование брахитерапии местно-распространенного рака шейки матки. Медицинская физика, 2(42): 10–17.
4. Іванкова В.С., Хруленко Т.В., Шевченко Г.М. та ін. (2008) Консервативне лікування місцево-поширених форм раку шийки матки та можливості його удосконалення. Променева діагностика, променева терапія, 2: 38–42.
5. Лучевая терапия в лечении рака : практическое руководство / под ред. Chapman & Hall Medical. — М. : ВОЗ, 2000. — 338 с.
6. Кравец О.А., Марьина Л.А., Нечушкин М.И. и др. (2009) Результаты лучевой терапии рака шейки матки с использованием иридия-192 для контактного облучения. Опухоли женской репродуктивной системы, 3–4: 99–101.
7. Туркевич В.Г., Баранов С.Б., Авакумова В.В. (2000) Современные подходы при проведении брахитерапии гинекологического рака. Материалы 5-го Всерос. съезда онкологов «Высокие технологии в онкологии», Казань, Т.2: 361–362.
8. Gerbaulet A., Putter R., Mazeron J. et al. (2005) Cervix carcinoma. The GEC ESTRO handbook of brachytherapy, Belgium: ACCO, 301–363.
9. Aird E., De Neve W., Huyskena D. et al. (2003) Cervix carcinoma. ESTRO. Учебный курс Европейской Ассоциации Терапевтических Радилогов и Онкологов. Физика в клинической лучевой терапии. Москва, Россия: 25–29 мая.
10. Strauss H.-G., Kuhnt T., LabanC. et al. (2002) Chemoradiation in cervical cancer with cisplatin and high-dose rate brachytherapy combined with external beam radiotherapy results of a phase-II study. Strahlentherapie und Onkologie, 7(178): 378–385.
11. Duenas-Gonzalez A., Cetina-Peraz L., Onate-Ocana L.E. et al. (2005) Multimodel treatment of locally advanced cervical cancer. Arch. Med. Res., 2(36): 129–135.
12. Kellas-Sleczka S., Biaіas B., Fijaіkowski M. et al. (2009) Evaluation of HDR brachytherapy fraction dose on local control and complications rate in patients with cervical cancer IB and IIA. J. Contemp. Brachyther., 3: 187.
13. Grigsby P.W. (2000) Intracavitary brachytherapy and cervical cancer. The Cancer J. Scientific Americ., 6(6): 362–364.
14. Lertsanguansinchai P., Lertbutsayanukul C. et al. (2004) Phase III randomized trial comparing LDR and HDR brachytherapy in treatment of cervical carcinoma. Int. J. Radiat. Oncol. Biol. Phys., 59: 1424.
15. Biaіas B., Kellas-Sleczka S., Fijaіkowski M. et al. (2009) Tolerance and efficacy of preoperative intracavitary HDR brachytherapy in IB and IIA cervical cancer. J. Contemp. Brachyther., 1: 38–44.
16. Kravetz O.A., Bagatyrev V.N., Nechushkin M.I. (2008) Treatment results and prognostic analysis of radical radiotherapy for advanced cancer of the uterine cervix. Proceedings of UICC World Cancer Congress International Union Against Cancer. — Geneva, Switzerland, 27–31 August, P. 211.
17. Sood B.M., Gorla G., Gupta S. et al. (2002) Two fractions of high-dose-rate brachytherapy in the management of cervix cancer: clinical experience with and without chemotherapy. Int. J. Radiat. Oncol. Biol. Phys., 3(53): 702–706.
Современные технологии брахитерапии рака шейки матки
Национальный институт рака, Киев
Резюме. Проведена химиолучевая терапия 105 больным местно-распространенным раком шейки матки IIB–IIIB стадии опухолевого процесса (T2b-3bN0-1M0) по разработанным методам комплексной консервативной терапии с учетом индивидуального планирования курса Co HDR (high dose rate) брахитерапии. Была оценена эффективность химиолучевой терапии (регрессия опухолевого очага и выраженность общих, местных лучевых реакций со стороны «критических» органов и систем). Токсические эффекты лечения по количеству и степени выраженности в исследованных группах не отличались от контрольной и не превышали II степени.
рак шейки матки, Co (HDR) брахитерапия, химиолучевая терапия, регрессия, токсичность.














Leave a comment