Новий підхід до лікування пацієнтів з метастатичним нирково-клітинним раком
Стаховський Е.О.1, Вітрук Ю.В.1, Войленко О.А.1, Стаховський О.Е.1, Кононенко О.А.1, Пікуль М.В.1, Семко С.Л.1, Вукалович П.С.1, Гречко Б.О.1, Кошель Д.О.1, Тимошенко А.В.1, Буйвол О.В.1, Вітрук В.Й.2, Гарбар Р.Ф.2, Петрищева О.Х.2, Пасічник С.М.3
- 1Національний інститут раку, Київ, Україна
- 2Центр сучасної урології, Київ, Україна
- 3Львівський національний медичний університет імені Данила Галицького, Україна
Резюме. Матеріали та методи. У статті представлено результати проміжного аналізу проспективного нерандомізованого дослідження клінічної ефективності циторедуктивної резекції нирки в лікуванні хворих на метастатичний нирково-клітинний рак (мНКР), яке проводилося з 2008 р. в Національному інституті раку. Критеріями включення в це дослідження були: вік хворих від 18 до 75 років; клінічно та гістологічно підтверджений метастатичний світлоклітинний нирково-клітинний рак (будь-яке T/будь-яке N/M1); відсутність тромбозу ниркової чи нижньої порожнистої вени; об’єм функціонуючої паренхіми нирки (remaining functioning parenchyma volume — RFPV) на стороні ураження більше 50%. Критерії виключення — пацієнти з двосторонніми пухлинами нирки, вираженою хронічною хворобою нирок (сумарна швидкість клубочкової фільтрації <30 мл/хв), супутньою онкопатологією чи будь-якими іншими системними захворюваннями. Загалом до аналізу було включено 109 хворих: першу групу склали 55 (50,5%) пацієнтів, яким була виконана циторедуктивна резекція нирки (ЦР), другу групу — 54 (49,5%) хворих, яким виконана циторедуктивна нефректомія (ЦН). Метою дослідження було визначити показання до ЦР у хворих на мНКР та оцінити онкологічні результати. Результати. Групи співставні за віком, статтю, індексом маси тіла, загальним станом, наявністю супутньої патології, функцією нирок, кількістю уражених систем метастазами та Fuhrman grade. Групи відрізнялися за максимальним діаметром пухлини, R.E.N.A.L. score, об’ємом функціонуючої паренхіми нирки, Т-стадією та групами ризику за Міжнародним консорціумом баз даних метастатичного раку нирки (International Metastatic Renal Cancer Database Consortium — IMDC). Не виявлено статистично значущої відмінності за показником виживаності у двох групах (p=0,093 за логранговим критерієм), але показник 7-річної комулятивної виживаності в групі ЦН становив 7,3±3,9% проти 23,9±6,3% в групі ЦР. ЦР нирки достовірно знижує ризик смерті порівняно з ЦН (p=0,037), відношення ризиків=0,62 (95% довірчий інтервал 0,39–0,97). Показники, що характеризують складність та безпеку хірургічного втручання, в основному були однаковими в обох групах. Летальних випадків не було при жодному з хірургічних методів. ЦР виконана при об’ємі функціонуючої паренхіми нирки на стороні ураження 56% і більше та у 85,4% випадків локалізації пухлини в полюсі нирки чи латерально, у 14,6% — у воротах нирки. Висновки. ЦР є безпечним хірургічним методом лікування хворих на мНКР, яка дозволяє зменшити об’єм пухлинного процесу, зберегти максимальну кількість функціонуючої паренхіми нирок за мінімальної хірургічної травми, що забезпечить зниження рівня ниркової недостатності та, як наслідок, зменшення кількості випадків виникнення потенційних несприятливих подій системної терапії та розвитку хронічної ниркової недостатності. Онкологічні результати у разі ЦР є кращими, ніж при ЦН — у вибраних випадках.
Одержано 1.08.2022
Прийнято до друку 19.08.2022
DOI: 10.32471/clinicaloncology.2663-466X.45-1.28874
Вступ
Протягом останніх десятиліть змінилися підходи до лікування пацієнтів з локалізованим та мНКР. Замість радикальної нефректомії рекомендується в якості кращого хірургічного методу резекція нирки, оскільки вона дозволяє максимально зберегти паренхіму нирки, не погіршуючи онкологічні результати [1]. Впровадження резекції нирки обумовлено тим, що у близько 26% хворих на НКР відмічають хронічну ниркову недостатність ще до проведення нефректомії [2], ще у великої кількості пацієнтів може розвинутися хронічна ниркова недостатність після хірургічного втручання у зв’язку з втратою ниркової маси [3–5], а також внаслідок нефротоксичної дії таргетної чи імунотерапії [6–8].
Ера нових таргетних препаратів та check-point інгібіторів кардинально змінила тактику лікування хворих на мНКР. Оскільки таргетна терапія та імунотерапія збільшили тривалість життя пацієнтів з метастатичним раком нирки [9, 10], хірургічне лікування має також зосереджуватися на збереженні ниркової функції, намагаючись знизити серцево-судинну захворюваність та покращити здатність хворих добре переносити системну терапію. Перевагою ж циторедуктивної хірургії є зменшення пухлинного навантаження на організм з метою покращення ефективності системного лікування, а також усунення потенційного джерела нових метастазів [11, 12].
На сьогодні спостерігається недостатність даних щодо впливу циторедуктивної резекції (ЦР) у порівнянні із циторедуктивною нефректомією (ЦН) на показник загальної виживаності. Проте в окремих випадках резекція нирки може відповідати радикальній нефректомії з точки зору безпеки, що дає шанс отримати хороші онкологічні та функціональні результати.
Мета дослідження. Визначити показання до ЦР нирки у хворих на мНКР та оцінити онкологічні результати.
Матеріали та методи
У науково-дослідному відділенні пластичної та реконструктивної онкурології Національного інституту раку України з 2008 р. проводиться проспективне нерандомізоване дослідження, яке має на меті перевірити клінічну ефективність ЦР нирки в лікуванні хворих на мНКР. У разі виконання резекції нирки хворого рандомізують до групи ЦР, якщо виконано нефректомію — до групи ЦН.
Дослідження було схвалено Локальною етичною комісією при Національному інституті раку та проводиться відповідно до Гельсінської декларації та Настанови з належної клінічної практики (Good Clinical Practice — GCP).
Стратегія лікування хворих на мНКР обговорюється в рамках мультидисциплінарної команди. У всіх випадках в аспекті хірургічного втручання перевага віддається ЦР нирки, показання до якої базується на об’ємі функціонуючої паренхіми нирки об’ємом функціонуючої паренхіми нирки (remaining functioning parenchyma volume — RFPV) на боці ураження [13], локалізації та розміру пухлини.
Усі хворі після операції отримують послідовну системну терапію згідно з наявними стандартами лікування. Ефективність терапії оцінюють на основі спіральної комп’ютерної томографії (СКТ) чи магнітно-резонансної томографії (МРТ), які виконують на початку лікування та під час усіх контрольних обстежень. Контрольні обстеження включають регулярні лабораторні дослідження — з метою виявлення небажаних явищ лікування та обов’язкове проведення СКТ чи МРТ кожні 3 міс. Перехід на наступну лінію терапії проводять у разі прогресування за критеріями RECIST 1.1. Вивчаються показники локального рецидивування, а також канцер-специфічної та загальної виживаності хворих на мНКР.
Під час формування бази даних усі пацієнти проходять оцінку щодо віднесення їх до груп ризику згідно з Міжнародним консорціумом баз даних метастатичного раку нирки (International Metastatic Renal Cancer Database Consortium — IMDC) з метою більш точного порівняння. Ускладнення оцінюють за допомогою бальної системи Clavien — Dindo, визначення інтраопераційної крововтрати, тривалості післяопераційного перебування в лікарні та рівня 30-денних повторних госпіталізацій. Вираженість супутньої патології порівнюють на основі системи підрахунку балів Чарльсона. Функцію нирок оцінюють за даними динамічної нефросцинтиграфії чи формули Кокрофта — Голта.
Проміжний аналіз було проведено в березні 2021 р. У період з квітня 2008 до грудня 2020 р. в клініці було прооперовано 2615 хворих на рак нирки, серед них мНКР було діагностований у 413 (15,8%) пацієнтів. ЦН виконана у 298 осіб (72,1%), ЦР — у 115 (27,9%) хворих на мНКР.
Критеріями включення в проміжний аналіз дослідження були:
- вік хворих 18–75 років;
- клінічно та гістологічно підтверджений метастатичний світлоклітинний нирково-клітинний рак (будь-яке Т/будь-яке N/M1);
- відсутність тромбозу ниркової чи нижньої порожнистої вени;
- об’єм функціонуючої паренхіми нирки на боці ураження більше 50%.
Пацієнтів з двосторонніми пухлинами нирки, вираженою хронічною хворобою нирок (сумарна швидкість клубочкової фільтрації (сШКФ) <30 мл/хв), супутньою онкопатологією чи будь-якими іншими системними захворюваннями не було включено в цей аналіз.
Аналіз результатів проводили в пакеті Statistical software EZR v. 1.54 (graphical user interface for R statistical software version 4.0.3, R Foundation for Statistical Computing, Vienna, Austria) [14]. Закон розподілу кількісних показників відрізнявся від нормального, тому для їх представлення розраховано медіанне значення (Ме) та міжквартильний інтервал (QI–QIII). Показники для двох груп порівнювали за критерієм Манна — Уітні. Для порівняння якісних ознак використано точний критерій Фішера (у разі альтернативного закону розподілу) або критерій c2 (для трьох і більше градацій). Аналіз виживаності проводився за Каплан — Майєр (логранговий критерій порівняння). Модель пропорційних інтенсивностей Кокса було використано для виділення змінних, що впливають на виживаність. Для оцінки впливу факторної ознаки застосовували показник відношення ризиків (hazard ratio — HR), розраховано 95% довірчий інтервал (ДІ) показника. Урахування факторів ризику в рамках багатофакторної моделі Кокса дозволило стандартизувати групи за складністю випадку та визначити співвідношення ризиків обох хірургічних стратегій. Під час проведення аналізу критичний рівень значущості прийнято рівним 0,05.
Загалом до попереднього аналізу було включено 109 хворих. 33 (30,3%) пацієнтам високого ризику виконували нефректомію (11–12 балів згідно з R.E.N.A.L. score) з метою зменшення розміру пухлини та збільшення можливості виконання органозберігального лікування [15], після гістологічної верифікації діагнозу їм проводили 2 цикли неоад’ювантної системної терапії препаратами І лінії (сунітиніб 50 мг чи пазопаніб 800 мг). Повторно виконували СКТ чи МРТ, оцінювали ефективність терапії відповідно до RECIST 1.1 та проводили хірургічне втручання щонайменше через 10–14 днів після останнього прийому препарату. Використання такого підходу дозволило зменшити розмір пухлини в середньому на 24,6+7,3% та виконати резекцію нирки у 17 (51,5%) випадках. У 16 (48,5%) хворих все ж таки було проведено нефректомію.
Результати
До першої групи увійшло склали 55 (50,5%) пацієнтів, яким було виконано ЦР, до другої групи — 54 (49,5%) хворих, яким проводили ЦН. Демографічні та клінічні параметри обох досліджуваних груп подано в табл. 1.
Таблиця 1. Демографічні та клінічні параметри досліджуваних груп
| Показник | Група ЦН, n=54 | Група ЦР, n=55 | Рівень значущості відмінності, p | ||
|---|---|---|---|---|---|
| Вік | 56
(50–63) |
58
(50,25–65) |
0,179 | ||
| Співвідношення чоловіків/жінок | 38/16 | 40/15 | 0,834 | ||
| Індекс маси тіла (ІМТ) | 26,25
(24,1—31,3) |
26,8
(23,85–32,4) |
0,882 | ||
| ECOG | 0 | 20 (37) | 20 (36,4) | 0,997 | |
| 1 | 33 (61,1) | 34 (61,8) | |||
| 2 | 1 (1,9) | 1 (1,8) | |||
| Індекс Карновського | 90
(90–90) |
90
(90–97,5) |
0,696 | ||
| Бал за Чарльсоном | 10
(9–11) |
10
(9,25–11) |
0,433 | ||
| Креатинін | 0,0865
(0,068–0,101) |
0,082
(0,0725–0,0963) |
0,790 | ||
| сШКФ | 95
(77–115) |
91
(76–112,25) |
0,265 | ||
| Максимальний діаметр пухлини | 77
(67–105) |
54
(44–67,25) |
<0,001 | ||
| R.E.N.A.L. score | 10
(9–11) |
8
(7–10) |
<0,001 | ||
| RFPV | 60,5
(52–69) |
79
(67,5–85,75) |
<0,001 | ||
| Т-стадія | 1а | 0 (0,0) | 8 (14,5) | <0,001 | |
| 1в | 8 (14,8) | 29 (52,7) | |||
| 2а | 8 (14,8) | 3 (5,5) | |||
| 2в | 3 (5,6) | 2 (3,6) | |||
| 3а | 20 (37,0) | 8 (14,5) | |||
| 4 | 15 (27,8) | 5 (9,1) | |||
| Системи з M-ураженням | Одна | 36 (66,7) | 35 (63,6) | 0,93 | |
| Дві | 16 (29,6) | 13 (23,6) | |||
| Три і більше | 2 (3,7) | 7 (12,7) | |||
| Шкала Fuhrman | 2 | 20 (37) | 20 (36,4) | 1 | |
| 3 | 21 (38,9) | 21 (38,2) | |||
| 4 | 13 (24,1) | 14 (25,4) | |||
| Група ризику за IMDC | favourable | 19 (35,2) | 12 (21,8) | 0,030 | |
| intermediate | 34 (63,0) | 35 (63,6) | |||
| рoor | 1 (1,9) | 8 (14,5) | |||
Як видно з табл. 1, групи порівнянні за віком, статтю, індексом маси тіла (ІМТ), загальним станом, супутньою патологією, функцією нирок, кількістю уражених метастазами систем та шкалою Fuhrman. Групи відрізнялися за максимальним діаметром пухлини, R.E.N.A.L score, RFPV, T-стадією та групами ризику згідно з IMDC.
Максимальний період спостереження за хворими становив 116 міс. Протягом цього часу внаслідок прогресування захворювання померло 85 (78%) хворих, двоє (1,8%) — від супутньої патології (по одному з кожної групи). Враховуючи високий рівень специфічної смерті від раку, канцер-специфічна виживаність хворих на мНКР не оцінювалася, основний акцент зроблено на показник загальної виживаності.
Крива загальної виживаності в обох групах наведена на рис. 1. Не виявлено статистично значущої відмінності у виживаності в двох групах (p=0,093 за логранговим критерієм), але показник 7-річної кумулятивної виживаності у групі ЦН становив 7,3±3,9% проти 23,9±6,3% у групі ЦР.
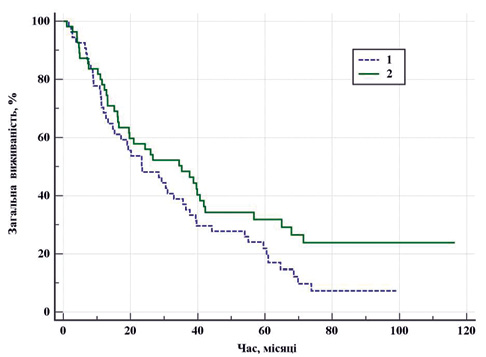
Беручи до уваги різницю між групами в прогнозі IMDC, Т-стадії та максимальному діаметрі пухлини, було вирішено перейти до Cox-пропорційної моделі ризиків для з’ясування основних факторів, що впливають на показник виживаності у вибраних групах пацієнтів. Аналіз включав 16 факторів: вік, стать, ІМТ, функціональний стан згідно зі шкалою Східної об’єднаної онкологічної групи (Eastern Cooperative Oncology Group — ECOG), бал за Чарльсоном, індекс Карновського, креатинін сироватки крові, cШКФ, Т-стадія, IMDC, максимальний діаметр пухлини, об’єм крововтрати, інтраопераційні та ранні післяопераційні ускладнення, а також вид хірургічного втручання. Розроблено модель, що включає 5 факторних ознак. Модель відповідала критеріям адекватності (c2 = 20,0 з 6 ступенями свободи, p=0,003). Отриманий Cindex = 0,70 (95% ДІ 0,61–0,79), свідчить про наявність зв’язку з вибраними функціями: вік, ІМТ, бал за Чарльсоном, IMDC та тип хірургічного втручання (табл. 2).
Таблиця 2. Cox-пропорційна модель ризиків основних факторів, що впливають на показник виживаності
| Факторна ознака | Коефіцієнт моделі, b±m | Рівень значущості відмінності від 0 | Показник HR (95% ДІ) | |
| Вік | –0,047±0,026 | 0,066 | 0,95 (0,91–1,00) | |
| ІМТ | –0,057±0,021 | 0,008 | 0,94 (0,90–0,99) | |
| Бал за Чарльсоном | 0,40±0,17 | 0,014 | 1,50 (1,08–2,07) | |
| IMDC | Favorable | Референтна | ||
| Intermediate | 0,34±0,25 | 0,170 | 1,40 (0,87–2,28) | |
| Poor | 0,74±0,45 | 0,104 | 2,09 (0,86–5,08) | |
| Тип операції | ЦР | Референтна | ||
| ЦН | –0,48±0,23 | 0,037 | 0,62 (0,39–0,97) | |
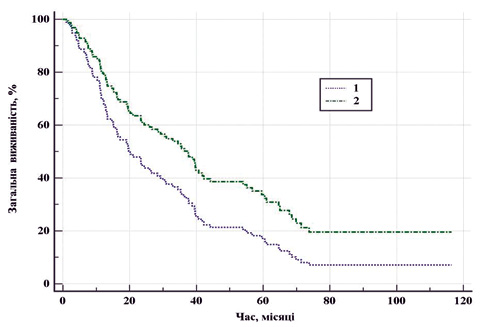
Під час проведення стандартизації за клінічною складністю випадку (див. табл. 2) виявлено, що ЦР нирки достовірно знижує ризик смерті порівняно з ЦН (р=0,037), HR=0,62 (95% ДІ 0,39–0,97). На рис. 2 наведено криву загальної виживаності у двох групах порівняння після проведення стандартизації за факторами ризику (вік, ІМТ, бал за Чарльсоном, IMDC).
Аналізуючи випадки виконання ЦР було встановлено, що у всіх 55 (100%) хворих об’єм функціонуючої паренхіми нирки на боці ураження становив 56% і більше, при цьому у 47 (85,4%) хворих пухлина локалізувалася в полюсі нирки чи латерально, у 8 (14,6%) — у воротах нирки. Слід відмітити, що максимальний діаметр пухлини, за якого було виконано ЦР, становив 208 мм, а RFPV при цьому — 61%.
Показники, що характеризують складність та безпеку хірургічного втручання, в основному були однаковими в обох групах: тривалість післяопераційного перебування у стаціонарі (у середньому 8 діб (7–11 діб) в групі ЦН проти 9 діб (7–11 діб) у групі ЦР; р=0,414); частота ускладнень під час операції (5,6% у групі ЦН проти 7,3% у групі ЦР; р>0,999); частота ранніх ускладнень (3,7% у групі ЦН проти 5,5% у групі ЦР; р>0,999), а також рівень крововтрати: середня крововтрата 374±356 мл у групі ЦН проти 468±372 мл у групі ЦР (р=0,09). Післяопераційна сечова нориця після ЦР виникла у 3 (5,4%) хворих, яку вдалося усунути стентуванням нирки. Летальних випадків не відмічали при жодному з хірургічних методів. Усі ці значення показують, що органозберігальна хірургія в цій ситуації мало чим відрізняється від нефректомії і залишається досить безпечною, щоб її можна було обговорити як варіант для пацієнта.
Обговорення
Роль циторедукції в лікуванні пацієнтів з метастатичним раком нирки залишається суперечливою. Удосконалення системної терапії зумовило проведення нового циклу досліджень, присвячених питанню послідовності виконання ЦН: до чи після системної терапії або взагалі доцільності її проведення у хворих на мНКР.
Ефективність ЦН було точно досліджено у 2004 р. R. Flanigan та співавторами [16], коли її комбінування з інтерфероном майже вдвічі підвищило показник виживаності в порівнянні з монотерапією інтерфероном та знизило ризик смерті на 31%. Подальші дослідження ЦН у поєднанні з таргетною терапією також підтвердили переваги комбінованого лікування для показника виживаності хворих на мНКР [17–19]. Ще однією перевагою циторедуктивної хірургії є максимальне зменшення первинної пухлини, яка стимулює імунну систему для контролю залишкового захворювання, з метою підвищення ефективності системної терапії [20].
Впровадження нових таргетних препаратів та check-point-інгібіторів поставили під сумнів необхідність такої складної операції [21–23]. Тим не менш дані кількох досліджень свідчать про те, що вона може бути корисною у пацієнтів із хорошим та проміжним прогнозом за групами ризику IMDC [17, 24]. Однак з впровадженням нових імунних агентів може виникнути інше питання в цій галузі: якщо ремісія може тривати роками, можливо, нам слід зберегти уражену нирку (у разі якщо пухлину можна видалити), щоб зменшити кількість побічних явищ та погіршення перебігу супутньої патології [25, 26]. Тому ми повинні враховувати, що у невеликої кількості пацієнтів циторедуктивна хірургія в поєднанні із системною терапією може забезпечити повну відповідь [27].
Основна мета резекції нирки — видалити первинну пухлину, зберегти нирку та нирковий кровообіг, досягти чистоти хірургічного краю. Дані, які ми маємо, свідчать про те, що органозберігальна операція при мНКР є безпечною, основним показанням до ЦР нирки є наявність об’єму функціонуючої паренхіми на боці ураження 56% і більше та локалізація пухлини в полюсі нирки чи латерально. Головним критерієм відбору пацієнтів є оцінка можливості проведення органозберігального лікування на основі нефрометричної системи оцінки пухлинного ураження нирки N.C.I.U. [13].
Одним з питань, відповідь на яке ми шукали в ході дослідження: чи можуть хворі на мНКР отримати переваги від резекції нирки, якщо вона є можливою? Основною метою було оцінити безпеку такої процедури у вибраних пацієнтів зі збереженою функцією нирок та вказати на потенційні позитивні моменти такої тактики порівняно з ЦН. Хоча ми розуміємо, що робота може містити упередження, але аналіз проводився з точки зору максимального виключення статистично неоднорідних випадків.
Загалом резекція нирки була безпечною з точки зору інтра- та післяопераційних ускладнень, тривалості післяопераційного перебування у стаціонарі та повторної госпіталізації порівняно із ЦН. Слід зазначити, що при нефректомії частіше виникали масивні кровотечі з травмою магістральних судин та суміжних органів, що могли призвести до серйозних ускладнень, але це в основному було зумовлено великим розміром пухлини. З іншого боку, при резекції нирки частіше виникали сечові нориці, які можна було успішно усунути консервативним шляхом. У пацієнтів, яким виконувалася резекція нирки, діаметр пухлини був менший, що зумовлює низький рівень специфічних ускладнень, на відміну від ЦН. Іншим важливим фактом є те, що рівень агресивності пухлини був співставним в обох групах (оцінка за шкалою Міжнародного товариства урологічної патології (International Society of Urological Pathology — ISUP). Це означає, що об’єм пухлини не може бути основним критерієм для оцінки прогнозу, а також за можливості змінює парадигму на потенційний органозберігальний підхід.
Оскільки у хворих, які брали участь у дослідженні, відмічали мНКР, ми не вказували окремо канцер-специфічної та загальної виживаності, розуміючи, що ці параметри, швидше за все, збігатимуться. Під час проведення стандартизації за клінічною складністю випадку в дослідженні було виявлено значну користь за показником виживаності від органозберігального підходу порівняно з нефректомією. Потенційним слабким місцем дослідження є різниця в чутливості до подальшої системної терапії, хоча слід враховувати, що групи складалися з пацієнтів із хорошим та проміжним прогнозом згідно з IMDC, що означає їх добру потенційну реакцію на системні агенти.
Важливим аспектом дослідження є очікувана функціональна перевага ЦР над ЦН. Пацієнти, які відповідали вимогам хірургічного втручання, мали хороші показники сШКФ в обох групах. Це означає, що майже всі пацієнти характеризувалися хорошими параметрами функції. З іншого боку, ми також розуміємо, що видалення одного з них, ймовірно, погіршить сумарну ШКФ, що призведе до вищого рівня несприятливих подій при системній терапії, що може суттєво обмежити чи відтермінувати її застосування та призвести до зниження рівня показника виживаності. Врешті-решт, слід пам’ятати, що стандартизація основних параметрів також виявила, що резекція нирки знижує ризик смерті порівняно з нефректомією. Це може обумовити необхідність проведення перспективного рандомізованого дослідження, щоб довести ефективність такого підходу.
Висновки
Застосування системної терапії в неоад’ювантному режимі у хворих на мНКР дозволить у першу чергу зменшити розмір пухлини в середньому на 24,6±7,3% та виконати органозберігальну операцію у більшого відсотка пацієнтів, по-друге, відібрати хворих, які отримають переваги від поєднання хірургічного лікування із системною терапією.
Показанням до ЦР нирки є наявність об’єму функціонуючої паренхіми на стороні ураження 56% і більше та локалізації пухлини в полюсі нирки чи латерально.
Онкологічні результати ЦР є кращими, ніж при нефректомії у вибраних пацієнтів та мають бути додатково досліджені в ширшому спектрі агентів для системної терапії при мНКР.
ЦР нирки є безпечним хірургічним методом лікування хворих на мНКР, яка дозволяє зменшити об’єм пухлинного процесу, зберегти максимальну кількість функціонуючої паренхіми нирок за мінімальної хірургічної травми, що забезпечить зниження рівня ниркової недостатності, та, як наслідок, зменшення кількості випадків виникнення потенційних несприятливих подій під час проведення системної терапії та розвитку хронічної ниркової недостатності.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Van Poppel, H., Da Pozzo, L., Albrecht, W., Matveev, V., Bono, A., Borkowski, A., … Sylvester, R. (2007). A Prospective randomized EORTC Intergroup Phase 3 study comparing the complications of elective nephron sparing surgery and radical nephrectomy for low-stage renal cell carcinoma. European Urology, 51, 1606–1615. doi: 10.1016/j.eururo.2006.11.013.
2. Huang, W. C., Levey, A. S., Serio, A. M., Snyder, M., Vickers, A. J., Raj, G. V., … Russo, P. (2006). Chronic kidney disease after nephrectomy in patients with renal cortical tumors: a retrospective cohort study. The Lancet Oncology, 7, 735–740. doi: 10.1016/S1470-2045(06)70803-8.
3. Barlow, L. J., Korets, R., Laudano, M., Benson, M., & McKiernan, J. (2010). Predicting renal functional outcomes after surgery for renal cortical tumors: a multifactorial analysis. BJU International, 106, 489–492. doi: 10.1111/j.1464-410X.2009.09147.x.
4. Kim, S. H., Lee, S. E., Hong, S. K., Jeong, C. W., Park, Y. H., Kim, Y. J., … Byun, S. S. (2013). Incidence and risk factors of chronic kidney disease in Korean patients with T1a renal cell carcinoma before and after radical or partial nephrectomy. Japanese Journal of Clinical Oncology, 43, 1243–1248. doi: 10.1093/jjco/hyt149.
5. Jeon, H. G., Jeong, I. G., Lee, J. W., Lee, S. E., & Lee, E. (2009). Prognostic factors for chronic kidney disease after curative surgery in patients with small renal tumors. Urology, 74, 1064–1068. doi: 10.1016/j.urology.2009.05.090.
6. Estrada, C. C., Maldonado, A., & Mallipattu, S. K. (2019). Therapeutic Inhibition of VEGF Signaling and Associated Nephrotoxicities. Journal of the American Society of Nephrology, 30, 187–200. doi: 10.1681/ASN.2018080853.
7. Jaimes, E. A. (2020). Renal Toxicity of Systemic Therapy for Renal Cell Carcinoma. Seminars in Nephrology, 40, 49−58. doi: 10.1016/j.semnephrol.2019.12.006.
8. Perazella, M. A., & Shirali, A. C. (2018). Nephrotoxicity of Cancer Immunotherapies: Past, Present and Future. Journal of the American Society of Nephrology, 29, 2039–2052. doi: 10.1681/ASN.2018050488.
9. Choueiri, T. K., Powles, T., Burotto, M., Escudier, B., Bourlon, M. T., Zurawski, B., … Motzer, R. J. (2021). Nivolumab plus Cabozantinib versus Sunitinib for Advanced Renal-Cell Carcinoma. The New England Journal of Medicine, 384(9), 829–841. doi: 10.1056/NEJMoa2026982.
10. Rini, B. I., Plimack, E. R., Stus, V., Gafanov, R., Hawkins, R., Nosov, D., … Powles, T. (2019). Pembrolizumab plus Axitinib versus Sunitinib for Advanced Renal-Cell Carcinoma. The New England Journal of Medicine, 380(12), 1116–1127. doi: 10.1056/NEJMoa1816714.
11. Williams, T., Rodriguez, R., Murray, K., Kovaleski, A., Madan, R., & Van Veldhuizen, P. (2015). Metastatic papillary renal cell carcinoma regression after cytoreductive nephrectomy. Urology, 85(2), 283–287. doi: 10.1016/j.urology.2014.10.005.
12. Bhindi, B., Abel, E. J., Albiges, L., Bensalah, K., Boorjian, S. A., Daneshmand, S., …Bex, A. (2019). Systematic Review of the Role of Cytoreductive Nephrectomy in the Targeted Therapy Era and Beyond: An Individualized Approach to Metastatic Renal Cell Carcinoma. European Urology, 75, 111–128. doi: 10.1016/j.eururo.2018.09.016.
13. Stakhovsky E., Vitruk I., Voylenko O., Kotov V., & Stakhovsky E. (2013). Functional renal parenchymas score as an indicator for partial nephrectomy in renal tumors. EAU 13th Central European Meeting (CEM), 4-6 October 2013, Prague, Czech Republic: European Urology, 11(4), 1125.
14. Kanda,Y. (2013). Investigation of the freely available easy-to-use software ‘EZR’ for medical statistics. Bone Marrow Transplant, 48: 452–458. doi: 10.1038/bmt.2012.244.
15. Voylenko, O., Stakhovsky, O., Vitruk, I., Kononenko, O. A., Pikul, M. V., Semko, S. L., & Stakhovsky, E. O. (2021). Efficacy of neoadjuvant targeted therapy in treatment of patients with localised clear-cell renal cell carcinoma. Advances in Urology, 2021, 6674637. doi: 10.1155/2021/6674637.
16. Flanigan, R. C., Mickisch, G., Sylvester, R., Tangen, C., Van Poppel, H., & Crawford, E. D. (2004). Cytoreductive nephrectomy in patients with metastatic renal cancer: a combined analysis. The Journal of Urology, 171(3), 1071–1076. doi: 10.1097/01.ju.0000110610.61545.ae.
17. Heng, D. Y., Wells, J. C., Rini, B. I., Wells, J. C., Rini, B. I., Beuselinck, B., … Choueiri, T. K. (2014). Cytoreductive nephrectomy in patients with synchronous metastases from renal cell carcinoma: results from the International Metastatic Renal Cell Carcinoma Database Consortium. European Urology, 66, 704–710. doi: 10.1016/j.eururo.2014.05.034.
18. Abern, M. R., Scosyrev, E., Tsivian, M., Messing, E. M., Polascik, T. J., & Dudek, A. Z. (2014). Survival of patients undergoing cytoreductive surgery for metastatic renal cell carcinoma in the targeted-therapy era. Anticancer Res. 2014, 34(5), 2405–2411.
19. de Groot, S., Redekop, W. K., Sleijfer, S. Oosterwijk, E., Bex, A., Kiemeney, L. A., & Uyl-de Groot, C. A. (2016). Survival in patients with primary metastatic renal cell carcinoma treated with sunitinib with or without previous cytoreductive nephrectomy: results from a population-based registry. Urology, 95, 121–127. doi: 10.1016/j.urology.2016.04.042.
20. Barbastefano, J., Garcia, J., Elson, P., Wood, L. S., Lane, B. R., Dreicer, R., Campbell, S. C., & Rini, B. I. (2010). Association of percentage of tumour burden removed with debulking nephrectomy and progression-free survival in patients with metastatic renal cell carcinoma treated with vascular endothelial growth factor-targeted therapy. BJU International, 106(9), 1266–1269. doi: 10.1111/j.1464-410X.2010.09323.x.
21. Mejean, A., Ravaud, A., Thezenas, S., Colas, S., Beauval, J. B., Bensalah, K., … Escudier, B. (2018). Sunitinib Alone or after Nephrectomy in Metastatic Renal-Cell Carcinoma. The New England Journal of Medicine, 379(5), 417–427. doi: 10.1056/NEJMoa1803675.
22. Bex, A., Mulders, P., Jewett, M., Wagstaff, J., van Thienen, J. V., Blank, C. U., …Haanen J. (2019). Comparison of Immediate vs Deferred Cytoreductive Nephrectomy in Patients With Synchronous Metastatic Renal Cell Carcinoma Receiving Sunitinib: The SURTIME Randomized Clinical Trial. JAMA Oncology, 5(2),164–170. doi: 10.1001/jamaoncol.2018.5543.
23. de Bruijn, R., Wimalasingham, A., Szabados, B., Stewart, G. D., Welsh, S. J., Kuusk, T., … Bex, A. (2020). Deferred Cytoreductive Nephrectomy Following Presurgical Vascular Endothelial Growth Factor Receptor-targeted Therapy in Patients with Primary Metastatic Clear Cell Renal Cell Carcinoma: A Pooled Analysis of Prospective Trial Data. European Urology Oncology, 3(2), 168–173. doi: 10.1016/j.euo.2019.12.004.
24. Ljungberg, B., Sundqvist, P., Lindblad, P., Kjellman, A., Thorstenson, A., Hellström, M., Kröger Dahlin, B. I., … Lundstam, S. (2020). Survival advantage of upfront cytoreductive nephrectomy in patients with primary metastatic renal cell carcinoma compared with systemic and palliative treatments in a real-world setting. Scandinavian Journal of Urology, 54(6), 487–492. doi: 10.1080/21681805.2020.1815833.
25. Wanchoo R., Karam, S., Uppal, N. N., Barta, V. S., Deray, G., Devoe, C., … Jhaveri, K. D. (2017). Adverse Renal Effects of Immune Checkpoint Inhibitors: A Narrative Review. Journal of the American Society of Nephrology, 45(2), 160–169. doi: 10.1159/000455014.
26. Kartolo, A., Sattar, J., Sahai, V., Baetz, T., & Lakoff, J. M. (2018). Predictors of immunotherapy-induced immune-related adverse events. Current Oncology, 25(5), e403–e410. doi: 10.3747/co.25.4047.
27. Buchler, T., Bortlicek, Z., Poprach, A., Pavlik, T., Veskrnova, V., Honzirkova, M., … Melichar, B. (2016). Czech Renal Cancer Cooperative Group Outcomes for Patients with Metastatic Renal Cell Carcinoma Achieving a Complete Response on Targeted Therapy: A Registry-based Analysis. European Urology, 70(3), 469–475. doi: 10.1016/j.eururo.2015.12.031.
Адреса для листування:
Вітрук Юрій Васильович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: uvitruk@ukr.net
Сorrespondence:
Vitruk Yuriy
33/43 Lomonosova Str., Kyiv, 03022
National Cancer Institute
E-mail: uvitruk@ukr.net














Leave a comment