Вплив ампліфікації ERBB2 на відсоток рецидивування набрякової форми раку грудної залози після комбінованого лікування
Смоланка І.І.1, Мовчан О.В.1, Ляшенко А.О.1, Іванкова О.М.1, Багмут І.Ю.2
- 1Національний інститут раку, Київ, Україна
- 2Харківська медична академія післядипломної освіти, Харків, Україна
Резюме. Молекулярні механізми, пов’язані із запаленням, вважаються важливими компонентами розвитку раку молочної залози, який є провідною причиною смерті серед жінок. Рецидив залишається однією з найсерйозніших проблем для пацієнтів з набряковими формами раку грудної залози після комбінованого лікування. Стійкість до протипухлинних препаратів розвивається на рівні тканини у зв’язку з особливостями запального мікрооточення при раковій інфільтрації. Було оброблено матеріали історій хвороби 60 пацієнтів за період 2018–2020 рр. До 1-ї групи (30 осіб) було включено пацієнток з набряковим раком грудної залози з підтвердженою мутацією гена Her-2/neu (ампліфікація ERBB2 (3+)), після проведеного комбінованого лікування (операція з неоад’ювантним курсом хіміотерапії). 2-гу групу становили пацієнтки з набряковим раком грудної залози (30 осіб), після проведеного комбінованого лікування (операція з неоад’ювантним курсом хіміотерапії) у яких ампліфікацію ERBB2 (3+) не спостерігали. Ампліфікація ERBB2 у пацієнтів з набряковою формою раку грудної залози пов’язана з поганим прогнозом щодо розвитку рецидивування захворювання. Інвазивна активність пухлинних клітин з ампліфікацією ERBB2 для набрякової форми раку грудної залози є вищою, ніж за відсутності ампліфікації ERBB2, що доведено показниками середнього балу експресії CD68, стабілін-1, YKL-39, SI-CLP у культурі тканин пухлини. Виявлено більш високу щільність CD3+ (у 10 разів), CD19+ (у 4 рази) лімфоцитів та нижчу щільність CD3+, CD8+ (у 1,5 раза) і CD16/56+ (у 2 рази) лімфоцитів з ампліфікацією ERBB2 у порівнянні з показниками у пацієнтів без ампліфікації ERBB2 (р <0,05). Рецидив пухлини відмічали протягом перших двох років після лікування у 60±8,9% пацієнток 1-ї групи та у 6,7±8,1% 2-ї групи.
Одержано 1.08.2022
Прийнято до друку 19.08.2022
DOI: 10.32471/clinicaloncology.2663-466X.45-1.28963
Вступ
Рецидив залишається одним з найсерйозніших проблемних питань для пацієнтів з набряковими формами раку грудної залози (НРГЗ) після комбінованого лікування [1] і спричиняє значне погіршення якості життя [2]. Стійкість до протипухлинних препаратів розвивається на рівні тканини у зв’язку з особливостями запального мікрооточення при раковій інфільтрації [5, 7]. Кілька механізмів резистентності, пов’язані з мікрооточенням, добре розпізнаються [6, 8], а саме: спадковий тип ракових клітин, які активізуються в результаті порушення метаболічних процесів, що ініціюють атаку проканцерогенів та спричиняють розвиток пухлини [9, 10]. Післяопераційні ускладнення та рецидивування раку вважаються основними проблемами, що виникають після оперативних втручань. Взаємозв’язок між післяопераційними ускладненнями і ослабленням захисних сил організму на тлі використання агресивних методик лікування при НРГЗ серед пацієнтів, які перенесли операцію з приводу раку, вже доведена догма [25, 26, 28–30].
Широко відомо, що операція є методом вибору в лікуванні пацієнтів з онкологічними захворюваннями, але без застосування сучасних схем хіміотерапії комплексне лікування є просто неможливим. Тому ми розглядаємо зміни в мікрооточенні пухлини саме після комбінованої терапії (хіміотерапія та оперативне лікування). Введення протипухлинних препаратів, природно, має прямий вплив на розвиток запальних змін при раковому процесі [13, 29].
Незважаючи на потенційно радикальне хірургічне лікування з призначенням сучасних схем хіміотерапії або променевої терапії, у 40% хворих спостерігають повернення захворювання [14]. Результати багатьох рандомізованих досліджень різних варіантів спеціальної терапії показали, що у хворих, які отримували комбіноване лікування (операція + променева терапія + хіміотерапія), частота місцевих рецидивів коливалася в межах 0,3–18%, у той час як після тільки хірургічного лікування показники місцевого рецидивування становили 15–34% [19]. За даними різних авторів, місцеві рецидиви протягом одного року після початку спеціального лікування реєструють у 0,5–30,9% хворих [1, 2, 4, 7].
Відсоток ампліфікації Human epidermal growth factor, receptor 2 (HER2) в ранжирних рамках у всьому світі становить 20–25% [27]. Тепер потрібна єдина платформа для розробки та проведення великих клінічних випробувань з кількома групами, які підтверджують концепцію та дають швидкі, цілеспрямовані та економічно ефективні оцінки потенційно нових терапевтичних методів лікування. НРГЗ є дуже складною формою раку грудної залози. Він становить лише 5% від усіх пухлин грудної залози, але характеризується найвищим рівнем рецидиву та пов’язаної з пухлиною смертності порівняно з іншими підтипами [24]. Узагальнюючи останні погляди на ключові біологічні особливості НРГЗ, слід відзначити особливу роль пухлинного мікрооточення як важливого чинника агресивного характеру раку грудної залози. На основі сучасного розуміння НРГЗ ми сподіваємося, що наступні покоління трансляційних досліджень сприятимуть підвищенню виживаності пацієнтів із цією смертельною хворобою, що є вкрай необхідним [10].
Незважаючи на значні попередні зусилля щодо скринінгу транскрипційних відмінностей між пацієнтами з НРГЗ та раком грудної залози без ознак набряку, надійна специфічна для НРГЗ молекулярна сигнатура наразі невідома. Вважається, що при НРГЗ більшість генів збагачені білками клітинного компонента плазматичної мембрани та інтерлейкінами [12, 30].
Складний зв’язок між раковими клітинами, елементами імунної системи й запальними клітинами регулює прогресування пухлини і можливе рецидивування хвороби [17, 18].
Без сумніву, оцінка клітинного і гуморального імунітету як прогностичного фактора для розпізнання шляхів канцерогенезу (особливо інфільтративних форм злоякісних новоутворень), є найважливішою ланкою в профілактиці, діагностиці та лікуванні при ракових пухлинах [14, 15].
Цікавими є дані про розвиток рецидивів онкозахворювань основних локалізацій за наявності гіперкріоглобулінемії на момент початку спеціального лікування [6, 20].
Кожен з різних фенотипічних підтипів асоційованих пухлинних макрофагів формується під впливом безлічі специфічних цитокінових дій у пухлинному мікрооточенні. Вони ілюструють протипухлинну дію макрофагів для раку, де наявність пухлино-асоційованих макрофагів співвідноситься з більш тривалою виживаністю пацієнтів [19, 26, 29].
Наявність хітиназоподібних білків у циркулюючій крові пов’язана з підвищеною агресивністю перебігу захворювання при різноманітних інфільтративно-запальних пухлинах і високим ризиком рецидивування хвороби. Тут макрофаги є джерелом хітиназоподібних білків, а також цілями для їх регуляторних ефектів [1, 3, 10, 16].
Беручи до уваги системний підхід до контролю мінімальних залишкових явищ ракового захворювання, можна виявити нові можливості для зниження ризику рецидиву після комбінованого лікування пацієнтів з раком різної локалізації на ранньому етапі [21–23].
Незважаючи на проведену радикальну операцію, ракова пухлина часто розвивається знову в місці оперативного втручання з усіма властивими їй клінічними проявами. Це вказує на те, що ракові клітини мають високий потенціал агресивності від свого первинного «органу-вогнища». Потенціал для рецидивування ракові клітини зберігають залежно від пухлинного мікрооточення. Імовірність повернення хвороби при онкологічній патології може знижуватися у разі зменшення впливу окремих елементів пухлинного мікрооточення. Незважаючи на наявність різних робіт, що вказують на тісний взаємозв’язок між раком різних локалізацій і його мікрооточенням, неприємно визнавати, що в клінічній практиці відсоток виникнення рецидивів раку різної локалізації залишається досить високим, через пускові механізми, статус яких необхідно узагальнити згідно зі взаємозв’язками з рецидивом раку.
Запалення є основним компонентом у пухлинному мікрооточенні, і зміна статусу прозапальних компонентів може блокувати антипухлинний імунітет. Показники периферичної крові на момент встановлення первинного діагнозу раку, а також у ранній післяопераційний період можуть відображати стан місцевої і загальної запальної відповіді організму. Оцінка таких параметрів периферичної крові, як рівень кріоглобулінів, кількість лімфоцитів і моноцитів, запропонована у якості прогностичних маркерів при багатьох злоякісних пухлинах [2, 6, 18, 20].
Молекулярні механізми, пов’язані із запаленням, вважаються важливими компонентами розвитку раку грудної залози, який є провідною причиною смерті серед жінок. Прозапальні цитокіни змінюють біологію пухлинних клітин і спричиняють прогресування раку і метастазування, активуючи стромальні клітини в мікрооточенні пухлини, у тому числі пов’язані з пухлиною хітиназоподібні білки, інтерлейкін-1, інтерлейкін-6, гіперкріоглобулінемія, а особливо за наявності таких агресивних чинників, як мутація гена Her-2/neu при раку грудної залози [16].
Однак біологічні процеси, які викликають рецидивування або підтримують залишкову хворобу під час лікування, можуть повністю відрізнятися від тих, які спричиняють первинне утворення пухлини [11, 15]. Повідомляється, що поліморфізм гена цитокіну здатний впливати на розвиток рецидиву раку грудної залози, що також передбачає, що навіть часткове зниження запальної сигналізації може відігравати захисну роль [17, 21].
Останні дослідження остаточно встановили найважливішу роль пухлинного мікрооточення при рецидивуванні — продемонстровано, що пухлинне мікрооточення містить велику кількість прозапальних цитокінів, хемокінів та факторів росту [29, 30].
Природно, що ретельне вивчення зв’язку запальних маркерів у периферичній крові та безпосередньо в пухлинному вогнищі має критично важливе значення для надання актуальної інформації клініцистам [25].
Матеріали та методи
Дослідження було проведено відповідно до Гельсінської декларації Всесвітньої медичної асоціації (World Medical Association – WMA), Статуту Української асоціації з біоетики, Порядку проведення клінічних випробувань лікарських засобів та експертизи матеріалів клінічних випробувань і Типового положення про комісію з питань етики, затверджених Наказом Міністерства охорони здоров’я України від 13 лютого 2006 р. № 66. Це дослідження було затверджено комісією з питань етики при Національному інституті раку України (протокол від 23 червня 2020 р. № 163).
Було оброблено матеріал історій хвороб 60 пацієнтів за період 2018–2020 рр., вік — 38–68 (середній — 48) років, функціонального стану за шкалою Східної об’єднаної онкологічної групи (Eastern Cooperative Oncology Group — ECOG) ECOG 0–2, усі жіночої статі. У всіх пацієнтів було гістологічно визначено аденокарциному GII–GIII.
1-шу групу становили 30 пацієнток з НРГЗ з підтвердженою мутацією гена Her-2/neu (ампліфікація ERBB2 (3+)) після проведеного комбінованого лікування (операція з неоад’ювантним курсом хіміотерапії).
До 2-ї групи увійшли 30 хворих на НРГЗ після проведеного комбінованого лікування (операція з неоад’ювантним курсом хіміотерапії), у яких ампліфікацію ERBB2 (3+) не спостерігали.
Терміни спостереження за хворими знаходилися в діапазоні 4 дні — 36 міс. Медіана становила 20,0 міс.
Визначення ампліфікації ERBB2 проводилося з використанням флуоресцентної гібридизації (fluorescence in situ hybridization — FISH) і імуногістохімії (immunohistochemistry — IHC). Подальша характеристика ампліфікації ДНК виконувалася з використанням цифрової крапельної полімеразної ланцюгової реакції (droplet digital polymerase chain reaction — DDPCR) і низьким покриттям цілого геному (low-coverage whole genome sequencing — LCWGS).
У всіх пацієнтів вивчено: рівень хітиназоподобних білків, кріоглобулінів, інтерлейкінів, пухлино-асоційованих макрофагів у доопераційний (при вперше виявленому захворюванні, до початку неоад’ювантного курсу хіміотерапії) і післяопераційний періоди.
Визначення рівня кріоглобулінів у сироватці крові, тобто імуноглобулінів, які зворотно преципітували за температури до 37 °C. Виділення кріоглобулінів із сироватки крові проводилося за методикою A.E. Kalovidoris. Концентрація кріоглобулінів оцінювалася спектрофотометрично на апараті SF-46 в динаміці на 3-; 5-; 7-й дні.
Результати
За рівнем пухлинної інвазії в обох групах переважали пацієнти з інвазією пухлини Т3 — 12 осіб 1-ї групи (40,0±8,9%) та 13 осіб з 2-ї (43,3±9,0%). За даними морфологічного дослідження, у 1-й групі метастази в лімфатичні вузли було діагностовано у 20 хворих (66,7±8,6%), метастази в регіонарні лімфатичні вузли відсутні у 10 пацієнтів (33,3±8,6%). У 2-й групі метастази в лімфатичні вузли було виявлено у 21 хворої (70,0±8,4%), метастази в регіонарні лімфатичні вузли відсутні у 9 пацієнток (30,0±8,4%).
У пацієнтів з НРГЗ є тенденція до підвищення експресії YKL-39 з наявністю ампліфікації ERBB2 при запальній інфільтрації пухлини, розташованої в стромі. Високу експресію стабіліну-1 (2,1±0,70, n=30) було виявлено в порівнянні з пухлинами пацієнтів, у яких не було відмічено ампліфікації ERBB2 (1,46±0,67, n=30, p=0,015) (табл. 1).
| Досліджуваний показник | Середній бал експресії М±SD в групі | |
| з наявністю ампліфікації ERBB2 | без наявності ампліфікації ERBB2 | |
| CD68 | 2,96±0,81 (n=33) | 2,26±0,82 (n=38) |
| YKL-39 | 2,35±0,99 (n=17) | 2,24±0,72 (n=37) |
| SI-CLP | 2,63±1,24 (n=30) | 2,23±0,77 (n=35) |
| Стабілін-1 | 2,94±1,01 (n=32) | 2,0±0,79 (n=36) |
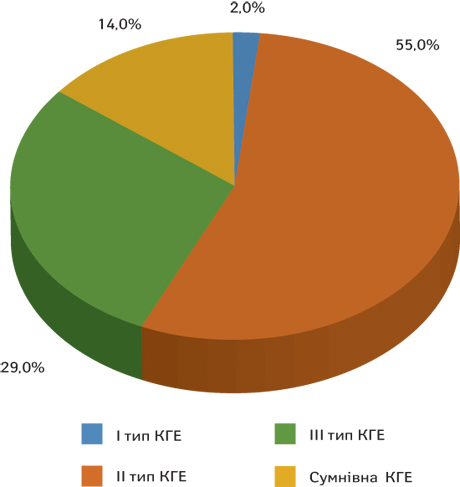
У більшості пацієнтів з ампліфікацією ERBB2 вміст кріоглобулінів відмічали на рівні 298,6±2,5 мг/л (1,3±0,08%) — у 33 (55%), що відповідає кріоглобулінемії II типу; 79,4±1,01 мг/л — у 10 (16%) — умовна кріоглобулінемія. Високий вміст 477,3±48 мг/л (3,4±0,2%) було зареєстровано у 17 (29%), що вказує на кріоглобулінемію III типу (коефіцієнт відхилення (hazard ratio — HR) = 0,71, 95% довірчий інтервал (confidence interval — CI): 0,22–0,83, p=0,005) (рисунок, табл. 2).
| Показник | Група хворих | |
| 1-ша (з наявністю ампліфікації ERBB2), n=30 | 2-га (без наявності ампліфікації ERBB2), n=30 | |
| Випадки рецидиву хвороби, % | 46,7±9,1 | 23,3±7,7 |
Обговорення
Аналіз розвитку запальної відповіді на фоні ампліфікації ERBB2 показав нижчу безрецидивну виживаність, що співпадає з даними J. Wang та співавторів [27]. Враховуючи, що запальна відповідь на фоні ампліфікації ERBB2 має прогностичну цінність при НРГЗ та може бути маркером обрання стратегії лікування E. Vagia та співавторів [24], M.C. Van Maaren та співавторів [25] показав, що серед випадків НРГЗ в осіб з високим рівнем запальної відповіді на фоні ампліфікації ERBB2 відмічали більш низьку загальну та безрецидивну виживаність. Це підтверджується результатами нашого дослідження: у пацієнтів з НРГЗ у разі розвитку запальної відповіді на фоні ампліфікації ERBB2 прогноз захворювання був гіршим, ніж у пацієнтів без ампліфікації ERBB2, що передбачає використання цих параметрів як потенційних маркерів для прогнозування виживаності.
Висновки
1. Ампліфікація ERBB2 упацієнтів з НРГЗ пов’язана з поганим прогнозом щодо розвитку рецидивування захворювання.
2. Інвазивна активність пухлинних клітин з ампліфікацією ERBB2 для НРГЗ є вищою, ніж за відсутності ампліфікації ERBB2, що доведено показниками середнього балу експресії CD68, стабілін-1, YKL-39, SI-CLP у культурі тканин пухлини.
3. Виявлено більш високу щільність лімфоцитів CD3+ (у 10 разів), CD19+ (у 4 рази) та нижчу щільність CD3+; CD8+ (1,5 раза) і CD16/56 + (у 2 рази) лімфоцитів у пацієнтів з ампліфікацією ERBB2 порівняно з показниками осіб без ампліфікації ERBB2 та рецидивування захворювання (p <0,05).
ПЕРЕЛІК ВИКОРИСТАНої літератури
1. Candido, J., & Hagemann, T. (2013). Cancer-related inflammation. J Clinical Immunology, 33(1), S79–84. doi: 10.1007/s10875-012-9847-0.
2. Cole, S. W. (2009). Chronic inflammation and breast cancer relapse. Journal of Clinical Oncology, 27(21), 3418–3419. doi: 10.1200/JCO.2009.21.9782.
3. Comito, G., Giannoni, E., Segura, C. P., Barcellos-de-Souza, P., Raspollini, M. R., Baroni, G., … Chiarugi, P. (2014). Cancer-associated fibroblasts and M2-polarized macrophages synergize during prostate carcinoma progression. Oncogene, 33(19), 2423–2431. doi: 10.1038/onc.2013.191.
4. Cupp, M. A., Cariolou, M., Tzoulaki, I., Aune, D., Evangelou, E., & Berlanga-Taylor, A. J. (2020). Neutrophil to lymphocyte ratio and cancer prognosis: An umbrella review of systematic reviews and meta-analyses of observational studies. BMC Medicine, 18(1), 360. doi: 10.1186/s12916-020-01817-1.
5. Esmatabadi, M. J., Bakhshinejad, B., Motlagh, F. M., Babashah, S., & Sadeghizadeh, M. (2016). Therapeutic resistance and cancer relapse mechanisms: Unfolding the story of tumour coming back. Journal of Bioscience, 41(3), 497–506. doi: 10.1007/s12038-016-9624-y.
6. Han, W. (2019). The role of the tumor microenvironment in waldenström macroglobulinemia. (Dis. Doctor of Philosophy in Biochemistry). University of New Hampshire, Durham.
7. Housman, G., Byler, S., Heerboth, S., Lapinska, K., Longacre, M., Snyder, N., & Sarkar, S. (2014). Drug resistance in cancer: An overview. Cancers, 6(3), 1769–1792. doi: 10.3390/cancers6031769.
8. Karsch-Bluman, A., Feiglin, A., Arbib, E., Stern, T., Shoval, H., Schwob, O., Berger, M., & Benny, O. (2019). Tissue necrosis and its role in cancer progression. Oncogene, 38(11), 1920–1935. doi: 10.1038/s41388-018-0555-y.
9. Land, W. G. (2015). The Role of Damage-Associated Molecular Patterns (DAMPs) in Human Diseases: Part II: DAMPs as diagnostics, prognostics and therapeutics in clinical medicine. Sultan Qaboos University Medical Journal, 15(2), e157–e170.
10. Lim, B., Woodward, W. A., Wang, X., Reuben, J. M., & Ueno, N. T. (2018). Inflammatory breast cancer biology: the tumour microenvironment is key. Nature Reviews Cancer, 18(8), 485–499. doi: 10.1038/s41568-018-0010-y.
11. Mantovani, A., Marchesi, F., Porta, C., Sica, A., & Allavena, P. (2007). Inflammation and cancer: Breast cancer as a prototype. Breast, 16, S27–S33. doi: 10.1016/j.breast.2007.07.013.
12. Maoz, M., Devir, M., Inbar, M., Inbar-Daniel, Z., Sherill-Rofe, D., Bloch, I., … Zick, A. (2019). Clinical Implications of Sub-grouping HER2 Positive Tumors by Amplicon Structure and Co-amplified Genes. Scientific Reports, 9(1), 18795. doi: 10.1038/s41598-019-55455-6.
13. McKinley, E. T., Sui, Y., Al-Kofahi, Y., Millis, B. A., Tyska, M. J., Roland, J. T., … Coffey, R. J. (2017). Optimized multiplex immunofluorescence single-cell analysis reveals tuft cell heterogeneity. JCI Insight, 2(11), 93487. doi: 10.1172/jci.insight.93487.
14. Méndez-García, L., Nava-Castro, K., Ochoa-Mercado, T., Palacios-Arreola, M., Ruiz-Manzano, R., Segovia-Mendoza, M., … Morales-Montor, J. (2019). Are Cytokines Important Players During Its Development and Progression?-Montor. Journal of Interferon & Cytokine Research, 39(1), 39–55. doi.org/10.1089/jir.2018.0024.
15. Oshi, M., Newman, S., Tokumaru, Y., Yan, L., Matsuyama, R., Endo, I., Nagahashi, M., & Takabe, K. (2020). Intra-Tumoral Angiogenesis Is Associated with Inflammation, Immune Reaction and Metastatic Relapse in Breast Cancer. International Journal of Molecular Sciences, 21(18), 6708. doi: 10.3390/ijms21186708.
16. Pellegrino, B., Hlavata, Z., Migali, C., De Silva, P., Aiello, M., Willard-Gallo, K., … Solinas, C. (2021). Luminal Breast Cancer: Risk of Recurrence and Tumor-Associated Immune Suppression. Molecular Diagnosis & Therapy, 25(4), 409–424. doi: 10.1007/s40291-021-00525-7.
17. Pradella, D., Naro, C., Sette, C., & Ghigna, C. (2017). EMT, and stemness: flexible processes tuned by alternative splicing in development and cancer progression. Molecular Cancer, 16(1), 8. doi: 10.1186/s12943-016-0579-2.
18. Qu, X., Tang, Y., & Hua, S. (2018). Immunological Approaches Towards Cancer and Inflammation: A Cross Talk. Frontiers in Immunology, 9, 563. doi: 10.3389/fimmu.2018.00563.
19. Reuben, J. L. (2012). Immunology of Inflammatory Breast Cancer. Research Gate. Inflammatory Breast Cancer. (p. 207–224). doi: 10.1007/978-94-007-3907-9_17. https://link.springer.com/chapter/10.1007/978-94-007-3907-9_17.
20. Roccatello, D., Saadoun, D., Ramos-Casals, M., Tzioufas, A. G., Fervenza, F. C., Cacoub, P., … Ferri, C. (2018). Cryoglobulinaemia. Nature Reviews Disease Primers, 4(1), 11. doi: 10.1038/s41572-018-0009-4.
21. Simard, S., Thewes, B., Humphris, G., Dixon, M., Hayden, C., Mireskandari, S., & Ozakinci, G. (2013). Fear of cancer relapse in adult cancer survivors: A systematic review of quantitative studies. Journal of Cancer Survivorship, 7(3), 300–22. doi: 10.1007/s11764-013-0272-z.
22. Sulciner, M. L., Serhan, C. N., Gilligan, M. M., Mudge, D. K., Chang, J., Gartung, A., … Panigrahy, D. J. (2018). Resolvins suppress tumor growth and enhance cancer therapy. Journal of Experimental Medicine, 215(1), 115–140. doi: 10.1084/jem.20170681.
23. Sun, Y. (2016). Tumor microenvironment and cancer therapy resistance. Cancer Letters, 380(1), 205–215. doi: 10.1016/j.canlet.2015.07.044.
24. Vagia, E., & Cristofanilli, M. (2021). New Treatment Strategies for the Inflammatory Breast Cancer. Current Treatment Options in Oncology, 22(6), 50. doi: 10.1007/s11864-021-00843-2. PMID: 33893888.
25. Van Maaren, M. C., Strobbe, L. J. A., Smidt, M. L., Moossdorff, M., Poortmans, P. M. P., & Siesling, S. (2018). Ten-year conditional recurrence risks and overall and relative survival for breast cancer patients in the Netherlands: taking account of event-free years. European Journal of Cancer, 102, 82–94. doi: europepmc.org/article/med/30144661.
26. Vrána, D., Matzenauer, M., Neoral, Č., Aujeský, R., Vrba, R., Melichar, B., … Jankowski, J. (2019). From Tumor Immunology to Immunotherapy in Gastric and esophagus Cancer. International Journal of Molecular Sciences, 20(1), 13. doi: 10.3390/ijms20010013.
27. Wang, J., & Xu, B. (2019). Targeted therapeutic options and future perspectives for HER2-positive breast cancer. Signal Transduction and Targeted Therapy, 4, 34. doi: 10.1038/s41392-019-0069-2.
28. Yagi, T., Baba, Y., Okadome, K., Kiyozumi, Y., Hiyoshi, Y., Ishimoto, T., … Baba, H. (2019).Tumour-associated macrophages are associated with poor prognosis and programmed death ligand 1 expression in oesophageal cancer. European Journal of Cancer, 111, 38–49. doi: 10.1016/j.ejca.2019.01.018.
29. Abbas, Z., & Rehman, S. (2018). An Overview of Cancer Treatment Modalities. Retrived from: https://www.intechopen.com/books/ neoplasm/an-overview-of-cancer-treatment-modalities.
30. Zare, A., Postovit, L. M., & Githaka, J. M. (2021). Robust inflammatory breast cancer gene signature using nonparametric random forest analysis. Breast Cancer Research, 23(1), 92. doi: 10.1186/s13058-021-01467-y.
Адреса для листування:
Мовчан Олексій
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
Е-mail: aleexeymed@gmail.com
Сorrespondence:
Movchan Oleksii
33/43 Lomonosova Str., Kyiv, 03022
National Cancer Institute
Е-mail: aleexeymed@gmail.com














Leave a comment