Метастази раку в лімфатичні вузли шиї без встановленого первинного вогнища
Галай О.О.1, Білинський Б.Т.2, Бондаренко С.Г.1, Дуда О.Р. 1, Друзюк О.В.1, Карп С.Ю.1, Лудчак В.Ю.1, Сендега І.М.1, Сліпецький Р.Р.2, Шмідт М.Р.1, Цьолко Т.Р.1
- 1Львівський онкологічний регіональний лікувально-діагностичний центр
- 2Львівський національний медичний університет імені Данила Галицького
Резюме. Мета. Вивчити результати лікування хворих з метастазами в лімфатичні вузли шиї без первинного вогнища. Об’єкт і методи. Проведено ретроспективний аналіз даних про 86 пацієнтів, що знаходилися на лікуванні у Львівському онкологічному центрі. Виділено 8 груп залежно від методу лікування. У 13 (15,1%) хворих проведено хірургічне лікування, 12 (14,0%) пацієнтів — операція + ад’ювантна променева терапія, 15 (17,4%) — хіміопроменеве лікування після операції, а в 6 (7,0%) випадках — післяопераційну хіміотерапію. У 8 (9,3%) хворих проведено курс променевої терапії, в 4 (4,7%) випадках — лише хіміотерапію, а 25 (29,0%) пацієнтів відмовилися від лікування. Гістологічний розподіл, відповідно, був таким: плоскоклітинний рак — 67,4% (n=58), аденокарцинома — 17,4% (n=15), меланома — 7,0% (n=6), недиференційований рак і нейроендокринна пухлина — по 3 (3,5%) випадки. Результати. Середня тривалість життя у хворих з метастазами в лімфатичні вузли шиї без первинного вогнища становила 21,34±3,33, а медіана — 7,0 міс. Найефективнішим було комбіноване лікування: операція з наступним курсом хіміопроменевої терапії — медіана виживаності становила 27 міс, а середня тривалість життя — 40,0±10,0 міс. Найнижчі показники виживаності отримано при монолікуванні: медіана виживаності після променевої терапії становила 8,0 міс, після хіміотерапії — 7,0 міс. Закономірно, що середня тривалість життя у хворих, які відмовилися від лікування, становила лише 4,33±0,9 міс, а медіана — лише 3,0 міс. Методом Пірсона отримано статистично достовірну різницю між групами, р=0,0003. Також низькі показники виживаності констатовано у пацієнтів з метастазами меланоми, де середня тривалість життя становила лише 3,3±0,7 міс. Якщо після проведення базових діагностичних обстежень первинне вогнище не верифіковано, недоцільно витрачати час на його пошуки. Згідно з отриманими даними, загальна виживаність мало залежить від ідентифікації джерела метастазування, тому слід розпочинати лікування, схеми та методи якого вже давно визначені. Само собою, це не означає відмови від детального контролю стану хворих з метою виявлення первинного вогнища в динаміці.
Одержано 4.05.2023
Прийнято до друку 16.05.2023
DOI: 10.32471/clinicaloncology.2663-466X.50-2.30486
ВСТУП
Коли пацієнти звертаються з метастатичною пухлиною на шиї і неможливо ідентифікувати первинне вогнище після відповідних обстежень, пухлина визначається як окультна, або пухлина без первинного вогнища. Це нечасте захворювання, яке діагностується у близько 5% хворих, що звертаються у спеціалізовані медичні центри [1, 2]. Пацієнти й онкологи часто стурбовані, коли первинну пухлину неможливо виявити. Первинне джерело ідентифікується при житті лише у 25% випадків. У 15–20% пацієнтів первинне вогнище не знаходять навіть при аутопсії. Хоча метастази без виявленого первинного вогнища відрізняються за своїм походженням, біологічна поведінка їх приблизно однакова. Вони характеризуються випадковою, нетиповою локалізацією (часто ураженням нерегіонарних лімфатичних вузлів), швидким прогресуванням процесу на самих ранніх етапах розвитку, а також незвичайною комбінацією імуногістохімічних маркерів. У зв’язку з високою гетерогенністю пухлин зазвичай не вдається з’ясувати, який клон клітин став джерелом метастазів, оскільки втрачається набір морфологічних ознак, що дозволяє розрізнити клітини за приналежністю до того чи іншого органа. На практиці метастази без встановленого первинного вогнища можуть призвести до різноманітних інтенсивних, безплідних і дорогих діагностичних процедур, які інколи не приносять позитивного результату [3, 4].
Метою цього дослідження було вивчити результати лікування хворих з метастазами в лімфатичні вузли шиї без первинного вогнища.
ОБʼЄКТ І МЕТОДИ
Проведено ретроспективний аналіз даних про 86 пацієнтів, що знаходилися на обстеженні та лікуванні у Львівському регіональному онкологічному центрі з 2007 до 2017 р. З метою дообстеження застосовували фіброназоларингоскопію та гастроскопію. За допомогою ультразвукової діагностики (УЗД), комп’ютерної томографії (КТ) або магнітно-резонансної томографії (МРТ) уточнювали розміри та поширеність ураження, визначали топографічне співвідношення пухлини з магістральними судинами шиї та оточуючими структурами. У всіх випадках діагноз підтверджено морфологічно. Виділено 8 груп залежно від методу лікування. Комбіноване лікування отримали 30 хворих, 6 — хіміопроменеву терапію, у 25 випадках проведено лише монолікування, ще 25 осіб з різних причин відмовилися від будь-якого лікування (табл. 1).
| Метод лікування | Кількість хворих | |
| n | % | |
| Хірургія+хіміопроменева терапія | 15 | 17,4 |
| Хірургія+променева терапія | 12 | 14,0 |
| Хірургія+хіміотерапія | 3 | 3,5 |
| Хіміопроменева терапія | 6 | 7,0 |
| Хірургія | 13 | 15,1 |
| Променева терапія | 8 | 9,3 |
| Хіміотерапія | 4 | 4,7 |
| Відмова від лікування | 25 | 29 |
| Разом | 86 | 100 |
Хіміотерапія включала 4–6 курсів (цисплатин + флуороурацил), а променева терапія проводилася в дозі 60–70 Гр, обсяг хірургічного втручання залежав від поширеності процесу. Оцінку виживаності проводили шляхом аналізу кривих за методом Каплана — Майєра.
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
Бiльшiсть пацiєнтiв становили чоловiки — 80,2% (n=69), жінки — 19,8% (n=17). Середній вік хворих становив 58,3±1,2 року. Гістологічний розподіл виглядав наступним чином: плоскоклітинний рак — 67,4% (n=58), аденокарцинома — 17,4% (n=15), меланома — 7,0% (n=6), недиференційований рак і нейроендокринна пухлина — по 3 (3,5%) випадки.
У більшості пацієнтів з пухлинними масами на шиї виявляють метастатичний рак. Джерело лімфаденопатії часто знаходять під час обстеження органів голови та шиї. Якщо первинне вогнище не виявлено, необхідно провести детальне обстеження всіх органів і систем, включаючи шкірний покрив, легені, органи травлення та сечостатевої системи. Позитронно-емісійну томографію (ПЕТ)/КТ, МРТ або КТ з контрастуванням має бути зроблено до біопсії. Перевага надається корбіопсії над відкритою біопсією, оскільки цього часто достатньо, щоб отримати достовірну морфологічну верифікацію та розробити план лікування. Коли гістологічно підтверджено плоскоклітинний рак, аденокарциному або анапластичний/недиференційований епітеліальний рак і не виявлено первинної пухлини, необхідно провести додаткові обстеження. Тест на визначення вірусу папіломи людини (ВПЛ) 16-го типу та вірусу Епштейна — Барр рекомендовано проводити при плоскоклітинному або недиференційованому раку [5, 6]. Позитивний тест на ВПЛ вказує, що первинна пухлина може розташовуватися в мигдалику або в корені язика, що дозволяє скоригувати зону опромінення та мішені в цих ділянках [7, 8].
Також ретельно повинні бути перевірені й досліджені ділянки слизових оболонок. Рекомендовано відповідне ендоскопічне дослідження з цілеспрямованими біопсіями ділянок ймовірного розташування первинної пухлини, хоча це рідко дає можливість виявити первинну пухлину. Багато первинних видів раку виявляють після тонзилектомії. Однак терапевтична користь від цієї операції є невизначеною, оскільки коли пацієнти були проліковані без тонзилектомії, лише у деяких випадках виникала клінічно значима первинна пухлина в мигдаликах [9].
Серед інститутів — учасників NCCN (National Comprehensive Cancer Network) існують значні відмінності у лікуванні незроговілого плоскоклітинного, низькодиференційованого або анапластичного плоскоклітинного раку без первинного вогнища. Більшість членів панелі NCCN вважають, що таких пацієнтів слід лікувати хірургічно з лімфодисекцією шиї (видалення лімфатичних вузлів I–V рівнів) з подальшою променевою або хіміопроменевою терапією. Іншими варіантами також можуть бути 1) хіміопроменеве лікування при ураженні лімфатичних вузлів категорії N2 або більше (категорія 2В); 2) первинне опромінення у пацієнтів з ураженням лімфатичних вузлів менше N2 (категорія 2В) або 3) індукційна хіміотерапія (категорія 3) з подальшим хіміопроменевим лікуванням або лише променевою терапією (табл. 2). Лімфодисекція шиї також може бути рекомендована після іншого лікування залежно від клінічної відповіді [1].
|
Категорія 1. На підставі високого рівня доказів, є єдина думка членів NCCN, що втручання є доцільним. Категорія 2А. На підставі низького рівня доказів, є єдина думка членів NCCN, що втручання є доцільним. Категорія 2В. На підставі низького рівня доказів, є думка членів NCCN, що втручання є доцільним. Категорія 3. На підставі будь-якого рівня доказів, є великі розбіжності серед членів NCCN, що втручання є доцільним. |
Дисекція шиї рекомендується для всіх пацієнтів з тиреоглобуліннегативною та кальцитоніннегативною аденокарциномою. Якщо метастатична аденокарцинома розташовується високо на шиї, доцільно проводити паротидектомію.
У нашому дослідженні в деяких випадках післяопераційний матеріал включав тканину слинної залози. Зазвичай ознак інвазії в тканину залози не відмічали, за винятком 7 випадків, коли ступінь проростання був значним і виникало питання диференціації: чи це первинна пухлина із слинної залози, чи метастаз з інвазією в тканину залози. Також при морфологічному дослідженні слід враховувати, що, по-перше, первинне вогнище може локалізуватися поряд, замасковане запальними змінами. По-друге, саме пухлинне ураження може бути первинним вогнищем. Належить дуже обережно оцінювати значення слинної залози, особливо малих слинних залоз, в яких може виникати плоскоклітинний рак.
Після лімфодисекції шиї рекомендації варіюють залежно від кількості уражених лімфатичних вузлів, наявності або відсутності екстракапсулярного поширення. При захворюванні N1 без екстракапсулярного поширення учасники NCCN рекомендують опромінення, яке охоплює зону повного об’єму пухлини, або ретельне спостереження з регулярними обстеженнями голови та шиї. Післяопераційне опромінення або конкурентна хіміопроменева терапія (категорія 2B для хіміопроменевого лікування) рекомендуються для лікування хворих з N2 або N3 без екстракапсулярного поширення. При екстракапсулярному поширенні конкурентна хіміопроменева терапія має рекомендацію категорії 1, а також варіантом може бути променева терапія в монорежимі [10–13].
Середня тривалість життя у хворих з метастазами в лімфатичні вузли шиї без первинного вогнища становила 21,34±3,33, а медіана — 7,0 міс. Найефективнішим було комбіноване лікування: операція з наступним курсом хіміопроменевої терапії — медіана виживаності становила 27 міс, а середня тривалість життя 40,0±10,0 міс (рис. 1).
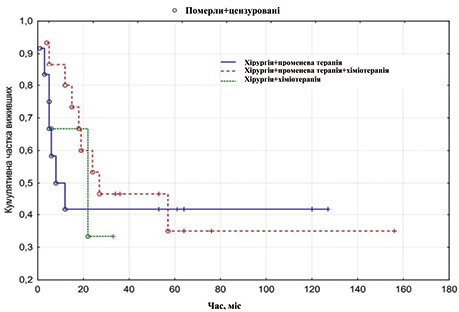
Також низькі показники виживаності констатовано у пацієнтів з метастазами меланоми, де середня тривалість життя становила лише 3,3±0,7 міс.
Методом Пірсона отримано статистично достовірну різницю між досліджуваними групами, р=0,0003.
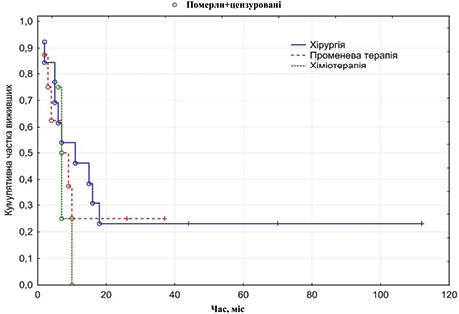
Найнижчі показники виживаності зафіксовано при монолікуванні: медіана виживаності після променевої терапії становила 8,0 міс, після хіміотерапії — 7,0 міс. Закономірно, що середня тривалість життя у хворих, що відмовилися від лікування, становила лише 4,33±0,9 міс, а медіана — 3,0 міс (рис. 2).
ВИСНОВКИ
Якщо після проведення базових діагностичних обстежень первинне вогнище не верифіковано, недоцільно витрачати час на його пошуки. Згідно з отриманими даними, загальна виживаність мало залежить від ідентифікації джерела метастазування, тому належить розпочинати лікування, схеми та методи якого вже давно визначені. Само собою, це не означає відмови від детального контролю стану хворих з метою виявлення первинного вогнища в динаміці.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. NCCN clinical practice guidelines in oncology. Head and neck cancers. Version1. 2022. Retrived from doi.org/10.6004/jnccn.2022.0016.
2. Zhou, M., Wu, Y., Wu, Y., Li, H., Ye, B., Yue, K., … Wang, X. (2023). Clinical characteristics and outcomes of cervical lymph node metastasis from unknown primary sites: a single institution’s 14-year experience. European Journal of Medical Research, 28(1), 5. doi: 10.1186/s40001-022-00957-9.
3. Arosio, A. D., Pignataro, L., Gaini, R. M., & Garavello, W. (2017). Neck lymph node metastases from unknown primary. Cancer Treatment Reviews, 53, 1–9. doi: 10.1016/j.ctrv.2016.11.014.
4. Galloway, T. J., & Ridge, J. A. (2015). Management of squamous cancer metastatic to cervical nodes with an unknown primary site. Journal of Clinical Oncology, 33, 3328–3337. doi: 10.1200/JCO.2015.61.0063.
5. Mizuta, M., Kitamura, M., Tateya, I., Tamaki, H., Tanaka, S., Asato, R., … Omori, K. (2018). Unknown primary squamous cell carcinoma of the head and neck: retrospective analysis of 80 cases. Acta Oto-Laryngologica, 138(6), 590–596. doi: 10.1080/00016489.2017.1422141.
6. Rudmik, L., Lau, H. Y., Matthews, T. W., Bosch, J. D., Kloiber, R., Molnar, C. P., & Dort, J. C. (2011). Clinical utility of PET/CT in the evaluation of head and neck squamous cell carcinoma with an unknown primary: a prospective clinical trial. Head and Neck, 33, 935–940. doi: 10.1002/hed.21566.
7. Rassy, E., Nicolai, P., & Pavlidis, N. (2019). Comprehensive management of HPV-related squamous cell carcinoma of the head and neck of unknown primary. Head and Neck, 41(10), 3700–3711. doi.org/10.1002/hed.25858.
8. Baldassarri, R., Aronberg, R., Levi, A. W., Yarbrough, W. G., Kowalski, D., & Chhieng, D. (2015). Detection and genotype of high-risk human papillomavirus in fine-needle aspirates of patients with metastatic squamous cell carcinoma is helpful in determining tumor origin. American Journal of Clinical Pathology, 143(5), 694–700. doi: 10.1309/AJCPCZA4PSZCFHQ4.
9. Wray, J., Amdur, R. J., Christopherson, K. M., Morris, C. G., Dziegielewski, P. T., Boyce, B. J., … Mendenhall, W. M. (2018). Lingual tonsillectomy likely does not improve outcomes for squamous cell carcinoma of the head and neck from an unknown primary site. American Journal of Clinical Oncology, 41(12), 1216–1219. doi: 10.1097/COC.0000000000000461.
10. Pflumio, C., Troussier, I., Sun, X. S., Salleron, J., Petit, C., Caubet, M., … Thariat, J. (2019). Unilateral or bilateral irradiation in cervical lymph node metastases of unknown primary? a retrospective cohort study. European Journal of Cancer, 111, 69–81. doi: 10.1016/j.ejca.2019.01.004.
11. Kamal, M., Mohamed, A. S. R., Fuller, C. D., Sturgis, E. M., Johnson, F. M., Morrison, W. H., … Garden, A. S. (2018). Outcomes of patients diagnosed with carcinoma metastatic to the neck from an unknown primary source and treated with intensity-modulated radiation therapy. Cancer, 124(7), 1415–1427. doi: 10.1002/cncr.31235.
12. Le, N. S., Janik, S., Simmel, H., & Erovic, B. M. (2019). Bilateral vs ipsilateral adjuvant radiotherapy in patients with cancer of unknown primary of the head and neck: an analysis of the clinical outcome and radiation-induced side effects. Head and Neck, 41, 1785–1794. doi: 10.1002/hed.25637.
13. Yamazaki, T., Kodaira, T., Ota, Y., Akimoto, T., Wada, H., Hiratsuka, J., … Uchida, N. (2017). Retrospective analysis of definitive radiotherapy for neck node metastasis from unknown primary tumor: Japanese radiation oncology study group study. Japanese Journal of Clinical Oncology, 47, 856–862. doi: 10.1093/jjco/hyx093.
Адреса для листування:
Галай Олег Орестович
79031, Львів, вул. Гашека, 2А
Львівський онкологічний регіональний лікувально-діагностичний центр
E-mail: ohalay@gmail.com
Сorrespondence:
Oleh Halay
2А Hashek str., Lviv, 79031
Lviv State Oncological Regional Treatment and Diagnostic Center
E-mail: ohalay@gmail.com














Leave a comment