Вибір ад’ювантного лікування раку ендометрія ІІІА–С стадій
Дяків І.Б.1, Крижанівська А.Є.1, Рижик В.М.1, Соколовська М.В.2, Вівчаренко Ю.К.3
- 1Івано-Франківський національний медичний університет, Івано-Франківськ, Україна
- 2Онкологічна клініка LISOD, Київ, Україна
- 3Прикарпатський клінічний онкологічний центр Івано-Франківської обласної ради
Резюме. Мета дослідження — оцінити ад’ювантне лікування у пацієнток з раком ендометрія ІІІА-С стадій. Матеріали та методи. Ретроспективно проведено дослідження 44 пацієнток з поширеним раком ендометрія ІІІА-С стадій, які отримали комплексне лікування у Прикарпатському клінічному онкологічному центрі Івано-Франківської обласної ради з 2020 до 2022 р. Вік пацієнток — 41–83 роки, у середньому — 63,5±7,8 року. Стадіювання раку ендометрія проводили відповідно до класифікації FIGO (International Federation of Gynecology and Obstetrics) (2021 р.) ІІІА — 9 (20,5%), ІІІВ — 8 (18,1%), ІІІС — 27 (61,4%). Морфологічну верифікацію виконано всім пацієнткам: підтверджено ендометріальну аденокарциному різного ступеня диференціювання у 26 (59,0%) хворих, а також інші гістологічні варіанти: муцинозну, серозну, світлоклітинну аденокарциному та плоскоклітинну карциному — у 18 (41,0%). Результати. Усім хворим на рак ендометрія проведено хірургічне лікування. Пангістеректомія IІ типу з оментектомією виконано у 33 (75,0%) хворих на рак ендометрія. Дещо менше виконано пангістеректомій I типу та пангістеректомій IIІ типу + резекцію сальника — 8 (18,2%) та 3 (6,8%) відповідно. На сьогодні немає єдиного консенсусу в стандартах лікування жінок на рак ендометрія ІІІА–ІV стадій за FIGO. Застосовується поєднання хірургічного лікування з хіміо- та/або радіотерапією. Ад’ювантне лікування поліхіміотерапією (паклітаксел/карбоплатин) отримали 36 (81,8%) пацієнтів. Післяопераційний курс дистанційної променевої терапії отримали 2 (4,5%) хворих, разову дозу 2 Гр до сумарної вогнищевої дози 40 Гр. Післяопераційне лікування із застосуванням променевої та хіміотерапії отримали 6 (13,7%) хворих. Висновки. Удосконалення комплексного лікування хворих на рак ендометрія, що поєднує хірургічне втручання, променеву терапію та хіміотерапію, є актуальним. Одним із напрямків підвищення ефективності комплексного лікування, за даними сучасної літератури та досліджень, є радіомодифікація променевої терапії та удосконалення методик застосування хіміопрепаратів.
Одержано 6.04.2023
Прийнято до друку 1.05.2023
DOI: 10.32471/clinicaloncology.2663-466X.50-2.30530
Вступ. Рак ендометрія (РЕ) посідає провідне місце серед злоякісних новоутворень жіночих статевих органів. На сучасному етапі визначається збільшення кількості випадків цієї патології. Висока поширеність РЕ, значні соціально-економічні затрати та психомедичні чинники зумовлюють актуальність даної проблеми та необхідність пошуку нових методів ранньої діагностики та лікування.
Згідно зі світовими даними, кількість уперше діагностованих випадків захворюваності в Європі становила майже 29,5% на 100 тис. жіночого населення за 2021 р. [1]. В Україні серед жіночого населення зареєстрована кількість випадків захворювання за 2018 р. становить 10,2%, за 2019 р. — 12,2%, 2020 р. — 13,4% що свідчить про зростання захворюваності на 2,0% щорічно. Переважно РЕ діагностують на ранніх стадіях, у 80% на І стадії з 5-річним показником виживаності понад 95%. Однак показники виживаності значно нижчі у хворих з регіонарним поширенням або віддаленими метастазами — 68 та 17% відповідно [2]. У той час як у більшості пацієнток діагностують ранні стадії РЕ і відмічають сприятливий прогноз у лікуванні, у пацієнтів із місцево-поширеним процесом існує високий ризик рецидиву [3, 4].
Первинне лікування РЕ складається з гістеректомії та двобічної сальпінгоофоректомії з додатковою лімфаденектомією у разі клінічних, радіологічних ознак поширення захворювання [5]. Послідовність подальшого ад’ювантного лікування пацієнтів із ІІІ стадією РЕ є дискутабельною. Згідно з джерелами NCCN (National Comprehensive Cancer Network), ESGO (International Federation of Gynecology and Obstetrics), пацієнтам з РЕ ІІІ стадії показана системна хіміотерапія (ХТ) ± променева терапія (ПТ), але не зазначено кількість циклів ХТ, коли, у якій послідовності і за яких обставин застосовувати той чи інший метод ад’ювантного лікування. [6]. Проведено два рандомізовані контрольовані дослідження PORTEC-3 та GOG-258. У дослідженні PORTEC-3 оцінювали переваги поєднання ХТ з ПТ. Дослідження порівнювало ПТ+ХТ з ПТ у популяції з 660 пацієнтів високого ризику РЕ, яка включала 295 пацієнтів із III стадією захворювання. За результатами дослідження відмічено підвищення виживаності пацієнтів при застосуванні ПТ+ХТ, з 5-річною загальною виживаністю (ЗВ) 78,5 та 68,5% у ПТ [7]. У дослідження GOG-258 рандомізували 715 пацієнтів із ІІІ стадією РE. Його учасники також, як і у дослідженні PORTEC-3, отримували ПТ+ХТ або тільки ХТ. Після завершення трайлу GOG-258 виявлено незначну різницю у виживаності — 59% для пацієнтів, які отримували лікування ПТ+ХТ, порівняно з 58% у пацієнтів, які отримували лише ХТ [8].
Мета дослідження. Оцінити ад’ювантне лікування у пацієнток з РЕ ІІІ стадії, поділитися власним досвідом та проаналізувати показники виживаності хворих.
Об’єкт і методи дослідження. Ретроспективно проведено дослідження за участю 44 пацієнток з поширеним РЕ ІІІА–С стадій, які отримали комплексне лікування у Прикарпатському клінічному онкологічному центрі Івано-Франківської обласної ради з 2020 до 2022 р. Вік пацієнток — 41–83 роки, у середньому — 63,5±7,8 року. Стадіювання РЕ проводили відповідно до класифікації FIGO (2021 р.) ІІІА — 9 (20,5%), ІІІВ — 8 (18,1%), ІІІС — 27 (61,4%). Морфологічну верифікацію виконано всім пацієнткам: підтверджено ендометріальну аденокарциному різного ступеня диференціювання у 26 (59,0%) хворих, а також інші гістологічні варіанти: муцинозну, серозну, світлоклітинну аденокарциному та плоскоклітинну карциному — у 18 (41,0%).
Усім пацієнткам проведено хірургічне видалення пухлини: пангістеректомію із двохбічною тазовою лімфодисекцією, оментектомію. В ад’ювантному режимі пацієнти із TNM стадіюванням, T1N1M0, T3N0M0, T2N1M0 отримали ПТ, ХТ, ПТ+ХТ.
Статистичний аналіз проводили за допомогою програмного забезпечення STATISTICA, версія 10.0 (портативна). Для оцінки співвідношення між результатами діагностичних методів та гістологічними результатами використано метод Пірсона, або χ2, тоді як для оцінки значущості відмінностей між методами — непараметричний тест (тест МакНемара), p ≤0,05 вважали статистично значущим.
Результати та їх обговорення. Усі хворі були жіночої статі. Характеристика пацієнток за віком представлена на рис. 1.
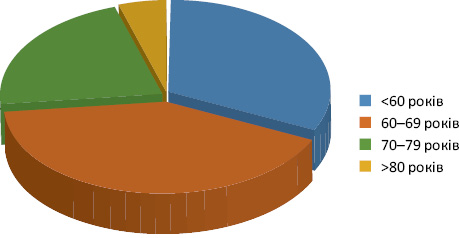
За даними, представленими на рис. 1, переважали хворі у віковій групі 60–69 років — 17 (38,8%), працездатного віку до 60 років — 16 (9,9%). Пацієнтів старечого віку — старше 70–79 років налічувалося 9 (20,4%), старше 80 років — 2 (4,5%).
За даними, представленими у табл. 1, переважали хворі із надмірною масою тіла, ожиріння І — 12 (27,3%) та ІІ ступеня — 18 (40,9%) відповідно. Також було 8 (18,3%) пацієнтів із ожирінням ІІІ ступеня. Практично з однаковою частотою відмічено нормальну масу тіла та передожиріння — у 2 (4,5%) та 4 (9,0%) пацієнток відповідно.
| Індекс маси тіла, кг/м2 | Хворі на РЕ | |
| n | % | |
| 18,5—24,99 (нормальна маса тіла) | 2 | 4,5 |
| 25—30 (передожиріння) | 4 | 9,0 |
| 31—35 (ожиріння І ступеня) | 12 | 27,3 |
| 36—40 (ожиріння ІІ ступеня) | 18 | 40,9 |
| ≥40 (ожиріння ІІІ ступеня) | 8 | 18,3 |
| Усього | 44 | 100 |
Усім хворим на РЕ проведено хірургічне лікування. У хворих на РЕ обсяги оперативного лікування залежали від поширеності пухлини тіла матки та гістологічної диференціації пухлини (табл. 2).
| Обсяги хірургічного втручання | Хворі на РЕ | |
| n | % | |
| Пангістеректомія II типу + оментектомія | 33 | 75,0 |
| Пангістеректомія I типу + резекція сальника | 8 | 18,2 |
| Пангістеректомія IIІ типу + резекція сальника | 3 | 6,8 |
| Усього | 44 | 100 |
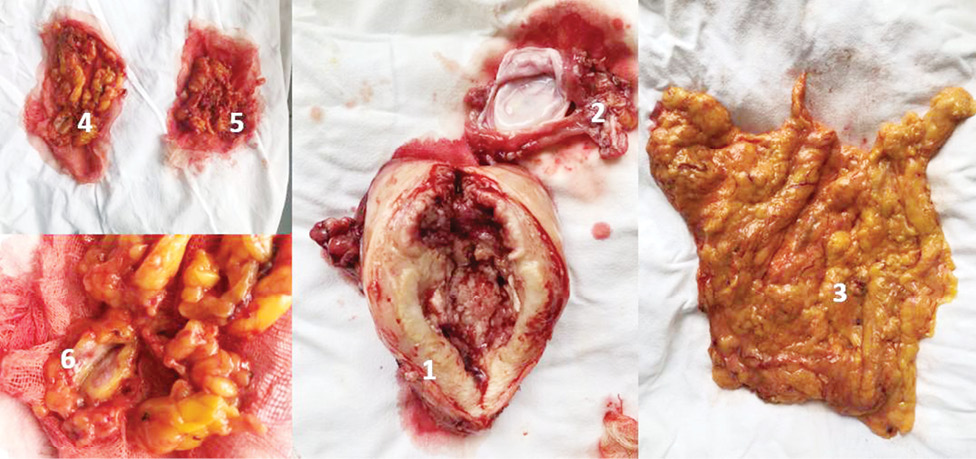
Пангістеректомію IІ типу з оментектомією виконано (рис. 2) у 33 (75,0%) хворих на РЕ. Дещо менше виконано пангістеректомій I типу та пангістеректомій IIІ типу + резекцію сальника — 8 (18,2%) та 3 (6,8%) відповідно.
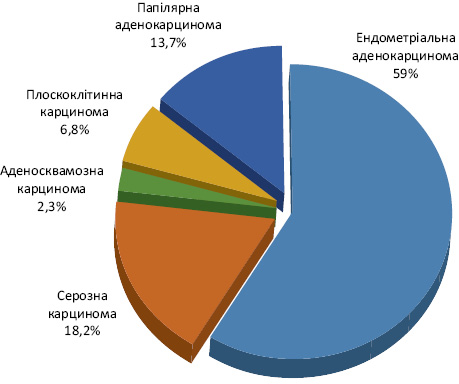
При гістологічному дослідженні післяопераційного матеріалу ендометріальна аденокарцинома верифікована у 26 (59,0%) хворих. Неендометріальну карциному діагностовано у 18 (41,0%) пацієнток: серозну карциному — у 8 (18,2%), папілярну та плоскоклітинну карциному — у 3 (6,8%) та 6 (13,7%) відповідно, а в 1 (2,3%) — аденосквамозну карциному (рис. 3).
При гістологічному дослідженні післяопераційного матеріалу пухлини тіла матки помірнодиференційована аденокарцинома (G2) верифікована у 16 (36,4%) хворих, а низькодиференційована (G3) — у 28 (63,6%) пацієнток (рис. 4).
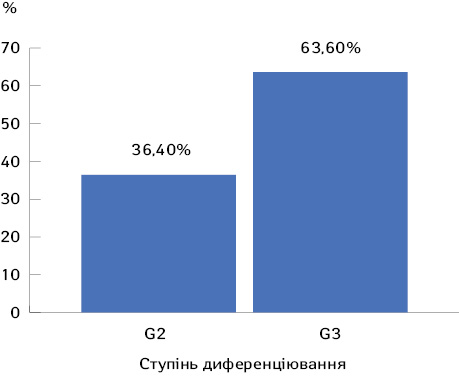
Дані ступенів диференціації пухлини також, у свою чергу, є фактором прогнозу та вибору тактики ад’ювантного лікування.
Доведено, що кількість видалених лімфатичних вузлів є дуже важливою, оскільки видалення більшої кількості лімфовузлів сприяє підвищенню рівня загальної виживаності при проміжному та високому ризику захворювання.
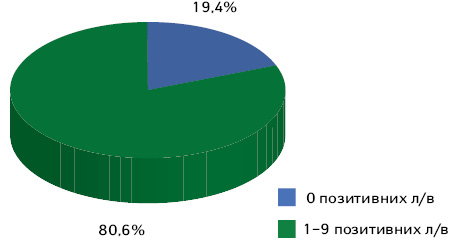
До уваги взято 36 пацієнтів, яким проведено видалення тазових лімфатичних вузлів (рис. 5). У 29 (80,6%) пацієнток гістологічно діагностовано метастази в тазові лімфатичні вузли. У 7 (19,4%) випадках при доопераційній радіологічній діагностиці констатовано метастази в тазові лімфатичні вузли, а гістологічно трактовано — реактивні зміни.
На сьогодні немає єдиного консенсусу в стандартах лікування жінок із РЕ ІІІА–ІV стадій за FIGO. Застосовується поєднання хірургічного лікування з ХТ та/або радіотерапією (табл. 3).
| Вид післяопераційного лікування | Хворі на РЕ | |
| n | % | |
| Дистанційна ПТ | 2 | 4,5 |
| Поліхіміотерапія (4–6 циклів) | 36 | 81,8 |
| Поліхіміотерапія (4 цикли) + дистанційна ПТ | 6 | 13,7 |
| Усього | 44 | 100,0 |
Ад’ювантне лікування поліхіміотерапією (паклітаксел/карбоплатин) отримали 36 (81,8%) пацієнток. Післяопераційний курс дистанційної променевої терапії отримали 2 (4,5%) хворих, разову дозу (РД) 2 Гр до сумарної вогнищевої дози (СВД) 40 Гр. Післяопераційне лікування із застосуванням ПТ та ХТ отримали 6 (13,7%) хворих.
Усім пацієнткам проведено імуногістохімічне дослідження післяопераційного матеріалу (табл. 4).
| Імуногістохімічний тип | Хворі на РЕ | |
| n | % | |
| RE(+)RP(+)her2neu(-) | 18 | 40,9 |
| RE(-)RP(+)her2neu(-) | 12 | 27,3 |
| RE(-)RP(-)her2neu(-) | 14 | 31,8 |
| Усього | 44 | 100 |
Експресію рецепторів естрогену та прогестерону діагностовано у 18 (40,9%) пацієнток, експресію рецепторів прогестерону — у 12 (27,3%) хворих, а тричі негативний тип — у 14 (31,8%) випадках. Після завершення ад’ювантного лікування пацієнти з позитивними рецепторами естрогену/прогестерону отримали підтримувальну гормонотерапію тамоксифеном чи летрозолом.
Вивчено та проаналізовано загальну виживаність хворих на поширений РЕ ІІІА–С стадій за 2020–2022 рр. (рис. 6). А також вивчено частоту виникнення локальних рецидивів та віддалених метастазів після проведеного спеціального онкологічного лікування. Даний аналіз проведено на підставі аналізу історій хвороб, а також результатів їх об’єктивного та фізикального обстеження протягом усього періоду динамічного спостереження. Оцінку виживаності проводили за методом Каплана — Майєра.
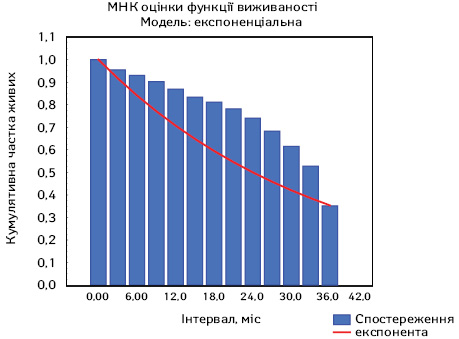
Загальна виживаність у хворих на РЕ ІІІА–С стадій становила 62,0%, летальність до року — 4,5%. Мінімальний термін спостереження хворих — 4,34 міс, максимальний — 36,2 міс, в середньому — 20,27±3,9 міс.
Локальний рецидив діагностовано у 3 (6,8%) пацієнтів: в 1 хворої в куксу піхви, у 2 — у заочеревинні лімфатичні вузли. Віддалене метастатичне ураження констатовано у 4 (9,1%) хворих: по 1 випадку в печінку, легені, кістки, очеревину (асцит).
Висновки
Удосконалення комплексного лікування хворих на РЕ, що поєднує хірургічне втручання, ПТ та ХТ є актуальним. Одним із напрямків підвищення ефективності комплексного лікування, за даними сучасної літератури та досліджень, є радіомодифікація ПТ та удосконалення методик застосування хіміопрепаратів.
Дане дослідження потребує подальшого вивчення, оскільки у стандартах лікування немає однозначної схеми ад’ювантного лікування пацієнтів з РЕ ІІІА–С стадій.
Список використаної літератури
1. Bray, F., Ferlay, J., Soerjomataram, I., Siegel, R. L., Torre, L. A., & Jemal, A. (2021). Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. Cancer Journal for Clinicians, 68(6), 394–424. doi: 10.3322/caac.21492.
2. Федоренко, З. П., Сумкіна, О. В., Горох, Є. Л., Гулак, Л. О., & Куценко, Л. Б. (2022). Рак в Україні, 2020–2021. Захворюваність, смертність, показники діяльності онкологічної служби. А. Ф. Шипко (Ред.), Бюлетень Національного канцер-реєстру України, 23, 129. http://www.ncru.inf.ua/publications.
3. Creasman, W., Ali, S., Mutch, D., Zaino, R., Powell, M., Mannel, R., … Miller, D. S. (2017). Surgical-pathological findings in type 1 and 2 endometrial cancer: an NRG Oncology/Gynecologic Oncology Group study on GOG-210 protocol. Gynecologic Oncology, 145(3), 519–525. doi: 10.1016/j.ygyno.2017.03.017.
4. Amant, F., Mirza, M., Koskas, M., & Creutzberg, C. (2018) Cancer of the corpus uteri. International Journal of Gynecology & Obstetrics, 143(2), 37–50. doi: 10.1002/ijgo.13866.
5. Colombo, N., Creutzberg, C., Amant, F., Bosse, T, Gonzalez-Martin, A., Ledermann, J., … Sessa, C. (2016). ESMO-ESGO-ESTRO consensus conference on endometrial cancer: diagnosis, treatment and follow-up. International Journal of Gynecology Cancer, 27(1), 16–41. doi: 10.1093/annonc/mdv484.
6. deBoer, S. M., Powell, M. E., Mileshkin, L., Katsaros, D., Bessette, P., Haie-Meder, C., … Creutzberg, C. L. (2018). Adjuvant chemoradiotherapy versus radiotherapy alone for women with high-risk endometrial cancer (PORTEC-3): final results of an international, open-label, multicentre, randomised, phase 3 trial. Lancet Oncology, 19(3), 295–309. doi: 10.1016/S1470-2045(18)30079-2.
7. de Boer, S. M., Powell, M. E., Mileshkin, L., Katsaros, D., Bessette, P., Haie-Meder, C., … Creutzberg, C. L. (2019). Adjuvant chemoradiotherapy versus radiotherapy alone in women with high-risk endometrial cancer (PORTEC-3): patterns of recurrence and post-hoc survival analysis of a randomised phase 3 trial Lancet Oncology, 20(9), 1273–1285. doi: 10.1016/S1470-2045(19)30395-X.
8. Matei, D., Filiaci, V., Randall, M. E., Mutch, D., Steinhoff, M. M., DiSilvestro, P. A., … Miller, D. S. (2019). Adjuvant chemotherapy plus radiation for locally advanced endometrial cancer. The New England Journal of Medicine, 380(24), 2317–2326. doi: 10.1056/NEJMoa1813181.
Адреса для листування:
Дяків Ірина Борисівна
76000, Івано-Франківськ, вул. Хотинська, 12/308
E-mail: irynadjakiv@ukr.net
Сorrespondence:
Dyakiv Iryna
12/308 Khotynska str., Ivano-Frankivsk, 76000
E-mail: irynadjakiv@ukr.net














Leave a comment