Індукційна таргетна терапія інгібіторами тирозинкінази в лікуванні EGFR-позитивного недрібноклітинного раку легені. Клінічний випадок та обговорення особливостей лікувального «таргетного» патоморфозу пухлини
Суховерша О.А.1, Циганков К.В.2, Кужевський І.В.3, Коваль С.С.4
- 1Онкоторакальний центр, КНП «Міська клінічна лікарня № 4» Дніпровської міської ради, м. Дніпро, Україна
- 2КНП «Міська клінічна лікарня № 4» Дніпровської міської ради, м. Дніпро, Україна
- 3Патоморфологічне відділення, КНП «Міська клінічна лікарня № 4» Дніпровської міської ради, м. Дніпро, Україна
- 4Клініко-діагностичне відділення, КНП «Міська клінічна лікарня № 4» Дніпровської міської ради, м. Дніпро, Україна
Резюме. У структурі раку легені переважає недрібноклітинний рак легені (НДРЛ), на який припадає 80–85% випадків цієї локалізації. Показники 5-річної виживаності при НДРЛ є досить низькими. Донедавна стандарт лікування пацієнтів з резектабельним НДРЛ включав хірургічну резекцію з передопераційною індукційною (неоад’ювантною) та післяопераційною (ад’ювантною) хіміо-/променевою терапією. Однак за такого підходу рецидив є поширеним явищем, і ризик його виникнення зростає зі стадією захворювання. Останнім часом застосування інгібіторів тирозинкінази — рецептора епідермального фактора росту (EGFR-TKI), та імунотерапії в схемах ад’ювантного лікування продемонстрували покращання виживаності без прогресії захворювання (ВБП) у хворих на НДРЛ. Осимертиніб є незворотним пероральним EGFR-TKI 3-го покоління з продемонстрованою потужною ефективністю при НДРЛ за показником ВБП, у тому числі у пацієнтів з метастатичним ураженням центральної нервової системи. Що стосується застосування осимертинібу в індукційному режимі, його ефективність при хірургічно операбельному НДРЛ із мутацією EGFR залишається недостатньо дослідженою. В якості переваги над ад’ювантним лікуванням, індукційна терапія при резектабельному НДРЛ має потенціал щодо зменшення розмірів пухлини та забезпечує більш раннє усунення мікрометастатичного захворювання, тим самим потенційно знижуючи ризик рецидиву та пролонгації захворювання. У статті наведено огляд досліджень ефективності застосування осимертинібу в індукційному режимі та результати власних спостережень.
DOI: 10.32471/clinicaloncology.2663-466X.50-2.30874
Вступ
 У структурі онкологічної захворюваності рак легені (РЛ) займає 12,8%. Показники 5-річної виживаності при РЛ виглядають досить погано: навіть у країнах із найвищим стандартом охорони здоров’я вони становлять лише 15–22%, а при середньому розвитку медицини цей показник ледь сягає 7–12%. Недрібноклітинний рак легені (НДРЛ) становить 80–85% випадків цієї локалізації та розвивається при множинних змінах ДНК епітеліальних клітин, внаслідок чого запускається безконтрольний клітинний поділ, втрачається здатність клітини до апоптозу. Різновидами цього раку є аденокарцинома, яка розвивається з клітин залозистого епітелію, поширюється відносно повільно та становить близько половини випадків НДРЛ. Плоскоклітинний рак легені (епідермоїдний) — розвивається в результаті переродження війчастого епітелію слизової оболонки бронхів, супроводжується накопиченням генетичних мутацій у клітинах плоского епітелію та відмічається у 20–25% випадків НДРЛ. Також відрізняється повільним розвитком та безсимптомним перебігом на ранніх стадіях, що ускладнює своєчасну діагностику і лікування. Саме тому НДРЛ є однією з основних причин смертності від раку [1, 2].
У структурі онкологічної захворюваності рак легені (РЛ) займає 12,8%. Показники 5-річної виживаності при РЛ виглядають досить погано: навіть у країнах із найвищим стандартом охорони здоров’я вони становлять лише 15–22%, а при середньому розвитку медицини цей показник ледь сягає 7–12%. Недрібноклітинний рак легені (НДРЛ) становить 80–85% випадків цієї локалізації та розвивається при множинних змінах ДНК епітеліальних клітин, внаслідок чого запускається безконтрольний клітинний поділ, втрачається здатність клітини до апоптозу. Різновидами цього раку є аденокарцинома, яка розвивається з клітин залозистого епітелію, поширюється відносно повільно та становить близько половини випадків НДРЛ. Плоскоклітинний рак легені (епідермоїдний) — розвивається в результаті переродження війчастого епітелію слизової оболонки бронхів, супроводжується накопиченням генетичних мутацій у клітинах плоского епітелію та відмічається у 20–25% випадків НДРЛ. Також відрізняється повільним розвитком та безсимптомним перебігом на ранніх стадіях, що ускладнює своєчасну діагностику і лікування. Саме тому НДРЛ є однією з основних причин смертності від раку [1, 2].
Донедавна стандарт лікування пацієнтів з резектабельним НДРЛ включав хірургічну резекцію з подальшою післяопераційною ад’ювантною хіміотерапією за умови наявності необхідних показань. Однак за такого підходу рецидив є поширеним явищем, і ризик його виникнення зростає зі стадією захворювання [3].
Останнім часом застосування інгібіторів тирозинкінази рецептора епідермального фактора росту (EGFR-TKI) та імунотерапії в схемах ад’ювантної терапії продемонстрували покращання виживаності без ознак захворювання (ВБОЗ) у хворих з НДРЛ.
Осимертиніб є незворотним пероральним EGFR-TKI третього покоління, який продемонстрував потужну ефективність щодо лікування пацієнтів з НДРЛ не тільки на етапі метастатичного процесу, але й на більш ранніх стадіях (IB–IIIA) захворювання в якості ад’ювантної терапії після проведення радикального хірургічного лікування.
Так, за результатами дослідження фази III ADAURA осимертиніб в якості ад’ювантної терапії продемонстрував значну перевагу показників ВБОЗ порівняно з плацебо у пацієнтів із НДРЛ IB–IIIA стадій з мутацією EGFR після повної резекції пухлини незалежно від наявності ад’ювантної хіміотерапії [4]. Показано, що застосування осимертинібу протягом 3 років в якості ад’ювантної терапії супроводжується статистично значущим зниженням ризику розвитку рецидиву або смерті на 77% для пацієнтів зі стадіями II–IIIA (відношення ризиків (ВР) 0,23; 95% довірчий інтервал (ДІ) 0,18–0,30) та на 73% для стадій IB–IIIA (ВР 0,27; 95% ДІ 0,21–0,34) порівняно із групою плацебо (медіана тривалості спостереження становила 44,2 міс у групі осимертинібу та 19,6 міс для групи плацебо). Разом з тим, якщо порівняти медіани щодо ВБОЗ в обох терапевтичних групах, то для пацієнтів II–IIIA стадій у групі осимертинібу медіана ВБОЗ становила 65,8 міс, а в групі плацебо — лише 21,9 міс, що демонструє абсолютну різницю у 43,9 міс (більше ніж 3,5 року) та підтверджує значний ризик рецидиву для пацієнтів при II–IIIA стадіях навіть на тлі проведення радикальної резекції та застосування ад’ювантної хіміотерапії.
Крім цього, варто наголосити, що значною подією 2023 р. стала презентація даних дослідження ADAURA щодо результатів 5-річної загальної виживаності (ASCO congress, червень 2023) [5]. Згідно з опублікованими даними застосування осимертинібу протягом 3 років в якості ад’ювантної терапії у пацієнтів із НДРЛ з мутацією EGFR після радикальної резекції пухлини знижує ризик смерті на 51% (ВР 0,49; 95,03% ДІ 0,33–0,73) як для популяції пацієнтів зі ІІ–IIIA (ВР 0,49; 95,03% ДІ 0,33–0,73), так і для загальної популяції стадії IB–IIIA (ВР 0,49; 95,03% ДІ 0,34–0,70). При цьому 85% пацієнтів у групі осимертинібу з ІІ та ІІІА стадіями залишалися живими протягом 5 років, у групі плацебо показник загальної виживаності становив 73%. Проте важливо зазначити, що в групі плацебо 88% пацієнтів після розвитку рецидиву знову поверталися до застосування TKI-EGFR, зокрема осимертинібу, у 43% випадках. Цікавим також є той факт, що після закінчення 3-річного курсу терапії у разі подальшого розвитку рецидиву в групі осимертинібу пацієнтам також призначали TKI-EGFR та, зокрема, осимертиніб в якості подальшого лікування. Таким чином, можна зазначити, що для пацієнтів з НДРЛ на ранніх стадіях захворювання у разі наявності мутації EGFR ад’ювантна терапія осимертинібом після проведення радикальної резекції пухлини надає шанс пацієнту прожити значно довше, ніж у пацієнтів з групи плацебо.
Загальновідомо, що показник загальної виживаності протягом 5 років для пацієнтів ІІ та ІІІА стадій тривалий час залишався на рівні лише 30–60% [6]. Однак сьогодні завдяки результатам дослідження ADAURA щодо ЗВ можна впевнено стверджувати, що застосування молекулярних та комбінованих методів лікування в онкохірургічній та онкологічній практиці значно підвищують показники виживаності EGFR-позитивного НДРЛ на ІІ–ІІІА стадіях до 85%. Саме тому сьогодні осимертиніб є першим препаратом таргетної терапії, який схвалений у багатьох країнах для проведення ад’ювантної терапії НДРЛ на IB–IIIA стадіях у пацієнтів із мутацією в гені EGFR після радикальної резекції пухлини та внесений до міжнародних рекомендацій ESMO та NCCN [3].
Що стосується застосування осимертинібу в індукційному режимі, його ефективність при хірургічно операбельному НДРЛ із мутацією EGFR залишається недостатньо дослідженою.
Впровадження тестування на біомаркери і забезпечення доступу до нових методів лікування мають на меті значно подовжити загальну виживаність хворих на НДРЛ IV стадії, являючи собою ефект прецизійних підходів в онкології. Неабиякий успіх таргетної терапії на основі визначення біомаркерів при поширеному НДРЛ, а також необхідність покращання показників виживаності на резектабельних стадіях захворювання створили основу для підвищення інтересу до перегляду індукційних стратегій [7].
Широке впровадження індукційного підходу на ранніх стадіях НДРЛ згорнуто встановленням ад’ювантної хіміотерапії як стандарту лікування, а також негативними результатами кількох рандомізованих контрольованих досліджень індукційної терапії, які в основному були недостатньо потужними і виконаними в невибраних популяціях. Але наступне дослідження НДРЛ Meta-analysis Collaborative Group репрезентувало перевагу щодо показника загальної виживаності (ЗВ) при застосуванні індукційної терапії порівняно з операцією, хоча не було представлено надійного прямого порівняння з ад’ювантною хіміотерапією. Однак впровадження цільової терапії на ранніх стадіях НДРЛ є важливою подією в онкології за останні 5 років [7].
Метааналізи результатів терапії пацієнтів з НДРЛ I–III стадії показали, що індукційна хіміотерапія з подальшим хірургічним втручанням статистично значуще покращувала ЗВ, час до віддаленого рецидиву та виживаність без подій (ВБП) порівняно з лише хірургічним втручанням. Продемонстровано зниження відносного ризику смерті на 18% та абсолютну перевагу в 5-річній ЗВ на 5–6% при застосуванні індукційної хіміотерапії порівняно з лише хірургічним втручанням. Незважаючи на такі багатообіцяючі результати, все ще існує потреба у більш ефективних, персоналізованих методах лікування [8].
Хоча EGFR-TKI є ефективним засобом лікування пацієнтів із прогресуючим НДРЛ з мутацією EGFR, і позитивні результати щодо ефективності продемонстровані в умовах ад’ювантної терапії, наразі немає EGFR-TKI, схвалених для індукційного лікування резектабельного НДРЛ з мутацією EGFR. Останні, хоча й обмежені, дані вказують на те, що індукційні EGFR-TKI з хіміотерапією або без неї можуть досягти клінічно значущої відповіді на терапію та покращити виживаність пацієнтів. Низка результатів свідчить, що комбінація EGFR-TKI і хіміотерапії може бути більш ефективним та багатообіцяючим варіантом передопераційного лікування, ніж лише EGFR-TKI. У сукупності ці висновки підкреслюють необхідність проведення подальших досліджень із застосуванням потужного EGFR-TKI з або без хіміотерапії в умовах індукційної терапії [8–11].
З цієї точки зору, застосування осимертинібу в ад’ювантному режимі як новий стандарт лікування пацієнтів з НДРЛ IB–IIIA стадії із мутацією EGFR відкриває можливості для розширення підходу на основі біомаркерів індукційною терапією найближчим часом.
Наразі рандомізоване багатоцентрове дослідження NeoADAURA III фази оцінюватиме індукційну терапію осимертинібом як монотерапію або у поєднанні з хіміотерапією порівняно з хіміотерапією з наступним хірургічним втручанням (та ад’ювантним лікуванням за вибором дослідника, включаючи осимертиніб) у пацієнтів з резектабельною стадією II–IIIB НДРЛ з мутацією EGFR. Результати допоможуть у подальшому визначити роль індукційної таргетної терапії осимертинібом при резектабельному НДРЛ з мутацією EGFR та мають потенціал щодо розширення варіантів лікування й впровадження їх у клінічну практику [7].
В якості переваги перед ад’ювантним лікуванням індукційна терапія при резектабельному НДРЛ має потенціал щодо зменшення розмірів пухлини та забезпечує більш раннє усунення мікрометастатичного захворювання, тим самим потенційно знижуючи ризик його рецидиву [8]. При цьому важливо зазначити, що осимертиніб в індукційному режимі може забезпечити високу ефективність та сприятливий профіль токсичності порівняно з цитотоксичною хіміотерапією, добре переноситься і не призводить до затримки проведення хірургічного втручання чи підвищення ризику хірургічних ускладнень [7–11]. Окрім того, дослідження результатів застосування осимертинібу в індукційному режимі можуть дати краще розуміння механізмів формування та шляхів подолання мінімальної залишкової хвороби. Однак враховуючи неоднорідність популяції ранніх стадій НДРЛ, особливо ІІІ стадії, стратегії лікування потребуватимуть індивідуалізованих підходів, щоб значно покращити результати. Тісна міждисциплінарна співпраця та ретельний відбір пацієнтів залишаються вкрай важливою запорукою успіху індукційних підходів, зокрема і при застосуванні осимертинібу в індукційному режимі, що сприятиме розширенню можливостей лікування на ранніх стадіях захворювання [7, 8].
Клінічний випадок
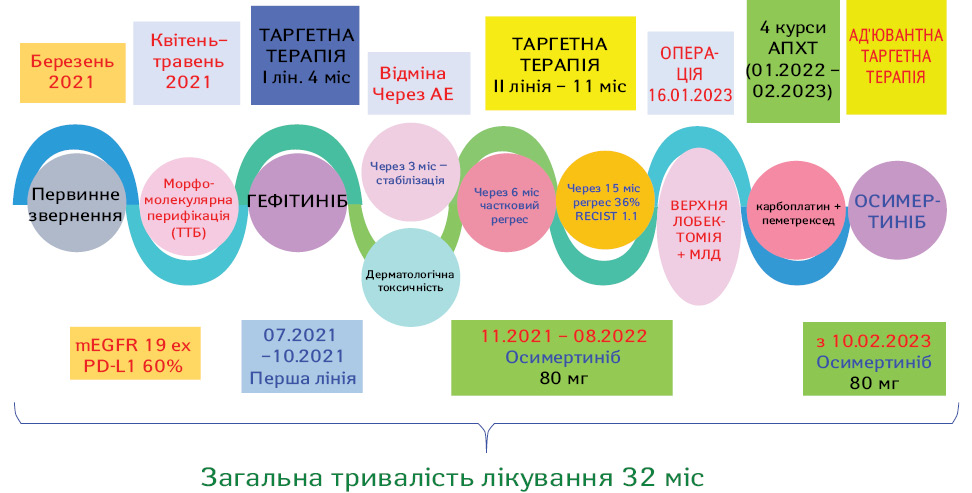
У березні 2021 р. на консультацію до онколога у КНП «Міська клінічна лікарня № 4» м. Дніпро звернулася пацієнтка С., 1961 р.н. з підозрою на злоякісну пухлину лівої легені. При подальшому обстеженні, за даними мультиспіральної комп’ютерної томографії (МСКТ), виявлено новоутворення 50х37 мм в парацентральній зоні верхньої частки лівої легені, з ознаками метастазування в обидві легені (дрібновогнищеві тіні: справа в С6 — вогнище 5х5 мм, зліва в С2 — утворення 10х6 мм, в С3 — вогнище 5х5 мм). Також виявлена медіастинальна лімфаденопатія: 4L (лівий паратрахеальний нижній лімфовузол) — 14х13 мм, № 5 (парааортальний лімфовузол 17х13 мм). Діагноз верифікований шляхом трансторакальної трепан-біопсії (08.04.21) гістологічно та імуногістохімічно (ІГХ) (ПГЗ № 21SP049213 від 14.04.2021 р. — аденокарцинома ацинарної будови в тканині легені). Молекулярне дослідження від 27.04.2021 р. № 21MOL002518 — виявлена мутація в 19ex гена EGFR; № 21CN006356 — високопозитивна експресія PD-L1 (60%); № 21CN006355 — не виявлено мутацій Alk, Ros-1. Рішенням онкокомісії хворій встановлений діагноз: недрібноклітинний неплоскоклітинний (EGFR 19 ex+) рак верхньої частки лівої легені сТ4 cN2 cМ 1а (pulm), ІVА стадії і рекомендовано проведення курсу таргетної терапії EGFR-TKI.
На першому етапі хвора отримувала таргетну терапію EGFR-TKI 1-го покоління (гефітиніб у дозі 250 мг/добу) протягом 4 міс. У подальшому у зв’язку з розвитком побічних ефектів терапії у вигляді дерматологічної токсичності 2 ст., хвора відмовилася від цього препарату. Таргетне лікування потім проводилося протягом 11 міс з використанням EGFR-TKI 3-го покоління (осимертиніб у дозі 80 мг/добу). Протягом лікування осимертинібом у пацієнтки зафіксовано наступні небажані явища: слабкість 1-го ступеня (наявна на фоні всього лікування), діарея 1-го ступеня — з 4-го тижня, періодично. Серйозних побічних ефектів не зареєстровано.
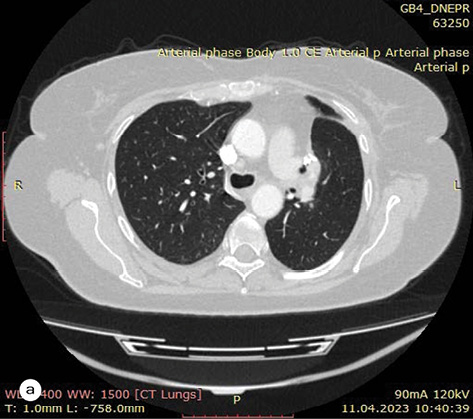
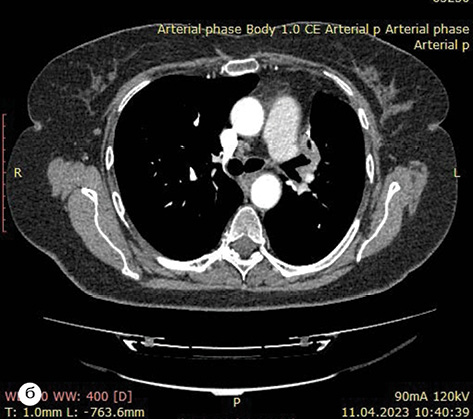
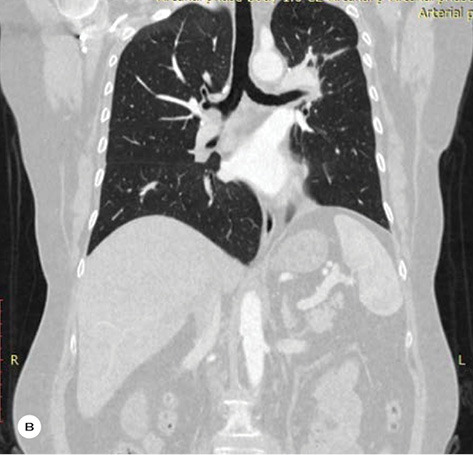
За результатами контрольного КТ-обстеження відмічена суттєва позитивна динаміка. Згідно з даними МСКТ від 27.10.2022 р. первинна пухлина верхньої частки лівої легені зменшилася до 35х18х28 мм, відсутня значима медіастинальна лімфаденопатія (–36% за Recist 1.1.) (рис. 1а–б). Також не виявлено описаних раніше дрібновогнищевих тіней у легенях, які були розцінені як метастази.
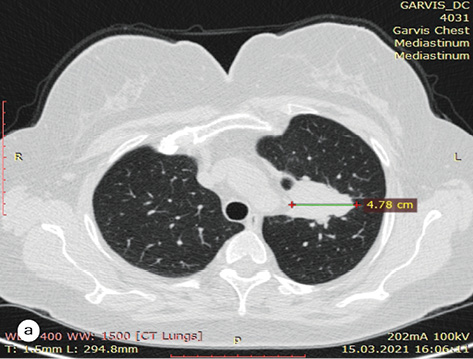
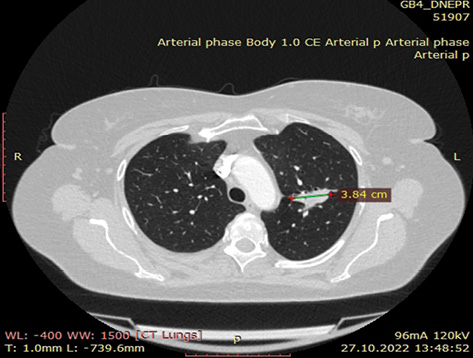
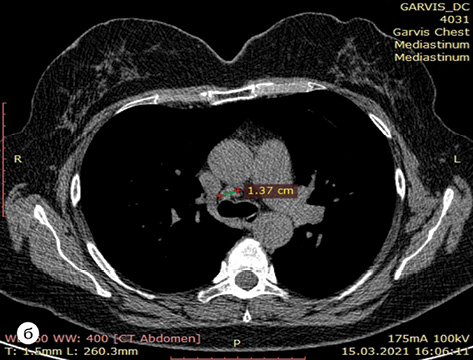
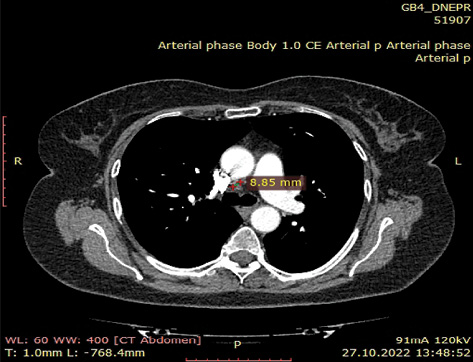
Випадок 07.11.2022 р. розглянутий на онкокомісії — враховуючи позитивну динаміку від проведеного таргетного лікування протягом 15 міс, відсутність достовірних (морфологічно підтверджених) даних щодо віддалених метастазів — рекомендовано проведення радикального оперативного втручання. Хвора обстежена клінічно та лабораторно. Із супутньої патології: гіпертонічна хвороба ІІ ст. Артеріальна гіпертензія І ст. Гіпертензивне серце (гіпертрофія лівого шлуночка — ГЛШ). Ішемічна хвороба серця (ІХС), кардіосклероз дифузний. Порушення ритму за типом передсердної екстрасистолії. НБПНПГ. НТК ІІ ст. НМК І ст. Аневризма МПП. СН стадія А, зі збереженою систолічною функцією ЛШ (ФВ 63%). ССР3.
Хворій 16.11.2022 р. виконана радикальна операція: торакотомія зліва, верхня лобектомія з медіастинальною лімфаденектомією. При операційній ревізії виявлено: пухлина розміщена в прикореневій зоні верхньої частки, розміром до 2 см в Д, з вираженим фіброзом в оточуючій легеневій тканині. Внутрішньогрудні лімфатичні вузли візуально не збільшені. Пухлина видалена повністю, також видалені лімфатичні вузли: аортопульмонального вікна, нижні паратрахеальні та біфуркаційні. Ускладнень під час операції та в періопераційний період не відмічено. Хвора виписана з відділення в задовільному стані на 7-му добу після операції.
Патоморфологічне дослідження операційного препарату № 38173-87/22 від 21.11.2022 р. — операційний препарат: легеня — пухлина 15х15х8 мм у діаметрі — аденокарцинома високого та помірного диференціювання з ЛП переважно 2-го ст. (ділянками ЛП 3–4 ст. та 1 ст.). Край резекції бронху та у всіх видалених лімфовузлах — росту пухлини немає. ІГХ від 25.11.2022 р. — помірнодиференційована ацинарна аденокарцинома легені, EGFR, Alk — негат., PD-L1 — негат.
Деталі патоморфологічного дослідження
Для морфологічних досліджень застосовували 10% розчин нейтрального формаліну, який забезпечує задовільну фіксацію шматочків тканин і окремих клітин. Основні етапи гістологічної обробки: фіксація біоптатів; дегідратація (зневоднення об’єктів в абсолютизованому ізопропанолі) і заливка в парапласт; приготування зрізів товщиною 4–5 мкм; забарвлення препаратів гематоксилін-еозином. Вивчали і фотографували гістологічні препарати під мікроскопом Zeiss «Primo Star», фотокамерою DCM 500. Також виконувалося ІГХ-дослідження отриманих зразків. Для вивчення біологічних властивостей резидуальної пухлини використовувалися антитіла до AE1/AE3; CK7; TTF; Napsin A; CK5/6; P40; GATA-3; ALK; PD-L1; bcl-2 alfa; p53; EGFR; Ki67. Для встановлення характеру запального інфільтрату — моноклональні мишачі антитіла до CD3, CD20, CD45, CD56, CD68 (Thermo Scientific, США) у рекомендованих виробником розведеннях. Для встановлення стану пухлинної строми і судин у якості первинних антитіл використовували SMA, CD31, CD34, D2-40 (Thermo Scientific, США). Для ІГХ-дослідження зрізи товщиною 4 мкм наносилися на адгезивні предметні скельця Super Frost Plus. Після стандартної депарафінізації і дегідратації проводили демаскування антигенних детермінант у цитратному буфері з рН=6,0 в Thermo Scientific РТ модулі при температурі 100 °С протягом 20 хв. Надалі зрізи інкубували у вологих камерах з первинними антитілами впродовж 45 хв. Для виявлення реакції використовували полімерну систему візуалізації Quanto (Termo Scientific, США) з хромогеном 3-діамінобензидин тетрахлорид (DAB) (Termo Scientific, США). Зрізи також дофарбовували гематоксиліном.
Патоморфологічна картина
Для патоморфологічного дослідження доставлена верхня частка лівої легені з щільним утворенням округлої форми, розміром 15х15х8 мм, розміщеним у прикореневій зоні. Пухлина була сіруватого кольору, з нечіткими контурами та помірним фіброзом оточуючої легеневої тканини, без проростання у вісцеральну плевру. Окремо доставлене ущільнення до 10 мм з верхньої частки легені та внутрішньогрудні лімфовузли.
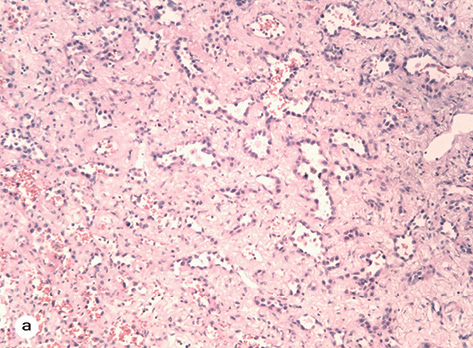
При гістологічному дослідженні близько 70% об’єму пухлини складала тканина з альвеолоподібними залозами (див. рис. 1а). Епітелій залоз був одношаровим низьким, подекуди — сплощеним. Клітини епітелію були бідні на цитоплазму, з поліморфними, гіперхромними, різновеликими ядрами, нагадували альвеолоцити 1-го і 2-го типу. Фігур мітозу в ядрах клітин практично не виявлено. Строма пухлини була дуже розвиненою, бідною на клітини, з фрагментацією волокнистих структур і вираженим плазматичним просочуванням.
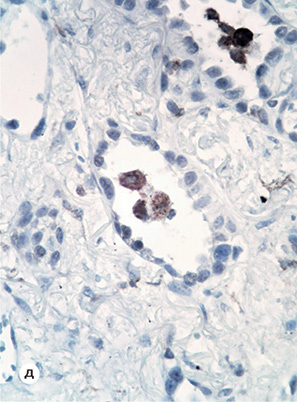
У центральних відділах новоутворення відмічено поля значного пошкодження пухлини (до 15% паренхіми) з відсутністю епітеліального компонента, з різноманітними дистрофічними змінами строми та апоптозом клітин. У цій зоні також виявлено поля фіброзу з відкладеннями темного пігменту, скупченням гігантських багатоядерних клітин (~5% об’єму пухлини). Одночасно визначена невелика ділянка (до 10% загального об’єму) з незначним пошкодженням пухлини, де аденокарцинома мала помірне диференціювання з вираженими дистрофічними змінами епітелію, нерівномірно розвиненою стромою та її плазматичним просочуванням. По краю резекції бронха й у видалених лімфатичних вузлах пухлинного росту не виявлено. Окремо доставлене утворення верхньої частки (до 10 мм), яке розцінювалося як метастаз первинної пухлини, мало будову «запальної псевдопухлини» з макрофагально-лімфоїдною інфільтрацією.
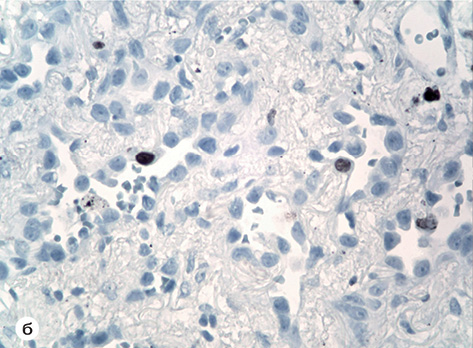
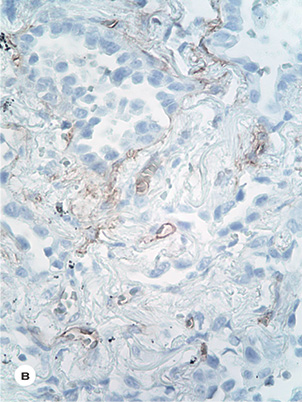
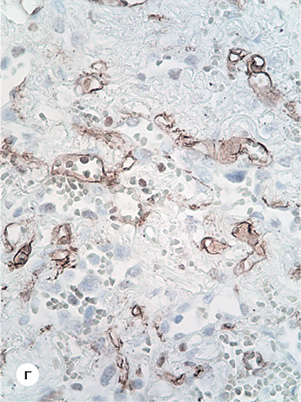
При ІГХ-дослідженні у всіх ділянках пухлини Ki-67+ виявлені поодинокі клітини епітелію (3–4%) (рис. 1б). Експресія EGFR в епітелії пухлини на усіх досліджених ділянках була відсутня. Проте відмічена помірна експресія EGFR в ендотелії капілярів і слабка експресія у стромальних елементах пухлини (рис. 1в). Ендотелій капілярів експресував CD31 і CD34 антигени (рис. 1г). Характерно, що AE1/AE3+ і Napsin A+ були наявні практично у 100% клітин пухлини; позитивна реакція CK7 і TTF також виявлена у більшості пухлинних клітин. Одночасно експресія GATA-3; ALK; PD-L1 у новоутворенні була відсутньою; позитивна реакція bcl-2 alfa відмічена лише в поодиноких клітинах пухлини, а позитивна реакція p53 — у 2–7% клітин і лише в окремих ділянках. Експресія CK5/6+ виявлена у 12–15% клітин пухлини; P40 — позитивна реакція коливалася в широких межах: з 15% до 70% клітин і відмічена в нечисленних ділянках.
Запальний інфільтрат строми пухлини був мінімальним, нерівномірним та дифузним. Середня кількість CD45+ лейкоцитів становила 8±2,1 в полі зору (при збільшенні ×400), при цьому до 70% клітин становили CD3+ Т-лімфоцити. CD20+ і CD56+ NK клітини були нечисленними. Також у невеликій кількості відмічені CD68+ макрофаги, які розміщувалися майже виключно в просвіті альвеолоподібних пухлинних залоз (див. рис. 1).
Обговорення отриманих результатів
Одразу слід зазначити, що це клінічне спостереження не є результатом свідомого застосування таргетної терапії EGFR-TKI у якості варіанта індукційного етапу комплексного лікування резектабельного НДРЛ. Таргетна терапія призначена згідно з рекомендаціями National Comprehensive Cancer Network (NCCN) та European Society for Medical Oncology (ESMO), орієнтуючись на встановлену за даними МСКТ генералізовану IVA ст. онкопроцесу з метастазами в обидві легені. І лише зафіксований «downstaging» пухлини за результатами контрольної МСКТ дозволив змінити лікувальну тактику та запропонувати радикальне оперативне втручання хворій.
Аналіз клінічного випадку та отриманих результатів лікування свідчать насамперед про досягнуту високу ефективність таргетної терапії EGFR-TKI ІІІ покоління для EGFR-позитивного НДКР легені на передопераційному етапі.
Про ефективність цього підходу свідчать клінічні дані: нормалізація загального стану пацієнтки, відсутність суттєвих побічних явищ під час терапії EGFR-TKI ІІІ покоління. Також очевидним є достовірний позитивний ефект у відношенні первинної пухлини та межистінних лімфатичних вузлів, який реєструвався за даними МСКТ і становив до 36% за Recist 1.1.
Цікавими вбачаються отримані дані інтраопераційної ревізії пухлини та її патоморфологічного дослідження, особливо порівняно з «традиційними» пошкодженнями після цитотоксичної хіміотерапії як стандартного підходу на сьогодні при лікуванні місцево-поширеного НДРЛ.
Безумовно, слід відмітити суттєву «щільність» первинної пухлини та помірну вираженість фіброзу в її зоні, які відмічені під час операційної ревізії. Порівняно з «хіміотерапевтичним» фіброзом, останній був більш «м’яким», не викликав «втягнення» в перипроцес часткових та сегментарних судин, вісцеральної плеври. Тому мобілізація судин і бронхів під час втручання не викликала суттєвих труднощів. Також не відмічено значного фіброзу в зоні кореня легені та локалізації лімфатичних вузлів межистіння, що сприяло адекватності і безпеці лімфаденектомії. Крововтрата під час операції не перевищила 130 мл. Також без ускладнень був перебіг післяопераційного періоду — дренажі з плевральної порожнини видалені на 3-тю добу, рана зажила первинним натягом.
У результаті проведеного патоморфологічного дослідження описані особливості терапевтичного «таргетного» патоморфозу пухлини, та одночасно зафіксовано високий ступінь пошкодження новоутворення. Гістологічна картина відповіді пухлини на лікування характеризувалася наявністю ділянок пошкодження різного ступеня тяжкості. Поряд з тим також виявлена гетерогенність будови і клітинного складу резидуальної пухлини, що не відповідає традиційним уявленням про хіміотерапевтичний патоморфоз пухлини. У наших спостереженнях відмічено формування полів з альвеолярним патерном і дуже низькою (3–4%) проліферативною активністю. Подібні зміни відомі як індукована терапією адаптація і еволюція раку легені. Альвеолярна сигнатура, що активується в ракових клітинах, призводить до відновлення та уникнення загибелі клітин під час лікування, забезпечує стійкість ракових клітин, у той же час створюючи менш агресивний злоякісний стан, і пов’язана з покращеною виживаністю пацієнтів [11]. Це узгоджується з уявленням про те, що клітини резидуальної пухлини знаходяться у персистуючому стані із повільним циклом та виживають без швидкої проліферації [12]. Наявність ділянок з ІГХ-ознаками плоскоклітинного диференціювання (до 15% клітин пухлини) може свідчити про трансформацію її у плоскоклітинний рак, що вважається механізмом набуття резистентності до інгібіторів EGFR [13, 14].
Виявлена нами відсутність експресії EGFR в епітелії резидуальної пухлини може свідчити про значне інгібування мутантного рецептора внаслідок терапії інгібіторами EGFR, що зумовлює зниження проліферативної активності пухлини, формування ділянок пошкоджень різного ступеня тяжкості, зменшення об’єму пухлини [11, 15]. Описана нами помірна експресія EGFR в ендотелії капілярів і слабка експресія у стромальних елементах може свідчити про наявність EGFR дикого типу в цих клітинах.
Експресія CD-34 в ендотелії судин, з нашої точки зору, свідчить про незрілість ендотелію і наявність процесів репарації в «залишковій» пухлині. Максимальна експресія CD-34 виявлена в ендотелії капілярів та інтерстиції периферичних ділянок новоутворення. У цих же ділянках відмічена дуже виражена експресія SMA, причому були відсутні ознаки проліферативної активності клітин. Виявлені феномени можуть свідчити на користь трансформації прогеніторних циркулюючих CD34+ клітин в ендотелій і міофібробласти, за рахунок чого регенерують строма і судини пухлини [16–18].
Цікавим також вбачається факт зникнення експресії PD-L1 клітинами пухлини, яка до лікування була високопозитивною (60%). Це може свідчити про значні імунологічні зрушення в пухлині, однак потребує подальших досліджень.
Запальний інфільтрат у дослідженій нами пухлині представлений переважно Т-лімфоцитами і дуже малою кількістю макрофагів. Такий його варіант відповідає характеру інфільтрату для встановлення більш ефективної імунологічної відповіді в резидуальній пухлині при таргетній терапії, що було продемонстровано в дослідженнях A. Maynard та співавторів [11]. Цей «запальний стан» може являти собою доповнення до альвеолярного патерну гістологічної будови резидуальної пухлини. Індукція більш імуностимулюючого фенотипу під час таргетної терапії, на думку вищезгаданих авторів, обґрунтовує потенційні комбінації таргетної терапії TKI-EGFR та імунотерапії для лікування НДРЛ на ранніх стадіях, до встановлення рецидиву пухлини при тривалому лікуванні EGFR-TKI.
У подальшому, з 29.11.2022 до 03.02.2023 р., хворій проведено 4 курси адʼювантної поліхіміотерапії (ПХТ) (карбоплатин+пеметрексед), і з 10 лютого 2023 р. отримує адʼювантну таргетну терапію осимертинібом у дозі 80 мг щоденно. Ускладнень та серйозних небажаних явищ при проведенні як ПХТ, так і таргетної терапії не виявлено.
На сьогодні пацієнтка С. перебуває під наглядом онколога КНП «Міська клінічна лікарня № 4». За результатами контрольного клінічного та КТ-обстеження від 11 квітня 2023 р. даних щодо рецидиву чи пролонгації хвороби не відмічено.
У цілому хвора перебуває під наглядом протягом 32 міс, з яких індукційна таргетна терапія становила 15 міс, адʼювантна ПХТ — 3 міс і протягом 7 міс проводиться адʼювантне таргетне лікування.
Таким чином, аналізуючи отримані нами результати, слід зазначити, що таргетна терапія EGFR-TKI ІІІ покоління місцево-поширеного EGFR-позитивного неплоскоклітинного раку легені є ефективним методом індукційного впливу, має свої особливості як у клінічному, так і в патоморфологічному аспекті і потребує подальших клінічних досліджень.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Ganti, A. K., Klein, A. B., Cotarla, I., Seal, B., & Chou, E. (2021). Update of Incidence, Prevalence, Survival, and Initial Treatment in Patients With Non–Small Cell Lung Cancer in the US. JAMA Oncol., 7(12), 1824–1832. doi: 10.1001/jamaoncol.2021.4932.
2. Shukla, A. A., Podder, S., Chaudry, S. R., Benn, B. S., & Kurman, J. S. (2022). Non-small cell lung cancer: epidemiology, screening, diagnosis, and treatment. AIMS Medical Science, 9(2), 348–361. doi: 10.3934/medsci.2022016.
3. Herbst, R. S., Wu, Y. L., John, T., Grohe, C., Majem, M., Wang, J., … Tsuboi, M. (2023). Adjuvant Osimertinib for Resected EGFR-Mutated Stage IB-IIIA Non-Small-Cell Lung Cancer: Updated Results From the Phase III Randomized ADAURA Trial. J Clin Oncol., 41(10), 1830–1840. doi: 10.1200/JCO.22.02186.
4. Grohé, C., Tsuboi, M., Wu, Y., John, T., Kato, T., Majem, M., … Herbst, R. S. (2023). Osimertinib as adjuvant therapy in patients with resected EGFRm stage IB-IIIA NSCLC: updated results from ADAURA. Pneumologie, 77, S17–S17.
5. Tsuboi, M., Herbst, R. S., John, T., Kato, T., Majem, M., Grohé, C., … Wu, Y. L. (2023). Overall survival with osimertinib in resected EGFR-mutated NSCLC. New England Journal of Medicine.
6. Deslypere, G., Gullentops, D., Wauters, E., & Vansteenkiste, J. (2018). Immunotherapy in non-metastatic non-small cell lung cancer: Can the benefits of stage IV therapy be translated into earlier stages? Therapeutic Advances in Medical Oncology, 10, 1758835918772810.
7. Saw, S. P. L., Ong, B. H., Chua, K. L. M., Takano, A., & Tan, D. S. W. (2021). Revisiting neoadjuvant therapy in non-small-cell lung cancer. Lancet Oncol., 22(11), e501–e516. doi: 10.1016/S1470-2045(21)00383-1.
8. Tsuboi, M., Weder, W., Escriu, C., Blakely, C., He, J., Dacic, S., … Chaft, J. E. (2021). Neoadjuvant osimertinib with/without chemotherapy versus chemotherapy alone for EGFR-mutated resectable non-small-cell lung cancer: NeoADAURA. Future Oncol., 17(31), 4045–4055. doi: 10.2217/fon-2021-0549.
9. Soria, J. C., Ohe, Y., Vansteenkiste, J., Reungwetwattana, T., Chewaskulyong, B., Lee, K. H., … Ramalingam, S. S. (2018). FLAURA Investigators. Osimertinib in Untreated EGFR-Mutated Advanced Non-Small-Cell Lung Cancer. N. Engl. J. Med., 378(2), 113–125. doi: 10.1056/NEJMoa1713137.
10. Wu, Y. L., Tsuboi, M., He, J., John, T., Grohe, C., Majem, M., … Herbst, R. S. (2020). ADAURA Investigators. Osimertinib in Resected EGFR-Mutated Non-Small-Cell Lung Cancer. N. Engl. J. Med., 383(18), 1711–1723. doi: 10.1056/NEJMoa2027071.
11. Maynard, A., McCoach, C. E., Rotow, J. K., Harris, L., Haderk, F., Kerr, D. L., … Bivona, T. G. (2020). Therapy-Induced Evolution of Human Lung Cancer Revealed by Single-Cell RNA Sequencing. Cell., 182(5), 1232–1251. doi: 10.1016/j.cell.2020.07.017.
12. Hata, A., Niederst, M., Archibald, H., Gomez-Caraballo, M., Siddiqui, F. M., Mulvey, H. E., … Engelman, J. E. (2016). Tumor cells can follow distinct evolutionary paths to become resistant to epidermal growth factor receptor inhibition. Nat. Med., 22, 262–269. doi.org/10.1038/nm.4040.
13. Izumi, H., Yamasaki, A., Ueda, Y., Sumikawa, T., Maeta, H., Nakamoto, S., & Shimizu, E. (2018). Squamous cell carcinoma transformation from EGFR-mutated lung adenocarcinoma: a case report and literature review. Clinical lung cancer, 19(1), e63–e66. doi.org/10.1016/j.cllc.2017.10.005.
14. Jukna, A., Montanari, G., Mengoli, M. C., Cavazza, A., Covi, M., Barbieri, F., … Rossi, G. (2016). Squamous cell carcinoma «transformation» concurrent with secondary T790M mutation in resistant EGFR-mutated adenocarcinomas. Journal of Thoracic Oncology, 11(4), e49–e51. doi.org/10.1016/j.jtho.2015.12.096.
15. Dominguez, C., Tsang, K. Y., & Palena, C. (2016). Short-term EGFR blockade enhances immune-mediated cytotoxicity of EGFR mutant lung cancer cells: rationale for combination therapies. Cell Death, Dis 7, e2380. doi.org/10.1038/cddis.2016.297.
16. Baranov, І. V., Nor, N. M., Slesarenko, S. V., Badiul, P. О., & Tsyhankov, К. V. (2020). Morphological features of skin scars on the background of treatment with autologous adipocytes. Medicni Perspektivi, 25(3), 96–104. doi.org/10.26641/2307-0404.2020.3.214822.
17. Zhang, Y., & Dong, E. (2014). New insight into vascular homeostasis and injury-reconstruction. Sci. China Life Sci., 57, 739–741. doi.org/10.1007/s11427-014-4719-x.
18. Wu, H., Chen, H., & Hu, P. C. (2007). Circulating endothelial cells and endothelial progenitors as surrogate biomarkers in vascular dysfunction. Clin Lab., 53(5–6), 285–295. pubmed.ncbi.nlm.nih.gov/17605403














Leave a comment