Індоціанін зелений у практиці онкохірурга (огляд літератури)
Хоптяна О.І., Добржанський О.Ю.
Резюме. Індоціанін зелений (ІЗ) відомий своєю спроможністю флуоресцентно фарбувати тканини та став предметом зростаючого інтересу у сфері онкохірургії. Його використання для покращання виявлення необхідних анатомічних структур та точної локалізації пухлин являє собою перспективну стратегію, що дозволяє хірургам окреслювати і прецизійно видаляти злоякісні утворення, знижуючи ризик пошкодження здорових тканин та поліпшуючи онкологічні результати. Мета. Головною метою цього дослідження є систематичний огляд та аналіз показань та обмежень використання ІЗ в лікуванні онкогінекологічної патології, а також злоякісних новоутворень шлунка та стравоходу. Огляд спрямований на оцінку потенційного впливу ІЗ на покращання діагностичних маніпуляцій та хірургічних втручань при злоякісних онкологічних захворюваннях жіночої статевої системи, а також злоякісних пухлинах шлунка та стравоходу. Висновки. На основі проведеного аналізу медичної літератури встановлено, що використання ІЗ в онкохірургії сприяє поліпшенню візуалізації анатомічних структур під час хірургічних втручань. Його використання є безпечним для пацієнтів, хоча і може супроводжуватися деякими побічними ефектами. Використання ІЗ під час онкохірургічних втручань допомагає покращити онкологічні результати та не впливає на рівень післяопераційних ускладнень та летальності. Проте необхідні додаткові проспективні дослідження для визначення оптимальних схем використання та для оцінки максимальної користі та безпеки для пацієнтів.
Одержано 31.10.2023
Прийнято до друку 10.11.2023
DOI: 10.32471/clinicaloncology.2663-466X.51-3.31190
Вступ
ІЗ — барвник, який володіє властивістю флуоресценції, тобто здатністю світитися під впливом світла певної довжини хвилі. Ця особливість ІЗ робить його об’єктом використання у великій кількості клінічних досліджень та різних галузях, таких як біологія, медицина, фармація та хімія. ІЗ, також відомий як «малахітова зелень», уперше синтезований у 1860 р. в результаті реакції бензальдегіду з ацетофеноном за наявності кальцію. У 1956 р. Управління з контролю за харчовими продуктами та лікарськими засобами США (Food and Drug Administration — FDA) затвердили використання ІЗ у клінічній практиці [1].
Механізм світіння ІЗ пов’язаний із механізмом флуоресценції. Спочатку ІЗ поглинає фотони світла в результаті взаємодії із світлом певної довжини хвилі. У медицині для активування флуоресценції ІЗ використовують світло, близьке до інфрачервоного (Near InfraRed — NIR), оскільки барвник має високу поглинаючу здатність у цьому діапазоні хвиль. Коли ІЗ поглинає фотони світла, електрони в молекулі барвника переходять на вищі енергетичні рівні. Перебуваючи у стані збудження, електрони з часом повертаються на свої вихідні низькі енергетичні рівні. При цьому вони випромінюють фотони світла, які мають довжину хвилі, характерну для ІЗ. Ці фотони утворюють флуоресцентне світло, яке може бути зафіксоване та виміряне за допомогою спеціального обладнання, такого як флуоресцентний спектрофотометр. Інтенсивність флуоресценції ІЗ зазвичай залежить від його концентрації в розчині, часу взаємодії зі світлом, властивостей середовища та інших факторів.
ІЗ в онкогінекології
Найчастіше в практиці онкогінеколога для виявлення сторожового лімфатичного вузла (СЛВ) використовували 3 барвники: ІЗ, радіоактивного колоїду технецію (Тс-99m) і синього барвника, у комбінації один з одним або самостійно. У проспективному дослідженні FILM (Fluorescence Imaging for Lymphatic Mapping), в якому охоплено пацієнток із раком шийки матки (РШМ) та раком ендометрія, порівняли результати лікування з використанням ІЗ та ізосульфану синього. Двобічне картування лімфатичних вузлів відбулося у 78 та 31% випадків із використанням ІЗ та синього барвника відповідно [2].
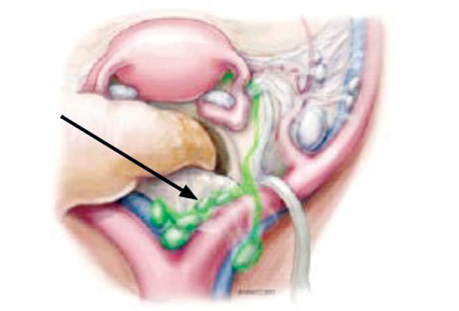
Для виявлення СЛВ у пацієнтів із раком ендометрія та РШМ використовують алгоритм 2013 р., розроблений командою в Меморіальному онкологічному центрі ім. Слоуна — Кеттерінга (Memorial Sloan Kettering Cancer Center) Національної мережі багатопрофільних онкологічних закладів США (National Comprehensive Cancer Network — NCCN; 2024) (рис. 1–3).

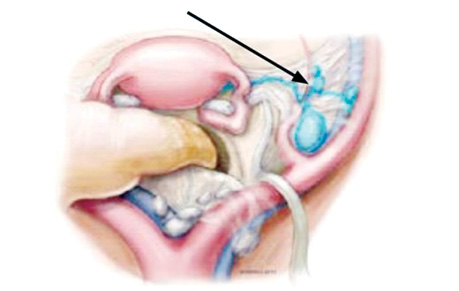
Рак ендометрія. Оцінка стану лімфатичних вузлів у пацієнток із раком ендометрія є важливим етапом хірургічного втручання, що впливає на тактику подальшого ад’ювантного лікування. Системна лімфодисекція не виявила переваги в загальній виживаності серед пацієнток, у яких відсутня рентгенологічно встановлена тазова лімфаденопатія, а біопсія СЛВ стала альтернативою [3, 4]. На сьогодні найкращим вибором для виявлення СЛВ при раку ендометрія залишається ІЗ, що виявив високу чутливість у 97% та негативну прогностичну цінність у 99,6% [2, 5]. Використання ІЗ для виявлення та біопсії СЛВ рекомендовано для пацієнток із раком ендометрія проміжної, високо-проміжної та високої груп згідно із рекомендаціями Європейської асоціації онкологів-гінекологів (European Society of Gynaecological Oncology — ESGO) [6]. У 2023 р. медична спільнота отримала результати дослідження, яке мало на меті оцінити довгострокові результати виживаності пацієнток високої групи ризику з раком ендометрія, яким виконано біопсію або лише біопсію СЛВ, або системну лімфодисекцію. За результатами дослідження безрецидивна виживаність у групі, де проведено біопсію СЛВ, становила 85,2%, а в групі системної лімфодисекції — 82,8%, що не має статистично значущої різниці [7]. Враховуючи онкологічну безпеку та низький рівень ризику розвитку лімфедем, а також кращий рівень життя пацієнток, яким проведено біопсію СЛВ з використанням ІЗ, — методику можливо активно використовувати у пацієнток із раком ендометрія (рис. 4, 5).
РШМ. ІЗ активно використовують для виявлення та біопсії СЛВ у пацієнток із РШМ. Алгоритм дій аналогічний тому, який використовують і при виявленні СЛВ у пацієнток із раком ендометрія (див. рис. 1–3). Цю процедуру виконують у пацієнток із Т1а1 стадією та позитивною лімфоваскулярною інвазією. У пацієнток із T1b1, T1b2, та T2a1 стадіями проводиться оцінка лімфатичних вузлів як 1-й крок у хірургічному лікуванні шляхом виявлення СЛВ із використанням ІЗ (рис. 6).
У дослідженні А. Buda та співавторів встановлено, що частота виявлення СЛВ становить 97, 89 і 100% із використанням радіоколоїду із синім барвником, синього барвника самостійно та ІЗ відповідно [8]. ІЗ можна використовувати в органозберігаючому лікуванні пацієнток на початкових стадіях РШМ з метою визначення СЛВ. Рекомендовано виявлення СЛВ із ультрастадіюванням [9].
Рак вульви. Виявлення уражених лімфатичних вузлів залишається найбільш важливим прогностичним фактором для оцінки загальної та безрецидивної виживаності пацієнток із раком вульви. Картування СЛВ увійшло в стандарти лікування раку вульви на ранніх стадіях після оприлюднених результатів досліджень Gynecologic Oncology Group (GOG)-173 та GROningen International Study on Sentinel nodes in Vulvar cancer (GROINSS V), у яких зафіксовані низькі показники хибнонегативних результатів у пацієнток, яким виконано біопсію СЛВ порівняно з паховою лімфаденектомією [10].
Для уніфокальних пухлин розмірами до 4 см без клінічно значущих (за даними комп’ютерної томографії/магнітно-резонансної томографії) лімфатичних вузлів рекомендовано виконання СЛВ згідно з оновленими стандартами ESGO [11]. В одному із досліджень встановлено ефективність виявлення СЛВ при використанні ізотопів/ІЗ порівняно з ізотопами/синім барвником [12]. Так, ІЗ доповнює радіоактивний провідник (Тс99) у лікуванні раку вульви, які є обов’язковими для проведення маркування СЛВ.
ЗАСТОСУВАННЯ ІЗ В ХІРУРГІЇ РАКУ ШЛУНКА
Навігація СЛВ. Він є 1-м дренуючим вузлом злоякісної пухлини шлунка. За умови, що 1-й дренуючий лімфатичний вузол є не ураженим метастазами, усі інші також вважаються негативними.
Нещодавно запропоновано флуоресценцію ІЗ в NIR як рішення для подолання факторів, пов’язаних з радіоактивними індикаторами та іншими барвниками, зокрема з їх вартістю, ятрогенними ефектами та простотою у використанні. Варто зауважити, що 1-ше використання ІЗ застосовано для виявлення СЛВ на ранніх стадіях раку шлунка [13]; відтоді його використання надзвичайно розширилося. Враховуючи його хорошу тропність до структур лімфатичної системи та низьку частоту розвитку алергічних реакцій, він вважається препаратом вибору серед інших барвників, таких як метиленовий синій та ін. У систематичному огляді та метааналізі 2014 р., проведеного L. Xiong та співавторами, зафіксовано підвищення частоти виявлення СЛВ і покращання чутливості методу з використанням ІЗ як альтернативи звичайним барвникам, незважаючи на відносну неоднорідність серед досліджень, включених до метааналізу. Тенденцію у використанні ІЗ оцінено позитивно з точки зору технологічного прогресу, і очікуються результати майбутніх досліджень. Щодо результатів біопсії СЛВ під контролем ІЗ у встановленні поширення раку шлунка, рівень виявлення становив 100%, незважаючи на чутливість у 84% [14]. У сучасній медичній літературі доведено позитивну тенденцію в якості використання контрастних засобів, що може відображати вдосконалення технологічної складової.
Картування лімфатичних вузлів. ІЗ також використовувався як ефективний допоміжний засіб для лімфодисекції під час виконання гастректомії. Видалення достатньої кількості лімфатичних вузлів має важливе значення для правильного визначення стадії. У більшості клінічних рекомендацій вказано на необхідність видалення мінімум 16 регіонарних лімфатичних вузлів для патологічного дослідження і залишається бажаним видалити 30 або більше вузлів [15, 16]. За таких умов картування лімфатичних вузлів за допомогою ІЗ призводить до розпізнавання лімфатичних вузлів і лімфатичних шляхів та для допомоги у виконанні повної лімфодисекції. Для оцінки ефективності лімфаденектомії під контролем IЗ проведені ретроспективні дослідження з невеликими вибірками. У цих дослідженнях виявлено неоднозначні результати при деяких обмеженнях у проведених дослідженнях, зокрема труднощах з видаленням флуоресцентних груп, які зазвичай не входять до стандартної лімфодисекції D2 (тобто групи 13, 14v або 16a). Натомість у деяких дослідженнях зафіксовано більшу кількість видалених вузлів у певних групах під час лапароскопічних хірургічних операцій з використанням NIR ІЗ [17–20].
Нещодавнє проспективне дослідження I.G. Kwon та співавторів мало на меті оцінити результати роботизованої гастректомії у пацієнтів з I стадією раку шлунка, яким проведено флуоресцентну лімфографію з використанням NIR-зображення [21]. Отримані дані порівняно з історичними контрольними групами. Ендоскопічно введено 1,25 мг/мл розчину ІЗ у розчині для ін’єкцій у підслизовий шар шлунка за добу до операції. У групі пацієнтів NIR–ІЗ загалом видалено більшу кількість лімфатичних вузлів, а у 92,5% пацієнтів вилучено понад 30 лімфатичних вузлів. Кількість лімфатичних вузлів, видалених із флуоресцентно підсилених груп, була значно вищою, особливо в групах 2, 6, 7, 8 і 9, і всі метастатичні лімфатичні вузли були флуоресцентними. Автори припустили, що флуоресценція полегшить пошук вузлів під час патологічного дослідження. Цей метод гарантує інтраопераційну оцінку повноти лімфодисекції та дозволяє точніше діагностувати та визначити стадію захворювання, підтверджуючи гіпотезу про те, що флуоресцентна NIR-лімфографія відіграє вирішальну роль у діагностиці та встановленні стадії. Це може зумовити виявлення пацієнтів, у яких відбулася міграція стадії (тобто зміна прогностичної групи після перекласифікації стадії захворювання), для яких може бути корисним ад’ювантне лікування. Завдяки вищій чутливості та специфічності для метастатичних вузлів автори припустили, що в найближчому майбутньому можна буде виконувати персоналізовану лімфодисекцію відповідно до індивідуальних моделей лімфогенного метастазування первинної пухлини. Крім того, не встановлено відмінностей у післяопераційних ускладненнях [21].
ОЦІНКА ПЕРФУЗІЇ ТКАНИН З МЕТОЮ ПОПЕРЕДЖЕННЯ НЕСПРОМОЖНОСТІ АНАСТОМОЗУ
ІЗ також використовують для оцінки кровопостачання анастомозу як при тотальній, так і субтотальній гастректомії та езофагектомії. Незважаючи на останні досягнення, неспроможність анастомозу викликає серйозне занепокоєння у спеціалістів галузі хірургії шлунка. Частота неспроможностей анастомозу коливається від 2,1 до 14,6% у країнах Східної Європи і до 26% — Західної. Це є основною причиною смертності, пов’язаної з хірургічним втручанням (у діапазоні 0–50%), і призводить до несприятливих віддалених результатів [22]. На сьогодні суб’єктивна оцінка прогнозу вірогідності неспроможності анастомозу не є достовірною. Вона ґрунтується на оцінці натягу тканин зони анастомозу, правильному приляганні тканин та адекватній перфузії [23]. Проведено кілька досліджень для оцінки стравохідно-шлункового анастомозу шляхом спроби кількісної оцінки кровопостачання ділянки анастомозу за допомогою ІЗ, що свідчить про те, що флуоресцентну ангіографію можна використовувати для зниження частоти неспроможності анастомозу після езофагектомії [24–27]. Однак у маленької кількості досліджень оцінено езофагоєюнальний анастомоз за допомогою ІЗ.
Y. Huh та співавтори провели інше проспективне дослідження щодо лапароскопічної гастректомії [28]. 30 процедур (дистальна резекція з реконструкціями BI або BII, тотальна гастректомія з реконструкцією за Roux-en-Y та пілорусзберігаюча гастректомія) оцінювали за допомогою NIR-камери шляхом введення 2,5–5,0 мг/мл розчину ІЗ одразу після накладання анастомозу. Клінічну та флуоресцентну оцінки проводили за 2 шкалами оцінки шляхом призначення певної кількості балів за окремими параметрами. Клінічній оцінці на основі візуальних спостережень (темний, плямистий, рожевий вигляд, пульсація мезентеріальних судин і кровоточиві краї резекції) надано велику кількість балів для всіх процедур, а флуоресценцію виявлено у 100% пацієнтів із затримкою візуалізації 4,1±3,2 хв (діапазон 2–15) після ін’єкції IЗ. Хоча візуалізація ІЗ була визнана невдалою у 7 пацієнтів (23,3%), жодних змін у плані хірургічного втручання не було внесено; неспроможність анастомозу встановлено в одного пацієнта з високими клінічними балами та показниками флуоресценції. Автори підтвердили спроможність та відтворюваність методики, але дійшли консенсусу, що необхідне проведення подальших досліджень, щоб довести її ефективність і визначити відповідне дозування введеного ІЗ [28].
НАВІГАЦІЯ ПЕРИГАСТРАЛЬНИХ СУДИН
ІЗ може бути корисним у судинній навігації, оскільки він може ідентифікувати форму та рівень відходження малих судин, які можуть бути не виявлені під час передопераційних візуалізаційних досліджень. Товщина тканини не вважається проблемою для NIR, коли тканини мають товщину 2–4 см [29, 30]. У дослідженні М. Kim та співавторів лікарі використовували 2,5 мг/мл розчину ІЗ відразу після перев’язки правої шлунково-сальникової вени шляхом 20 послідовних ін’єкцій, проспективно проводячи роботизовані або лапароскопічні гастректомії. Мета цього дослідження полягала в тому, щоб оцінити наявність інфрапілоричної артерії, яку необхідно зберегти під час пілорусзберігаючої гастректомії, або додаткової селезінкової артерії, що виходять з лівої шлунково-сальникової артерії, щоб запобігти інфаркту нижнього полюсу селезінки. Інфрапілоричну артерію ідентифікували у 80% випадків із часом процедури менше <1 хв, а додаткову селезінкову артерію, якщо вона наявна, завжди легко ідентифікувати. Автори припустили, що ІЗ може бути корисним для недосвідчених хірургів під час інфрапілоричної дисекції та для скорочення тривалості операції, зменшення об’єму крововтрати та кількості ятрогенних травм [29].
У ретроспективному дослідженні J.H. Lee та співавторів 31 пацієнта зафіксовані переваги технології ІЗ для виявлення додаткової лівої печінкової артерії під час операції [30]. Автори оцінили ступінь флуоресценції поверхні печінки після того, як на артерії біля лівої частки був розміщений ендоскопічний затискач, припускаючи, що флуоресценція в основному залежить від артеріального кровотоку. Потім вони внутрішньовенно ввели 5 мг ІЗ, розведеного у 2 мл розчину для ін’єкцій, і оцінили флуоресценцію печінки. У разі зниження флуоресценції лівої частки затискач видаляли, а васкуляризацію повторно оцінювали за допомогою нової внутрішньовенної ін’єкції ІЗ. Відповідно до зон кровопостачання допоміжних артерій, візуалізованих за допомогою NIR–ІЗ, артерію було перев’язано у 20 пацієнтів і збережено у 10 пацієнтів, і не встановлено жодних відмінностей щодо інтраопераційних або післяопераційних результатів. Автори дійшли висновку, що додаткові ліві печінкові артерії можна безпечно перев’язати після оцінки NIR-флуоресценції, уникаючи потенційно тяжких ускладнень під час резекції шлунка [30].
ВИСНОВКИ
Використання ІЗ в онкохірургії є актуальним та перспективним напрямком у полі боротьби з онкологічними захворюваннями. Оцінюючи результати проведених клінічних досліджень, можна зробити декілька важливих висновків.
По-перше, ІЗ є високоефективним у виявленні СЛВ, дозволяючи хірургам не збільшувати об’єм хірургічних втручань. Це сприяє підвищенню точності операцій та зниженню ризику розвитку післяопераційних ускладнень.
По-друге, ІЗ є безпечним засобом для використання в клінічній практиці, маючи мінімальну токсичність та частоту побічних ефектів. Це робить його доступним для широкого кола хворих, зокрема пацієнтів похилого віку та осіб зі складними супутніми захворюваннями.
У підсумку використання ІЗ у сфері онкохірургії є перспективним напрямком, що сприяє підвищенню ефективності та безпеки операцій, а також покращенню якості життя пацієнтів. Інноваційний підхід може відкрити нові можливості для подолання онкологічних проблем і сприяти подальшому розвитку сучасної медицини.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Alander, J. T., Kaartinen, I., Laakso, A., Pätilä, T., Spillmann, T., Tuchin, V. V., Venermo, M., & Välisuo, P. (2012). A Review of indocyanine green fluorescent imaging in surgery. International Journal of Biomedical Imaging, 2012, 940585. doi.org/10.1155/2012/940585.
2. Frumovitz, M., Plante, M., Lee, P. S., Sandadi, S., Lilja, J. F., Escobar, P. F., … Abu-Rustum, N. R. (2018). Near-infrared fluorescence for detection of sentinel lymph nodes in women with cervical and uterine cancers (FILM): a randomised, phase 3, multicentre, non-inferiority trial. The Lancet Oncology, 19(10), 1394–1403. doi.org/10.1016/S1470-2045(18)30448-0.
3. Kitchener, H., Swart, A. M., Qian, Q., Amos, C., & Parmar, M. K. (2009). Efficacy of systematic pelvic lymphadenectomy in endometrial cancer (MRC ASTEC trial): a randomised study. The Lancet, 373(9658), 125–136. doi.org/10.1016/S0140-6736(08)61766-3.
4. Panici, P. B., Basile, S., Maneschi, F., Lissoni, A. A., Signorelli, M., Scambia, G., … Mangioni, C. (2008). Systematic pelvic lymphadenectomy vs no lymphadenectomy in early-stage endometrial carcinoma: Randomized clinical trial. Journal of the National Cancer Institute, 100(23), 1707–1716. doi.org/10.1093/jnci/djn397.
5. Rossi, E. C., Kowalski, L. D., Scalici, J., Cantrell, L., Schuler, K., Hanna, R. K., … Boggess, J. F. (2017). A comparison of sentinel lymph node biopsy to lymphadenectomy for endometrial cancer staging (FIRES trial): a multicentre, prospective, cohort study. The Lancet Oncology, 18(3), 384–392. doi.org/10.1016/S1470-2045(17)30068-2.
6. Concin, N., Matias-Guiu, X., Vergote, I., Cibula, D., Mirza, M. R., Marnitz, S., … Fagotti, A. (2020). ESGO/ESTRO/ESP guidelines for the management of patients with endometrial carcinoma. International Journal of Gynecological Cancer, 31(1), 12–39. doi: 10.1136/ijgc-2020-002230.
7. Capozzi, V. A., Rosati, A., Maglietta, G., Vargiu, V., Scarpelli, E., Cosentino, F., … Fanfani, F. (2023). Long-term survival outcomes in high-risk endometrial cancer patients undergoing sentinel lymph node biopsy alone versus lymphadenectomy. International Journal of Gynecological Cancer, 33(7), 1013–1020. doi.org/10.1136/ijgc-2023-004314.
8. Buda, A., Crivellaro, C., Elisei, F., Di Martino, G., Guerra, L., De Ponti, E., … Milani, R. (2016). Impact of Indocyanine Green for Sentinel Lymph Node Mapping in Early Stage Endometrial and Cervical Cancer: Comparison with Conventional Radiotracer 99mTc and/or Blue Dye. Annals of Surgical Oncology, 23(7), 2183–2191. doi.org/10.1245/s10434-015-5022-1.
9. Cibula, D., Raspollini, M. R., Planchamp, F., Centeno, C., Chargari, C., Felix, A., … Lindegaard, J. (2023). ESGO/ESTRO/ESP Guidelines for the management of patients with cervical cancer — Update 2023. International Journal of Gynecological Cancer, (5), 649–666. doi.org/10.1136/ijgc-2023-004429.
10. Oonk, M. H., van Hemel, B. M., Hollema, H., de Hullu, J. A., Ansink, A. C., Vergote, I., … van der Zee, A. G. (2010). Size of sentinel-node metastasis and chances of non-sentinel-node involvement and survival in early stage vulvar cancer: Results from GROINSS-V, a multicentre observational study. The Lancet Oncology, 11(7), 646–652. doi.org/10.1016/S1470-2045(10)70104-2.
11. Oonk, M. H. M., Planchamp, F., Baldwin, P., Mahner, S., Mirza, M. R., Fischerová, D., … Zapardiel, I. (2023). European Society of Gynaecological Oncology Guidelines for the Management of Patients with Vulvar Cancer — Update 2023. International Journal of Gynecological Cancer, 33(7), 1023–1043. doi.org/10.1136/ijgc-2023-004486.
12. Deken, M. M., van Doorn, H. C., Verver, D., Boogerd, L. S. F., de Valk, K. S., Rietbergen, D. D. D., … Gaarenstroom, K. N. (2020). Near-infrared fluorescence imaging compared to standard sentinel lymph node detection with blue dye in patients with vulvar cancer — a randomized controlled trial. Gynecologic Oncology, 159(3), 672–680. doi.org/10.1016/j.ygyno.2020.09.044.
13. Hiratsuka, M., Miyashiro, I., Ishikawa, O., Furukawa, H., Motomura, K., Ohigashi, H., … Koyama, H. (2001). Application of sentinel node biopsy to gastric cancer surgery. Surgery, 129(3), 335–340. doi: 10.1067/msy.2001.111699.
14. Xiong, L., Gazyakan, E., Yang, W., Engel, H., Hünerbein, M., Kneser, U., & Hirche, C. (2014). Indocyanine green fluorescence-guided sentinel node biopsy: a meta-analysis on detection rate and diagnostic performance. European Journal of Surgical Oncology, 40(7), 843–849. doi: 10.1016/j.ejso.2014.02.228.
15. Smith, D. D., Schwarz, R. R., & Schwarz, R. E. (2005). Impact of total lymph node count on staging and survival after gastrectomy for gastric cancer: data from a large US-population database. Journal of Clinical Oncology, 23(28), 7114–7124. doi: 10.1200/JCO.2005.14.621.
16. Son, T., Hyung, W. J., Lee, J. H., Kim, Y. M., Kim, H. I., An, J. Y., … Noh, S. H. (2012). Clinical implication of an insufficient number of examined lymph nodes after curative resection for gastric cancer. Cancer, 118(19), 4687–4693. doi: 10.1002/cncr.27426.
17. Romanzi, A., Mancini, R., Ioni, L., Picconi, T., & Pernazza, G. (2021). ICG-NIR-guided lymph node dissection during robotic subtotal gastrectomy for gastric cancer. A single-centre experience. International Journal of Medical Robotics, 17(2), e2213. doi: 10.1002/rcs.2213.
18. Kim, T., Kong, S., Park, J., Son, Y., Huh, Y., Suh, Y., … Yang, H. K. (2018). Assessment of the completeness of lymph node dissection using near-infrared imaging with indocyanine green in laparoscopic gastrectomy for gastric cancer. J. Gastric Cancer, 18(2), 161–171. doi: 10.5230/jgc.2018.18.e19.
19. Tajima, Y., Yamazaki, K., Masuda, Y., Kato, M., Yasuda, D., Aoki, T., … Kusano, M. (2009). Sentinel node mapping guided by indocyanine green fluorescence imaging in gastric cancer. Annals of Surgery, 249(1), 58–62. doi: 10.1097/SLA.0b013e3181927267.
20. Lan, Y., Huang, K., Chen, P., Liu, C., Lo, S., Wu, C., … Fang, W. L. (2017). A pilot study of lymph node mapping with indocyanine green in robotic gastrectomy for gastric cancer. SAGE Open Medicine, 5, 2050312117727444. doi: 10.1177/2050312117727444.
21. Kwon, I. G., Son, T., Kim, H., & Hyung, W. J. (2019). Fluorescent lymphography-guided lymphadenectomy during robotic radical gastrectomy for gastric cancer. JAMA Surgery, 154(2), 150–158. doi: 10.1001/jamasurg.2018.4267.
22. Makuuchi, R., Irino, T., Tanizawa, Y., Bando, E., Kawamura, T., & Terashima, M. (2019). Esophagojejunal anastomotic leakage following gastrectomy for gastric cancer. Surgery Today, 49(3), 187–196. doi: 10.1007/s00595-018-1726-8.
23. Protyniak, B., Dinallo, A. M., Boyan, W. P., Dressner, R. M., & Arvanitis, M. L. (2015). Intraoperative indocyanine green fluorescence angiography–an objective evaluation of anastomotic perfusion in colorectal surgery. American Surgeon, 81(6), 580–584. doi: 10.1177/000313481508100621.
24. Kitagawa, H., Namikawa, T., Iwabu, J., Fujisawa, K., Uemura, S., Tsuda, S., & Hanazaki, K. (2018). Assessment of the blood supply using the indocyanine green fluorescence method and postoperative endoscopic evaluation of anastomosis of the gastric tube during esophagectomy. Surgical Endoscopy, 32(4), 1749–1754. doi: 10.1007/s00464-017-5857-6.
25. Koyanagi, K., Ozawa, S., Oguma, J., Kazuno, A., Yamazaki, Y., Ninomiya, Y., … Tachimori, Y. (2016). Blood flow speed of the gastric conduit assessed by indocyanine green fluorescence: new predictive evaluation of anastomotic leakage after esophagectomy. Medicine (Baltimore), 95(30), e4386. doi: 10.1097/MD.0000000000004386.
26. Shimada, Y., Okumura, T., Nagata, T., Sawada, S., Matsui, K., Hori, R., … Tsukada, K. (2011). Usefulness of blood supply visualization by indocyanine green fluorescence for reconstruction during esophagectomy. Esophagus, 8(4), 259–266. doi: 10.1007/s10388-011-0291-7.
27. Ohi, M., Toiyama, Y., Mohri, Y., Saigusa, S., Ichikawa, T., Shimura, T., … Kusunoki, M. (2017). Prevalence of anastomotic leak and the impact of indocyanine green fluorescein imaging for evaluating blood flow in the gastric conduit following esophageal cancer surgery. Esophagus, 14(4), 351–359. doi: 10.1007/s10388-017-0585-5.
28. Huh, Y., Lee, H., Kim, T., Choi, Y., Park, J., Son, Y., … Yang, H. K. (2019). Efficacy of assessing intraoperative bowel perfusion with near-infrared camera in laparoscopic gastric cancer surgery. Journal of Laparoendoscopic & Advanced Surgical Techniques and Videoscopy, 29(4), 476–483. doi: 10.1089/lap.2018.0263.
29. Kim, M., Son, S., Cui, L., Shin, H., Hur, H., & Han, S. (2017). Real-time vessel navigation using indocyanine green fluorescence during robotic or laparoscopic gastrectomy for gastric cancer. Journal of Gastric Cancer, 17(2), 145–153. doi: 10.5230/jgc.2017.17.e17.
30. Lee, J. H., Son, T., Chung, Y. E., Cho, M., Kim, Y. M., Kwon, I. G., … Hyung, W. J. (2021). Real-time identification of aberrant left hepatic arterial territories using near-infrared fluorescence with indocyanine green during gastrectomy for gastric cancer. Surgical Endoscopy, 35(5), 2389–2397. doi: 10.1007/s00464-020-08265-1.
Адреса для листування:
Хоптяна Ольга Іванівна
03022, Київ, вул. Юлії Здановської, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: hoptyana.olha@ukr.net
Correspondence:
Olga Khoptiana
Nonprofit Organization National Cancer Institute
33/43 Yulii Zdanovskoi str., Kyiv, 03022
E-mail: hoptyana.olha@ukr.net














Leave a comment