Застосування детекції сторожових лімфатичних вузлів при операціях з приводу раку грудної залози: сучасний погляд на проблему
Смоланка І.І., Солодянникова О.І., Скляр С.Ю., Костриба О.І.
Резюме. Методика ідентифікації сторожових лімфатичних вузлів була розроблена з метою мінімізації ускладнень при радикальних операціях з приводу раку грудної залози. Водночас виконання резекції сторожових лімфатичних вузлів при початкових стадіях захворювання дозволяє досягти результатів, аналогічних таким при повній лімфодисекції. У статті представлено сучасний погляд на проблему, показання до застосування методики, рекомендації щодо стандартів лікування.
Проблема раку грудної залози (РГЗ), незважаючи на значні досягнення сучасної онкології, удосконалення методів діагностики та лікування, залишається актуальною. За даними ВООЗ, кожен рік у світі реєструють більше 1,2 млн нових випадків РГЗ. В Україні з 90-х років РГЗ займає перше місце в структурі онкологічної захворюваності жіночого населення. За даними Національного канцер-реєстру України, рівень захворюваності на РГЗ постійно зростає та становить 70,9 на 100 тис. жіночого населення [1].
В останнє десятиріччя відбулися кардинальні зміни тактики ведення та лікування пацієнток, хворих на РГЗ. По-перше, при початкових стадіях пухлинного процесу розширені радикальні оперативні втручання змінилися на менш руйнівні та органозберігаючі. По-друге, при початкових стадіях РГЗ відбувається перегляд показань до виконання повної регіонарної лімфодисекції. Серед відомих способів комплексного лікування при РГЗ, незважаючи на значні досягнення в системній протипухлинній терапії (хіміотерапія, гормоно- та таргетна терапія), основним залишається хірургічний метод. Але саме застосування сучасного консервативного лікування дозволяє зменшити обсяги оперативних втручань, зберегти грудну залозу (ГЗ) та регіонарний лімфоколектор, що значно підвищує якість життя пацієнток, які лікуються з приводу РГЗ. Перевага зберігаючих операцій перед розширеними є важливим фактором, який зумовлює оптимальну соціально-трудову реабілітацію хворих. Важливими у цьому напрямку є індивідуалізація операцій на шляхах лімфовідтоку та ідентифікація стану регіонарних лімфатичних вузлів (ЛВ).
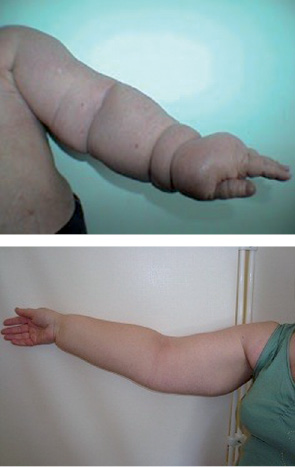
Враховуючи зональний анатомічний варіант лімфогенного розповсюдження метастазів при РГЗ (рис. 1), радикальне оперативне втручання (у тому числі й органозберігаюче) раніше завжди передбачало проведення повної регіонарної лімфодисекції, навіть при клінічно неуражених («негативних») ЛВ. Відомо, що видалення регіонарних ЛВ I–III рівня при оперативних втручаннях майже в 30% випадків призводить до виникнення післяопераційних ускладнень, які проявляються у вигляді тривалої сероми — лімфореї (іноді до 2 міс), больового синдрому в акcилярній ділянці, обмеження рухливості в плечовому суглобі, набряків верхньої кінцівки, лімфостазів (рис. 2), ушкодження аксилярної вени та плечового сплетіння [2, 4].
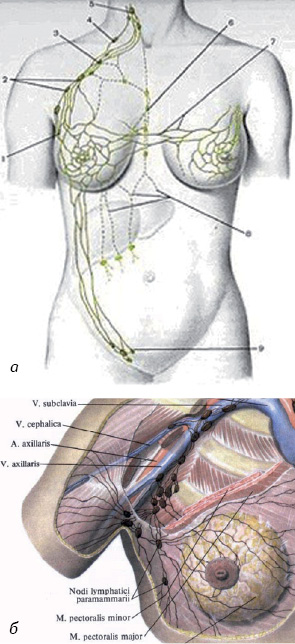
У 1977 р. R.M. Cabanas після ряду досліджень опублікував повідомлення про існування так званого сторожового лімфатичного вузла (СЛВ), через який у першу чергу здійснюється відтік лімфи з тканини, ураженої пухлиною. Розглядаючи механізм залучення до метастатичного процесу ЛВ, D.L. Morton і A.J. Cochran відновили поняття послідовності лімфогенної дисемінації, яке ввів W.S. Halsted, описуючи радикальні операції на ГЗ. Останнім часом було доведено, що у 90% пацієнтів первинне метастазування відбувається у СЛВ, а вже потім ракові клітини розповсюджуються на інші ЛВ та віддалені органи. У 1977 р. E. Holmes запропонував застосовувати метод лімфосцинтиграфії з метою візуалізації СЛВ у передопераційний період. У 90-х роках минулого сторіччя при хірургічному втручанні у хворих на РГЗ запропоновано виконання дослідження СЛВ з метою можливості підтвердження наявності або відсутності метастатичного ураження регіонарних ЛВ взагалі та планування обсягу регіонарної лімфодисекції. У 1991 р. D.L. Morton для візуалізації СЛВ порекомендував використовувати барвники, а саме «Isosulfan blue due», у 1994 р. J.C. Alex запропонував з цією самою метою застосовувати радіоактивний лімфотропний колоїд, який має можливість проникати в лімфатичні капіляри.
Численні дослідження, у яких порівнювали 3- та 5-річну безрецидивну виживаність, довели, що при відмові від повної лімфодисекції в пацієнток з РГЗ в ранній стадії (з негативними СЛВ) ці показники не гірші, а іноді й кращі, ніж у пацієнток після розширених операцій. Відсутність пухлинних клітин у СЛВ теоретично свідчить про неуражений стан усього лімфатичного колектора, що створює передумови до його збереження. Значна кількість післяопераційних ускладнень після виконання повної регіонарної лімфодисекції сприяє розробці методів детекції та ідентифікації СЛВ з метою інтраопераційного стадіювання захворювання та визначення необхідного обсягу лімфодисекції при лікуванні РГЗ у початкових формах. Відомо, що при початкових стадіях РГЗ та відсутності метастатичного ураження в СЛВ ймовірність подальшого лімфатичного метастазування не перевищує 3% [2, 3, 5, 6].
З моменту розробки методик органозберігаючих операцій біопсія СЛВ — це друге найбільш вагоме досягнення в хірургічному лікуванні при РГЗ. Зараз твердження про необхідність виконання повної лімфодисекції для радикалізму оперативного лікування спростоване для випадків, коли СЛВ не містить метастазів [5]. Таким чином, застосування детекції та резекції СЛВ зумовлено особливостями лімфогенних шляхів метастазування пухлин ГЗ, їх методики розробляються з метою визначення стану регіонарних ЛВ з мінімальною травматизацією тканин та без видалення великої частини підшкірної клітковини. Доведено, що СЛВ є фільтром для контрастних препаратів і тому може бути виявлений першим при лімфографії.
У світі практика відмови від регіонарної лімфодисекції при радикальних оперативних втручаннях у хворих на РГЗ вводиться у стандарти лікувальної установи тільки після відпрацювання методики детекції ЛВ, досягнення 85–90% рівня верифікації їх стану та зведення кількості хибнонегативних результатів (тобто випадків, коли СЛВ не містить метастазу, а регіонарні ЛВ уражені) при терміновому гістологічному дослідженні СЛВ до не більше ніж 5% (NCCN 2007/2008; ASCO 2008/2009). Згідно зі світовими рекомендаціями на початковому етапі, до набуття досвіду клініки проведення детекції СЛВ, потрібно обов’язково виконувати регіонарну лімфодисекцію (для контролю за правильним виконанням детекції). Перед початком лікування хворі підлягають загальноклінічному обстеженню, у тому числі для виявлення супутніх захворювань. Важкі соматичні хвороби у фазі декомпенсації є протипоказанням до проведення хірургічного лікування за вказаною методикою. На догоспітальному етапі пацієнтки з вузловими формами РГЗ повинні проходити повне обстеження з метою діагностики ступеня поширеності пухлинного процесу — клінічне та інструментальне обстеження ГЗ: рентгенівська мамографія, комплексне ультразвукове дослідження (УЗД) для оцінки стану новоутворення, яке підлягає лікуванню; пункційна та трепан-біопсія утворень ГЗ з цитологічним та гістологічним дослідженням матеріалу. Важливим є підтвердження відсутності метастатичного ураження регіонарного метастатичного колектора. При проведенні рентгенологічного дослідження увагу звертають на розмір ЛВ, їх кількість, групування в конгломерати, зміну щільності. Бажаним є застосування перед обстеженням та лікуванням комп’ютерної томографії для виключення наявності віддалених метастазів. Однією з умов підвищення ефективності органозберігаючого лікування є адекватна оцінка ступеня васкуляризації пухлини та її регіонарних метастазів, для чого застосовується комплексне УЗД, яке доцільно проводити на початковому етапі інструментального обстеження. Точність комплексного УЗД у виявленні метастатично уражених ЛВ наближається до 85%. Поєднання мамографії, комплексного УЗД та інтраопераційної біопсії СЛВ радіоізотопним методом та за допомогою хромолімфографії підвищує точність діагностики і є на даний час оптимальним.
За наявності підозри на метастатичне ураження регіонарних ЛВ детекція та резекція СЛВ недоцільні, рекомендовано виконання повної лімфодисекції.
Показання до виконання детекції СЛВ
Не кожен випадок оперативного втручання у хворих на РГЗ потребує застосування методики детекції та резекції СЛВ. Враховуючи світовий досвід та досвід нашої клініки, розроблено критерії її планування та виконання, а саме:
- початкові форми РГЗ (розмір пухлини — Тinsitu, Т1, Т2; пухлина до 3 см);
- морфологічна (бажано імуногістохімічна) верифікація діагнозу РГЗ;
- відсутність клінічних, рентгенологічних та морфологічних ознак метастатичного ураження регіонарних ЛВ (N0);
- відсутність передопераційного лікування (неоад’ювантної терапії) та попередніх оперативних втручань на ГЗ.
Протипоказання до виконання детекції СЛВ:
- попереднє лікування РГЗ (неоад’ювантна променева або поліхіміотерапія);
- мультицентричний ріст пухлини;
- метастатичні зміни (N+) в ЛВ;
- набрякова форма РГЗ;
- наявність рубців в ГЗ та аксилярній ділянці (операції, травми, запальні процеси).
Методики проведення детекції СЛВ при лікуванні хворих на РГЗ
Упровадження методик інтраопераційного дослідження СЛВ в клініці потребує тісної співпраці онкохірургів з патоморфологічним підрозділом лікувальної онкологічної установи. Патоморфологи повинні мати відповідну кваліфікацію та обладнання, яке дозволить проводити експрес-дослідження СЛВ для виявлення наявності чи відсутності їх метастатичного ураження. Для проведення інтраопераційного дослідження СЛВ застосовують дві методики — з використанням радіофармпрепарату (РФП) та за допомогою хромолімфографії (барвника) — наприклад 1% водного розчину метиленового синього. Детекцію СЛВ із застосуванням РФП проводять разом з радіологічним підрозділом лікувальної установи та за наявності в ньому обладнання, зазначеного в описі методики.
Труднощі з ідентифікацією СЛВ можуть виникати при локалізації пухлини у внутрішніх квадрантах ГЗ (коли СЛВ може локалізуватися за грудиною), бути пов’язаними з індивідуальними особливостями лімфовідтоку, періодом підготовки команди лікарів та засвоєнням нової методики. Для відпрацювання методик детекції СЛВ рекомендовано застосувати їх у не менше ніж 20–30 хворих та водночас виконувати регіонарну лімфодисекцію у повному обсязі для порівняння результатів гістологічного дослідження СЛВ (термінове гістологічне дослідження) та інших регіонарних ЛВ (заключне гістологічне дослідження). Рівень хибнонегативних результатів при терміновому гістологічному дослідженні СЛВ не може перевищувати 5%, рівень точності та специфічності детекції СЛВ не має бути меншим ніж 85–90%. Слід зазначити, що кількість СЛВ може коливатися від 1 до 4 та більше в окремих випадках.
Методика із застосуванням РФП складається з двох етапів — лімфосцинтиграфії та інтраопераційної детекції СЛВ за допомогою гамма-лічильника. Для проведення лімфосцинтиграфії використовують від 0,4 до 2 мл міченого Тс наноколу або наноцису (колоїдні носії ізотопу); активністю 200–400 МБк з розміром часток 3–5 нм, який вводять перитуморально, підшкірно, субареолярно або над пухлиною.
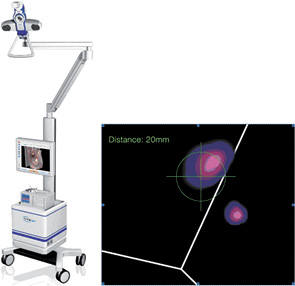
Запис сцинтиграфії в статичному режимі проводять через 20–30 хв і 1,5–2 год після ін’єкції за допомогою гамма-камери. Параметри збору даних на гамма-камері: розмір матриці — 256×256, набір не менше 200 тис. імпульсів на матрицю зображення; фотопік енергії випромінювання Тс (140 кВ) з розміром дискримінаційного вікна 15%. Статичну сцинтиграфію проводять у прямій передній, бічній і передньо-бічній (45 °) проекціях. У разі успішної візуалізації СЛВ на шкірі пацієнтки відмічають та маркують його проекцію. Через 1 добу виконують інтраопераційну детекцію СЛВ за допомогою портативного або стаціонарного гамма-лічильника по радіальних лініях від місця ін’єкції в напрямку до регіонарних лімфатичних колекторів (рис. 3, 4). У зоні маркування проводять розтин шкіри, після знаходження СЛВ здійснюється його контроль під час хірургічного доступу. У процесі інтраопераційної детекції застосовується низькоенергетичний детектор з високою роздільною здатністю; гамма-лічильник налаштовують на фотопік енергії випромінювання Тс з розміром вікна дискримінації 50%. Вилучений ЛВ відсилають на інтраопераційне патоморфологічне дослідження на заморожених зрізах (frozen section). Тим часом проводять оперативне втручання на ГЗ (частіше в обсязі квадрантектомії, при Тinsitu— лампектомії). Після одержання висновку гістологічного дослідження приймають рішення про подальшу оперативну тактику стосовно обсягу лімфодисекції. У разі негативного результату щодо ураження СЛВ операційну рану зашивають, за наявності метастатичного ураження — виконують лімфодисекцію у повному обсязі. Рана дренується за допомогою профільного дренажу с вакуумною аспірацією.

При застосуванні другої методики готують та автоклавують 1% водний розчин метиленового синього, 2–3 мл стерильного розчину в асептичних умовах вводять в ділянку навколо пухлини. Через 15–20 хв вже спостерігається накопичення
препарату в зонах СЛВ. Після мобілізації найближчих до пухлини ЛВ шукають та видаляють забарвлений. При локалізації пухлини в зовнішньому квадранті ГЗ, коли найчастіше першими уражаються ЛВ аксилярної ділянки, операція може починатися з детекції СВ (рис. 5). Над можливим місцем накопичення барвника виконують розтин шкіри, видаляють забарвлений ЛВ та проводять його гістологічне експрес-дослідження, після чого виконують радикальну операцію на ГЗ (частіше в обсязі квадрантектомії, при Тinsitu— лампектомії), після верифікації встановлюють необхідний обсяг лімфатичної дисекції та її зональність. При локалізації пухлини в інших квадрантах ГЗ після видалення ураженого квадранта проводять ревізію регіонарних зон лімфатичного колектора, в місцях, де спостерігається накопичення препарату (барвника), вилучають забарвлений ЛВ, проводять гістологічне експрес-дослідження та виконують за необхідності лімфодисекцію.
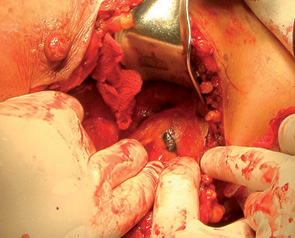
Для поліпшення результатів детекції СЛВ багатьма клініками світу, де впроваджено ці методики, рекомендується використання подвійного методу — із застосуванням РФП та хромолімфографії. При такому підході підвищуються точність та специфічність детекції СЛВ. Видалені забарвлені ЛВ одразу відправляють на гістологічне експрес-дослідження, результати якого оголошують ще до завершення операції. У разі діагностування метастатичного ураження СЛВ рекомендовано проведення регіонарної лімфодисекції в повному обсязі. При початкових стадіях РГЗ та відсутності в СЛВ пухлинних клітин повну регіонарну лімфодисекцію не проводять, але оперативне втручання все одно вважається радикальним.
В усіх випадках заключний патогістологічний висновок про стан вилучених ЛВ роблять після парафінової проводки на підставі дослідження зрізів, забарвлених гематоксилін-еозином, та імуногістохімічного аналізу. Після отримання заключного патогістологічного висновку планується адекватний обсяг ад’ювантного протипухлинного лікування.
Патогістологічна класифікація регіонарних ЛВ (6-те видання, 2002 р.), яку застосовують при проведенні детекції СЛВ:
- pN(sn) — СЛВ;
- pN0 — відсутні метастази в регіонарних ЛВ, додаткових обстежень на наявність клітин пухлини не проводили;
- pN0(і-) — відсутні метастази в регіонарних ЛВ при звичайному гістологічному дослідженні, негативні результати імуногістохімічного аналізу;
- pN0(і+) — відсутні метастази в регіонарних ЛВ при звичайному гістологічному дослідженні, позитивні дані імуногістохімічного аналізу, при імуногістохімії — немає груп розміром понад 0,2 мм;
- pN0(mol-) — відсутні метастази в регіонарних ЛВ при звичайному гістологічному дослідженні, негативні результати молекулярних досліджень (RT-PCR)*;
- pN0(mol+) — відсутні метастази в регіонарних ЛВ при звичайному гістологічному дослідженні, позитивні результати молекулярних досліджень (RT-PCR)*;
- pN1 — метастази в 1–3 пахвових ЛВ і/або внутрішніх грудних ЛВ з мікроскопічними проявами хвороби у висіченому СЛВ, але останні клінічно не проявляються**;
- pN1mі — мікрометастази (понад 0,2 мм, жоден не більший ніж 2 мм).
На сьогодні прийнятими вважаються наступні рекомендації:
- для пацієнтів з pТin situ та Т1, N0(sn) — доцільно відмовитися від виконання аксилярної лімфодисекції та ввести це в стандарти онкологічної установи;
- для пацієнтів з pN0(і+)(sn) доцільно відмовитися від виконання аксилярної лімфодисекції тільки у випадку сприятливих властивостей пухлини (обов’язковим вважається попереднє імуногістохімічне дослідження пухлини за допомогою трепан-біопсії);
- при вирішенні питання про доцільність лімфодисекції у пацієнтів з pN0(і+)(sn) необхідно враховувати розмір пухлини, ступінь злоякісності, рецепторний статус.
На XI та XII Міжнародних конференціях з питань лікування РГЗ (Сент-Галлен, 2011, 2013) було вирішено, що відмова від виконання аксилярної лімфодисекції доцільна у пацієнтів з РГЗ з низьким рівнем ризику рецидивування, а саме при початкових стадіях захворювання, N0, G1, максимально одному ураженому СЛВ із 5 досліджених, ER/PgR-позитивному та HER2-негативному статусі пухлини, Ki-67 <14%.
Застосування методики детекції та біопсії СЛВ призводить до значного зниження частоти ускладнень, скорочення термінів та зменшення вартості стаціонарного лікування, адекватного планування ад’ювантного протипухлинного лікування. Зменшення обсягу регіонарної лімфодисекції у хворих на РГЗ у початковій стадії може бути рекомендовано до впровадження в клінічну практику онкологічних лікувальних установ України. Важливо зазначити, що якість життя пацієнток з неушкодженим та невидаленим аксилярним лімфатичним колектором у поєднанні з органозберігаючою операцією набагато вища та може бути порівняна з життям здорової людини.
ВИСНОВКИ
Інтраопераційне дослідження СЛВ слід проводити тільки при початкових стадіях РГЗ (за клінічно та рентгенологічно доведеної відсутності метастатичного ураження регіонарних лімфовузлів).
Інтраопераційне дослідження СЛВ є сучасним і ефективним методом стадіювання РГЗ, яке дозволяє визначити показання та обсяг регіонарної лімфодисекції.
Проведення детекції СЛВ дозволяє уникнути невиправдано травматичних хірургічних втручань при початкових стадіях РГЗ та інтактних ЛВ, запобігає виникненню післяопераційних ускладнень, скорочує терміни лікування та підвищує якість життя хворих.
Дані проведених досліджень доводять, що для поліпшення результатів лікування, підвищення точності стадіювання процесу та адекватного планування обсягу лімфодисекції при операціях з приводу РГЗ у початкових стадіях слід використовувати подвійний метод детекції СЛВ — застосування РФП та хромолімфографії у комплексі.
Список використаної літератури
1. Федоренко З.П., Михайлович Ю.Й., Гулак Л.О. та ін. (2013) Рак в Україні, 2011–2012. Захворюваність, смертність, показники діяльності онкологічної служби. Бюл. Нац. канцер-реєстру, 14: 120 с.
2. Bergkvist L., de Boniface J., Jönsson Р.U. et al. (2008) Axillary recurrence rate after negative sentinel node biopsy in breast cancer: three-year follow-up of the Swedish Multicenter Cohort Study. Ann. Surg., 247 (1): 150–156.
3. Veronesi U., Paganelli G., Viale G. et al. (2006) Sentinel-lymph-node biopsy as a staging procedure in breast cancer: update of a randomised controlled study. Lancet Oncol., 7(12): 983–990.
4. Veronesi U., Galimberti V., Paganelli G. et al. (2009) Axillary metastases in breast cancer patients with negative sentinel nodes: a follow-up of 3548 cases. Eur. J. Cancer., 45(8): 1381–1388.
5. Schwartz G.F. (2004) Clinical Practice Guidelines for the use of axillary sentinel lymph node biopsy in carcinoma of the breast: current update. Brest J., 10: 85–98.
6. Langer I., Guller U., Hsu-Schmitz S.F. et al. (2009) Sentinel lymph node biopsy is associated with improved survival compared to level I & II axillary lymph node dissection in node negative breast cancer patients. Division General Surgery, University Hospital Basel, Switzerland. Eur. J. Surg. Oncol., 35(8): 805–813.
КRT-PCR: ланцюгова реакція зворотної транскриптази/полімерази.
Клінічна відсутність передбачає неможливість визначення ураження за допомогою методів візуалізації (за винятком лімфосцинтиграфії) або при клінічному огляді.
Использование детекции сторожевых лимфатических узлов при операциях по поводу рака грудной железы: современный взгляд на проблему
Резюме. Методика идентификации сторожевых лимфатических узлов была разработана с целью минимизации осложнений при радикальных операциях по поводу рака грудной железы. Вместе с тем проведение резекции сторожевых лимфатических узлов при начальных стадиях заболевания позволяет достичь результатов, аналогичных таковым при выполнении полной лимфодиссекции. В статье представлены современный взгляд на проблему, показания к применению методики, рекомендации относительно современных стандартов лечения.
рак грудной железы, лимфатические узлы, эффективность лечения.














Leave a comment