Розширення ролі імуноонкологічного лікування у веденні пацієнтів з меланомою та тричі негативним раком грудної залози
Резюме. Наприкінці листопада 2023 р. онкологів, хірургів, морфологів та радіаційних онкологів в історичній частині столиці зібрав захід, що став традиційним останніми роками, — «Актуальне в онкології». Цьогорічна зустріч, що мала на меті обмін знаннями, передовими технологіями та найновішими науковими дослідженнями, стала результатом співпраці професійної спільноти лікарів-онкологів «OncoHub» та лабораторії «CSD LAB». Видатною подією «Uptodate 4.0 + Молекулярні зустрічі» став сателітний симпозіум, проведений компанією «МСД Україна», який викликав настільки великий інтерес, що у конференц-залі не вистачило місць і організаторам довелося додати ще 1 щільний ряд зі стільців у всю стіну.
DOI: 10.32471/clinicaloncology.2663-466X.52-4.31677
Учасників симпозіуму вітала Маргарита Огнівенко, керівник відділу госпітальних препаратів компанії «МСД Україна». Вона нагадала, як 6 років тому в тих самих конференц-залах йшлося про революційний підхід — імуноонкологію, яку саме тоді тільки починали використовувати. Терапію пембролізумабом тоді призначали на пізніх стадіях меланоми, а пізніше запровадили у нео- та ад’ювантних умовах при цілій низці захворювань, зокрема при меланомі та раку грудної залози (РГЗ). Новітній досвід у розвитку цих 2 напрямків представлено під час симпозіуму.
Найважливіше у встановленні діагнозу меланоми
Максим Єрмаков, клінічний онколог (лікарня ізраїльської онкології LISOD), у своїй доповіді розповів про діагностику, стадіювання та вибір тактики лікування пацієнтів з меланомою. На жаль, наразі 5-річна виживаність пацієнтів з цим злоякісним новоутворенням в Україні нижча від такої у світі, і однією з можливостей виправлення ситуації повинно стати покращення виявлення та стадіювання захворювання на ранніх стадіях, коли прогноз є значно кращим (табл. 1).
| Кількість пацієнтів на обліку | Майже 30 тис. із 1,1 млн (3%) усіх пацієнтів з онкопатологією (2021) |
| Серед загального контингенту хворих | 13-те місце за чисельністю (1-ше (17%) – немеланомний рак шкіри; 2-ге – РГЗ (15,3%) |
| Нових випадків у 2022 р., з них:
1-ша стадія 2-га стадія 3-тя стадія 4-та стадія стадія не встановлена |
2845
32,3% 46,5% 6,4% 5,7% 8,9% |
| Виживаність (5-річна) у 2022 р.:
1–2-га стадії 3-тя стадія 4-та стадія |
60–70%
40% 12% |
Слід також зауважити, що відлік «нової ери» щодо виживаності хворих у США, Європі та Австралії авторитетними міжнародними організаціями ведеться, починаючи із масового запровадження в середині 1990-х років біопсії сторожових лімфовузлів (СЛВ) (sentinel lymph node) [2].
Вкрай важливим для індивідуального прогнозу є правильне визначення стадії процесу та адекватне обрання лікування після встановлення діагнозу (нео- та ад’ювантна терапія, хірургічне втручання), адже меланомоспецифічна виживаність протягом 5 років у пацієнтів з ранніми стадіями захворювання є високою, але це стосується й частоти розвитку рецидивів. Тобто період у декілька років після виявлення захворювання є дуже відповідальним щодо обрання правильної тактики. Так, за даними ретроспективного спостереження, медіана якого становила 52 міс, за 738 дорослими із патологічною меланомою шкіри II стадії, які отримували лікування в Меморіальному онкологічному центрі Слоуна Кеттерінга (Memorial Sloan Kettering Cancer Center) у період 1993–2013 рр., рецидиви розвинулися у 219 пацієнтів, найчастіше — у легенях та головному мозку (табл. 2).
| Стадія | Медіана періоду до розвитку рецидиву (міс) | 5-річна частота розвитку рецидиву (%) | Період розвитку 50% рецидивів (міс) | 5-річна меланомоспецифічна виживаність (%) |
| IIA | 195,1 | 77 | 29 | 87 |
| IIB | Не досягнуто | 62 | 23 | 78 |
| IIC | 85,9 | 53 | 15 | 69 |
Чи пов’язані визначення стадії та клінічні результати?
Стадіювання процесу вкрай необхідне для ухвалення рішень щодо лікування, підкреслив М. Єрмаков, нагадавши основні параметри пухлин за системою TNM Американського об’єднаного комітету з вивчення раку (American Joint Committee on Cancer — AJCC) [4].
Запровадження імуноонкологічного лікування змінило прогноз пацієнтів з меланомою, підкреслив доповідач. За його словами, нові горизонти в організації допомоги очікуються, зокрема, із отриманням результатів досліджень неоад’ювантної терапії при ІІІ стадії захворювання та комбінації мРНК-вакцин з пембролізумабом.
Визначенню тактики раннього лікування пацієнтів з меланомою присвятила свою доповідь Марія Кукушкіна, клінічний онколог, керівник Центру онкодерматології ММ «Добробут». Отже, верифікацію діагнозу при локалізованих формах виконують, беручи до уваги 2 основних показники:
- товщину пухлини за Breslow;
- наявність чи відсутність виразкування поверхні ураження.
Значення показника гістологічно визначеної товщини необхідне для вибору тактики хірургічного лікування (яким має бути відступ від біопсійного рубця при висіченні) [5, 6]. При цьому рекомендації щодо безпечних периферичних хірургічних меж є досить одностайними (рівень консенсусу 100% згідно з настановою Європейського товариства медичної онкології (European Society for Medical Oncology — ESMO) [5]:
- in situ: 5 мм;
- товщина пухлини ≤2 мм: 1 см;
- товщина пухлини >2 мм: 2 см.
Щодо уражень обличчя, кистей, стоп, нижніх третин гомілок та передпліч, — знання цих параметрів є принциповим, оскільки для закриття дефекту важливий кожний міліметр шкіри. Під час операції насамперед широко висікається пухлина, а потім виконується ключовий елемент алгоритму обстеження та первинного лікування хворих — біопсія СЛВ. Її виконання при стадії IB (T1b) залежно від товщини пухлини за Breslow [7]:
- <0,8 мм без виразкування — не показане;
- <0,8 мм за наявності виразкування — обговорюється;
- >1 мм незалежно від статусу виразкування — пропонується.
Біопсію СЛВ виконують у Національному інституті раку (НІР) з 2011 р., зазначила М. Кукушкіна, а у LISOD — навіть трошки раніше. На думку доповідача, в Україні вже достатньо апаратури, щоб виконувати цю процедуру усім, хто її потребує, адже це є вкрай необхідним з точки зору визначення тактики майбутнього лікування та прогнозу.
Результати СЛВ допомагають ухвалювати більш виважені рішення щодо лікування та можуть сприяти його дотриманню. Так, навіть за доступності ад’ювантної імунотерапії незалежно від статусу СЛВ результати пацієнтів відрізняються, як зафіксовано у даних нещодавно опублікованої екстраполяції інформації з багатьох джерел [8]. Так, ризик розвитку рецидиву в зоні регіонарного лімфоколектору при меланомі високого ризику T3b і T4 становить:
- близько 7–9%, якщо пацієнт отримав біопсію СЛВ та імунотерапію;
- 20–27% — тільки імунотерапію без біопсії СЛВ;
- близько 14% — тільки біопсію СЛВ;
- близько 40% — при неотриманні обох.
Отже, за відсутності проспективних даних робиться припущення, що оптимальне лікування первинних меланом високого ризику T3b і T4 досягається шляхом поєднання біопсії СЛВ та ад’ювантної імунотерапії відповідно до існуючих показань.
Подальша оцінка ризику
Кращій оцінці ризику можуть також допомогти спеціальні інструменти, зокрема від Інституту меланоми Австралії (Melanoma Institute Australia): калькулятори ризику ураження СЛВ, рецидиву, результатів імунотерапії тощо (melanomarisk.org.au).
А як вирішити питання щодо необхідності проведення досліджень візуалізації? Як зазначила М. Кукушкіна, починаючи зі стадії IIC, згідно із європейським консенсусним документом рекомендоване обстеження всього тіла за допомогою комп’ютерної томографії (КТ) або позитронно-емісійної томографії (ПЕТ-КТ) поєднано з магнітно-резонансною томографією головного мозку [9]. Зі свого боку, настановою Національної мережі багатопрофільних онкологічних закладів США (National Comprehensive Cancer Network — NCCN) передбачено виконання візуалізації у разі позитивного результату біопсії СЛВ [7]. При цьому слід брати до уваги, що клінічно приховані мікрометастази (N1a або N2a), тобто виявлені при біопсії СЛВ, поєднуються із віддаленими метастазами менш ніж у 2% пацієнтів, а клінічно виявлені (пальповані) — від 4 до 16%. Про це свідчать дані досліджень, на які посилаються в консенсусному документі [9]. Після запровадження у НІР біопсії СЛВ у 2011 р., підкреслила доповідач, жодного випадку віддалених метастазів у пацієнтів з наявністю мікрометастазів у СЛВ не виявлено.
KEYNOTE-716 — орієнтир у ранньому лікуванні
Діагностика патоморфологічної стадії IIB або IIC за алгоритмом NCCN вважається показанням для призначення пембролізумабу. Кінцевий аналіз застосування цього препарату в дослідженні KEYNOTE-716 нещодавно представлено на конференції Американського товариства клінічної онкології (American Society of Clinical Oncology – ASCO) [10]. За висновками авторів, ад’ювантна терапія пембролізумабом при спостереженні з медіаною у 39,4 міс у 976 пацієнтів з резектованою меланомою стадій IIB та IIC продовжувала мати більше переваг відносно виживаності без віддалених метастазів (distant metastasis-free survival — DMFS) та виживаності без рецидиву (recurrence-free survival — RFS) порівняно з плацебо за відсутності нових сигналів безпеки. Пацієнти з негативними результатами біопсії СЛВ отримували лікування протягом близько 1 року (17 циклів з інтервалом у 3 тиж) або до розвитку рецидиву захворювання чи неприйнятної токсичності. По закінченню цієї 1-ї частини дослідження активну терапію призначали пацієнтам обох груп за наявності показань. Цікаво, що медіана віку учасників, які отримували пембролізумаб, становила 60 років, а майже 40% з них були віком ≥65 років. Останні, як не дивно, мали кращі результати (рис. 1). Порівняно з плацебо через 6 міс застосування ад’ювантного пембролізумабу покращило DMFS в абсолютному порівнянні близько на 10% (84,4 проти 74,7%; відношення ризиків (ВР) 0,59), а RFS — на 13% (76,2 проти 63,4%; ВР 0,62). При цьому переваги щодо DMFS та RFS відмічали незалежно від початкової стадії раку (стадія IIB або IIC).
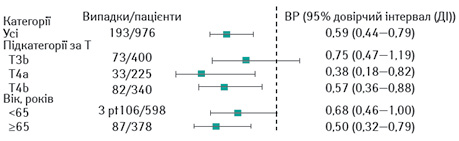
Важливо, що при застосуванні пембролізумабу частота утворення віддалених метастазів як 1-го рецидиву виявилася нижчою, ніж при застосуванні плацебо.
Ще один імуноонкологічний препарат
Показання ще одного імунотерапевтичного препарату — ніволумабу у США нещодавно розширено із включенням пацієнтів із резектованою меланомою IIB/C стадій. Його ефективність оцінювали в CHECKMATE-76K (NCT04099251) — рандомізованому подвійному сліпому дослідженні, в яке залучено 790 пацієнтів зі стадією IIB/C меланоми. Пацієнтів рандомізовано (2:1) у групу ніволумабу 480 мг або плацебо шляхом внутрішньовенної інфузії кожні 4 тиж протягом 1 року або до розвитку рецидиву захворювання чи неприйнятної токсичності.
Переваги щодо RFS та DMFS, як і у вищеописаному дослідженні, також виявляли у групі ад’ювантної терапії [11]. Так, RFS при застосуванні ніволумабу була у статистично значущому ступені нижчою порівняно з плацебо (ВР=0,42). Покращення DMFS згідно з початковою оцінкою теж було клінічно значущим (ВР=0,47). Переваги ніволумабу фіксували у всіх попередньо виділених підгрупах, враховуючи вік, стадію та розмір пухлини.
Як лікують ІІІ стадію меланоми?
Суттєвою відмінністю лікувальної тактики при поширеному новоутворенні є рекомендація неоад’ювантної терапії [7]. Щоправда, переважною сферою її застосування залишаються клінічні дослідження, але можливо, підкреслила доповідач, що невдовзі загальноприйняту послідовність лікування пацієнтів з ІІІ стадією буде змінено. В якості неоад’ювантної може бути запропонована імунотерапія.
Так, ефективність ад’ювантного лікування пембролізумабом було досліджено в подвійному сліпому дослідженні EORTC 1325/KEYNOTE-054 за участю 1019 пацієнтів з резектованою меланомою III стадії високого ризику [12]. Пембролізумаб, який застосовували по 200 мг кожні 3 тиж протягом 1 року, забезпечив за 5-річної медіани спостереження стійке покращення RFS (55,4 проти 38,3%) та DMFS (60,6 проти 44,5%) (рис. 2). Поліпшення RFS та DMFS були послідовними у всіх підгрупах, зокрема серед 853 пацієнтів з пухлинами, позитивними щодо ліганда білка програмованої клітинної відповіді (PD-L1).
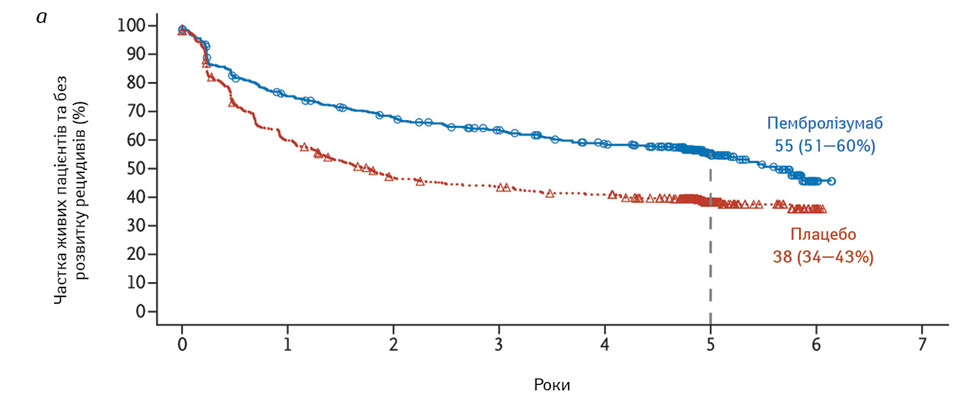
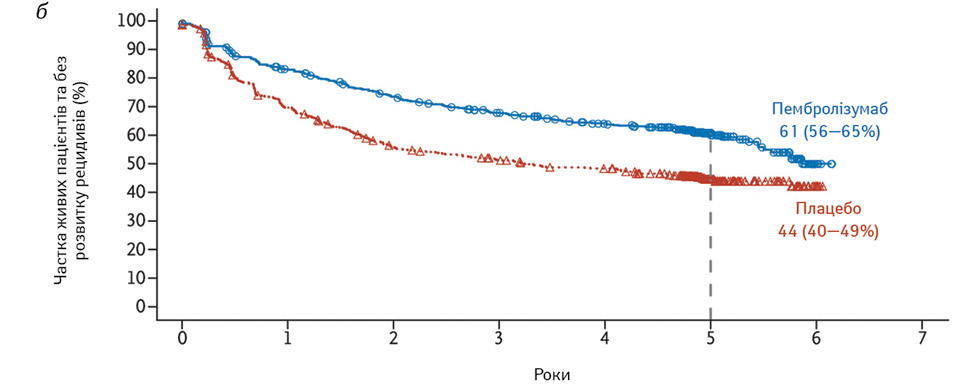
Ще одна можлива схема ад’ювантної терапії для пацієнтів з меланомою ІІІ стадії — таргетна терапія інгібітором ферменту серин-треонін кінази (BRAF) дабрафенібом та інгібітором мітоген-активованої протеїнкінази (MEK) траметинібом для перорального застосування. За наявності онкогенних мутацій BRAF V600E або V600K, які виявляють близько в 40% меланом, комбінована терапія покращує результати пацієнтів з неоперабельною або метастатичною меланомою, як зафіксовано в результатах досліджень. Зокрема, через 3 роки рівень RFS становив 58% у групі комбінованої терапії та 39% у групі плацебо. Комбінована терапія також призвела до вищих показників загальної виживаності та DMFS, ніж плацебо, з клінічно значущим нижчим ризиком на 43 і 49% відповідно [13].
Отже, які варіанти системного лікування можна запропонувати пацієнтам з резектабельною меланомою до та після хірургічного втручання (рис. 3)? Неоад’ювантний пембролізумаб був нещодавно рекомендований для пацієнтів з резектабельною стадією IIIB [14], до того ж після оперативного втручання можна орієнтуватися на переваги для пацієнта, зокрема доступність ліків та готовність приймати їх пероральним чи інфузійним шляхом. Також обов’язково слід взяти до уваги безпеку. Загалом, як зазначила доповідач, імунотерапія переноситься легше, ніж таргетна, але має свій профіль імуноопосередкованих побічних реакцій. У випадку пембролізумабу вони є добре вивченими та керованими [14].
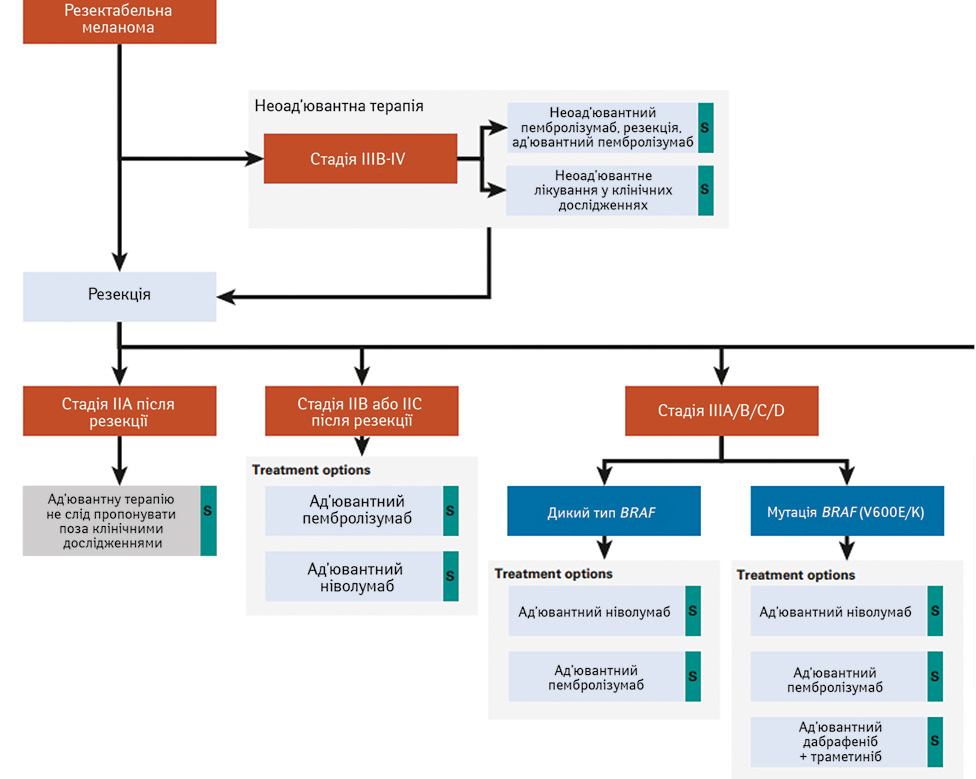
Орієнтиром у призначенні неоад’ювантної терапії при резектабельній меланомі на пізніх стадіях слугує рандомізоване дослідження ІІ фази S1801 [15]. При медіані періоду спостереження 14,7 міс група зі 154 пацієнтів, що отримали 3 дози пембролізумабу перед оперативним втручанням, мала значуще вищий рівень безреакційної виживаності, ніж група лише ад’ювантної терапії (159 пацієнтів) (P=0,004). В абсолютному вираженні різниця RFS між цими групами через 2 роки становила 23% на користь неоад’ювантної терапії (72%) порівняно з ад’ювантною (49%) (рис. 4).
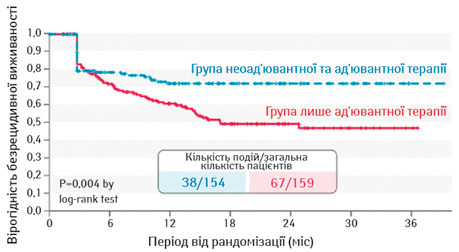
При цьому розвиток рецидиву у деяких пацієнтів під час терапії в неоад’ювантних умовах [16] не має вводити в оману. Як зауважила доповідач, в експертному середовищі превалює думка, що певній когорті пацієнтів оперативне втручання не потрібне, а імунотерапія коротким курсом лише сприятиме їх виявленню.
Обґрунтуванню неоад’ювантної терапії в якості нового стандарту лікування також сприятиме поточне рандомізоване дослідження III фази неоад’ювантної імунотерапії операбельної меланоми стадії IIIB-D, NADINA (ідентифікатор ClinicalTrials.gov: NCT04949113).
Наступні висновки М. Кукушкіна зробила на завершення своєї доповіді:
1. Тактика лікування та прогноз пацієнтів з меланомою визначаються характеристиками первинної пухлини, статусом СЛВ та поширеністю захворювання.
2. Біопсія СЛВ дозволяє визначити стадію захворювання та сприяє покращенню локального контролю захворювання за допомогою ад’ювантної терапії.
3. При ІІВ, ІІС та ІІІ стадіях пембролізумаб в ад’ювантному режимі знижує ризик розвитку рецидиву та віддалених метастазів.
4. Поява результатів клінічного дослідження імунотерапії в неоад’ювантному режимі зумовлює зміни стандартів лікування при ІІІ стадії та, можливо, незабаром і при ІІ стадії меланоми високого ризику.
Хіміоімунотерапія — стандарт лікування ІІ та ІІІ стадій ТНРГЗ
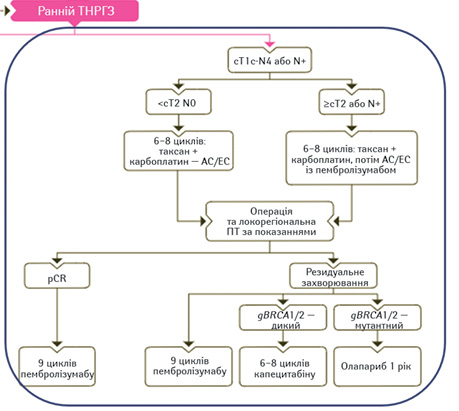
Про оптимальну діагностично-лікувальну тактику щодо пацієнток із тричі негативним раком грудної залози (ТНРГЗ) розповів Денис Помінчук, клінічний онколог (клініка «Верум Експерт»). Так, усі пацієнти із ТНРГЗ у будь-якому віці потребують генетичного тестування, на результати якого орієнтуються, призначаючи системну терапію (рис. 5).
Неоад’ювантна хіміотерапія є кращим підходом для лікування II або III стадії ТНРГЗ. При цьому досягнення повної патоморфологічної відповіді (pathologic complete response — pCR) на неоад’ювантне лікування пов’язане із дуже сприятливими показниками RFS та загальної виживаності. Кореляція між повною відповіддю та віддаленими результатами особливо велика при ТНРГЗ, менша — при HER-2-позитивному захворюванні та є найменшою при гормоночутливих пухлинах [17, 18].
Додавання пембролізумабу до хіміотерапії на основі таксанів і препаратів платини з наступним застосуванням антрацикліну значно підвищило частоту pCR і покращило показник безрецидивної виживаності на ранніх стадіях ТНРГЗ високого ризику.
Загалом призначення ефективної передопераційної хіміотерапії може допомогти поліпшити результати ТНРГЗ, оскільки пацієнти, які не досягли pCR після проведення неоад’ювантної терапії, отримують ад’ювантну терапію з урахуванням результатів неоад’ювантної [19].
При цьому пембролізумаб є єдиним схваленим інгібітором контрольних точок для лікування ТНРГЗ на ранніх стадіях. Його застосовують як у неоад’ювантних, так і ад’ювантних умовах. Користь підтверджено також від застосування інгібіторів полі(АДФ-рибози) полімерази (poly (ADP ribose) polymerase — PARP), які показані пацієнтам із гермінальними мутаціями із втратою функції у 2 важливих генах сприйнятливості до РГЗ, які мають вирішальне значення для відповіді на пошкодження ДНК, — gBRCA1 і gBRCA2.
Значно покращити результати пацієнтів з високим ризиком (ІІ–ІІІ стадіями) із ТНРГЗ допомагає імуноонкологічне лікування, що відображено в настанові NCCN [18], зауважила у своїй доповіді Наталія Отченаш (КНП «Обласний центр онкології», Харків). Бажаною є така схема:
- преоперативно пембролізумаб + карбоплатин + паклітаксел (4 цикли по 21 дню);
- потім пембролізумаб + циклофосфамід + доксорубіцин або епірубіцин (також 4 цикли);
- в якості ад’ювантної терапії — також пембролізумаб (9 циклів), якщо він був призначений преопераційно;
- також можлива ад’ювантна терапія капецитабіном (6–8 циклів) або олапарибом за наявності мутації gBRCA1/2 (протягом 1 року).
Як оцінити потенційну ефективність ад’ювантної терапії в перші місяці її застосування? На жаль, маркери для раннього застосування наразі відсутні. Дещо іншою є ситуація в умовах неоад’ювантної терапії, відзначила доповідач. Так, якщо системну терапію проводять у передопераційний період, досліджуючи операційний матеріал, можна оцінити, чи досягнуто pCR. Цей параметр застосовують в якості кінцевої точки у клінічних дослідженнях, оскільки він пов’язаний зі значним поліпшенням віддалених клінічних результатів [20, 21]. Метааналіз 25 досліджень при ранньому ТНРГЗ продемонстрував ризик смерті, нижчий на 81%, та прогресування, рецидиву або смерті — на 76%, серед пацієнтів, які досягли pCR після неоад’ювантної хіміотерапії [22].
KEYNOTE-522: пембролізумаб та відстрочена активація імунної відповіді
Ретельний аналіз результатів дослідження KEYNOTE-522 може пролити світло на питання щодо адаптації лікування пембролізумабом в ад’ювантній терапії залежно від наявності чи відсутності відповіді на попередню неоад’ювантну імунохіміотерапію.
Дослідження продемонструвало, що додавання пембролізумабу збільшило загальну частоту pCR з 51,2% до 64,8% (P=0,00055), і покращення показників pCR спостерігалися незалежно від експресії PD-L1 [21, 23]. Четвертий запланований проміжний аналіз продемонстрував статистично значуще покращення EFS у пацієнтів, які отримували пембролізумаб (84,5% проти 76,8%, відносний ризик: 0,63) [23]. Пацієнти, які досягли pCR після неоад’ювантної терапії, мали дуже сприятливий результат незалежно від того, чи застосовували пембролізумаб, з 3-річним показником EFS 94,4% порівняно з 92,5% (табл. 3). Навпаки, у пацієнтів, у яких не було досягнуто pCR, додавання пембролізумабу дало переваги: показники EFS за 3 роки становили 67,4% у групі пембролізумабу та 56,8% у групі плацебо. Незважаючи на те що також відбулося кількісне покращення показника загальної виживаності, дані все ще незрілі.
| Проміжний аналіз 1 | Проміжний аналіз 4 | |||
| Групи | Пембролізумаб + хіміотерапія (n=401) | Плацебо + хіміотерапія (n=201) | Пембролізумаб + хіміотерапія (n=784) | Плацебо + хіміотерапія (n=390) |
| pCR (%) | 64,8 | 51,2 | 84,5 | 76,8 |
Переваги щодо безподійної виживаності у групі пембролізумабу серед пацієнтів без pCR може свідчити про можливість відтермінованої активації адаптивної імунної відповіді. Також може мати місце менший залишковий тягар пухлини (residual cancer burden — RCB) наприкінці неоад’ювантної фази в групі пембролізумабу з хіміотерапією, ніж у групі плацебо з хіміотерапією [21]. Це дає змогу рекомендувати пембролізумаб також за відсутності pCR (рис. 6).
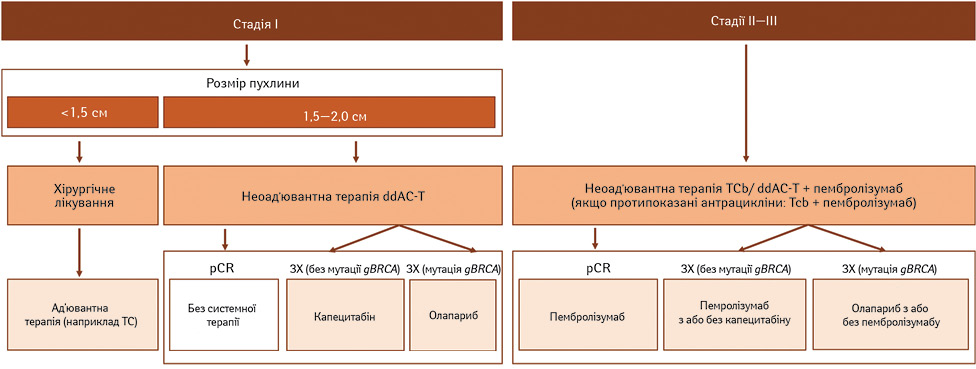
Примітки: ddAC-T — доксорубіцин і циклофосфамід (режим dd (dose dense)) з наступним паклітакселем; gBRCA — мутація BRCA зародкової лінії; ЗХ — залишкова хвороба; TC — доцетаксел і циклофосфамід; TCb — паклітаксел і карбоплатин [19].
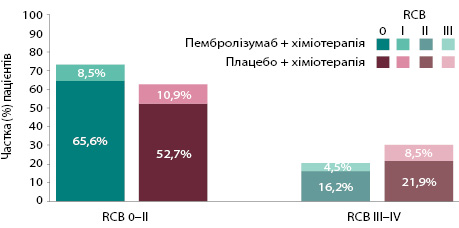
Виживаність без подій була гіршою для пацієнтів із вищим показником RCB. Проте лікування пембролізумабом поєднано з хіміотерапією «зрушило» RCB у менший бік. Про це йшлося у презентації доповіді на щорічній конференції ASCO (2022) [24]. Так, у групі пембролізумабу відсоток пацієнтів кожної категорії RCB був нижчим, ніж у групі плацебо. Ці результати вказують на те, що переваги пембролізумабу щодо виживаності без подій поширюються на пацієнтів, які не досягли pCR (рис. 7).
Оскільки розмір залишкової пухлини, скоріше за все, є маркером ефективності попереднього системного лікування, важливо проводити ретельну оцінку операційного матеріалу як у гістологічному, так і в біологічному плані. Як пояснила Н. Отченаш, імуногістохімічне дослідження також необхідне, зважаючи на поточний патоморфоз пухлини, що призводить до зміни її характеристик. А це, зі свого боку, може вплинути на вибір подальшого лікування.
Між тим проаналізовано результати ще більш тривалого спостереження, медіаною у близько 5 років, за учасниками дослідження KEYNOTE-522. Нещодавно вони були представлені на Конгресі ESMO 2023 [25]. Протягом спостереження із медіаною тривалості 63,1 міс неоад’ювантна хіміотерапія з пембролізумабом (4 цикли) і наступною ад’ювантною схемою із включенням пембролізумабу (9 циклів) продовжувала демонструвати покращення безподійної виживаності порівняно з неоад’ювантною хіміотерапією (81,3 проти 72,3%; коефіцієнт ризику (КР) 0,63, 95% ДІ 0,49–0,81) у 1174 пацієнтів з раннім ТНРГЗ незалежно від досягнення повної відповіді. Медіана EFS не була досягнута в жодній групі. Так, переваги у відношенні EFS при застосуванні пембролізумабу зберігаються понад 5 років, що має велике практичне значення стосовно рішень про продовження курсу лікування, підкреслила Н. Отченаш.
Суттєво, що додавання пембролізумабу не погіршувало вплив хіміотерапії та не підвищувало частоту розвитку поширених токсичних ефектів, пов’язаних із хіміотерапією. Більш висока частота розвитку імуноопосередкованих небажаних явищ у групі хіміотерапії з пембролізумабом зумовлена насамперед ендокринопатіями і шкірними реакціями, які розвивалися в основному під час неоад’ювантної фази. Як зазначила Н. Отченаш, вітчизняні лікарі подекуди відчувають упередження щодо зазначених побічних ефектів, проте ці явища, як правило, мають невисокий ступінь тяжкості та успішно купуються шляхом переривання лікування, призначення глюкокортикоїдів або замісної гормональної терапії [21, 26, 27].
Підсумовуючи, доповідач зауважила, що пембролізумаб у комбінації з платиновмісною неоад’ювантною хіміотерапією з подальшим ад’ювантним лікуванням пембролізумабом після операції стає новою стандартною схемою лікування для пацієнтів з ТНРГЗ на ранніх стадіях з високим ризиком. Отримані результати вже сприяли схваленню в США та Європі комбінації пембролізумабу поєднано з хіміотерапією як неоад’ювантної терапії з подальшим ад’ювантним монопрепаратом пембролізумабу у пацієнтів з високим ризиком із тричі негативним захворюванням на ранній стадії.
список Використаної літератури
1. Федоренко, З. П., Сумкіна, О. В., Горох, Є. Л., & Гулак, Л. О. (2023). Рак в Україні, 2021–2022. Захворюваність, смертність, показники діяльності онкологічної служби. О. В. Єфіменко (Ред.), Бюлетень Національного канцер-реєстру України, 24. http://www.ncru.inf.ua/publications/BULL_24/index.htm.
2. Gershenwald, J. E., Scolyer, R. A., Hess, K. R., Sondak, V. K., Long, G. V., Ross, M. I., … Thompson, J. F. (2017). For members of the American Joint Committee on Cancer Melanoma Expert Panel and the International Melanoma Database and Discovery Platform. Melanoma staging: Evidence-based changes in the American Joint Committee on Cancer eighth edition cancer staging manual. CA Cancer J. Clin., 67(6), 472–492. doi: 10.3322/caac.21409.
3. Lee, A. Y., Droppelmann, N., Panageas, K. S., Zhou, Q., Ariyan, C. E., Brady, M. S., … Coit, D. G. (2017). Patterns and Timing of Initial Relapse in Pathologic Stage II Melanoma Patients. Ann. Surg. Oncol., 24(4), 939–946. doi: 10.1245/s10434-016-5642-0.
4. Amin, M. B., Greene, F. L., Edge, S. B., Compton, C. C., Gershenwald, J. E., Brookland, R. K., … Winchester, D. P. (2017) The Eighth Edition AJCC Cancer Staging Manual: Continuing to build a bridge from a population-based to a more «personalized» approach to cancer staging. CA Cancer J. Clin., 67(2), 93–99. doi: 10.3322/caac.21388.
5. Michielin, O., van Akkooi, A. C. J., & Keilholz, U. ESMO Guidelines Committee (2019). Cutaneous melanoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up†. Ann. Oncol., 30(12), 1884–1901. doi: 10.1093/annonc/mdz411.
6. Garbe, C., Amaral, T., Peris, K., Hauschild, A., Arenberger, P., Basset-Seguin, N., … Lorigan, P. (2022). European Dermatology Forum (EDF), the European Association of Dermato-Oncology (EADO), and the European Organization for Research and Treatment of Cancer (EORTC). European consensus-based interdisciplinary guideline for melanoma. Part 2: Treatment — Update 2022. Eur. J. Cancer,170, 256–284. doi: 10.1016/j.ejca.2022.04.018.
7. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) (2023). Melanoma: Cutaneous. Version: 3. http://www.nccn.org/guidelines/category_1.
8. Varey, A. H. R., Thompson, J. F., & Carlino, M. S. (2023). Has the advent of modern adjuvant systemic therapy for melanoma rendered sentinel node biopsy unnecessary? Eur. J. Cancer, 186, 166–171. doi: 10.1016/j.ejca.2023.03.011.
9. Garbe, C., Amaral, T., Peris, K., Hauschild, A., Arenberger, P., Basset-Seguin, N., … Lorigan, P. (2022). European Dermatology Forum (EDF), the European Association of Dermato-Oncology (EADO), and the European Organization for Research and Treatment of Cancer (EORTC). European consensus-based interdisciplinary guideline for melanoma. Part 1: Diagnostics: Update 2022. Eur. J. Cancer, 170, 236–255. doi: 10.1016/j.ejca.2022.03.008.
10. Luke, J. J., Ascierto, P. A., Khattak, M. A., Merino, L. de la C., Del Vecchio, M., Rutkowski, P., … Long, G. V. (2023). Pembrolizumab versus placebo as adjuvant therapy in stage IIB or IIC melanoma: Final analysis of distant metastasis-free survival in the phase 3 KEYNOTE-716 study. Journal of Clinical Oncology, 41(17_suppl). doi.org/10.1200/JCO.2023.41.17_suppl.LBA9505.
11. Long, G. V., Del Vecchio, M., Weber, J., Hoeller, C., Grob, J.-J., Mohr, P., … Kirkwood, J. M. (2023). Adjuvant therapy with nivolumab versus placebo in patients with resected stage IIB/C melanoma(CheckMate76K) Winter Clinical Dermatology Conference, Hawaii (January 13–18, 2023) and Miami (February 17–20, 2023). jofskin.org/index.php/skin/article/view/2021/1667.
12. Eggermont, A., Kicinski, M., Blank, C., Mandala, M., Long, G., Mar, V., … Caroline, R. (2022). Five-Year Analysis of Adjuvant Pembrolizumab or Placebo in Stage III Melanoma. NEJM Evidence, 1. doi: 10.1056/EVIDoa2200214.
13. Long, G. V., Hauschild, A., Santinami, M., Atkinson, V., Mandalà, M., Chiarion-Sileni, V., … Kirkwood, J. M. (2017). Adjuvant Dabrafenib plus Trametinib in Stage III BRAF-Mutated Melanoma. N. Engl. J. Med. 9, 377(19), 1813–1823. doi: 10.1056/NEJMoa1708539.
14. Seth, R., Agarwala, S. S., Messersmith, H., Alluri, K. C., Ascierto, P. A., Atkins, M. B., … Weber J. (2023). Systemic Therapy for Melanoma: ASCO Guideline Update. J. Clin. Oncol., 20, 41(30), 4794–4820. doi: 10.1200/JCO.23.01136.
15. Patel, S. P., Othus, M., Chen, Y., Wright, G. P. Jr., Yost, K. J., Hyngstrom, J. R., … Ribas, A. (2023). Neoadjuvant-Adjuvant or Adjuvant-Only Pembrolizumab in Advanced Melanoma. N. Engl. J. Med. 2, 388(9), 813–823. doi: 10.1056/NEJMoa2211437.
16. Long, G. V., Menzies, A. M., & Scolyer, R. A. (2023) Neoadjuvant Checkpoint Immunotherapy and Melanoma: The Time Is Now. J. Clin. Oncol., 10, 41(17), 3236–3248. doi: 10.1200/JCO.22.02575.
17. Loibl, S., André, F., Bachelot, T., Barrios, C. H., Bergh, J., Burstein, H. J., … Harbeck, N. (2023). ESMO Guidelines Committee. Early breast cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up†. Ann. Oncol., 8, S0923-7534(23)05104-9. doi: 10.1016/j.annonc.2023.11.016. Epub. ahead of print. PMID: 38101773.
18. Gradishar, W. J., Moran, M. S., Abraham, J., Abramson, V., Aft, R., Agnese, D., … Kumar, R. (2023). NCCN Guidelines® Insights: Breast Cancer, Version 4, 2023. J. Natl. Compr. Canc. Netw., 21(6), 594–608. doi: 10.6004/jnccn.2023.0031.
19. Han, H. S., Vikas, P., & Stringer-Reasor, E. M. (2023) Early-Stage Triple-Negative Breast Cancer Journey: Beginning, End, and Everything in Between. American Society of Clinical Oncology Educational Book 2023, 43, ascopubs.org/doi/full/10.1200/EDBK_390464.
20. Cortazar, P., Zhang, L., Untch, M., Mehta, K., Costantino, J. P., Wolmark, N., … von Minckwitz, G. (2014) Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet. 12, 384(9938), 164–72. doi: 10.1016/S0140-6736(13)62422-8.
21. Schmid, P., Cortes, J., Dent, R., Pusztai, L., McArthur, H., Kümmel, S, … O’Shaughnessy, J. (2022). KEYNOTE-522 Investigators. Event-free Survival with Pembrolizumab in Early Triple-Negative Breast Cancer. N. Engl. J. Med. 10, 386(6), 556–567. doi: 10.1056/NEJMoa2112651.
22. Huang, M., O’Shaughnessy, J., Zhao, J., Haiderali, A., Cortés, J., Ramsey, S. D., … Fasching, P. A. (2020) Association of Pathologic Complete Response with Long-Term Survival Outcomes in Triple-Negative Breast Cancer: A Meta-Analysis. Cancer Res. 15, 80(24), 5427–5434. doi: 10.1158/0008-5472.CAN-20-1792.
23. Hu, H., & Kaklamani, V. (2023) Updates on the preoperative immunotherapy for triple-negative breast cancer. Transl. Breast Cancer Res., 4, 17. doi: 10.21037/tbcr-23-16.
24. Schmid, P., & Ferreira, M. (2020). P38: KEYNOTE-522 Study of Pembro + Chemo vs. Placebo + Chemo as Neoadjuvant Treatment Followed by Pembro vs. Placebo as Adjuvant Treatment for Early TNBC: Pathologic Complete Response in Key Subgroups, http://www.researchgate.net/ publication/352750092_P38_KEYNOTE-522_Study_of_Pembro_Chemo_vs_Placebo_Chemo_as_Neoadjuvant_Treatment_Followed_by_Pembro_vs_Placebo_as_Adjuvant_Treatment_for_Early_TNBC_Pathologic_Complete_
Response_in_Key_Subgroups.
25. Pusztai, L., Denkert, C., O’Shaughnessy, J., Cortes, J., Dent, R. A., McArthur, H. L., … Haven, C. T. N. (2022). Event-free survival by residual cancer burden after neoadjuvant pembrolizumab + chemotherapy versus placebo + chemotherapy for early TNBC: Exploratory analysis from KEYNOTE-522. JCO, 40, 503–503. doi: 10.1200/JCO.2022.40.16_suppl.503.
26. Schmid, P., Cortes, J., Dent, R. A., Pusztai, L., McArthur, H. L., Kummel, S., … O’Shaughnessy, J. (2023). LBA18 Pembrolizumab or placebo plus chemotherapy followed by pembrolizumab or placebo for early-stage TNBC: Updated EFS results from the phase III KEYNOTE-522 study. Annals of Oncology, 34, S1257. doi: 10.1016/j.annonc.2023.10.008.
27. Takahashi, M., Cortés, J., Dent, R., Pusztai, L., McArthur, H., Kümmel, S., … Schmid, P. (2023). Pembrolizumab Plus Chemotherapy Followed by Pembrolizumab in Patients With Early Triple-Negative Breast Cancer: A Secondary Analysis of a Randomized Clinical Trial. JAMA Netw. Open., 1, 6(11), e2342107. doi: 10.1001/jamanetworkopen.2023.42107.
Дар’я Полякова














Leave a comment