Огляд VI видання Японських рекомендацій з лікування раку шлунка
Лукашенко А.В., Черченко К.Д., Остапенко Ю.В., Пацко В.В., Разумейко І.В.
Резюме. Рак шлунка (РШ) — хвороба, яка має значні розбіжності за показниками захворюваності та смертності залежно від частини світу, що між певними країнами може становити більше ніж у 40 разів. Основний відсоток нових пацієнтів реєструють на Сході — Південна Корея, Китай, Японія та ін. Відповідно ці країни мають вузькоспеціалізовані напрямки в лікуванні РШ та тривалий позитивний досвід впровадження скринінгових програм. Скринінг у розвинених країнах Сходу змінив структуру захворюваності РШ, наприклад, у Японії — у бік виявлення ранньої стадії РШ більше ніж у половині первинних випадків. Це значно підвищило відсоток пацієнтів, які повністю виліковуються від РШ, а в терапії переважають малотравматичні методи малоінвазивної хірургії. У світі у 2023 р. РШ був 3-м у структурі смертності від онкопатології, щорічна захворюваність становить 1,1 млн нових випадків РШ із прогнозом до збільшення — 1,8 млн у 2040 р. В Україні від РШ у 2022 р. померло більше 4000 громадян, показник захворюваності становив 9,2 на 100 000 населення (6145 нових випадків), смертності — 6,7 на 100 000 населення, 48% пацієнтів померли протягом 1 року від моменту встановлення діагнозу. Для порівняння показник захворюваності РШ в Японії є одним з найнижчих у світі — 31,6 на 100 000 населення, показник смертності втричі нижчий — 8,2 на 100 000 населення, що свідчить про високу ефективність заходів протиракової боротьби, зокрема з РШ, що розроблені японськими фахівцями. Після публікації попереднього огляду Японських рекомендацій з лікування РШ у 2018 р. отримано результати кількох ключових рандомізованих досліджень з хірургічного лікування РШ, також сфокусованих на малоінвазивних ендоскопічних, лапароскопічних, роботизованих операціях. У напрямках медикаментозного лікування РШ, результати клінічних випробувань нових протипухлинних засобів сприяли значним змінам у клінічних рекомендаціях щодо вибору нових схем, які також включили напрямок імунотерапії. У цій публікації представлений огляд VI англомовного видання Японських рекомендацій з лікування раку шлунка (Japanese Gastric Cancer Treatment Guidelines) із наголосом на змінах до попередньої версії з урахуванням даних останніх клінічних досліджень.
Одержано 22.01.2024
Прийнято до друку 29.01.2024
DOI: 10.32471/clinicaloncology.2663-466X.53-1.31836
У цій роботі ми представляємо огляд VI англомовного видання Японських рекомендацій з лікування раку шлунка (Japanese Gastric Cancer Treatment Guidelines), опублікованих у 2023 р.
Основні напрямки уточнень у поточній версії Японських рекомендацій з лікування раку шлунка:
1. Оновлено 32 пункти, що включають хірургічне лікування, ендоскопічні операції, медикаментозну терапію та паліативну підтримку.
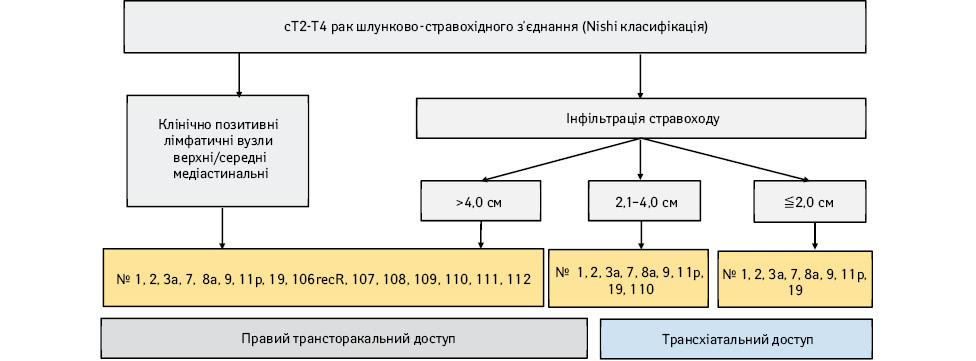
2. На основі результатів проспективного дослідження, проведеного спільно Японською асоціацією раку шлунка (Japanese Gastric Cancer Association) і Японською асоціацією раку стравоходу (Japanese Esophageal Cancer Association), уточнено алгоритми вибору варіанта операції та обсягу лімфатичної дисекції при РШ cT2–T4, оновлено відповідний алгоритм для карциноми стравохідно-шлункового з’єднання.
3. Оновлено рекомендації щодо лапароскопічної та роботизованої хірургії РШ за результатами останніх досліджень.
4. Оновлено схеми медикаментозної терапії для лікування неоперабельних пацієнтів із поширеним РШ. Автори дійшли висновків, що, незважаючи на розширення варіантів медикаментозного лікування, якісних доказів, отриманих шляхом прямого порівняння між кожним режимом терапії, на сьогодні не існує. Так, жодних пріоритетів тієї чи іншої схеми медикаментозного лікування для пацієнтів в Японії не встановлено.
5. Представлені результати останніх досліджень препаратів імунотерапії раку (інгібітори контрольних точок).
АЛГОРИТМ ЛІКУВАННЯ ХВОРИХ НА РШ, РЕКОМЕНДОВАНИЙ ДО ЗАСТОСУВАННЯ В КЛІНІЧНІЙ ПРАКТИЦІ
Алгоритм лікування хворих на РШ наведено на рис. 1. Визначення статусу пухлини (T/N/M та стадія) у цьому огляді базується на основі XV видання Японської класифікації раку шлунка [1], яке є ідентичним до класифікації VIII видання Міжнародного протиракового союзу (Union for International Cancer Control — UICC)/TNM [2].
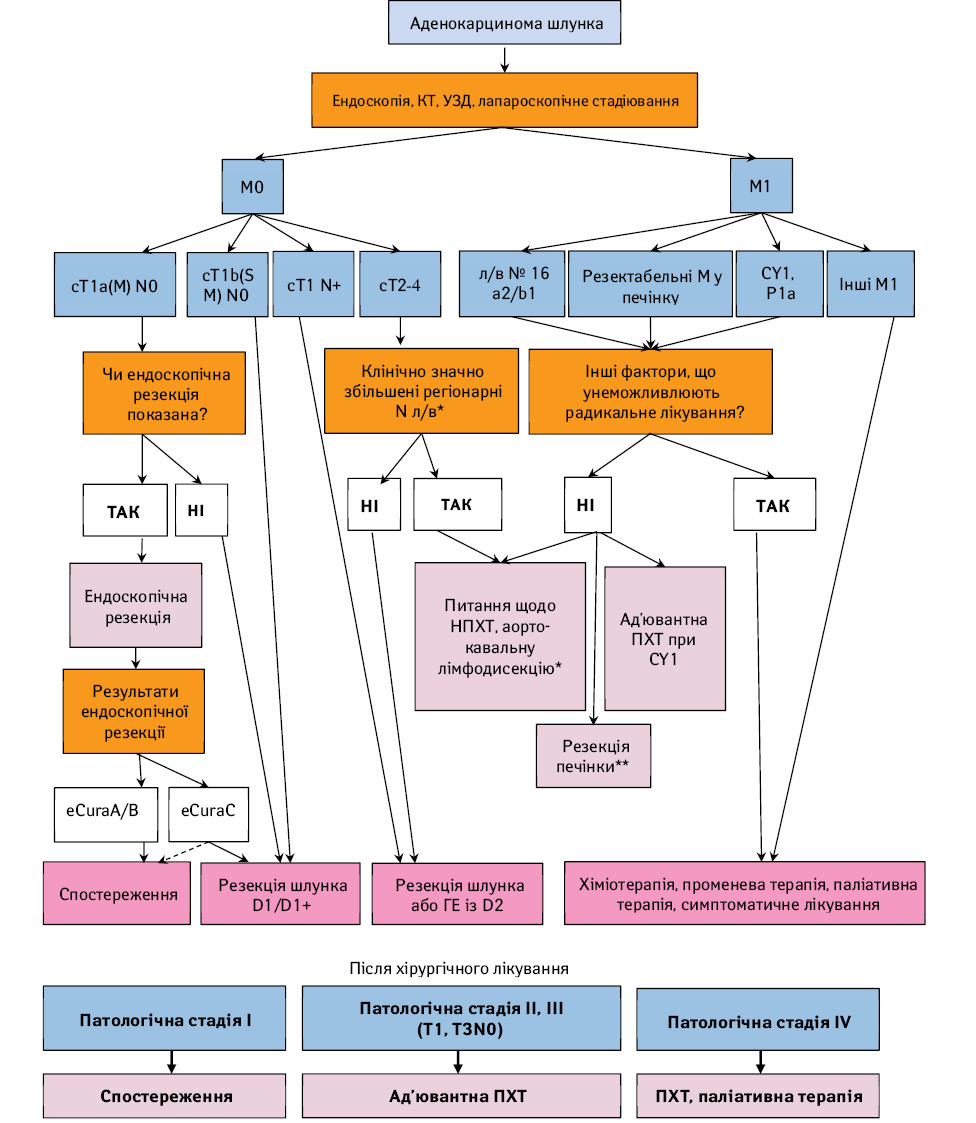
Обґрунтування TNМ-критеріїв та стадій на основі XV видання Японської класифікації раку шлунка [1]:
- N1: кількість метастатично уражених регіонарних лімфатичних вузлів становить 1–2 (регіонарні групи включають зони 1–12, 14v);
- N2: 3–6 вузлів;
- N3a: 7–15 вузлів;
- N3b: більше 16 вузлів;
- М1: метастази поза регіонарними лімфатичними вузлами (зокрема за даними цитологічного дослідження змиву черевної порожнини — CY1). Визначення стадії див. у табл. 1, 2.
| M0 | M0 | M1 | |
| N0 | N(+) | Будь-яке N | |
| T1 (M, SM)/T2 (MP) | I | IIA | IVB |
| T3 (SS)/T4a (SE) | IIB | III | IVB |
| T4b (SI) | IVA | IVA | IVB |
Примітки: M — пухлина не поширюється за мукозальний шар; SM — пухлина не поширюється за субмукозальний шар; SM — пухлина поширюється на м’язовий шар; SS — пухлина не поширюється за субсерозний шар; SE — пухлина поширюється на серозний шар; SI — пухлина поширюється на суміжні органи.
| M0 | M0 | M0 | M0 | M0 | M1 | |
| N0 | N1 | N2 | N3а | N3b | будь-яке N | |
| T1a (M) pT1b (SM) | IA | IB | IIA | IIB | IIIB | IV |
| T2 (MP) | IB | IIA | IIB | IIIA | IIIB | IV |
| T3 (SS) | IIA | IIB | IIIA | IIIB | IIIC | IV |
| T4a (S) | IIB | IIIA | IIIA | IIIB | IIIC | IV |
| T4b (SI) | IIIA | IIIB | IIIB | IIIC | IIIC | IV |
Примітки: M — пухлина не поширюється за мукозальний шар; SM — пухлина не поширюється за субмукозальний шар; SM — пухлина поширюється на м’язовий шар; SS — пухлина не поширюється за субсерозний шар; SE — пухлина поширюється на серозний шар; SI — пухлина поширюється на суміжні органи.
Відповідно до такої версії рекомендацій виконання позитронно-емісійної комп’ютерної томографії (ПЕТ-КТ) для стадіювання РШ має слабку доказову базу — рівень доказовості С.
Роль лапароскопічного стадіювання у визначенні подальшої тактики лікування є незначною у пацієнтів із сукупними ознаками дисемінації пухлини в очеревині, чутливість та специфічність цитологічних змивів черевної порожнини залишається низькою. Ця процедура особливо корисна для хворих на місцево-поширений РШ, яким може бути показана неоад’ювантна ПХТ (НПХТ). Але в наведеній версії рекомендацій вона має слабку доказову базу — рівень доказовості С.
КЛАСИФІКАЦІЯ ХІРУРГІЧНИХ ВТРУЧАНЬ ПРИ РШ
Стандартні оперативні втручання. Субтотальна резекція шлунка (резекція щонайменше 2/3 шлунка), гастректомія (ГЕ) (повне видалення шлунка) з D2 лімфодисекцією.
Нестандартні оперативні втручання. У нестандартній операції обсяг резекції шлунка та/або лімфодисекції змінюється залежно від стадії раку. Ця категорія включає модифіковані та розширені хірургічні втручання.
Модифіковані оперативні втручання. Обсяг резекції шлунка та/або лімфодисекції зменшується (D1, D1+ і т.д.) порівняно зі стандартною хірургічною операцією.
Розширені оперативні втручання:
1) субтотальна резекція або ГЕ з комбінованим видаленням або резекцією суміжних органів, що уражені місцево-поширеною пухлиною;
2) субтотальна резекція або ГЕ з розширеною лімфодисекцією, що перевищує D2.
Нерадикальні хірургічні втручання. Нерадикальні хірургічні втручання можуть бути запропоновані хворим, яких визнано інкурабельними (невиліковними). Ці операції поділяються на паліативні та циторедуктивні хірургічні втручання залежно від мети.
Паліативні, симптоматичні хірургічні втручання. У пацієнтів з поширеним/метастатичним РШ можуть розвинутися серйозні ускладнення, такі як кровотеча, стеноз. Як опція, може бути розглянуте оперативне втручання для усунення цих симптомів. Залежно від резектабельності первинної пухлини та хірургічних ризиків найліпшим вибором є паліативна резекція шлунка або гастроєюностомія. Паліативні втручання при стенозі шлунка мають значний вплив на відновлення природного харчування [3] та підтримки задовільної якості життя [4].
Циторедуктивні (R2) операції. Циторедуктивну хірургію визначають як резекцію шлунка або ГЕ, що виконана у пацієнтів з інкурабельними факторами, такими як метастази в печінку та перитонеальний канцероматоз, у разі відсутності симптомів та ускладнень, пов’язаних з розвитком пухлини, таких як кровотеча або обструкція.
Циторедуктивні операції спрямовані на продовження тривалості життя або відстрочення розвитку симптомів РШ шляхом зменшення об’єму пухлини. У міжнародному мультицентровому рандомізованому контрольованому дослідженні REGATTA, JCOG0705/KGCA01 не отримано жодних доказів на підтримку ефективності циторедуктивної хірургії при РШ [5]. Цей тип операцій не рекомендований при РШ.
Класифікація оперативних втручань при РШ:
- ГЕ або тотальна ГЕ (повне видалення шлунка), що включає кардію і пілорус;
- дистальна субтотальна резекція шлунка (ДСРШ), що включає пілорус. Зберігається кардіальний відділ шлунка. При стандартній ДСРШ 2/3 шлунка мають бути видалені;
- пілорусзберігаюча резекція шлунка (ПЗРШ). Резекція шлунка, при якій зберігається верхня третина шлунка і пілорус разом з частиною антрума;
- проксимальна резекція шлунка (ПРШ). Резекція, що включає кардію (шлунково-стравохідний перехід). Зберігається пілорус;
- сегментарна резекція. Циркулярна резекція шлунка зі збереженням кардії та пілоруса;
- локальна резекція;
- нерезекційна операція (шунтування, гастростомія, єюностомія).
Класифікація варіантів резекції при раку кукси шлунка:
- завершальна ГЕ. Тотальне видалення кукси шлунка, що також включає кардію або пілорус, залежно від попередньо виконаної резекції;
- субтотальна резекція кукси шлунка. Дистальна резекція кукси шлунка зі збереженням кардії.
ВИЗНАЧЕННЯ ОБСЯГУ РЕЗЕКЦІЇ ШЛУНКА
Край резекції. Рекомендований проксимальний край резекції щонайменше 3 см для T2 та більш глибоких пухлин з експансивним типом росту (класифікація за Borrmann, типи 1 і 2) і 5 см при РШ інфільтративного типу росту (класифікація за Borrmann, типи 3 та 4) (рис. 2). Коли не можуть бути дотримані ці правила, то доцільно розглянути «чистоту» проксимального краю резекції за допомогою інтраопераційної експрес-біопсії (замороженої секції). Для РШ, що поширюється на стравохід, межа 5 см не є обов’язковою, але для забезпечення резекції R0 бажано провести дослідження замороженої секції лінії резекції.
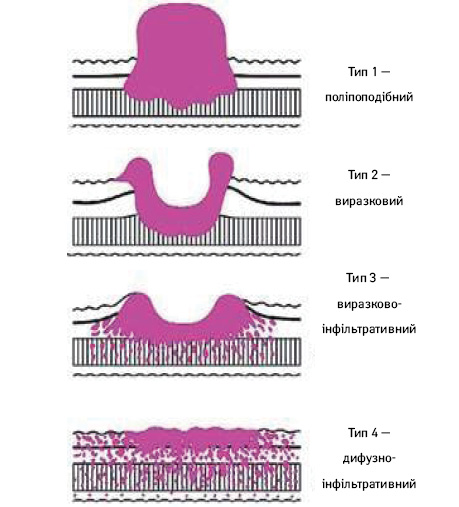
Для пухлин Т1 необхідно дотримуватися відстані 2 см від краю пухлини. Коли при ранньому РШ межа пухлини неясна, передопераційне ендоскопічне маркування кліпсами межі пухлини на основі результатів біопсії буде корисним для ухвалення рішення щодо лінії резекції.
Відбір обсягу резекцій шлунка. При клінічних ознаках метастазів у регіонарні лімфатичні вузли (сN+) або при РШ Т2–Т4а рекомендована ГЕ або ДСРШ. ДСРШ є достатнім обсягом операції за умови дотримання негативного проксимального краю резекції. У разі неможливості отримати достатній проксимальний край резекції шляхом ДСРШ, операцією вибору є ГЕ. При інвазії РШ у підшлункову залозу, коли є потреба у виконанні панкреатоспленектомії, показано виконання ГЕ незалежно від місця знаходження пухлини в шлунку. Якщо пухлина розміщена вздовж великої кривизни та наявні метастази в лімфатичні вузли групи N4sb, рекомендована ГЕ зі спленектомією, навіть якщо первинна пухлина може бути видалена за допомогою ДСРШ. При аденокарциномі, що локалізована в зоні гастроезофагеального переходу, рекомендовано виконання резекції стравоходу із ПРШ та подальшою реконструкцією трансплантатом із кукси шлунка, або ГЕ із резекцією стравоходу та пластикою тонкокишковим або товстокишковим трансплантатом.
При РШ cT1N0 рекомендовані такі види резекції шлунка залежно від локалізації пухлини:
- ПЗРШ: при пухлинах у середній частині шлунка з дистальним краєм пухлини на відстані принаймні 4 см від пілоруса;
- ПРШ: для пухлин верхньої третини шлунка, коли більше ніж половина шлунка може бути збережена;
- сегментарна резекція і локальна резекція із контролем «сторожового вузла» можуть розглядатися тільки як напрямки клінічних досліджень.
Вибір обсягу лімфодисекції. Обсяг лімфодисекції за критеріями D-рівня класифікують на D1, D1+ або D2, зони дисекції визначають відповідно до типу резекції шлунка. Варіанти виконання цих обсягів дисекції наведені далі. Також окремо представлені обсяги дисекції для раку шлунка, що поширюється на стравохід.
Коли ступінь виконаної лімфодисекції не повною мірою відповідає критеріям D рівня, група лімфатичних вузлів, яка була додатково видалена або залишена in situ, може бути записана у наступний спосіб: D1(+N8a) або D2(−N12а).
D1 лімфодисекція показана при РШ сT1a, що не відповідає критеріям для ендоскопічної мукозальної/субмукозальної резекції (ЕМР/ЕСР), а також при РШ сT1bN0 диференційованого типу діаметром ≤1,5 см.
D1+ лімфодисекція показана при РШ T1N0, що не підпадає під критерії D1 і D2.
D2 лімфодисекція показана при РШ сT2–T4, а також сT1N+. Профілактична спленектомія або дисекція лімфовузлів воріт селезінки не рекомендовані, якщо пухлина не поширюється на велику кривизну шлунка (рівень консенсусного рішення 100%, рівень доказовості А) [7]. Профілактична спленектомія або дисекція лімфовузлів воріт селезінки при пухлинах, що поширюються на велику кривизну шлунка, має слабку рекомендаційну базу (рівень консенсусного рішення 87,5%, рівень доказовості С).
D2 + лімфодисекція розширення лімфодисекції понад D2 класифікується як нестандартна резекція і може бути розглянута в наступних випадках (хоча вагомих доказів безпеки цієї процедури немає):
- дисекція групи N10 (лімфатичні вузли воріт селезінки) з або без видалення селезінки при раку верхнього відділу шлунка з поширенням на велику кривизну (D2+N10);
- дисекція групи N14v (лімфатичний вузол зони передньої поверхні верхньої брижової вени) при раку дистального відділу шлунка з метастазуванням у лімфатичні вузли групи N6 (D2+N14v);
- дисекція лімфовузлів групи N13 (лімфатичний вузол на задній поверхні голівки підшлункової залози) при РШ, що поширюється на дванадцятипалу кишку (D2+N13) [8]. Метастази в лімфатичні вузли групи N13, які не включені до регіональних лімфатичних вузлів при РШ, зазвичай слід класифікувати як М1. Однак, оскільки вузли групи N13 входять до числа регіонарних лімфатичних вузлів для раку дванадцятипалої кишки за класифікацією TNM і Японською класифікацією РШ (15-те видання), їх слід вважати регіональними лімфатичними вузлами у випадку, коли РШ поширюється на дванадцятипалу кишку;
- дисекція групи N16 (аортокавальна група лімфатичних вузлів) при РШ із поширеним ураженням лімфатичних вузлів (D2+N16). Підхід, що включає комбінацію НПХТ із подальшою розширеною лімфодисекцією в таких клінічних випадках, як гранично-резектабельні метастази в лімфатичні вузли груп N16a2/b1, має слабку доказову базу, навіть за наявності вираженого ефекту виконання НПХТ (рівень доказовості С).
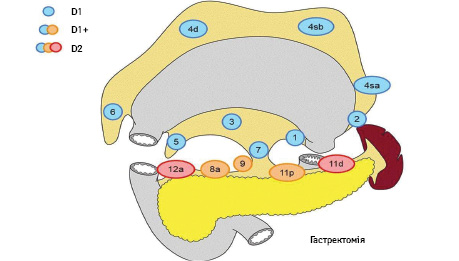
Вибір обсягу лімфодисекції при ГЕ (рис. 3):
- D0: лімфодисекція менше ніж D1;
- D1: N 1–7;
- D1+: D1 + N 8a, 9, 11p;
- D2: D1 + N 8a, 9, 10, 11p, 11d, 12a.
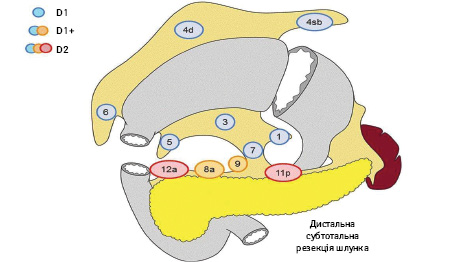
Вибір обсягу лімфодисекції при ДСРШ (рис. 4):
- D0: лімфодисекція менше ніж D1;
- D1: N 1, 3, 4sb, 4d, 5, 6, 7;
- D1+: D1 + N 8a, 9;
- D2: D1 + N 8a, 9, 11p, 12a.
Вибір обсягу лімфодисекції при ПЗРШ (рис. 5):
- D0: лімфодисекція менше ніж D1;
- D1: N 1, 3, 4sb, 4d, 6, 7;
- D1+: D1+ N 8a, 9.
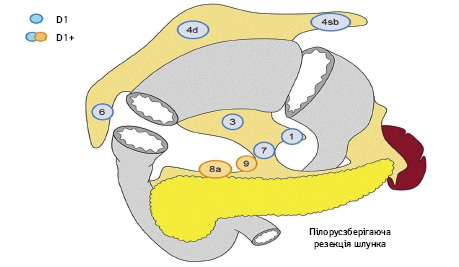
Відповідно до наведеної версії рекомендацій, виконання ПЗРШ, навіть при ранніх формах раку середньої третини шлунка, має слабку доказову базу — рівень доказовості С.
Вибір обсягу лімфодисекції при ПРШ (рис. 6):
- D0: лімфодисекція менше ніж D1;
- D1: N 1, 2, 3a, 4sa, 4sb, 7;
- D1+: D1 + N 8a, 9, 11p;
- D2: D1 + N 8a, 9, 11p, 11d.
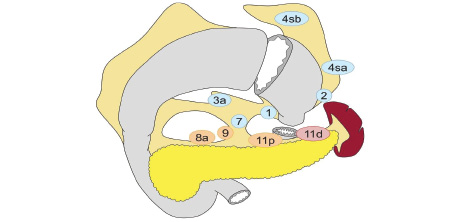
Для РШ, що поширюється на стравохід: D2 лімфодисекція повинна додатково включати N19, 20, 110; при РШ, що поширюється на стравохід, лімфовузли N110 (нижні грудні параезофагальні лімфовузли знаходяться біля нижньої частини стравоходу) видаляються для досягнення достатнього краю резекції. Коли езофагектомія та ПРШ проводяться через карциноми стравохідно-шлункового з’єднання, визначення лімфовузлів N110 відповідає Японській класифікації раку стравоходу.
Відповідно до цієї версії рекомендацій виконання ПРШ при РШ проксимальних відділів cT1N0 має слабку доказову базу — рівень доказовості С.
Вибір обсягу лімфодисекції при раку кукси шлунка
При пухлинах ≥cT2 рекомендується лімфодисекція регіонарних лімфатичних вузлів шлунка, які не були видалені під час первинної операції. Рутинна лімфатична дисекція вузлів воріт селезінки (N10), або профілактична спленектомія не рекомендовані — такий агресивний підхід має слабку доказову базу, рівень доказовості D.
Рак стравохідно-шлункового сполучення
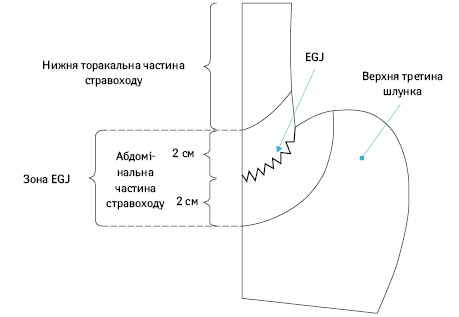
Поточне видання Японських рекомендацій з лікування РШ визначає зони лімфодисекції відповідно до вибору обсягу резекції шлунка і стравоходу, а не локалізації пухлини.
В Японській класифікації РШ рак стравохідно-шлункового сполучення був визначений як аденокарцинома або плоскоклітинний рак з центром, локалізованим у межах 2 см від стравохідно-шлункового сполучення. Наразі немає консенсусу за типом резекції та обсягом лімфодисекції, які були б стандартом у лікуванні при раку стравохідно-шлункового сполучення. Японська асоціація раку шлунка (Japanese Gastric Cancer Association) і Японська асоціація раку стравоходу (Japanese Esophageal Cancer Association) об’єднали зусилля для проведення загальнонаціонального дослідження раку стравохідно-шлункового сполучення сТ2–Т4 з акцентом на зони уражених регіонарних лімфатичних вузлів [9]. Встановлена залежність ризику метастазів у лімфатичних вузлах від ступеня поширеності раку шлунка стравоходом: низька вірогідність ураження медіастинальних лімфатичних вузлів при ураженні стравоходу <2 см, особливо при <1 см; висока вірогідність ураження нижніх медіастинальних лімфатичних вузлів (зона N110), але низька вірогідність ураження верхніх і середніх медіастинальних груп при пухлинній інвазії стравоходу від 2,1 до 4,0 см; висока вірогідність ураження всіх груп медіастинальних лімфатичних вузлів при поширенні пухлини на стравохід >4 см.
На основі дослідження побудовано алгоритм вибору обсягу лімфодисекції відповідно до локалізації пухлини, морфології та з урахуванням Т-критерію (рис. 7) — відповідно рекомендації до видалення зон лімфатичних вузлів із ризиком розвитку метастазів >10%. Проте немає даних про віддалені результати такого підходу, однак на сьогодні цей алгоритм відповідно до класифікації Nishi (рис. 8, 9) рекомендований при раку стравохідно-шлункового сполучення із поширенням cT2 і більше.
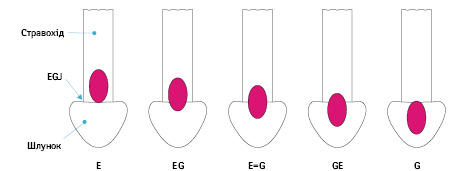
Вибір обсягу резекції стравоходу і шлунка для раку стравохідно-шлункового сполучення
Операцією вибору може бути: ПРШ з або без резекції нижньої частини стравоходу, ГЕ з або без резекції нижньої частини стравоходу, резекція стравоходу з резекцією верхньої частини шлунка. Проте наразі рекомендація ПРШ для лікування раку стравохідно-шлункового сполучення має слабкий доказовий рівень — С.
Розширення обсягу лімфодисекції для раку стравохідно-шлункового сполучення
Лімфодисекція, як показано в алгоритмі, наведеному на рис. 7, є орієнтовною рекомендацією, однак перевага у виживаності більш обширної лімфодисекції не може бути спростована в цей час. Проте при пухлинах із інвазією стравоходу <2 см, хірурги, як правило, видаляють нижні медіастинальні лімфатичні вузли зони 110 єдиним комплексом з ділянкою стравоходу для отримання впевненого «чистого» краю резекції стравоходу. Стосовно розширення лімфодисекції на параортальну групу лімфатичних вузлів (N16a2lat) при раку стравохідно-шлункового з’єднання за 2 спроби голосування не досягнуто консенсусного рішення (рівень рекомендацій С).
Рівень лімфодисекції для раку стравохідно-шлункового з’єднання повинен бути визначений відповідно до обсягу для ГЕ або ПРШ, як представлено на рис. 2 і 5, із відповідним розширенням на групи 106recR, 107, 108, 109, 111 та 112 при пухлинах, що поширюються на стравохід більше ніж на 4 см.
Хірургічний доступ до нижньої частини стравоходу. При РШ, що поширюється на стравохід ≤3 см від дистального відділу стравоходу, рекомендованим є трансхіатальний абдомінальний доступ (JCOG9502) [12]. Трансторакальний доступ показаний, коли є ураження стравоходу >3 см, враховуючи нещодавні рекомендації до видалення всіх груп медіастинальних лімфатичних вузлів при поширенні онкопатології на стравохід більше ніж на 4 см. Трансхіатальний доступ також може бути використаний при пухлинах, що поширюються на стравохід <4 см, за умови забезпечення надійної техніки формування анастомозу.
ІНШЕ
Збереження блукаючого нерва. Збереження печінкової гілки переднього та/або черевної гілки заднього блукаючих нервів сприяє поліпшенню післяопераційної якості життя завдяки зниженню ризику розвитку жовчних каменів, діареї та/або втрати маси тіла після резекції шлунка. У разі ПЗРШ печінкова гілка блукаючого нерва має бути збережена для підтримання задовільної функції пілоруса, але підхід до виконання ПЗРШ при ранній стадії раку середньої третини шлунка на сьогодні має слабку рекомендаційну базу — С.
Видалення великого сальника. Оментектомія, як правило, включена до стандарту при резекції шлунка у хворих на РШ T3 (проростання серозного шару) або більш поширених пухлин. Проте рівень доказовості цього підходу розцінюється як слабкий — С. При РШ T1/T2 великий сальник може бути збережений на відстані >3 см від шлунково-сальникової аркади. Зараз продовжується дослідження (JCOG1711) цього підходу при пухлинах на стадії Т3.
Бурсектомія. При РШ, що проростає в серозну оболонку задньої стінки шлунка, виконання бурсектомії (видалення очеревини сальникової сумки) запропоновано з метою абластики мікроскопічних метастазів у цій зоні. Однак виконання цієї процедури не сприяло позитивному впливу на загальну виживаність відповідно до результатів масштабного рандомізованого дослідження JCOG1001 як за загальним результатом, так і при порівняльному аналізі підгруп із пухлинами на стадії T4a, та пухлинами, локалізованими в задній стінці шлунка [13].
Комбіновані (мультивісцеральні) резекції рекомендовані при місцево-поширеному РШ, що уражує суміжні органи.
Хірургічне лікування РШ із метастазами в печінку можливе за умов невеликої кількості вогнищ та відсутності інших зон метастазування, але відповідно до вказаної версії рекомендацій такий підхід має слабку доказову базу.
Лапароскопічна хірургія РШ. Ефективність лапароскопічної ДСРШ при клінічній І стадії РШ порівняно із відкритою ДСРШ підтверджена у фазі 3 рандомізованих контрольованих клінічних досліджень, проведених у Японії та Південній Кореї (JCOG0912, KLASS-01) [14, 15]. Тому лапароскопічну ДСРШ при І клінічній стадії РШ рекомендовано як один зі стандартних варіантів лікування (рівень доказовості А). Доцільність лапароскопічної ГЕ або ПРШ також підтверджено в одногруповому клінічному дослідженні (JCOG1401) [16]. Питання безпеки ГЕ або ПРШ при виконанні лапароскопічним шляхом наведені в єдиному на сьогодні рандомізованому дослідженні JCOG1401, в якому показник неспроможності стравохідно-єюнального анастомозу становив 2,5% (6/244, 95% довірчий інтервал (ДІ) 0,9–5,3), що відповідає необхідному рівню безпеки та може бути орієнтиром для оцінки якості роботи хірургічних бригад.
Віддалені результати дослідження JCOG0912 можна екстраполювати на ГЕ або ПРШ при I клінічній стадії. Однак оскільки дані про виживаність у дослідженні не були чітко повідомлені, лапароскопічна ГЕ або ПРШ має слабку рекомендаційну базу (рівень доказовості С). В Японії лапароскопічні хірургічні процедури може виконувати лише кваліфікований хірург, що відповідає системі кваліфікації навичок ендоскопічної хірургії Японського товариства ендоскопічної хірургії (Japanese Society of Endoscopic Surgery — JSES), або хірург під керівництвом інструктора з еквівалентними навичками.
Для оцінки можливостей лапароскопії при поширеному РШ в Японії, Південній Кореї та Китаї проведені широкомасштабні рандомізовані клінічні дослідження (JLSSG0901, KLASS-02, CLASS-01), що підтвердили безпеку та порівнянні віддалені результати лапароскопічної ДСРШ із відкритою ДСРШ [17–19]. При лапароскопічних доступах не відмічали збільшення кількості післяопераційних ускладнень. У дослідженнях CLASS-01 [20] і KLASS-02 [21] також підтверджено рівноцінну загальну 5-річну тривалість життя після лапароскопічної ДСРШ порівняно з відкритою операцією. В Японії у дослідженні JLSSG0901 встановлено значне зниження крововтрати в групі лапароскопічної ДСРШ (30 мл) на тлі збільшення тривалості операцій у середньому на 60 хв порівняно з дослідженнями CLASS або KLASS, що свідчить про відмінності в лапароскопічній хірургічній техніці в зазначених 3 країнах. Відповідно ця версія рекомендацій (рекомендації японською мовою, видані у 2021 р.) визначає лапароскопічні операції при РШ II/III стадій як не рекомендовані (рівень доказовості С) до отримання результатів дослідження JLSSG0901. Повідомляємо, що в нещодавно опублікованих результатах дослідження JLSSG0901 у 2023 р. встановлені порівнянні віддалені результати лапароскопічних операцій — 5-річна тривалість життя 75,7% проти 73,9% у групі відкритих операцій при РШ, II/III стадій, що очікувано стане підґрунтям до змін у наступній, VII версії Японських рекомендацій [22].
Робот-асистована хірургія. Робот-асистовану хірургію РШ схвалено для покриття медичним страхуванням в Японії у 2018 р. і відповідно впроваджено в багатьох закладах для проведення більш складних операцій. Японські дослідники повідомили про зменшення кількості післяопераційних ускладнень у групах роботизованої хірургії порівняно з лапароскопічною. Однак оскільки ці дослідження були непорівняльні або ретроспективні, не зафіксовано чітких переваг роботизованої хірургії РШ [23, 24]. Триває рандомізоване контрольоване дослідження (JCOG1907) для визначення переваг роботизованої хірургії над лапароскопічною в терапії РШ T1–2 N0–2 з точки зору післяопераційних ускладнень. Наразі робот-асистована хірургія РШ I клінічної стадії має слабку доказову базу (рівень доказовості С).
Рекомендовані методи реконструкції після ГЕ:
- езофагоєюностомія за Ру;
- інтерпозиція сегмента тонкого кишечнику;
- метод «подвійного тракту».
Кожен метод відновного етапу після ГЕ має свої переваги і недоліки. Функціональні переваги реконструкції шляхом формування резервуара ще не встановлені.
Рекомендовані методи реконструкції після ДСРШ:
- гастродуоденостомія за Більрот І;
- гастроєюностомія за Більрот ІІ;
- гастроєюностомія за Ру;
- інтерпозиція сегмента тонкого кишечнику.
Рекомендована реконструкція після ПЗРШ:
- гастростомія.
Рекомендовані методи реконструкції після ПРШ:
- езофагогастростомія;
- інтерпозиція сегмента тонкого кишечнику;
- метод «подвійного тракту».
Ендоскопічні резекції на ранній стадії РШ
ЕМР. При цій операції зона ураження разом із навколишньою слизовою оболонкою «піднімається» шляхом інфільтрації підслизового шару ін’єкціями фізіологічного розчину (нормо- або гіпертонічного) і видаляється з використанням ендоскопічної петлі [25, 26].
ЕСР. Слизову оболонку, що оточує ураження, вирізають по колу з використанням високочастотної коагуляції (зазвичай з ізоляцією), підслизовий шар відділяють від м’язового шару [27–29].
Морфологічний аналіз видаленого РШ на ранній стадії повинен допомогти визначити диференційований або недиференційований морфологічний варіанти. 1-й включає папілярну аденокарциному (pap) і тубулярну аденокарциному (tub1, tub2). 2-й — погано диференційовану аденокарциному (por1, por2) і каблучкоподібну карциному (sig).
У разі виявлення муцинозної аденокарциноми (muc) у підслизовому шарі операційний препарат класифікують як недиференційований незалежно від того, чи походить він від диференційованого, чи недиференційованого типу.
Гістологічне превалювання та внутрішньопухлинні виразкові (UL) знахідки. Пухлина, що формується з компонентів як диференційованого, так і недиференційованого типу, класифікується за 1 із 2 типів відповідно до кількісної переваги. Крім того, якщо в пухлині виявлено більше 1-го гістологічного типу, усі гістологічні типи слід реєструвати в порядку кількісного превалювання, наприклад tub2>tub1.
Діагноз UL1 встановлюють на основі морфологічного доказу знайдених виразкових уражень. Однак при встановленні остаточного діагнозу слід також враховувати ендоскопічні та/або радіологічні дані. У разі ендоскопічного видалення рубця зазвичай морфологічне дослідження виявляє фіброз, обмежений невеликими ділянками, локалізованими прямо під м’язовою пластинкою слизової оболонки [30]. Однак, якщо його не можна відрізнити від рубця після виразки, слід класифікувати як UL1.
Показання до ендоскопічної резекції РШ
Ендоскопічна резекція рекомендована при РШ на ранній стадії, який має дуже низьку ймовірність розвитку метастазів у лімфатичні вузли і можливий для резекції en bloc [31, 32]. Утворення, що технічно можна ендоскопічно видалити, розподіляють на 3 групи залежно від рівня отриманої доказової бази.
Пухлина, що підлягає ендоскопічній резекції як стандартне лікування (абсолютні показання), визначається як пухлина з імовірністю метастазування в регіонарні лімфатичні вузли <1%. Для цієї групи пацієнтів результати ендоскопічної резекції не відрізняються від радикальної хірургічної терапії.
Пухлина, що підлягає ендоскопічній резекції в межах клінічного дослідження (розширені показання), визначається як пухлина, для якої відсутня достатня доказова база за віддаленими результатами лікування після ендоскопічної резекції, хоча ймовірність наявності метастазів у лімфатичних вузлах становить <1%.
Пухлина, що підлягає ендоскопічній резекції через певні обставини (відносні показання), визначається як пухлина, яку за звичайних умов показано лікувати стандартним хірургічним втручанням, але ендоскопічна резекція може вилікувати пацієнта, а також може бути варіантом терапії в разі неможливості проведення стандартної операції.
Абсолютні показання до ЕМР/ЕСР РШ [33–35]
ЕМР або ЕСР визначають як стандартний підхід при аденокарциномі диференційованого типу без знахідок виразкування (UL0), при глибині інвазії, клінічно визначеній як T1a, і діаметрі ≤2 см.
Абсолютні показання до ЕСР РШ:
- аденокарцинома диференційованого типу без виразкових ознак (UL0), при глибині інвазії клінічно визначеній як T1a, діаметр >2 см;
- аденокарцинома диференційованого типу з виразковими ознаками (UL1), при глибині інвазії клінічно визначеній як T1a і діаметрі ≤ 3 см;
- аденокарцинома недиференційованого типу без виразкових ознак (UL0), при глибині інвазії клінічно визначеній як T1a, діаметр ≤2 см.
Розширені показання до ендоскопічної резекції РШ [36]
Місцевий рецидив, при якому глибину інвазії клінічно діагностують як T1a, після проведення первинної ендоскопічної резекції — ендоскопічну радикальність (eCura) C-1, наведену нижче, для пухлин з абсолютними показаннями та аденокарцином диференційованого типу.
Пухлини цієї категорії виключені з абсолютних показань до ендоскопічної резекції через відсутність довгострокових результатів клінічних досліджень, певні зміни можуть бути внесені в рекомендації після отримання фінальних результатів дослідження JCOG1009/1010 [37].
Відносні показання до ендоскопічної резекції РШ
Стандартне радикальне лікування — рекомендовано при РШ у випадках, які не підходять під критерії абсолютних та розширених показань до проведення ендоскопічної резекції. Однак ендоскопічна резекція може бути виконана пацієнтам літнього віку та пацієнтам з високим ризиком розвитку ускладнень і вираженою супутньою патологією. Такий клінічний випадок може підпадати під відносні показання до виконання ендоскопічної резекції.
Рекомендації до ендоскопічної резекції для місцевого рецидиву після ЕМР/ЕСР
Місцеві рецидиви РШ після ЕМР/ЕСР, які виконували за абсолютними показаннями, можна вважати такими, що відповідають критеріям розширених показань. У такому разі може бути запропонована інша ЕСР. Однак з огляду на недостатність доказів щодо довгострокової виживаності повторну ЕСР слід розглядати як напрямок клінічних досліджень.
Визначення радикальності ендоскопічної резекції РШ потребує оцінки 2 факторів: повнота видалення первинної пухлини та ризик розвитку регіонарних метастазів.
Радикальність типу А (eCuraA)
Ендоскопічна резекція РШ класифікується як тип А (eCuraA), коли виконані наступні умови:
- пухлина без виразкового компонента (UL0);
- en bloc резекція;
- будь-який розмір пухлини;
- гістологічно домінантний диференційований тип;
- pT1a;
- негативний горизонтальний край резекції (HM0);
- негативний вертикальний край резекції (VM0);
- відсутність лімфоваскулярної інфільтрації (Ly0, V0).
Однак, якщо недиференційований компонент ураження становить більше 2 см, ендоскопічна радикальність класифікується як тип C-2 (eCuraC-2).
Коли в препараті виявлено виразковий компонент (UL1), резекція вважається eCuraA за умови виконання пунктів:
- en bloc резекція;
- розмір пухлини ≤3 см;
- гістологічного домінування диференційованої аденокарциноми;
- pT1a;
- HM0, VM0, Ly0, V0.
Радикальність типу В (eCuraВ)
Резекція класифікується як тип В (eCuraВ) для гістологічно превалюючої недиференційованої аденокарциноми, коли наступні умови виконані:
- UL0;
- en bloc резекція;
- pT1a;
- HM0, VM0, Ly0, V0;
- розміри пухлини ≤2 см.
Резекція також може бути класифікована як eCuraB при pT1b пухлинах, якщо виконані наступні умови:
- en bloc резекція;
- гістологічно превалює диференційована карцинома;
- pT1b1 (SM1) (< 500 µм від м’язового шару);
- HM0, VM0, Ly0, V0;
- розміри пухлини ≤3 см.
Однак, якщо недиференційований компонент інфільтрує підслизовий шар, ендоскопічна резекція класифікується як eCuraС-2 [38].
Радикальність типу С (eCurаС)
Резекція визначається як тип С (eCuraС), коли результати гістологічного дослідження не підходять під критерії eCuraА та eCuraВ.
Резекція класифікується як тип С-1 (eCuraС-1) за умови гістологічного превалювання диференційованої карциноми та виконання інших критеріїв eCuraА та eCuraВ, але резекція не була en bloc або має позитивний край резекції. Інші eCuraС резекції класифікуються як тип С-2 (eCuraС-2).
Тактика лікування після ендоскопічної резекції (рис. 10)
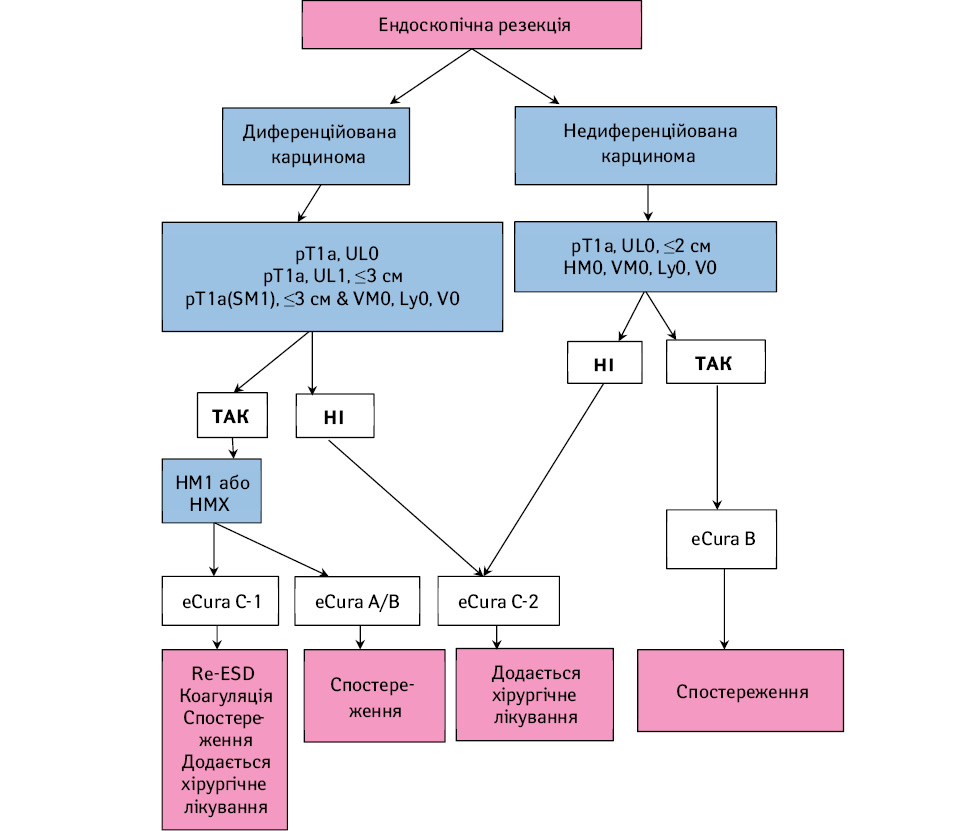
Лікування повинно визначатися після ретельного морфологічного дослідження.
Лікування після ендоскопічної резекції типу eCuraA або eCuraB
Контрольна ендоскопія рекомендована 1 або 2 рази на рік після резекції типу eCuraA [39].
Додатково до ендоскопії рекомендоване проведення УЗД органів черевної порожнини або спіральна КТ для виключення метастазів при резекції eCuraB [40]. Для обох типів резекції eCuraA та eCuraB рекомендоване визначення Helicobacter pylori та за наявності позитивного результату — ерадикація [41–43]. Враховуючи тривалі ризики метахронного РШ — є потреба в тривалому спостереженні.
Лікування після ендоскопічної резекції типу eCuraС-1
Оскільки ризик розвитку метастазів у лімфатичні вузли низький, після отримання згоди пацієнта можна вибрати одну з наступних альтернатив згідно з політикою закладу: повторна ЕСР, хірургічна резекція, ретельне спостереження з очікуванням ефекту опіку від початкового ЕСР та ендоскопічна коагуляція з використанням лазерного або аргоноплазмового коагулятора [44].
Якщо пухлина диференційованого типу ≤3 см, UL1 або pT1b1 (SM1), розмір залишкового ураження слизової оболонки слід повторно оцінити за допомогою ендоскопії. Коли сума довжин резекції та залишкового ураження перевищує 3 см, резекцію шлунка з лімфодисекцією слід вважати стандартом лікування. Крім того, пацієнтам з позитивним горизонтальним краєм у межах ділянки підслизової інвазії слід рекомендувати провести радикальну резекцію шлунка із лімфодисекцією, оскільки гістологічний діагноз після R1 ендоскопічної резекції РШ може бути неточним.
Лікування після ендоскопічної резекції типу eCuraС-2
Резекцію шлунка із лімфодисекцією слід розглядати як стандарт лікування. У випадку неможливості виконання хірургічного втручання через вік пацієнта або наявність тяжких супутніх захворювань необхідно оцінити та достатньо пояснити пацієнтам ризик залишкового захворювання у вигляді метастазів у лімфатичні вузли (табл. 3 [45] і 4 [46]) та вірогідність розвитку місцевого рецидиву та/або віддалених метастазів, а також інформацію про те, що рецидивна хвороба в більшості випадків невиліковна та з несприятливим прогнозом [47].
| Глибина ураження | Ступінь виразкування | Диференційована карцинома | Недиференційована карцинома | |||
| М | UL0 | Діаметр пухлини | ≤2 см | >2 см | ≤2 см | >2 см |
| Наявність метастазів у лімфатичні вузли | 0% (0/437) | 0% (0/493) | 0% (0/310) | 2,8% (6/214) | ||
| 95% ДІ | 0~0,7% | 0~0,6% | 0~0,96% | 1,0~6,0% | ||
| UL1 | Діаметр пухлини | ≤3 см | >3 см | ≤2 см | >2 см | |
| Наявність метастазів у лімфатичні вузли | 0% (0/488) | 3,0% (7/230) | 2,9% (8/271) | 5,9% (44/743) | ||
| 95% ДІ | 0~0,6% | 0,3~9,0% | 1,2~5,7% | 4,3~7,9% | ||
| SM1 | Діаметр пухлини | ≤3 см | >3 см | Будь-який діаметр | ||
| Наявність метастазів у лімфатичні вузли | 0% (0/145) | 2,6% (2/78) | 10,6% (9/85) | |||
| 95% ДІ | 0~2,6% | 0,3~0,9% | 5,0~19,2% | |||
Примітки: зелена зона — показання до ендоскопічної резекції, жовта зона — розширені показання, червона зона — відносні показання, М — мукозальний шар, SM1 — субмукозальний шар.
| Загальна кількість балів | Кількість пацієнтів (n=1101) | Кількість пацієнтів з метастазами в лімфатичні вузли (n=94) | Частота метастазів у лімфатичні вузли (%) |
| 0 | 62 | 1 | 1,6 |
| 1 | 341 | 9 | 2,6 |
| 2 | 185 | 9 | 4,9 |
| 3 | 148 | 11 | 7,4 |
| 4 | 132 | 11 | 8,3 |
| 5 | 141 | 28 | 19,9 |
| 6 | 77 | 21 | 27,3 |
| 7 | 15 | 4 | 26,7 |
Загальні бали нараховують за такою схемою: 1 бал додається до кожного з наступних результатів: діаметр ≥3 см, позитивний вертикальний край резекції, венозна інвазія, глибина ≥SM2. 3 бали нараховано при гістологічно виявленій лімфатичній інвазії [40].
Системна медикаментозна терапія для нерезектабельного, поширеного та рецидивного РШ
Хоча недавні досягнення в галузі протипухлинних препаратів дозволили отримувати значний відсоток об’єктивної відповіді на лікування при неоперабельному або рецидивному РШ, у кінцевому підсумку не отримано значного впливу на подовження загальної тривалості життя хворих. Медіана тривалості життя при поширеному РШ залишається в середньому 15 міс [48, 49]. Нинішня мета протипухлинної терапії полягає в продовженні тривалості життя, затримці розвитку симптомів, ускладнень РШ.
Перевагу хіміотерапії над симптоматичним лікуванням доведено в рандомізованих контрольованих дослідженнях у пацієнтів з неоперабельним РШ із загальним станом за шкалою Східної кооперативної онкологічної групи (Eastern Cooperative Oncology Group — ECOG) 0–2 [50–52]. Лише в поодиноких випадках повідомляли про 5-річну тривалість життя хворих із поширеним РШ, що отримували тільки хіміотерапію. Так, хіміотерапія — це лікування, яке насамперед розглядається при неоперабельному/рецидивному РШ у хворих із задовільним загальним станом або у пацієнтів після R2-резекцій.
Принципи показань до хіміотерапії
Системна хіміотерапія показана пацієнтам з поширеним, метастатичним РШ або тим, хто переніс R2-резекцію, за умови збереження задовільного загального стану та функцій основних органів. Точніше, показана пацієнтам з ECOG 0–2 з нерезектабельним локально поширеним раком або РШ із синхронними чи метахронними віддаленими метастазами.
Стандартні критерії для призначення пацієнту системної хіміотерапії
Призначення хіміотерапії потрібно ухвалювати для кожного пацієнта окремо, для цього необхідно перевірити наступні критерії:
- гістологічно підтверджений РШ;
- ECOG 0–2. Хіміотерапія загалом не рекомендована пацієнтам з ECOG 3 або гірше, рішення зробити виняток з правила має бути ухвалено окремо, враховуючи безпеку та клінічні наслідки для кожного пацієнта (особливе занепокоєння викликають пацієнти з масивним асцитом або обширними перитонеальними метастазами);
- збережена функція основних органів;
- відсутність тяжкої форми супутньої патології;
- підписана інформована згода від пацієнта.
Рутинне обстеження до та під час хіміотерапії.
1. Перед початком хіміотерапії слід перевірити або виміряти наступні показники: ECOG, зріст, масу тіла, з’ясувати симптоми, результати загального медичного огляду, лабораторні дані, зокрема тести на віруси гепатитів та визначення площі пухлинних уражень шляхом КТ або іншої відповідної методики діагностики.
2. Відповідь на проведене лікування слід оцінювати за допомогою відповідних методів діагностики, що включають КТ, ендоскопію та контрастне рентгенологічне дослідження кожні 2 або 3 міс, порівнюючи результати діагностики з відповідними даними, отриманими до початку хіміотерапії. Відповідь пухлини слід оцінювати за Японською класифікацією раку шлунка або за критеріями оцінки відповіді при солідних пухлинах (Response Evaluation Criteria in Solid Tumors — RECIST), щоб вирішити, продовжувати хіміотерапію чи ні.
3. Рішення про продовження лікування, зміну дози препарату чи інтервалу між терапією слід ухвалювати, враховуючи баланс між несприятливими явищами та ефективністю лікування, посилаючись на деталі клінічних випробувань, за допомогою яких було обрано відповідну схему терапії. Слід бути обережним, щоб не нехтувати проявами токсичності, такими як шкірна токсичність, дисгевзія та периферична нейропатія.
4. Необхідно коригувати лікування відповідно до рекомендацій щодо реактивації вірусу при проведенні хіміотерапії для носіїв вірусу гепатиту B або інфікованих пацієнтів.
Протипухлинні препарати
Основні протипухлинні препарати, що призначають при нерезектабельному РШ: 5-фторурацил, тефагур/5-хлор-2,4-дигідроксипіридин/оксонат калію (S-1), кальцію фолінат, капецитабін, цисплатин, оксаліплатин, іринотекан, доцетаксел, паклітаксел, наб-паклітаксел, трифлуридин/типірацил, трастузумаб, рамуцирумаб, ніволумаб, пембролізумаб та трастузумаб дерукстекан. Ці препарати застосовують як монотерапію або в комбінаціях, які базуються на даних клінічних випробувань.
Визначення рекомендаційного класу та рівня доказовості кожного хіміотерапевтичного режиму
Відповідно до японських рекомендацій рекомендаційний клас, наданий кожному режиму хіміотерапії, класифікується на наступні 2 рівні, беручи до уваги не тільки дані клінічних досліджень, але й спостереження з клінічної практики.
«Рекомендовані режими»
Рекомендовані схеми лікування в Японії визначаються як такі, що відповідають будь-якій із наведених нижче вимог для пацієнтів, які перебувають у задовільному загальному стані.
- У клінічних дослідженнях III фази доведено значну перевагу цієї схеми над стандартним лікуванням РШ або визначенням рівноцінних показників загальної виживаності.
- Відтворювана клінічна користь встановлена в численних клінічних дослідженнях II фази для певної групи пацієнтів.
- Запропонований режим лікування використаний у групах контролю в клінічних дослідженнях III фази і розглядається як одна зі стандартних схем (рис. 11).

«Умовно рекомендовані» схеми медикаментозного лікування РШ
Умовно рекомендовані схеми визначаються як схеми, які відповідають будь-якій із нижченаведених вимог і можуть замінити «рекомендовані схеми», якщо вони вважаються більш доречними з урахуванням таких факторів, як: 1) загальний стан пацієнта, зокрема симптоми захворювання, вік, функції основних органів та супутні захворювання; 2) соціальні фактори, такі як необхідність госпіталізації, вартість терапії, відстань до лікарні, що може обмежувати частоту відвідувань; та 3) персоніфіковані переваги, що базуються на спектрі побічних явищ.
- Схема лікування трактується як «клінічно корисна» за специфічних обставин, коли пацієнт не може переносити рекомендований режим.
- Схема терапії трактується як «клінічно корисна» на основі широкого використання в Японії в загальній практиці або через інтерпретацію відповідних клінічних досліджень, навіть якщо доказової бази недостатньо для включення до «рекомендованих режимів».
«Рекомендовані режими» та «умовно рекомендовані режими» зазначені в схемах на рис. 11 та в табл. 5, засновані на голосуванні 6 клінічних онкологів, які є членами the JGCA Guidelines Committee. Однак у клінічній практиці необов’язково відмовлятися від використання схем, які не наведені на рис. 11 та в табл. 5. Відбір був суворим, і навіть схеми, які підтримали 50–69% (4 із 7) клінічних онкологів, не представлені в огляді. Враховуючи складність щоденної клінічної практики, певні схеми лікування, яких немає в переліку, можуть бути корисним варіантом.
| 1-ша лінія | 2-га та наступні лінії |
| HER2(-)
5-ФУ+CDDP 5-ФУ+кальцію фолінат 5-ФУ+кальцію фолінат+паклітаксел S-1 S-1+доцетаксел HER2(+) 5-ФУ+CDDP+T-mab FOLFOX+T-mab |
HER2(-)
Щотижня паклітаксел Щотижня наб-паклітаксел Доцетаксел Іринотекан Рамуцирумаб Рамуцирумаб+іринотекан Рамуцирумаб+наб-паклітаксел HER2(+) Вищевказані режими +T-mab, якщо минулі режими не включали T-mab Продовження терапії T-mab на тлі прогресії не рекомендоване У випадках раннього рецидиву під час або протягом 6 міс після припинення ад’ювантної хіміотерапії не рекомендовано застосовувати препарати, що вже були в схемі ад’ювантної терапії |
Примітки: T-mab — трастузумаб, навіть при використанні цього підходу загальна стратегія повинна враховувати попередню таблицю із базою з основних 7 препаратів: фторпіримідини, похідні платини, таксани, іринотекан, рамуцирумаб, ніволумаб та трифлуридин/типірацил. Жоден з препаратів не рекомендований до продовження при прогресії.
Через недостатність даних клінічних досліджень у пацієнтів літнього віку та осіб з порушенням функції органів або супутніми захворюваннями неможливо вказати, чи «умовно рекомендований режим» є кращим або безпечнішим за «рекомендований режим», під час якого знижується доза або змінюється інтервал введення препарату. Тому оптимальний терапевтичний режим для цих пацієнтів слід вибирати окремо в кожному конкретному випадку, а рекомендації є лише орієнтиром.
Рівень доказовості відповідно до критеріїв MINDS clinical guideline manual version 2.0 (табл. 6) надано тільки для «рекомендованих режимів». Для «умовно рекомендованих режимів» рівень доказовості не описаний через відсутність доказів для конкретного клінічного стану, коли «умовно рекомендовані схеми» можуть бути більш прийнятними, ніж «рекомендовані схеми».
| А (сильний) | Сильна надійність в очікуваному значенні ефекту |
| В (помірний) | Помірна надійність очікуваного значення ефекту |
| С (обмежений) | Обмежена надійність очікуваного значення ефекту |
| Д (слабкий) | Майже ненадійний рівень для очікуваного значення ефекту |
Терапія 1-ї лінії для нерезектабельного локально поширеного та рецидивного РШ
Тест HER2. Оскільки режим, що включає трастузумаб, став стандартом лікування при HER2-позитивному РШ, тестування на HER2 настійно рекомендовано всім пацієнтам, які є кандидатами для проведення хіміотерапії внаслідок неоперабельного РШ. Методи визначення HER2 включають імуногістохімічне дослідження та гібридизацію in situ (ISH).
HER2-негативний РШ
Базовим стандартом у лікуванні нерезектабельного РШ є поєднання фторпіримідинів із похідними платини.
Комбінація S-1 + цисплатин (SP) є стандартом вибору на підставі результатів 2 досліджень III фази, проведених в Японії (дослідження JCOG 9912 [53] та SPIRITS [54]) (рівень доказовості A).
Після того, як було доведено рівноцінну ефективність схеми 5-фторурацил/цисплатин (FP) із комбінацією капецитабіну та цисплатину (XP), вона в подальшому рекомендована як контроль у глобальних дослідженнях III фази, дослідженнях ToGA [55] і AVAGAST [56].
Оскільки в аналізі результатів цих досліджень в Японії встановлено безпеку й ефективність, комбінацію додано до списку «рекомендованих схем» (рівень доказовості A). CapeOX — комбінація капецитабіну та оксаліплатину, що затверджена у 2014 р. в Японії, проявила ефективність на рівні, що як мінімум дорівнює схемі FP в ІІІ фазі дослідження (японські пацієнти не були охоплені), що стало базою для триплетів — комбінування цих режимів з епірубіцином (рівень доказовості В) [57]. Комбінація S-1 та оксаліплатину (SOX) також показала ефективність, порівнянну до SP у дослідженні G-SOX (рівень доказовості В) [48]. Схеми, що включають оксаліплатин, більш прості для проведення, ніж ті, що базуються на цисплатині, через відсутність потреби в гідратації. Крім того, комбінація 5-фторурацил/кальцію фолінат (LV) з оксаліплатином (FOLFOX) використана як контрольна схема в нещодавніх порівняльних дослідженнях [58–60] та наразі затверджена в Японії. Схема FOLFOX також може бути використана у пацієнтів, у яких є проблеми з оральним прийомом ліків, наприклад, при непрохідності кишечнику. Для підсумку, список «рекомендованих режимів» 1-ї лінії терапії для лікування нерезектабельного локально поширеного та рецидивного РШ включає різноманітні комбінації фторпіримідинів та препаратів платини, вибір схеми лікування для кожного пацієнта необхідно проводити із комплексним урахуванням клінічних даних.
Ця версія рекомендацій враховує новий напрямок лікування поширеного РШ. У 3 значних рандомізованих контрольованих дослідженнях (KEYNOTE-062, ATTRACTION-4, CheckMate 649), у яких вивчали ефективність інгібіторів контрольних точок у 1-й лінії лікування поширеного РШ [61–63], а також ніволумаб у комбінації з хіміотерапією (CapeOX, FOLFOX або SOX), встановлено більшу ефективність за віддаленими результатами лікування порівняно зі стандартною хіміотерапією. Тому ці комбінації стали «рекомендованими схемами». Однак оскільки переваги в загальній виживаності при терапії ніволумабом у комбінації з цитостатиками не були чітко доведені для пацієнтів за параметром PD-L1 й сукупним позитивним числом <5 або взагалі від’ємним, баланс ризику та користі від хіміотерапії окремо та в комбінації з ніволумабом повинен розглядатися окремо відповідно до стану пацієнта. Пацієнти із поширеним РШ та обмеженою можливістю перорального прийому або значним канцероматозом (помірним або значним асцитом, порушенням кишкової прохідності), а також пацієнти літнього віку не були залучені в ці дослідження. Так, стандартної «найкращої» схеми лікування поширеного РШ не встановлено у вказаному виданні рекомендацій.
За результатами останніх консенсусних рішень, проведення хіміотерапії пацієнтам із поширеним РШ і метастазами в кістковий мозок має слабку доказову базу (рівень доказовості D), так само як і у пацієнтів із метастатичним ураженням центральної нервової системи (рівень доказовості D).
HER2-позитивний РШ. Дослідження ToGA визначає HER2-позитивний РШ як такий, що за результатами діагностики є IHC3+ або FISH+ [55]. Подовження медіани тривалості життя фіксували в когорти IHC3+ або FISH+/IHC2+. Отже, схеми, що містять трастузумаб, рекомендовані пацієнтам з IHC3+ або FISH+/IHC2+. За результатами дослідження ToGA, найкращою є комбінація трастузумабу з цисплатином і капецитабіном (або 5-ФУ). Рекомендованими є також комбінації трастузумабу із 3-тижневим або послідовним введенням цисплатину (SP), ефективність обох схем встановлено у 2 дослідженнях фази II (рівень доказовості B). У результатах досліджень II фази, які оцінювали комбінації трастузумабу із режимами CapeOX і SOX, виявлено певні позитивні результати при поширеному РШ. Ці схеми оцінюються як «умовно рекомендовані режими» та мають показання для пацієнтів із поганою переносимістю цисплатину [64–69].
Терапія 2-ї лінії для нерезектабельного, локально поширеного та рецидивного РШ
Хіміотерапія 2-ї лінії рекомендована для пацієнтів із поширеним РШ відповідно до результатів рандомізованих досліджень, у яких зафіксовано значну перевагу хіміотерапії над найкращою симптоматичною терапією — BSC (Best Supportive Care).
У рандомізованих дослідженнях, що були проведені в Німеччині [70], Південній Кореї [71] та Великій Британії [72], відмічено значне подовження тривалості життя у пацієнтів на РШ, що отримували хіміотерапію 2-ї лінії (доцетаксел або іринотекан) порівняно з BSC. Японське дослідження III фази, WJOG4007, не виявило переваг монотерапії іринотеканом над паклітакселом (щотижневий прийом), але медіана тривалості життя становила близько 9 міс в обох групах лікування [73]. Монотерапія препаратами доцетакселу, іринотекану або паклітакселу (щотижневе введення) відповідно до досліджень, наведених вище, може бути визначена, як «умовно рекомендована», якщо комбінація паклітакселу/рамуцирумабу, описана нижче, вважається неможливою для призначення.
Відповідно до поточної версії рекомендацій монотерапія в 2-й лінії лікування нерезектабельного РШ належить до «умовно рекомендованої».
Оскільки в дослідженні III фази RAINBOW застосування комбінації паклітакселу/рамуцирумабу встановило переваги над монотерапію паклітакселом [74], ця схема наразі є єдиною «рекомендованою схемою» (рівень доказовості А). Крім того, у дослідженні REGARD виявлено достовірні переваги монотерапії рамуцирумабом над BSC за показниками тривалості життя. Так, монотерапія препаратами паклітакселу, доцетакселу, іринотекану та рамуцирумабу є «умовно рекомендованими режимами», коли є протипоказання до прийому комбінації паклітаксел/рамуцирумаб. Наб-паклітаксел (паклітаксел, що кон’югований з альбуміном) схвалений до застосування в Японії у 2013 р. Клінічне дослідження ABSOLUTE зафіксувало неефективність щотижневого введення наб-паклітакселу порівняно з паклітакселом [75], і цей режим також входить до числа «умовно рекомендованих схем», коли рамуцирумаб не може бути призначений пацієнту. Комбінація наб-паклітакселу та рамуцирумабу є «умовно рекомендованим» режимом, коли наб-паклітаксел є кращим для вибору порівняно з паклітакселом, наприклад, з точки зору розвитку побічних реакцій.
Ефективність продовження терапії трастузумабом після прогресування HER2-позитивного РШ, який спочатку лікували цим препаратом, спростовано в рандомізованому дослідженні. Відтак рекомендованим є підхід не продовжувати трастузумаб після прогресії.
У 3-й або наступній лініях паліативної терапії РШ можуть бути застосовані препарати ніволумабу або іринотекану в монорежимах.
Імунотерапія анти-PD-L1 антитілом — пембролізумабом, яке є одним з інгібіторів контрольних точок, виявилася ефективною у пацієнтів із РШ з мікросателітною нестабільністю (MSI). Тест MSI рекомендується перед лікуванням 2-ї лінії. Частота MSI-high у пацієнтів із метастатичним РШ становить близько 3–5%. Пембролізумаб рекомендований для пацієнтів із неоперабельним поширеним РШ з високим MSI, що спрогресував після хіміотерапії. У цій версії рекомендацій монотерапія пембролізумабом для лікування РШ з MSI-high є «рекомендованою схемою» для 2-ї або пізніших ліній терапії, що має підґрунтя: 1) аналіз дослідження KEYNOTE-158, зокрема з пацієнтами з РШ, дав відносно хороші показники відповіді на терапію та тривалості життя без прогресування; і 2) монотерапія пембролізумабом показала кращі результати, ніж монотерапія паклітакселом, в аналізі підгрупи пацієнтів з MSI-high у дослідженні KEYNOTE-061, яке охоплювало японських пацієнтів. Однак прямого порівняння між пембролізумабом і комбінацією паклітакселу з рамуцирумабом у популяції з MSI-high не проводилося. Так, наразі неможливо зробити висновок, що є пріоритетним для пацієнтів з MSI-high РШ, — паклітаксел + рамуцирумаб або пембролізумаб.
При прогресії РШ під час або протягом 6 міс після припинення ад’ювантної хіміотерапії не рекомендовано застосовувати препарати, що вже були в схемі ад’ювантної терапії.
Необхідність широкого молекулярного профілювання із визначенням генетичних альтерацій для первинно лікованого поширеного РШ має слабку доказову базу (рівень доказовості С).
3-тя або наступні лінії лікування неоперабельного поширеного/рецидивного РШ
Терапію 3-ї лінії слід розглянути за умови задовільного загального стану пацієнта після лікування 2-ї лінії. Монотерапія ніволумабом, іринотеканом або трифлуридином/типірацилом є «рекомендованими схемами» для лікування в 3-й або наступних лініях для пацієнтів із задовільним загальним станом. У рандомізованому дослідженні в Південній Кореї виявлено подовження тривалості життя у пацієнтів із поширеним РШ при терапії доцетакселом або іринотеканом як у 2-й, так і 3-й лінії лікування, а подальший аналіз підгруп терапії 3-ї лінії зафіксував перевагу хіміотерапії над найкращим підтримувальним лікуванням. Іринотекан стає основним препаратом терапії в 3-й лінії, оскільки паклітаксел + рамуцирумаб рекомендовані як терапія 2-ї лінії. Ніволумаб із трифлуридином/типірацилом проявили позитивний вплив на тривалість життя порівняно з плацебо у пацієнтів, які раніше отримували терапію за більш ніж двома схемами (дослідження ATTRACTION-2 і TAGS). Обидва препарати є «рекомендованими схемами» для лікування в 3-й або наступних лініях. З іншого боку, оскільки не проведено жодного дослідження, яке б прямо порівнювало ніволумаб, іринотекан та трифлуридин/типірацил, пріоритет і відповідна послідовність лікування остаточно не визначені для цих 3 препаратів.
При застосуванні терапії трастузумабом дерукстеканом, препаратом, що є кон’югованим з лікарським засобом антитілом до HER2, виявлено значно вищу частоту відповіді та довшу загальну тривалість життя порівняно зі звичайною хіміотерапію (іринотеканом або паклітакселом) у рандомізованому дослідженні II фази в Азії для HER2-позитивних пацієнтів із поширеним РШ, які попередньо отримали 2 або більше ліній лікування. У дослідженні DESTINY-Gastric01 у проміжному аналізі зафіксовані оптимістичні результати за напрямками загальної відповіді та віддалених результатів виживаності, незважаючи на те, що кількість випадків була невеликою. Оскільки трастузумаб дерукстекан є єдиним препаратом, для якого підтверджено переваги в подовженні тривалості життя порівняно з хіміотерапією в лікуванні 3-ї лінії, цей препарат є пріоритетним для терапії 3-ї лінії HER2-позитивного РШ.
Станом на вересень 2020 р. інгібітори контрольних точок не схвалені як лікування 1-ї лінії, монотерапія ніволумабом у 3-й лінії рекомендована для випадків без попереднього використання імунотерапії. У грудні 2021 р. ніволумаб рекомендовано для пацієнтів, що мають комбіноване позитивне число (Combined positive score — CPS) ≥5.
Ад’ювантна хіміотерапія
Післяопераційна ад’ювантна хіміотерапія проводиться з метою зниження ризику прогресування РШ шляхом впливу на залишкові пухлинні клітини після хірургічного лікування. Пацієнтам із цитологічно-позитивним (CY1 — відсутність візувального канцероматозу) статусом перитонеального лаважу після резекції шлунка також рекомендована ад’ювантна хіміотерапія. Різні схеми пройшли численні клінічні дослідження в Японії, але не було твердих доказів на підтримку ад’ювантної хіміотерапії, поки у 2006 р. довели ефективність препарату S-1 (дослідження ACTS-GC) [76, 77], що визначило монотерапію S-1 як стандарт ад’ювантної терапії РШ в Японії (рівень доказовості А). У це дослідження залучили пацієнтів з РШ II, IIIA або IIIB стадій, за винятком стадій II та pT1, за попередньою 13-ю японською класифікацією РШ, яким проведено R0-резекцію з ≥D2-лімфодисекцією. У подальших дослідженнях ад’ювантних режимів проводилося порівняння комбінацій інших протипухлинних препаратів із S-1. У хворих на РШ III стадії комбінація доцетакселу із S-1 показала перевагу за показником безрецидивної тривалості життя порівняно з монотерапією S-1 у проміжному аналізі дослідження ІІІ фази JACCRO GC-07 [78].
З іншого боку, ефективність комбінації капецитабіну із оксаліплатином з точки зору подовження безрецидивної тривалості життя доведена у 2002 р. у клінічному дослідженні III фази, проведеному в Південній Кореї (CLASSIC) для лікування РШ II/III стадій [79]. З 2015 р. оксаліплатин схвалено для ад’ювантної терапії РШ в Японії.
Після завершення систематичного огляду для підготовки цієї настанови (грудень 2020 р.) зʼявилися дані, що терапія S-1 та оксаліплатином (SOX) значно подовжує виживаність без захворювання, що є первинною кінцевою точкою, порівняно з S-1 у дослідженні ІІІ фази ARTIST2 ад’ювантної хіміотерапії для післяопераційної стадії (pStage) II/III з дисекцією D2 [80]. Отже, адʼювантну хіміотерапію рекомендовано S-1 у монорежимі або комбінації для pStage II/III РШ, яка увійшла до рекомендацій, оскільки виявили, що вона покращує показник виживаності після резекції з лікувальною метою.
На сьогодні в Японії рекомендовано 1-річне застосування S-1 для морфологічної II стадії РШ (3-річна безрецидивна виживаність 93,1%, 3-річна загальна виживаність 96,1%), за даними дослідження JCOG 1104 [81]. Монотерапія S-1 є умовно рекомендованою схемою для морфологічної III стадії РШ, стандартом є комбінована терапія, рекомендована на основі результатів дослідження JAC-CRO-GC07.
Підхід, що включає радикальне хірургічне втручання при IV стадії РШ із подальшою ад’ювантною хіміотерапією, на сьогодні має слабку доказову базу (рівень доказовості С), зокрема і в разі наявності позитивного цитологічного змиву — CY1.
НПХТ
НПХТ базується на наявній можливості «лікувальної резекції», що визначається відповідно до клінічного стадіювання. Японські автори вважають необхідним відокремлювати наявні клінічні випадки від «гранично резектабельних» або нерезектабельних із можливістю конверсії.
Незважаючи на те що в Японії накопичено великий досвід післяопераційної хіміотерапії, є численні клінічні ситуації, що обмежують проведення інтенсивної ад’ювантної хіміотерапії, наприклад, через неможливість перорального прийому за наявності післяопераційних ускладнень. З іншого боку, НПХТ може підвищити відсоток пацієнтів, що отримують комбіноване лікування, оскільки вона проводиться перед операцією. Проте ад’ювантну терапію призначають пацієнтам, що мають морфологічну стадію хвороби, на відміну НПХТ, яка базується на клінічній стадії, що визначають у більшості випадків на основі діагностичних зображень. Недоліками НПХТ автори вважають ризик гіпердіагностики при ранньому РШ, що не потребує передопераційної хіміотерапії, та недіагностовані випадки перитонеального канцероматозу, які не підпадають під критерії НПХТ. Також слід враховувати відсоток пацієнтів, що мають ризик перейти в категорію осіб з неоперабельною патологією через її прогресування під час хіміотерапії або ризик збільшення кількості післяопераційних ускладнень унаслідок віддаленої токсичності НПХТ.
НПХТ — це стандарт лікування в західних країнах, переваги цього підходу також підтверджені в дослідженнях у Китаї та Південній Кореї [82, 83]. В Японії отримані позитивні результати застосування комбінації S-1 із цисплатином в якості НПХТ для пацієнтів із РШ зі значно збільшеними регіонарними лімфатичними вузлами, що в подальшому стало стандартом лікування. Водночас та сама комбінація в якості НПХТ при скірозних типах раку, що мають несприятливий прогноз, не мала позитивного впливу [84]. Відповідно до використання НПХТ в Японії не існує консенсусного рішення.
Первинно неоперабельні або нерезектабельні випадки при поширеному РШ після НПХТ, що мала позитивний ефект, можуть бути в подальшому прооперовані за умови проведення радикальної (R0) операції, проте такий підхід «конверсії» первинно неоперабельних/нерезектабельних випадків РШ має слабку доказову базу — рівень доказовості D.
Паліативна допомога
Паліативна допомога — це комплекс заходів, що покращують якість життя пацієнтів та їхніх сімей, які стикаються з проблемами, пов’язаними із невиліковними захворюваннями, що загрожують життю; попередження та зменшення вираженості страждань шляхом раннього виявлення, градації та лікування больового синдрому та інших проблем, фізичних, психосоціальних та духовних (визначення паліативної допомоги згідно з рекомендаціями Всесвітньої організації охорони здоров’я (ВООЗ), 2002) [85]. Європейське товариство медичної онкології (European Society for Medical Oncology — ESMO) визначило «підтримувальну терапію» як «комплекс заходів, спрямованих на оптимізацію комфорту, функціонування та соціальної підтримки пацієнтів та їх сімей на всіх стадіях захворювання», а «паліативну терапію» як «заходи, що повинні проводитися в разі неможливості протипухлинного лікування [86]. У Базовій стратегії протиракової боротьби в Японії «підтримувальна терапія» визначається як «профілактика та лікування симптомів, викликаних пухлиною, корекція побічних ефектів та ускладнень, пов’язаних з лікуванням пухлини». Так, визначення паліативної підтримки та підтримувальної терапії відрізняється в Японії та за її межами. Враховуючи багато спільних моментів доцільно комплексно розглядати підтримувальну/паліативну терапію. Пацієнти з РШ та їх сім’ї також мають різні психічні, соціальні та духовні розлади, крім фізичного болю. Паліативна та підтримувальна терапія болю відіграє основну роль у лікуванні раку, основні клінічні дослідження з підтримувальної терапії проводяться в цьому напрямку. Важливість паліативної допомоги зростає відповідно із прогресуванням РШ. Методи паліативної допомоги при РШ включають променеву терапію та психотерапію на додаток до медикаментозного лікування. Інші паліативні хірургічні заходи, такі як встановлення шлункових стентів при декомпенсованому стенозі, мають слабке рекомендаційне підґрунтя (рівень доказовості С). Методика, що включає реінфузію асцитичної рідини, очищеної від клітин (cell‐free and concentrated ascites reinfusion therapy — CART), у пацієнтів з асцитом потребує відповідного обладнання та досвіду лікарів, на сьогодні має низьку доказову базу (рівень доказовості D).
Клінічний супровід пацієнтів після операцій через РШ
Концепція хірургії швидкого відновлення при операціях з приводу РШ (enhanced recovery after surgery — ERAS) має потужну доказову базу — рівень доказовості А [87]. Впровадження ERAS дозволяє скоротити час перебування пацієнтів у стаціонарі, однак в окремих дослідженнях повідомляють про можливе збільшення кількості ускладнень через прискорення старту перорального харчування [88], тому цей факт необхідно враховувати в кожному конкретному клінічному випадку. Якщо немає особливих проблем із активізацією пацієнта (пацієнт не потребує перебування в ліжку), пероральний прийом рідини може бути розпочатий на 1-шу добу після операції, після чого відповідне споживання твердої їжі на 2-гу добу та виписка зі стаціонару на 7–10-ту добу після операції (див. табл. 5).
Надзвичайно важко встановити універсальний клінічний маршрут для пацієнтів, які перенесли операцію щодо РШ. Пропозиція «базового маршруту» може сприяти зменшенню розбіжностей у хірургічному лікуванні РШ між хірургічними установами. Основний напрямок алгоритмів хірургії швидкого відновлення побудований навколо виконання деяких базових елементів, таких як видалення назогастрального зонда, початок перорального прийому рідини, твердих харчових продуктів, введення антибіотиків, зупинка внутрішньовенного введення рідини і виписка з лікарні (орієнтир — 8–14 діб після операції) — наведено в табл. 7.
| Клінічні дії | День після операції (п/о) |
| Видалення назогастрального зонда | До або на 1-й день п/о |
| Початок вживання рідини | На 1-й день п/о або пізніше |
| Початок вживання їжі | Між 2-м та 4-м днем п/о |
| Профілактичне призначення антибіотиків | Тільки в день операції |
| Видалення епідурального катетера | До або на 3-й день п/о |
| Видалення сечового катетера | До або на 3-й день п/о |
| Внутрішньовенна інфузія | Між 5-м та 7-м днем п/о |
| Видалення дренажів | До або на 5-й день п/о |
| Виписка з лікарні | Між 8-м та 14-м днем п/о |
Критерії виписки зі стаціонару включають температуру тіла нижче 37 °C, пероральний прийом їжі більше ніж 1/3 обсягу передопераційного харчування й адекватний контроль болю. Цей клінічний шлях застосовний до всіх хірургічних втручань, зокрема ГЕ, ДСРШ, ПРШ, незалежно від того, чи була операція проведена лапароскопічно, чи відкритим доступом. Однак протокол післяопераційного відновлення повинен визначатися індивідуально, особливо для пацієнтів з високим хірургічним ризиком і тяжкими супутніми захворюваннями, які включають порушення функції серця, легень, печінки чи нирок. Останнім часом дослідники схиляються до подальшого скорочення післяопераційного перебування в стаціонарі шляхом впровадження концепції ERAS, але клінічний ефект цієї програми в хірургії РШ ще до кінця не визначено.
Спостереження після операції через РШ
Наступні дії в амбулаторній клінічній практиці корисні для адаптації пацієнтів до життя вдома, контролю пострезекційних симптомів, подолання проблем із харчуванням. Крім того, епіднагляд за раннім виявленням ознак прогресії та вторинним метахронним раком зазвичай проводиться відповідно до рівня ризику рецидиву, який оцінюється на основі клінічних даних [89, 90]. Однак докази того, що таке спостереження фактично збільшує тривалість життя, відсутні. Через недостатність проспективних досліджень, в яких вивчали програми спостереження після операцій унаслідок РШ, неможливо дати будь-які рекомендації щодо того, як часто потрібно проводити обстеження. Однак у деяких ретроспективних дослідженнях відмічено, що КТ, вимірювання пухлинних маркерів (СЕА і СА19-9) і ендоскопія ефективні для виявлення ознак прогресії, раку кукси шлунка і метахронного множинного раку. Рівень пухлинних маркерів за необхідності схильний зростати за 2–3 міс до того, як метастази можуть бути виявлені за допомогою методів візуалізації [91]. Моделі програм для раннього і поширеного РШ наведено в табл. 8 та 9.
| Період після оперативного втручання | Роки | 1 | 1,5 | 2 | 2,5 | 3 | 4 | 5 | ||
| Місяці | 1 | 6 | 12 | |||||||
| Медичний огляд, PS, маса тіла | o | o | o | o | o | o | o | o | o | |
| Аналізи крові, зокрема онкомаркери | o | o | o | o | o | o | o | o | o | |
| КТ та/або УЗД | o | o | o | o | o | o | ||||
| Ендоскопія | o | o | o | |||||||
| Період після оперативного втручання | Роки | 1 | 2 | 2,5 | 3 | 3,5 | 4 | 4,5 | 5 | |||||||
| Місяці | 1 | 2 | 6 | 9 | 12 | 15 | 18 | 21 | 24 | |||||||
| Медичний огляд, PS, маса тіла | o | o | o | o | o | o | o | o | o | o | o | o | o | o | o | |
| Аналізи крові, зокрема онкомаркери | o | o | o | o | o | o | o | o | o | o | o | o | o | o | o | |
| КТ та/або УЗД | o | o | o | o | o | o | o | o | ||||||||
| Ендоскопія | o | o | o | |||||||||||||
Спостереження має тривати не довше 5 років, після чого пацієнтів слід направляти до лікарів загальної практики за місцем проживання або заохочувати до проходження базових оглядів, які проводяться в межах програм охорони здоров’я в їхніх районах або за місцем роботи [92]. У цьому аспекті необхідна співпраця між медичними установами різних рівнів для надання комплексної допомоги хворим на РШ. Залишається актуальною потреба в науковому підтвердженні прогностичної значущості програм післяопераційного спостереження.
Список використаної літератури
1. Association Japanese Gastric Cancer (2017). Japanese Classification of Gastric Carcinoma. The 15th Edition. Tokyo: Kanehara Shuppan.
2. Brierley, J. D., Gospodarowicz, M. K., Wittekind, C., editors (2017). TNM classification of malignant tumours. 8th ed. New Jersey: Wiley Blackwell.
3. Fujitani, K., Ando, M., Sakamaki, K., Terashima, M., Kawabata, R., Ito, Y., … Yoshida, K. (2017). Multicentre observational study of quality of life after surgical palliation of malignant gastric outlet obstruction for gastric cancer. BJS Open, 1, 165–174. doi: 10.1002/bjs5.26.
4. Terashima, M., Fujitani, K., Ando, M., Sakamaki, K., Kawabata, R., Ito, Y., … Yoshida, K. (2021). Survival analysis of a prospective multicenter observational study on surgical palliation among patients receiving treatment for malignant gastric outlet obstruction caused by incurable advanced gastric cancer. Gastric Cancer, 24, 224–231. doi: 10.1007/s10120-020-01114-z.
5. Fujitani, K., Yang, H. K., Mizusawa, J., Kim, Y. W., Terashima, M., Han, S. U., … Tsujinaka, T. (2016). Gastrectomy plus chemotherapy versus hemotherapy alone for advanced gastric cancer with a single non-curable factor (REGATTA): a phase 3, randomised controlled trial. The Lancet Oncology, 17(3), 309–318. doi: 10.1016/S1470-2045(15)00553-7.
6. Japanese Gastric Cancer Association (2011). Japanese classification of Gastric Carcinoma: 3 English edition. Journal of Gastric Cancer, 14(2), 101–112. doi: 10.1007/s10120-011-0041-5.
7. Sano, T., Sasako, M., Mizusawa, J., Yamamoto, S., Katai, H., Yoshikawa, T., … Fujitani, K. (2017). Stomach Cancer Study Group of the Japan Clinical Oncology Group: randomized controlled trial to evaluate splenectomy in total gastrectomy for proximal gastric carcinoma. Annals of Surgery, 265(2), 277–283. doi: 10.1097/SLA.0000000000001814.
8. Tokunaga, M., Ohyama, S., Hiki, N., Fukunaga, T., Inoue, H., Yamada, K., Sano, T., … Nakajima, T. (2009). Therapeutic value of lymph node dissection in advanced gastric cancer with macroscopic duodenum invasion: is the posterior pancreatic head lymph node dissection beneficial? Annals of Surgical Oncology, 16(5), 1241–1246. doi: 10.1245/s10434-009-0345-4.
9. Kurokawa, Y., Takeuchi, H., Doki, Y., Mine, S., Terashima, M., Yasuda, T., … Kitagawa, Y. (2021). Mapping of lymph node metastasis from esophagogastric junction tumors: a prospective nationwide multicenter study. Annals of Surgery, 274, 120–127. doi: 10.1097/SLA.0000000000003499.
10. Japan Esophageal Society (2017). Japanese classification of esophageal cancer, 11th edition: part II and III. Esophagus, 14, 37–65.
11. Nishi, M., Kajisa, T., Aiko, T., Kaneko, Y., & Kawaji, T. (1973). The proposal of the gastric cardia. Gekarinshou, 15, 1328–1338.
12. Sasako, M., Sano, T., Yamamoto, S., Sairenji, M., Arai, K., Kinoshita, T., … Hiratsuka, M. (2006). Japan Clinical Oncology Group (JCOG9502): left thoracoabdominal approach versus abdominal-transhiatal approach for gastric cancer of the cardia or subcardia: a randomised controlled trial. The Lancet Oncology, 7(8), 644–651. doi: 10.1016/S1470-2045(06)70766-5.
13. Kurokawa, Y., Doki, Y., Mizusawa, J., Тerashima, M., Katai, H., Yoshikawa, T., … Sasako, M. (2018). Bursectomy versus omentectomy alone for resectable gastric cancer (JCOG1001): a phase 3, open-label, randomised controlled trial. Lancet Gastroenterology & Hepatology, 3, 460–468. doi: 10.1016/S2468-1253(18)30090-6.
14. Kim, H. H., Han, S. U., Kim, M. C., Kim, W., Lee, H. J., Ryu, S. W., … Hyung, W. J. (2019). Effect of laparoscopic distal gastrectomy vs open distal gastrectomy on long-term survival among patients with Stage I gastric cancer: the KLASS-01 randomized clinical trial. JAMA Oncology, 5(4), 506–513. doi: 10.1001/jamaoncol.2018.6727.
15. Katai, H., Mizusawa, J., Katayama, H., Morita, S., Yamada, T., Bando, E., … Sasako, M. (2020). Survival outcomes after laparoscopy-assisted distal gastrectomy versus open distal gastrectomy with nodal dissection for clinical stage IA or IB gastric cancer (JCOG0912): a multicentre, non-inferiority, phase 3 randomised controlled trial. Lancet Gastroenterology & Hepatology, 5(2), 142–151. doi: 10.1016/S2468-1253(19)30332-2.
16. Katai, H., Mizusawa, J., Katayama, H., Kunisaki, C., Sakuramoto, S., Inaki, N., … Terashima, M. (2019). Single-arm confirmatory trial of laparoscopy-assisted total or proximal gastrectomy with nodal dissection for clinical stage I gastric cancer: Japan Clinical Oncology Group study JCOG1401. Journal of Gastric Cancer, 22(5), 999–1008. doi: 10.1007/s10120-019-00929-9.
17. Inaki, N., Etoh, T., Ohyama, T., Uchiyama, K., Katada, N., Koeda, K., & Kitano, S. (2015). Multi-institutional, prospective, phase II feasibility study of laparoscopy-assisted distal gastrectomy with D2 lymph node dissection for locally advanced gastric cancer (JLSSG0901). World Journal of Surgery, 39(11), 2734–2741. doi: 10.1007/s00268-015-3160-z.
18. Lee, H. J., Hyung, W. J., Yang, H. K., Han, S. U., Park, Y. K., An, J. Y., … Kim, M. C. (2019). Short-term outcomes of a multicenter randomized controlled trial comparing laparoscopic distal gastrectomy with D2 lymphadenectomy to open distal gastrectomy for locally advanced gastric cancer (KLASS-02-RCT). Annals of Surgery, 270, 983–991. doi: 10.1097/SLA.0000000000003217.
19. Hu, Y., Huang, C., Sun, Y., Su, X., Cao, H., Hu, J., … Li, G. (2016). Morbidity and mortality of laparoscopic versus open D2 distal gastrectomy for advanced gastric cancer: a randomized controlled trial. Journal of Clinical Oncology, 34, 1350–1357. doi: 10.1200/JCO.2015.63.7215.
20. Yu, J., Huang, C., Sun, Y., Su, X., Cao, H., Hu, J., … Li, G. (2019). Effect of laparoscopic vs open distal gastrectomy on 3-Year disease-free survival in patients with locally advanced gastric cancer: the CLASS-01 randomized clinical trial. JAMA, 321(20), 1983–1992. doi: 10.1001/jama.2019.5359.
21. Hyung, W. J., Yang, H. K., Park, Y. K., Lee, H. J., An, J. Y., Kim, W., … Han, S. U. (2020). Long-term outcomes of laparoscopic distal gastrectomy for locally advanced gastric cancer: the KLASS-02-RCT randomized clinical trial. Journal of Clinical Oncology, 38(28), 3304–3313. doi: 10.1200/JCO.20.01210.
22. Etoh, T., Ohyama, T., Sakuramoto, S., Tsuji, T., Lee, S. W., Yoshida, K., … Kitano, S. (2023). Five-Year Survival Outcomes of Laparoscopy-Assisted vs Open Distal Gastrectomy for Advanced Gastric Cancer: The JLSSG0901 Randomized Clinical Trial. JAMA Surgery, 158(5), 445–454. doi: 10.1001/jamasurg.2023.0096.
23. Uyama, I., Suda, K., Nakauch, M., Kinoshita, T., Noshiro, H., Takiguchi, S…, Terashima, M. (2019). Clinical advantages of robotic gastrectomy for clinical stage I/II gastric cancer: a multi-institutional prospective single-arm study. Gastric Cancer, 22(2), 377–385. doi: 10.1007/s10120-018-00906-8.
24. Hikage, M., Tokunaga, M., Makuuchi, R., Irino, T., Tanizawa, Y., Bando, E., … Terashima, M. (2018). Comparison of surgical outcomes between robotic and laparoscopic distal gastrectomy for cT1 gastric cancer. World Journal of Surgery, 42(6), 1803–1810. doi: 10.1007/s00268-017-4345-4.
25. Tada, M., Murakami, A., Karita, M., Yanai, H., & Okita, K. (1993). Endoscopic resection of early gastric cancer. Endoscopy, 25(7), 445–450. doi: 10.1055/s-2007-1010365.
26. Inoue, H., Takeshita, K., Hori, H., Muraoka, Y., Yoneshima, H., & Endo, M. (1993). Endoscopic mucosal resection with a cap-fitted panendoscope for esophagus, stomach, and colon mucosal lesions. Gastrointestinal Endoscopy, 39(1), 58–62. doi: 10.1016/s0016-5107(93)70012-7.
27. Hirao, M., Masuda, K., Asanuma, T., Naka, H., Noda, K., Matsuura, K., … Ueda, N. (1988). Endoscopic resection of early gastric cancer and other tumors with local injection of hypertonic saline-epinephrine. Gastrointestinal Endoscopy, 34(3), 264–269. doi: 10.1016/s0016-5107(88)71327-9.
28. Ono, H., Kondo, H., Gotoda, T., Shirao, K., Yamaguchi, H., Saito, D., … Yoshida, S. (2011). Endoscopic mucosal resection for treatment of early gastric cancer. Gut, 48(2), 225–229. doi: 10.1136/gut.48.2.225.
29. Ono, H., Hasuike, N., Inui, T., Takizawa, K., Ikehara, H., Yamaguchi, Y., … Matsubayashi, H. (2008). Usefulness of a novel electrosurgical knife, the insulation-tipped diathermic knife-2, for endoscopic submucosal dissection of early gastric cancer. Journal of Gastric Cancer, 11(1), 47–52. doi: 10.1007/s10120-008-0452-0.
30. Shimoda, T., Kushima, R., & Ono, H. (2013). Histological features of peptic ulceration and biopsy scar of gastric ESD specimen. Stomach Intestine, 48, 16–24.
31. Gotoda, T., Yanagisawa, A., Sasako, M., Ono, H., Nakanishi, Y., Shimoda, T., & Kato, Y. (2000). Incidence of lymph node metastasis from early gastric cancer: estimation with a large number of cases at two large centers. Journal of Gastric Cancer, 3(4), 219–225. doi: 10.1007/pl00011720.
32. Hirasawa, T., Gotoda, T., Miyata, S., Kato, Y., Shimoda, T., Taniguchi, H., … Yamaguchi, T. (2009). Incidence of lymph node metastasis and the feasibility of endoscopic resection for undifferentiated-type early gastric cancer. Journal of Gastric Cancer, 12(3), 148–152. doi: 10.1007/s10120-009-0515-x.
33. Gotoda, T., Iwasaki, M., Kusano, C., Seewald, S., & Oda, I. (2010). Endoscopic resection of early gastric cancer treated by guideline and expanded National Cancer Centre criteria. British Journal of Surgery, 97(6), 868–871. doi: 10.1002/bjs.7033.
34. Hasuike, N., Ono, H., Boku, N., Mizusawa, J., Takizawa, K., Fukuda, H. … Muto, M. (2018). A non-randomized confirmatory trial of an expanded indication for endoscopic submucosal dissection for intestinal-type gastric cancer (cT1a): the Japan Clinical Oncology Group study (JCOG0607). Journal of Gastric Cancer, 21(1), 114–123. doi: 10.1007/s10120-017-0704-y.
35. Takizawa, K., Ono, H., Hasuike, N., Takashima, A., Minashi, K., Boku, N., … Muto, M. (2021). A nonrandomized, single-arm confirmatory trial of expanded endoscopic submucosal dissection indication for undifferentiated early gastric cancer: Japan Clinical Oncology Group study (JCOG1009/1010). Gastric Cancer, 24(2), 479–491. doi: 10.1007/s10120-020-01134-9.
36. Sekiguchi, M., Suzuki, H., Oda, I., Abe, S., Nonaka, S., Yoshinaga, S., … Saito, Y. (2013). Favorable long-term outcomes of endoscopic submucosal dissection for locally recurrent early gastric cancer after endoscopic resection. Endoscopy, 45(9), 708–713. doi: 10.1055/s-0033-1344332.
37. Takizawa, T., Takashima, A., Kimura, A., Mizusawa, J., Hasuike, N., Ono, H., … Fukuda, H. (2013). A phase II clinical trial of endoscopic submucosal dissection for early gastric cancer of undifferentiated type: Japan Clinical Oncology Group study JCOG1009/1010. Japanese Journal of Clinical Oncology, 43(1), 87–91. doi: 10.1093/jjco/hys189.
38. Jung, D. H., Bae, Y. S., Yoon, S. O., Lee, Y. C., Kim, H., Noh, S. H., … Kim, H. (2015). Poorly differentiated carcinoma component in submucosal layer should be considered as an additional criterion for curative endoscopic resection of early gastric cancer. Annals of Surgical Oncology, 22(3), 772–777. doi: 10.1245/s10434-015-4794-7.
39. Nakajima, T., Oda, I., Gotoda, T., Hamanaka, H., Eguchi, T., Yokoi, C., & Saito, D. (2006). Metachronous gastric cancers after endoscopic resection: how effective is annual endoscopic surveillance? Journal of Gastric Cancer, 9(2), 93–98. doi: 10.1007/s10120-006-0372-9.
40. Gotoda, T., Sasako, M., Ono, H., Katai, H., Sano, T., & Shimoda, T. (2001). Evaluation of the necessity for gastrectomy with lymph node dissection for patients with submucosal invasive gastric cancer. British Journal of Surgery, 88(3), 444–449. doi: 10.1046/j.1365-2168.2001.01725.x.
41. Kato, M., Ota, H., Okuda, M., Kikuchi, S., Satoh, K., Shimoyama, T., … Takahashi, S. (2019). Guidelines for the management of Helicobacter pylori infection in Japan: 2016 Revised Edition. Helicobacter, 24(4), 12597. doi: 10.1111/hel.12597.
42. Fukase, K., Kato, M., Kikuchi, S., Inoue, K., Uemura, N., Okamoto, S., … Asaka, M. (2008). Effect of eradication of Helicobacter pylori on incidence of metachronous gastric carcinoma after endoscopic resection of early gastric cancer: an open-label, randomised controlled trial. Lancet, 372(9636), 392–397. doi: 10.1016/S0140-6736(08)61159-9.
43. Choi, I. J., Kook, M. C., Kim, Y. I., Cho, S. J., Lee, J. Y., Kim, C. G., … Nam, B. H. (2018). Helicobacter pylori therapy for the prevention of metachronous gastric cancer. New England Journal of Medicine, 378(12),1085–1095. doi: 10.1056/NEJMoa1708423.
44. Eguchi, T., Gotoda, T., Oda, I., Hamanaka, H., Hasuike, N., & Saito, D. (2003). Is endoscopic one‐piece mucosal resection essential for early gastric cancer? Digestive Endoscopy, 15(2), 113–116. doi: 10.1046/j.1443-1661.2003.00227.x.
45. Japanese Gastric Cancer Association (2021). Japanese gastric cancer treatment guidelines 2018 (ver. 5). Gastric Cancer, 24, 1–21. doi: 10.1007/s10120-020-01042-y.
46. Hatta, W., Gotoda, T., Oyama, T., Kawata, N., Takahashi, A., Yoshifuku, Y., … Shimosegawa, T. (2017). A scoring system to stratify curability after endoscopic submucosal dissection for early gastric cancer: «eCura system». Journal of the American College of Gastroenterology, 112(6), 874–881. doi: 10.1038/ajg.2017.95.
47. Takizawa, K., Hatta, W., Gotoda, T., Kawata, N., Nakagawa, M., Takahashi, A., … Shimosegawa, T. (2019). Recurrence patterns and outcomes of salvage surgery in cases of non-curative endoscopic submucosal dissection without additional radical surgery for early gastric cancer. Digestion, 99(1), 52–58. doi: 10.1159/000494413.
48. Yamada, Y., Higuchi, K., Nishikawa, K., Gotoh, M., Fuse, N., Sugimoto, N., … Hyodo, I. (2015). Phase III study comparing oxaliplatin plus S-1 with cisplatin plus S-1 in chemotherapy-naïve patients with advanced gastric cancer. Annals of Oncology, 26(1), 141–148. doi: 10.1093/annonc/mdu472.
49. Kang, Y. K., Chin, K., Chung, H. C., Kadowaki, S., Oh, S. C., Nakayama, N., … Boku, N. (2020). S-1 plus leucovorin and oxaliplatin versus S-1 plus cisplatin as first-line therapy in patients with advanced gastric cancer (SOLAR): a randomised, open-label, phase 3 trial. Lancet Oncology, 21(8), 1045–1056. doi: 10.1016/S1470-2045(20)30315-6.
50. Murad, A. M., Santiago, F. F., Petroianu, A., Rocha, P. R., Rodrigues, M. A., & Rausch, M. (1993). Modified therapy with 5‐fluorouracil, doxorubicin, and methotrexate in advanced gastric cancer. Cancer, 72(1), 37–41. doi: 10.1002/1097-0142(19930701)72:1<37::aid-cncr2820720109>3.0.co;2-p.
51. Glimelius, B., Hoffman, K., Haglund, U., Nyrén, O., & Sjödén, P. O. (1994). Initial or delayed chemotherapy with best supportive care in advanced gastric cancer. Annals of Oncology, 5(2), 189–190. doi: 10.1093/oxfordjournals.annonc.a058778.
52. Pyrhonen, S., Kuitunen, T., Nyandoto, P., & Kouri, M. (1995). Randomised comparison of fluorouracil, epidoxorubicin and methotrexate (FEMTX) plus supportive care with supportive care alone in patients with non-resectable gastric cancer. British Journal of Cancer, 71(3), 587–591. doi: 10.1038/bjc.1995.114.
53. Boku, N., Yamamoto, S., Fukuda, H., Shirao, K., Doi, T., Sawaki, A., … Gastrointestinal Oncology Study Group of the Japan Clinical Oncology Group (2009). Fluorouracil versus combination of irinotecan plus cisplatin versus S-1 in metastatic gastric cancer: a randomised phase 3 study. The Lancet Oncology, 10(11), 1063–1069. doi: 10.1016/S1470-2045(09)70259-1.
54. Koizumi, W., Narahara, H., Hara, T., Takagane, A., Akiya, T., Takagi, M., … Takeuchi, M. (2008). S-1 plus cisplatin versus S-1 alone for first-line treatment of advanced gastric cancer (SPIRITS trial): a phase III trial. The Lancet Oncology, 9(3), 215–221. doi: 10.1016/S1470-2045(08)70035-4.
55. Bang, Y. J., Van Cutsem, E., Feyereislova, A., Chung, H. C., Shen, L., Sawaki, A., … ToGA Trial Investigators (2010). Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. The Lancet, 376(9742), 687–697. doi: 10.1016/S0140-6736(10)61121-X.
56. Ohtsu, A., Shah, M. A., Van Cutsem, E., Rha, S. Y., Sawaki, A., Park, S. R., … Kang, Y. K. (2011). Bevacizumab in combination with chemotherapy as first-line therapy in advanced gastric cancer: a randomized, double-blind, placebo-controlled phase III study. Journal of Clinical Oncology, 29(30), 3968–3976. doi: 10.1200/JCO.2011.36.2236.
57. Cunningham, D., Starling, N., Rao, S., Iveson, T., Nicolson, M., Coxon, F., … Norman, A. R. (2008). Capecitabine and oxaliplatin for advanced esophagogastric cancer. New England Journal of Medicine, 358(1), 36–46. doi: 10.1056/NEJMoa073149.
58. Shah, M. A., Bang, Y. J., Lordick, F., Alsina, M., Chen, M., Hack, S. P., … Cunningham, D. (2017). Effect of fluorouracil, leucovorin, and oxaliplatin with or without onartuzumab in HER2-negative, MET-positive gastroesophageal adenocarcinoma: the METGastric randomized clinical trial. JAMA Oncology, 3(5), 620–627. doi: 10.1001/jamaoncol.2016.5580.
59. Yoon, H. H., Bendell, J. C., Braiteh, F. S., Firdaus, I., Philip, P. A., Cohn, A. L., … Wainberg, Z. A. (2016). Ramucirumab combined with FOLFOX as front-line therapy for advanced esophageal, gastroesophageal junction, or gastric adenocarcinoma: a randomized, double-blind, multicenter Phase II trial. Annals of Oncology, 27(12), 2196–2203. doi: 10.1093/annonc/mdw423.
60. Shah, M. A., Bodoky, G., Starodub, A., Cunningham, D., Yip, D., Wainberg, Z. A., … Ajani, J. A. (2021). Phase III study to evaluate efficacy and safety of andecaliximab with mFOLFOX6 as first-line treatment in patients with advanced gastric or GEJ adenocarcinoma (GAMMA-1). Journal of Clinical Oncology, 39(9), 990–1000. doi: 10.1200/JCO.20.02755.
61. Shitara, K., Van Cutsem, E., Bang, Y. J., Fuchs, C., Wyrwicz, L., Lee, K. W., … Tabernero, J. (2020). Efficacy and safety of pembrolizumab or pembrolizumab plus chemotherapy vs chemo- therapy alone for patients with first-line, advanced gastric cancer. JAMA Oncology, 6(10), 1571–1580. doi: 10.1001/jamaoncol.2020.3370.
62. Janjigian, Y. Y., Shitara, K., Moehler, M., Garrido, M., Salman, P., Shen, L., … Ajani, J. A. (2021). First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastrooesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial. Lancet, 398(10294), 27–40. doi: 10.1016/S0140-6736(21)00797-2.
63. Kang, Y. K., Chen, L. T., Ryu, M. H., Oh, D. Y., Oh, S. C., Chung, H. C., … Boku, N. (2022). Nivolumab plus chemotherapy versus placebo plus chemotherapy in patients with HER2-negative, untreated, unresectable advanced or recurrent gastric or gastro-oesophageal junction cancer (ATTRACTION-4): a randomised, multicentre, double-blind, placebo-controlled, phase 3 trial. Lancet Oncology, 23(2), 234–247.
64. Kurokawa, Y., Sugimoto, N., Miwa, H., Tsuda, M., Nishina, S., Okuda, H., … Furukawa, H. (2014). Phase II study of trastuzumab in combination with S-1 plus cisplatin in HER2-positive gastric cancer (HERBIS-1). British Journal of Cancer, 110(5), 1163–1168. doi: 10.1038/bjc.2014.18.
65. Miura, Y., Sukawa, Y., Hironaka, S., Mori, M., Nishikawa, K., Tokunaga, S., … Hyodo, I. (2018). Five-weekly S-1 plus cisplatin therapy combined with trastuzumab therapy in HER2-positive gastric cancer: a phase II trial and biomarker study (WJOG7212G). Journal of Gastric Cancer, 21(1), 84–95. doi: 10.1007/s10120-017-0725-6.
66. Rivera, F., Romero, C., Jimenez-Fonseca, P., Izquierdo-Manuel, M., Salud, A., Martínez, E., … López, C. (2019). Phase II study to evaluate the efficacy of Trastuzumab in combination with Capecitabine and Oxaliplatin in first-line treatment of HER2-positive advanced gastric cancer: HERXO trial. Cancer Chemotherapy and Pharmacology, 83(6), 1175–11781. doi: 10.1007/s00280-019-03820-7.
67. Yuki, S., Shinozaki, K., Kashiwada, T., Kusumoto, T., Iwatsuki, M., Satake, H., … Mori, M. (2020). Multicenter phase II study of SOX plus trastuzumab for patients with HER2(+) metastatic or recurrent gastric cancer: KSCC/HGCSG/CCOG/PerSeUS 1501B. Cancer Chemotherapy and Pharmacology, 85(1), 217–23. doi: 10.1007/s00280-019-03991-3.
68. Takahari, D., Chin, K., Ishizuka, N., Takashima, A., Minashi, K., Kadowaki, S., … Yamaguchi, K. (2019). Multicenter phase II study of trastuzumab with S-1 plus oxaliplatin for chemotherapy-naive, HER2-positive advanced gastric cancer. Gastric Cancer, 22(6), 1238–1246. doi: 10.1007/s10120-019-00973-5.
69. Ryu, M. H., Yoo, C., Kim, J. G., Ryoo, B. Y., Park, Y. S., Park, S. R., … Kang, Y. K. (2015). Multicenter phase II study of trastuzumab in combination with capecitabine and oxaliplatin for advanced gastric cancer. European Journal of Cancer, 51(4), 482–488. doi: 10.1016/j.ejca.2014.12.015.
70. Thuss-Patience, P. C., Kretzschmar, A., Bichev, D., Deist, T., Hinke, A., Breithaupt, K., … Reichardt, P. (2011). Survival advantage for irinotecan versus best supportive care as second-line chemotherapy in gastric cancer–a randomised phase III study of the Arbeitsgemeinschaft Internistische Onkologie (AIO). European Journal of Cancer, 47(15), 2306–2314. doi: 10.1016/j.ejca.2011.06.002.
71. Kang, J. H., Lee, S. I., Lim, D. H., Park, K. W., Oh, S. Y., Kwon, H. C., … Park, S. H. (2012). Salvage chemotherapy for pretreated gastric cancer: a randomized phase III trial comparing chemotherapy plus best supportive care with best supportive care alone. Journal of Clinical Oncology, 30(13), 1513–1518. doi: 10.1200/JCO.2011.39.4585.
72. Ford, H. E., Marshall, A., Bridgewater, J. A., Janowitz, T., Coxon, F. Y., Wadsley, J., … COUGAR-02 Investigators (2014). Docetaxel versus active symptom control for refractory oesophagogastric adenocarcinoma (COUGAR-02): an open-label, phase 3 randomised controlled trial. The Lancet Oncology, 15(1), 78–86. doi: 10.1016/S1470-2045(13)70549-7.
73. Hironaka, S., Ueda, S., Yasui, H., Nishina, T., Tsuda, M., Tsumura, T., … Hyodo, I. (2013). Randomized, open-label, phase III study comparing irinotecan with paclitaxel in patients with advanced gastric cancer without severe peritoneal metastasis after failure of prior combination chemotherapy using fluoropyrimidine plus platinum: WJOG 4007 trial. Journal of Clinical Oncology, 31(35), 4438–4444. doi: 10.1200/JCO.2012.48.5805.
74. Wilke, H., Muro, K., Van Cutsem, E., Oh, S. C., Bodoky, G., Shimada, Y., … Ohtsu, A. (2014). Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (RAINBOW): a double-blind, randomised phase 3 trial. The Lancet Oncology, 15(11), 1224–1235. doi: 10.1016/S1470-2045(14)70420-6.
75. Shitara, K., Takashima, A., Fujitani, K., Koeda, K., Hara, H., Nakayama, N., … Koizumi, W. (2017). Nab-paclitaxel versus solvent-based paclitaxel in patients with previously treated advanced gastric cancer (ABSOLUTE): an open-label, randomised, non-inferiority, phase 3 trial. Lancet Gastroenterology & Hepatology, 2(4), 277–287. doi: 10.1016/S2468-1253(16)30219-9.
76. Sakuramoto, S., Sasako, M., Yamaguchi, T., Kinoshita, T., Fujii, M., Nashimoto, A., … Arai, K. (2007). Adjuvant chemotherapy for gastric cancer with S-1, an oral fluoropyrimidine. New England Journal of Medicine, 357(18), 1810–1820. doi: 10.1056/NEJMoa072252.
77. Sasako, M., Sakuramoto, S., Katai, H., Kinoshita, T., Furukawa, H., Yamaguchi, T., … Ohashi, Y. (2011). Five-year outcomes of a randomized phase III trial comparing adjuvant chemotherapy with S-1 versus surgery alone in stage II or III gastric cancer. Journal of Clinical Oncology, 29(33), 4387–4393. doi: 10.1200/JCO.2011.36.5908.
78. Yoshida, K., Kodera, Y., Kochi, M., Ichikawa, W., Kakeji, Y., Sano, T., … Fujii, M. (2019). Addition of docetaxel to oral fluoropyrimidine improves efficacy in patients with stage III gastric cancer: interim analysis of JACCRO GC-07, a randomized controlled trial. Journal of Clinical Oncology, 37(15), 1296–1304. doi: 10.1200/JCO.18.01138.
79. Bang, Y. J., Kim, Y. W., Yang, H. K., Chung, H. C., Park, Y. K., Lee, K. H., … CLASSIC Trial Investigators (2012). Adjuvant capecitabine and oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC): a phase 3 open-label, randomised controlled trial. Lancet, 379(9813), 315–321. doi: 10.1016/S0140-6736(11)61873-4.
80. Park, S. H., Lim, D. H., Sohn, T. S., Lee, J., Zang, D. Y., Kim, S. T., … Kang, W. K. (2021). A randomized phase III trial comparing adjuvant single-agent S1, S-1 with oxaliplatin, and postoperative chemoradiation with S-1 and oxaliplatin in patients with node-positive gastric cancer after D2 resection: the ARTIST 2 trial. Annals of Oncology, 32(3), 368–374. doi: 10.1016/j.annonc.2020.11.017.
81. Yoshikawa, T., Terashima, M., Mizusawa, J., Nunobe, S., Nishida, Y., Yamada, T., … Sasako, M. (2019). Four courses versus eight courses of adjuvant S-1 for patients with stage II gastric cancer (JCOG1104): an open-label, phase 3, non-inferiority, randomised trial. Lancet Gastroenterology & Hepatology, 4(3), 208–216. doi: 10.1016/S2468-1253(18)30383-2.
82. Kang, Y. K., Yook, J. H., Park, Y. K., Lee, J. S., Kim, Y. W., Kim, J. Y., … Noh, S. H. (2021). PRODIGY: a phase III study of neoadjuvant docetaxel, oxaliplatin, and S-1 plus surgery and adjuvant S-1 versus surgery and adjuvant S-1 for resectable advanced gastric cancer. Journal of Clinical Oncology, 39, 2903–2913. doi: 10.1200/JCO.20.02914.
83. Zhang, X., Liang, H., Li, Z., Xue, Y., Wang, Y., Zhou, Z, … Ji, J. (2021). Perioperative or postoperative adjuvant oxaliplatin with S-1 versus adjuvant oxaliplatin with capecitabine in patients with locally advanced gastric or gastro- oesophageal junction adenocarcinoma undergoing D2 gastrectomy (RESOLVE): an open-label, superiority and non-inferiority, phase 3 randomised controlled trial. Lancet Oncology, 22(8), 1081–1092. doi: 10.1016/S1470-2045(21)00297-7.
84. Terashima, M., Iwasaki, Y., Mizusawa, J., Katayama, H., Nakamura, K., Katai, H., … Sasako, M. (2019). Randomized phase III trial of gastrectomy with or without neoadjuvant S-1 plus cis- platin for type 4 or large type 3 gastric cancer, the short-term safety and surgical results: Japan Clinical Oncology Group Study (JCOG0501). Gastric Cancer, 22(5), 1044–1052. doi: 10.1007/s10120-019-00941-z.
85. Japanese Society for Palliative Medicine. Retrieved from http://www.jspm.ne.jp/proposal/proposal.html.
86. Cherny, N. I., Catane, R., & Kosmidis, P. (2003). ESMO takes a stand on supportive and palliative care. Annals of Oncology, 14(9), 1335–1337. doi: 10.1093/annonc/mdg379.
87. Tanaka, R., Lee, S. W., Kawai, M., Tashiro, K., Kawashima, S., Kagota, S., … Uchiyama, K. (2017). Protocol for enhanced recovery after surgery improves short-term outcomes for patients with gastric cancer: a randomized clinical trial. Gastric Cancer, 20(5), 861–871. doi: 10.1007/s10120-016-0686-1.
88. Shimizu, N., Oki, E., Tanizawa, Y., Suzuki, Y., Aikou, S., Kunisaki, C., … Seto, Y. (2018). Effect of early oral feeding on length of hospital stay following gastrectomy for gastric cancer: a Japanese multicenter, randomized controlled trial. Surgery Today, 48(9), 865–874. doi: 10.1007/s00595-018-1665-4.
89. Kodera, Y., Ito, S., Yamamura, Y., Mochizuki, Y., Fujiwara, M., Hibi, K., … Nakao A. (2003). Follow-up surveillance for recurrence after curative gastric cancer surgery lacks survival benefit. Annals of Surgical Oncology, 10(8), 898–902. doi: 10.1245/aso.2003.12.009.
90. Park, C. H., Park, J. C., Chung, H., Shin, S. K., Lee, S. K., Cheong, J. H., … Kim, C. B. (2016). Impact of the Surveillance Interval on the Survival of Patients Who Undergo Curative Surgery for Gastric Cancer. Annals of Surgical Oncology, 23(2), 539–545. doi: 10.1245/s10434-015-4866-8.
91. Takahashi, Y., Takeuchi, T., Sakamoto, J., Touge, T., Mai, M., Ohkura, H., … Nakazato, H. (2003). The usefulness of CEA and/or CA19-9 in monitoring for recurrence in gastric cancer patients: a prospective clinical study. Gastric Cancer, 6(3), 142–145. doi: 10.1007/s10120-003-0240-9.
92. Lee, J. H., Kim, H. I., Kim, M. G., Ha, T. K., Jung, M. S., & Kwon, S. J. (2016). Recurrence of gastric cancer in patients who are disease-free for more than 5 years after primary resection. Surgery, 159(4), 1090–1098. doi: 10.1016/j.surg.2015.11.002.
Адреса для листування:
Лукашенко Андрій
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: mail.onco@gmail.com
Correspondence:
Lukashenko Andrii
33/43 Yulii Zdanovskoi Str., Kyiv
Nonprofit Organization National Cancer Institute
E-mail: mail.onco@gmail.com














Leave a comment