Анестезіологічне забезпечення пацієнта із рецесивно-дистрофічним бульозним епідермолізом: клінічний випадок та практичні рекомендації
Починок О.О., Лісний І.І., Остафійчук В.В.
Резюме. Бульозний епідермоліз (БЕ) є рідкісним спадковим дерматологічним захворюванням, що характеризується порушенням цілісності дермо-епідермального з’єднання, унаслідок чого навіть мінімальна механічна дія може спричинити утворення бульозних уражень. Анестезіологічне забезпечення пацієнтів із тяжкими формами БЕ, зокрема рецесивно-дистрофічною (РД), становить серйозне клінічне завдання через високий ризик шкірних і слизових пошкоджень, труднощі із венозним доступом, моніторингом, інтубацією та веденням дихальних шляхів. У цій статті представлено клінічний випадок 24-річного пацієнта з генералізованою формою РД БЕ, у якого на тлі хронічного дерматозу розвинувся плоскоклітинний рак шкіри правої кисті, що потребував хірургічного лікування в обсязі ампутації правої кисті. Детально описано адаптовану передопераційну підготовку, методи модифікованого моніторингу, обґрунтування вибору тотальної внутрішньовенної анестезії (Total intravenous anesthesia — TIVA) та післяопераційне ведення. Підкреслено важливість мультидисциплінарного підходу, ретельного планування і делікатної техніки як ключових чинників для досягнення безпечного та ефективного результату без ускладнень. Описаний клінічний приклад може бути використаний як модель для розробки анестезіологічних стратегій у пацієнтів з тяжкими формами БЕ.
Одержано 14.05.2025
Прийнято до друку 5.06.2025
DOI: 10.32471/clinicaloncology.2663-466X.34547
ВСТУП
БЕ — це гетерогенна група рідкісних спадкових захворювань, що характеризуються підвищеною крихкістю шкіри та слизових оболонок унаслідок порушення цілісності дермо-епідермального з’єднання. Основним клінічним проявом є утворення бул, ерозій та хронічних виразкових дефектів навіть при незначній механічній дії чи терті шкіри [1, 2]. Це стан, що значно ускладнює повсякденне життя пацієнтів, підвищує ризик інфекційних ускладнень, втрати білків, хронічного болю, а також розвитку плоскоклітинного раку шкіри — особливо дистрофічних форм БЕ [3, 4].
Залежно від глибини порушень структури шкіри та типу дефектного білка БЕ класифікується на 4 основні типи: простий, пограничний, дистрофічний і Кіндлер-синдром. Ця класифікація, оновлена завдяки молекулярно-генетичній діагностиці, дозволяє точніше прогнозувати тяжкість перебігу та ризики ускладнень [5, 6]. Наприклад, у дистрофічному БЕ відзначається мутація гена COL7A1, що кодує колаген VII — критичний компонент якірних фібрил, які забезпечують зв’язок між базальною мембраною та дермою [5, 7].
Анестезіологічне забезпечення пацієнтів з БЕ є надзвичайно складним і ризикованим, що зумовлено не лише структурною крихкістю шкіри, а й частою супутньою патологією — анемією, хронічним болем, гіпоальбумінемією, нутритивною недостатністю, контрактурами, мікростомією, стриктурами стравоходу і гортані [8, 9]. Ці фактори значно ускладнюють усі етапи анестезії — від венозного доступу до інтубації, моніторингу та позиціювання пацієнта на операційному столі [10].
Кожний контакт з пацієнтом потребує максимально щадного підходу. Замість традиційних методів фіксації катетерів і датчиків застосовують гелеві або силіконові пов’язки, спеціальні м’які матеріали, уникнення клеїв та пластирів, а також ретельне знеболення при будь-яких маніпуляціях [3, 11]. Ендотрахеальна інтубація, особливо за наявності рубцевих змін у ділянці ротоглотки, є високоризикованою: може викликати утворення нових бул, кровотечу або навіть обструкцію дихальних шляхів. У таких випадках рекомендовано розглядати використання відеоларингоскопії або фіброоптичної інтубації у спонтанному диханні [12].
Також важливо враховувати фармакокінетичні особливості: гіпоальбумінемія може змінювати зв’язування з білками плазми крові деяких препаратів (наприклад фентанілу, пропофолу), що потребує коригування доз цих препаратів [13]. Крім того, у хворих на БЕ часто відмічається знижена толерантність до об’єму інфузії через знижений онкотичний тиск і хронічну нутритивну недостатність.
З огляду на вищевикладене, анестезіологічне забезпечення пацієнтів із БЕ має базуватися на мультидисциплінарному підході, передопераційній стратифікації ризику, індивідуалізації тактики анестезії та міждисциплінарній взаємодії (зокрема з дерматологами, гастроентерологами, стоматологами) [14].
Метою роботи є представлення клінічного випадку та аналіз ключових аспектів анестезіологічного ведення хворого з тяжкою формою БЕ з акцентом на адаптацію методів інтубації, ведення венозного доступу, інтраопераційного моніторингу та знеболення.
МАТЕРІАЛИ ТА МЕТОДИ
У статті представлено детальний опис клінічного випадку анестезіологічного забезпечення пацієнта з підтвердженим діагнозом РД БЕ, який проходив планове оперативне втручання в умовах Національного інституту раку (Київ) у 2024 р. Діагноз підтверджено на основі клінічної картини, гістологічного аналізу біоптату шкіри та результатів молекулярно-генетичного тестування (мутації гена COL7A1), відповідно до сучасної класифікації C. Has та співавт., 2020 р. [15].
КЛІНІЧНИЙ ВИПАДОК
У Національному інституті раку проведено хірургічне лікування 24-річного пацієнта з діагнозом місцево-поширеного плоскоклітинного раку шкіри правої кисті, який виник на тлі РД форми (БЕ), тяжкого генералізованого підтипу. Хворого госпіталізовано для виконання ампутації правої кисті. Особливості дерматологічного статусу зумовили необхідність надзвичайно обережного підходу на всіх етапах передопераційної підготовки та анестезіологічного забезпечення.
Пацієнт прибув в операційну із вже встановленим периферичним венозним катетером G22. Його фіксація здійснювалася за двоетапним методом із застосуванням делікатного бар’єра у вигляді силіконової пов’язки (типу Mepilex Transfer, Mepilex Lite або Mepitel), поверх якого використовувався пластир із мінімальною клейкістю. Такий підхід дозволив уникнути прямого контакту клею з епідермісом та знизити ризик його відшарування (рис. 1).
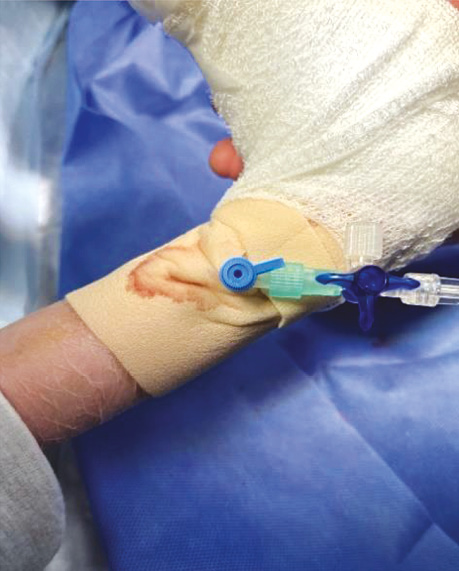
Рис. 1. Фіксований внутрішньовенний катетер
Інтраопераційний моніторинг був адаптований відповідно до стану шкіри. Пульсоксиметричний датчик розміщувався на пальці стопи (через ураження шкіри рук) з фіксацією м’яким бинтом без використання пружинної прищіпки (рис. 2).
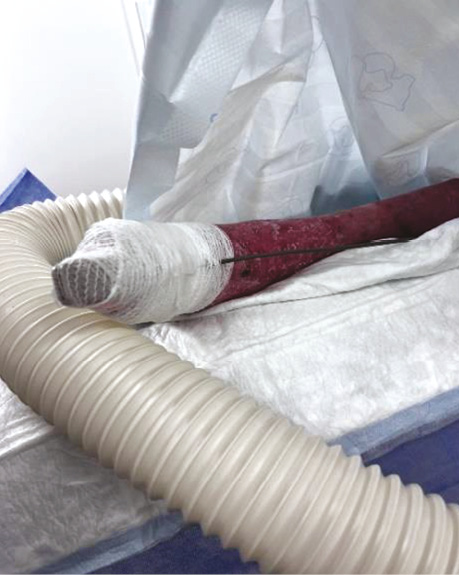
Рис. 2. Фіксація пульсоксиметра на пальці
Для вимірювання артеріального тиску застосовувалася манжета, встановлена на нижній кінцівці поверх м’якого одягу, що дозволило уникнути безпосереднього контакту з ураженою шкірою (рис. 3). Через наявність значних рубцевих змін на грудній клітці моніторинг за допомогою електрокардіографії (ЕКГ) був недоступний; для контролю серцевого ритму використовувалися плетизмографія пульсоксиметра та пальпація пульсу.
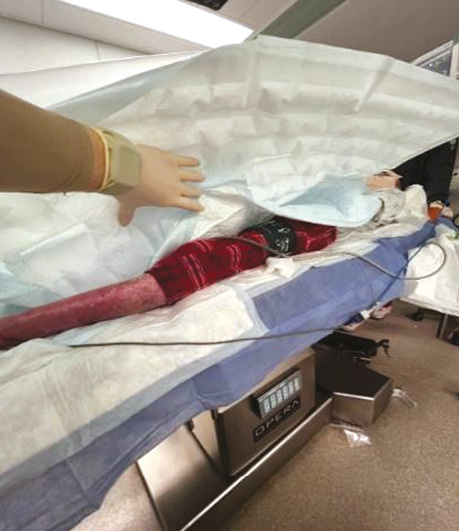
Рис. 3. Манжета для вимірювання неінвазівного артеріального тиску, встановлена на нижню кінцівку
Дихальні шляхи та обличчя пацієнта були захищені нетравматичними пов’язками (Mepitel), що запобігало пошкодженню шкіри при контакті з носовими канюлями або іншим обладнанням. Подача кисню здійснювалася через м’які силіконові носові канюлі зі швидкістю 3–4 л/хв (рис. 4). Маскової вентиляції уникали через ризик компресійного ураження шкіри обличчя. У зв’язку з поширеними ураженнями шкіри в надключичній зоні ухвалено рішення відмовитися від центральної венозної катетеризації та регіонарної анестезії, що відповідає сучасним застереженням при тяжких формах БЕ (рис. 5).
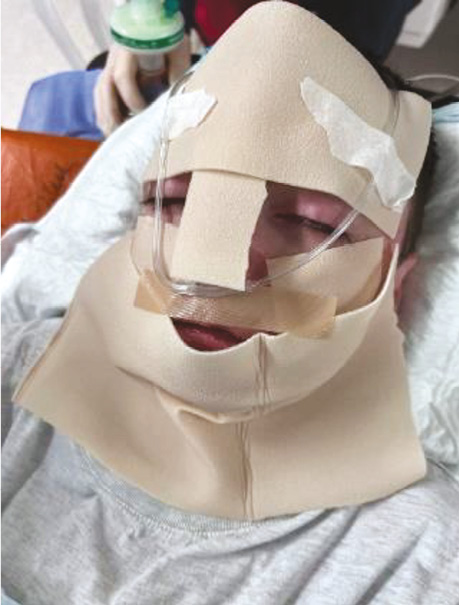
Рис. 4. Захист обличчя
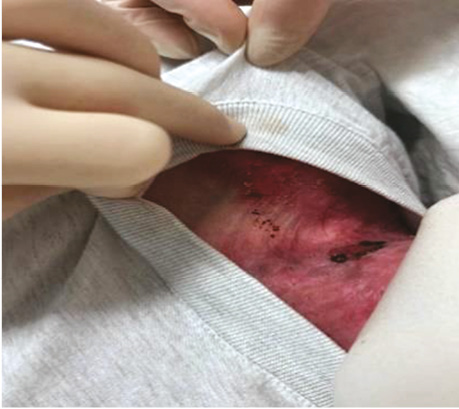
Рис. 5. Пошкодження над- і підключичної ділянок
Передопераційна підготовка включала призначення омепразолу 40 мг внутрішньовенно за 40 хв до операції, інфузію Стерофундину (500 мл), а також профілактичне введення цефазоліну 2 г. Загальна анестезія проводилася внутрішньовенно, використано TIVA. Індукція здійснювалася із застосуванням 100 мг пропофолу та 0,1 мг фентанілу, а підтримка — інфузією пропофолу зі швидкістю 5 мг/кг маси тіла/год протягом 1 год 10 хв. Додатково введено 800 мл розчину Рінгера, дексаметазон 4 мг, ондансетрон 8 мг і декскетопрофен 50 мг внутрішньовенно. Спонтанне дихання пацієнта зберігалося впродовж усієї операції, вентиляційна підтримка не знадобилася.
Показники гемодинаміки та сатурації залишалися стабільними впродовж усієї процедури. Після завершення хірургічного втручання пацієнта переведено до профільного відділення. Ускладнень з боку анестезіологічного забезпечення не зареєстровано.
ОБГОВОРЕННЯ
БЕ — це рідкісне генетичне захворювання, що потребує від медичного персоналу високого рівня обережності та чіткого дотримання індивідуального підходу до кожного клінічного втручання. Пацієнти з тяжкими формами РД БЕ мають критично вразливу шкіру, що унеможливлює застосування звичних методів фіксації, моніторингу та маніпуляцій із дихальними шляхами.
У нашому випадку продемонстровано безпечне використання TIVA у хворого з тяжким генералізованим підтипом РД БЕ, з наявністю місцево-поширеної плоскоклітинної карциноми кисті, що потребувала ампутації. Ключовим завданням стало уникнення будь-якого механічного пошкодження епідермісу при збереженні повного моніторингу та гемодинамічної стабільності.
Проблематика моніторингу життєвих функцій є одним із найчастіших викликів у таких пацієнтів. Згідно з досвідом серії випадків B.M. Mittal та співавт.[16], ЕКГ-електроди часто неможливо зафіксувати, а пульсоксиметр потребує делікатної адаптації до неуражених зон. Аналогічний підхід до фіксації датчиків пульсоксиметра на нижній кінцівці із використанням м’якого бинта був успішно використаний і в нашому клінічному випадку. Згідно з W.A. Ames та співавт. [17], фіксація манжети тонометра на м’якому бар’єрі є рекомендованим підходом для запобігання гіперемії та бульозного пошкодження.
Вибір методу анестезії у пацієнтів з БЕ залишається предметом дискусій. У більшості описаних випадків, включно з дослідженням M.B. Peterson та співавт. [18], інгаляційної анестезії слід уникати через можливу подразнювальну дію на слизові оболонки, ризик утворення бул у ротовій порожнині та труднощі фіксації маски. Зокрема, автори рекомендують TIVA із застосуванням пропофолу та короткодіючих опіоїдів як найбезпечніший вибір. У нашому випадку застосування саме TIVA дозволило уникнути потреби в масковій вентиляції та забезпечити стабільну седацію при самостійному диханні.
Складним етапом у веденні таких пацієнтів залишається підбір методу анальгезії, особливо в разі неможливості проведення регіонарної анестезії. Як наведено в публікаціях S.M. Ji та співавт. [19], периферичні блокади можуть бути небезпечними при залученні шкіри з рубцевими або ерозивними змінами. Альтернативою є системна анальгезія, що включає застосування нестероїдних протизапальних препаратів (у нашому випадку декскетопрофену), парацетамолу та мультикомпонентного підходу з додаванням дексаметазону та ондансетрону для профілактики нудоти та запалення.
Варто відзначити, що в аналогічному випадку, описаному L. Bowen та співавт. [20], пацієнт із пограничним БЕ потребував стоматологічного втручання під загальною анестезією, при якому проводилася відеоларингоскопія з аплікацією місцевих анестетиків на інструменти — для запобігання бульозним реакціям слизової оболонки. У нашому випадку обійтися без інвазивного контролю дихальних шляхів дозволила стабільна спонтанна вентиляція.
Не менш важливим чинником є мультимодальна підготовка операційної команди, що включає попередню симуляцію дій, наявність альтернативного безлатексного обладнання, гелевих накладок, делікатного одягу для покриття пацієнта, як рекомендовано у протоколі DEBRA International [21].
Отже, вибір анестезіологічної тактики у таких пацієнтів має бути заснований на принципах мінімальної інвазивності з акцентом на запобігання будь-яким силам тертя або тиску на шкіру, уникаючи стандартних фіксувальних засобів.
ВИСНОВКИ
Пацієнти з тяжкими формами БЕ, особливо РД типу, є клінічно вразливою категорією, що потребує багатоступеневої індивідуалізації анестезіологічної тактики. Наш клінічний випадок демонструє безпечне виконання ампутації кінцівки під тотальною внутрішньовенною анестезією без потреби в інвазивному контролі дихальних шляхів завдяки ретельному передопераційному плануванню. Метод TIVA підтвердив свою ефективність і безпеку. Ключову роль відіграє мультидисциплінарний підхід за участі дерматолога, анестезіолога, хірурга та медичного персоналу, обізнаного у специфіці догляду хворих на БЕ. Описаний підхід може бути використаний як зразковий алгоритм у схожих клінічних ситуаціях за умов дотримання повної індивідуалізації та уникнення будь-яких агресивних дій щодо шкіри пацієнта.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Fine, J. D. (2010). Inherited epidermolysis bullosa: recent basic and clinical advances. Current Opinion in Pediatrics, 22(4), 453–458. doi: 10.1097/MOP.0b013e32833bb74f.
2. Has, C., Bauer, J. W., Bodemer, C., Bolling, M. C., Bruckner-Tuderman, L., … Mellerio, J. E. (2020). Consensus reclassification of inherited epidermolysis bullosa and other disorders with skin fragility. British Journal of Dermatology, 183(4), 614–627. doi: 10.1111/bjd.18921.
3. Eady, R. A. J., Fine, J. D., & Burge, S. M. (2004). Genetic blistering diseases. In T. Burns, S. Breathnach, N. Cox, C. Griffiths (Ed.), Rook’s Textbook of Dermatology (7th ed.) (рр. 1993–2028). Oxford: Wiley-Blackwell. doi: 10.1002/9780470750520.ch40.
4. Montaudié, H., Chiaverini, C., Sbidian, E., Charlesworth, A., & Lacour, J. P. (2016). Inherited epidermolysis bullosa and squamous cell carcinoma: a systematic review of 117 cases. Orphanet Journal of Rare Diseases, 11(1), 117. doi: 10.1186/s13023-016-0489-9.
5. Uitto, J., Bruckner-Tuderman, L., McGrath, J. A., Riedl, R., & Robinson, C. (2018). EB2017 — Progress in Epidermolysis Bullosa Research toward Treatment and Cure. Journal of Investigative Dermatology, 138(5), 1010–1016. doi: 10.1016/j.jid.2017.12.016.
6. Intong, L. R. A., & Murrell, D. F. (2012). Inherited epidermolysis bullosa: new diagnostic criteria and classification. Clinics in Dermatology, 30(1), 70–77. doi: 10.1016/j.clindermatol.2011.03.012.
7. Varki, R., Sadowski, S., Pfendner, E., & Uitto, J. (2007). Epidermolysis bullosa. II. Type VII collagen mutations and phenotype-genotype correlations in the dystrophic subtypes. Journal of Genetic Medicine, 44(3), 181–192. doi: 10.1136/jmg.2006.045302.
8. Van Den Heuvel, I., Boschin, M., Langer, M., Frosch, M., Gottschalk, A., Ellger, B., & Hahnenkamp, K. (2013). Anesthetic management in pediatric patients with epidermolysis bullosa: a single center experience. Minerva Anestesiologica, 79(7), 727–732.
9. Herod, J., Denyer, J., Goldman, A., & Howard, R. (2002). Epidermolysis bullosa in children: pathophysiology, anaesthesia and pain management. Pediatric Anesthesia, 12(5), 388–397. doi: 10.1046/j.1460-9592.2002.00878.x.
10. Fine, J. D., Bruckner-Tuderman, L., Eady, R. A., Bauer, E. A., Bauer, J. W., Has, C., … Zambruno, G. (2014). Inherited epidermolysis bullosa: updated recommendations on diagnosis and classification. Journal of the american academy of dermatology, 70(6),1103–1126. doi: 10.1016/j.jaad.2014.01.903.
11. Iohom, G., & Lyons, B. (2001). Anaesthesia for children with epidermolysis bullosa: a review of 20 years’ experience. European Journal of Anaesthesiology, 18(11), 745–754. doi: 10.1046/j.1365-2346.2001.00916.x.
12. Kandemir, E., Gökdemir, B., Kaya, D., Leblebici, F., & Çekmen, N. (2022). Anesthetic Management of a Patient with Epidermolysis Bullosa for Esophageal Dilatation: A Case Report. Clinical medical reviews and case reports, 9, 406. doi: 10.23937/2378-3656/1410406.
13. Zidório, A. P. C., Dutra, E. S., Costa, I. M. C., & Leão, D. O. D. (2015). Nutritional aspects of children and adolescents with epidermolysis bullosa: literature review. Anais Brasileiros de Dermatologia, 90(2), 217–223. doi: 10.1590/abd1806-4841.20153206.
14. Duipmans, J. C., & Jonkman, M. F. (2010). Interdisciplinary management of epidermolysis bullosa in the public setting: the Netherlands as a model of care. Dermatologic Clinics, 28(2), 383–386. doi: 10.1016/j.det.2010.02.005.
15. Has, C., Bauer, J. W., Bodemer, C., Bolling, M. C., Bruckner-Tuderman, L., Diem, A., … Mellerio, J. E. (2020). Consensus reclassification of inherited epidermolysis bullosa and other disorders with skin fragility. British Journal of Dermatology,182(3), 574–592. doi: 10.1111/bjd.18921.
16. Mittal, B. M., Sheehan, K. R., Goodnough, C. L., Turkmani-Bazzi, S., Sheppard, K. O., & Bushell, E. (2022). Transnasal humidified rapid insufflation ventilatory exchange for difficult airway management in adults with recessive dystrophic epidermolysis bullosa: A case series. A&A Practice, 16(1), e01483. doi: 10.1213/XAA.0000000000001483.
17. Ames, W. A., Mayou, B. J., & Williams, K. N. (1999). Anaesthetic management of epidermolysis bullosa. British Journal of Anaesthesia, 82(5), 746–751. doi: 10.1093/bja/82.5.746.
18. Peterson, M. B., Strupp, K. M., Brockel, M. A., Wilder, M. S., Zieg, J., Bruckner, A. L., … Szolnoki, J. M. (2022). Anesthetic Management and Outcomes of Patients With Epidermolysis Bullosa: Experience at a Tertiary Referral Center. Anesthesia & Analgesia, 134(4), 810–821. doi: 10.1213/ANE.0000000000005749.
19. Ji, S. M., Hong, S. M., Cho, C. M., Kwon, M. A., & Kim, S. K. (2017). Anesthetic Considerations in Pediatric Patients with Epidermolysis Bullosa: A Case Report. Journal of Anesthesia and Clinical Research, 8, 735. doi: 10.4172/2155-6148.1000735.
20. Bowen, L., & Burtonwood, M. T. (2018). Anaesthetic management of children with epidermolysis bullosa. BJA Education, 18 (2), 41–45. doi: 10.1016/j.bjae.2017.11.005.
21. Schulz, A., Martini, M., & Krämer, S. M. (2020). Oral health care in epidermolysis bullosa: Clinical practice guidelines. DEBRA International. Retrieved from: http://www.debra-international.org/oral-health-care-in-eb-cpg.
Адреса для листування:
Починок Олена
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: gelena.mart@gmail.com
Correspondence:
Olena Pochynok
33/43 Yulii Zdanovskoi str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: gelena.mart@gmail.com














Leave a comment