КІТРУДА (пембролізумаб): розширення можливостей у лікуванні резектабельного недрібноклітинного раку легень
Резюме. Недрібноклітинний рак легень (НДКРЛ) є одним із найпоширеніших типів онкопатології, який є причиною більшості смертей, пов’язаних з раком, у всьому світі [1]. Втім останніми десятиріччями відбулося значне удосконалення ведення пацієнтів, що досягається комбінуванням хірургічних втручань, хіміє- та імунотерапії. У цьому контексті значущим досягненням стала розробка і застосування препаратів моноклональних антитіл, таких як пембролізумаб (КІТРУДА), що є блокатором ліганду програмованої клітинної смерті 1 (PD-L1). Мета цієї статті — представити результати новітнього клінічного дослідження, що стали ключем до більших можливостей у лікуванні дорослих пацієнтів із резектабельним НДКРЛ з високим ризиком рецидиву. Завдяки KEYNOTE-671 пембролізумаб поєднано з хімієтерапією, яка містить платину, може спочатку застосовуватися як неоад’ювантне, а потім — у вигляді монотерапії як ад’ювантне лікування [2]. Суттєво, що пембролізумаб став першим інгібітором імунних кінцевих точок, що отримав схвалення Управління з контролю за харчовими продуктами та лікарськими засобами (Food and Drug Administration — FDA) для періопераційного застосування [3].
DOI: 10.32471/clinicaloncology.2663-466X.34575
Із історії схвалення препарату
Імунотерапія відіграє дедалі більшу роль у лікуванні резектабельного НДКРЛ, особливо в неоад’ювантному та ад’ювантному режимах. Зокрема, відкриття PD-L1 проклало шлях для значного підвищення виживаності пацієнтів без мутацій рецептора епідермального фактора росту (Epidermal growth factor receptor — EGFR) або кінази анапластичної лімфоми (ALK) [4]. Своєю чергою, пембролізумаб став першим представником імунотерапевтичних засобів, що отримав схвалення Європейської комісії в якості першої лінії лікування метастатичного НДКРЛ [5].
Зокрема, у клінічному дослідженні III фази KEYNOTE-024 пацієнти з нелікованим поширеним НДРЛ були рандомізовані або для отримання пембролізумабу, або хімієтерапії. У пацієнтів з високою експресією PD-L1 (частка клітин пухлини, які експресують PD-L1 ≥50%), монотерапія пембролізумабом була пов’язана зі значними перевагами щодо виживаності без подій* (ВБП) та загальної виживаності (ЗВ) порівняно з хімієтерапією [6]. Пізніші дослідження свідчать, що пембролізумаб у комбінації з хімієтерапією призводить до значного підвищення виживаності незалежно від експресії PD-L1 як у плоскоклітинному, так і неплоскоклітинному гістологічних підтипах (табл. 1).
| Рік | Показання, які додано | Додаткові умови | Основні дослідження |
|---|---|---|---|
| 2015 | Місцево-поширений або метастатичний процес; щонайменше 1 попередній курс хімієтерапії | Експресія PD-L1 (TPS ≥1%). За наявності EGFR- / ALK-мутацій спочатку — відповідна таргетна терапія | KEYNOTE-001 |
| 2016 | 1-ша лінія монотерапії | TPS ≥50%, відсутність EGFR- /ALK-мутацій | KEYNOTE-024 |
| 2018 | 1-ша лінія, комбінація з хімієтерапією; неплоскоклітинний тип | Незалежно від PD-L1, без EGFR- /ALK-мутацій | KEYNOTE-189 |
| 2019 | 1-ша лінія, комбінація з хімієтерапією; плоскоклітинний тип | Незалежно від PD-L1
та наявності EGFR- /ALK-мутацій |
KEYNOTE-407 |
| 2023 | Ад’ювантна терапія при процесі високого ризику (стадії IB [T2a ≥4 см], II, IIIA) після повної резекції | Попередня терапія на базі платини | KEYNOTE-091 |
| 2023 | Комбінована неоад’ювантна + ад’ювантна монотерапія | Резектабельний НДРЛ з високим ризиком рецидиву | KEYNOTE-671 |
Значне підвищення показників ВБР та ЗВ згідно з результатами дослідження KEYNOTE-671 стало основою схвалення періопераційного застосування пембролізумабу не тільки у ЄС та США, але й у багатьох інших країнах [8].
Періопераційна терапія та мультидисциплінарна допомога
Навіть враховуючи поліпшення результатів лікування пацієнтів завдяки застосуванню ад’ювантної хімієтерапії на основі платини, прогноз пацієнтів із резектабельним НДКРЛ залишався складним. Так, у даних опублікованого у 2008 р. об’єднаного аналізу великих досліджень ад’ювантної хімієтерапії на основі цисплатину (Lung Adjuvant Cisplatin Evaluation — LACE) у пацієнтів з НДКРЛ підтверджено вплив хімієтерапії як щодо ЗВ (абсолютна користь 5,4% через 5 років), так і ВБП (абсолютна користь 5,8% через 5 років) [9]. Загалом це дослідження було сплановано заради з’ясування користі окремих режимів ад’ювантного лікування, проте сумарні показники відображають результати на певному етапі розвитку медичної допомоги цим пацієнтам (рис. 1).
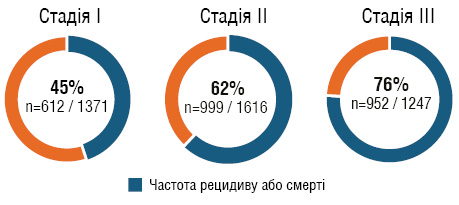
Рис. 1. Частота рецидивів або смерті протягом 5 років за стадіями [9]
Об’єднаний аналіз 5 рандомізованих досліджень:
- у дослідження залучено 4584 хворих, яким провели повну резекцію;
- 49,8% (n=2281) із цих пацієнтів отримали ад’ювантну хімієтерапію.
Потребу в більш ефективній системній ад’ювантній терапії було також підкреслено в опублікованих у 2018 р. результатах лікування пацієнтів з НДКРЛ стадій IB–IIIA у Франції, Німеччині та Великій Британії [10].
Серед 831 дослідженого пацієнта 239 (29%) мали захворювання стадії IB, 179 (22%) — стадії IIA, 165 (20%) — стадії IIB та 248 (30%) — стадії IIIA. Ад’ювантну системну терапію отримували 402 особи (48,4%) (Франція — 61,8%; Німеччина — 51,9%; Велика Британія — 33,4%). У цьому ретроспективному дослідженні 33% (n=272 / 831) пацієнтів стикнулися з рецидивом, при цьому перший рецидив у багатьох був метастатичним (рис. 2).
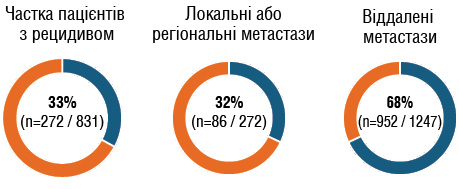
Рис. 2. Частка пацієнтів з рецидивами (локальні, регіональні або віддалені метастази) за даними ретроспективного обсерваційного дослідження (медіана спостереження — 26 міс) [10]
- Дані отримано від 831 хворого з повною резекцією.
- 48,4% (n=402) пацієнтів отримували ад’ювантну системну терапію.
Загалом ці дослідження демонструють перспективність подальшого застосування пембролізумабу в терапевтичних стратегіях для лікування резектабельного НДКРЛ, відкриваючи можливості для покращення довгострокових результатів та розширення застосування імунотерапії в онкології.
Слід також зазначити, що мультидисциплінарний підхід до ведення пацієнтів із НДКРЛ забезпечує інтеграцію молекулярних даних та клінічних факторів для вибору оптимальної терапії, що суттєво поліпшує прогноз і виживаність [11]. Настанови Національної мережі багатопрофільних онкологічних закладів США (National Comprehensive Cancer Network — NCCN) підкреслюють, що спільна робота спеціалістів різних профілів сприяє більш точному визначенню показань до імунотерапії та дозволяє адаптувати лікування залежно від індивідуальних характеристик пухлини та пацієнта (рис. 3) [12]. Крім того, у дослідженнях підтверджено, що такий комплексний підхід знижує частоту небажаних подій і підвищує якість життя пацієнтів із поширеним НДКРЛ [13].
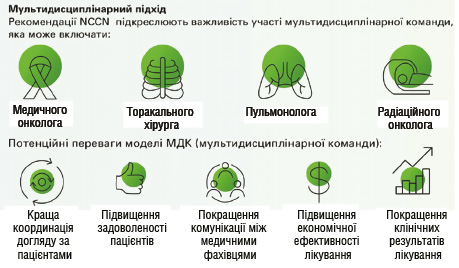
Рис. 3. Орієнтовний склад та потенційні переваги моделі МДК [11, 13]
Неоад’ювантне + ад’ювантне лікування пембролізумабом
Як зазначено вище, періопераційне призначення пембролізумабу в комбінації з неоад’ювантною хімієтерапією забезпечує підвищення ВБР та ЗВ порівняно з неоад’ювантною хімієтерапією та хірургічним втручанням при НДКРЛ. Про це свідчать результати річного спостереження учасників KEYNOTE-671, якими стали пацієнти із резектабельним НДКРЛ з високим ризиком рецидиву [14].
Рандомізоване подвійне сліпе плацебо-контрольоване клінічне дослідження III фази KEYNOTE-671 спрямоване на оцінку ефективності та безпеки комбінованої неоад’ювантної терапії із застосуванням пембролізумабу у пацієнтів з резектабельним НДКРЛ стадій II, III А або ІІІВ (N2) згідно з 8-ю редакцією Американського об’єднаного комітету з питань раку (American Joint Commission on Cancer — AJCC) [15].
Критеріями виключення були неоперабельність пухлини, наявність метастазів, а також супутні тяжкі соматичні захворювання, які могли вплинути на безпеку або результати лікування (рис. 4). Основною метою дослідження було підвищення БПВ та ЗВ хворих (рис. 5).
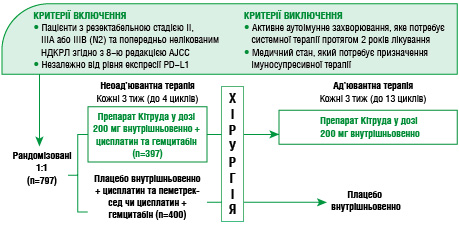
Рис. 4. Дизайн дослідження KEYNOTE-671 [16]

Рис. 5. Первинні та ключові вторинні критерії оцінки ефективності [16]
Лікування тривало до завершення 17 циклів терапії або до моменту прогресування захворювання, яке унеможливлювало проведення остаточного оперативного втручання, чи до настання рецидиву онкопатології в ад’ювантній фазі, або до прогресування захворювання у пацієнтів, яким не проводилося оперативне втручання чи була проведена неповна резекція та які перейшли в ад’ювантну фазу лікування, або до моменту виникнення ознак неприпустимої токсичності.
Пацієнти залучені до клінічного дослідження незалежно від рівня експресії PD-L1
У ході дослідження 81% хворих, які отримували препарат Кітруда в комбінації з хімієтерапією на основі платини, перенесли остаточну (радикальну) хірургічну операцію порівняно з 76% пацієнтів, які отримували плацебо в комбінації з хімієтерапією на основі платини [16].
Підвищення ЗВ при застосуванні препарату Кітруда порівняно з плацебо + хімієтерапія / плацебо
Раніше повідомлялося про значне підвищення показників ВБР [16], що призвело до схвалення періопераційного пембролізумабу в Сполучених Штатах Америки, Європі та інших країнах у цій ситуації. Так, результати другого проміжного аналізу (медіана періоду спостереження — 36,6 міс) KEYNOTE-671, який став основою для схвалення, свідчать [14]:
- спостережувальні події: 27,7% (110 / 397 пацієнтів) у групі препарату Кітруда + хімієтерапія / препарат Кітруда та 36% (144 / 400 хворих) у групі плацебо + хімієтерапія / плацебо;
- медіани ЗВ не досягнуто (95% довірчий інтервал (ДІ) НД (не досягнуто) — НД) у групі препарату Кітруда + хімієтерапія / препарат Кітруда проти 52,4 міс (95% ДІ 45,7 — НД) у групі плацебо + хімієтерапія / плацебо.
Після закінчення 36-місячного періоду:
- спостережувані події (найчастіше прогресування захворювання або рецидив) зафіксовано у 174 (44%) з 397 учасників групи препарату Кітруда + хімієтерапія / препарат Кітруда порівняно із 248 (62%) з 400 осіб групи плацебо + хімієтерапія / плацебо;
- медіана ВБП становила 47,2 міс (95% ДІ 32,9 — НД) у групі препарату Кітруда + хімієтерапія / препарат Кітруда та 18,3 міс (14,8–22,1) у групі плацебо + хімієтерапія / плацебо (відносний ризик (ВР) = 0,59 (95% ДІ 0,48–0,72) (рис. 6). Оцінка Каплана — Меєра 36-місячної ВБП становила 54% (95% ДІ 49–59) у групі пембролізумабу та 35% (95% ДІ 30–41) у групі плацебо (рис. 7).
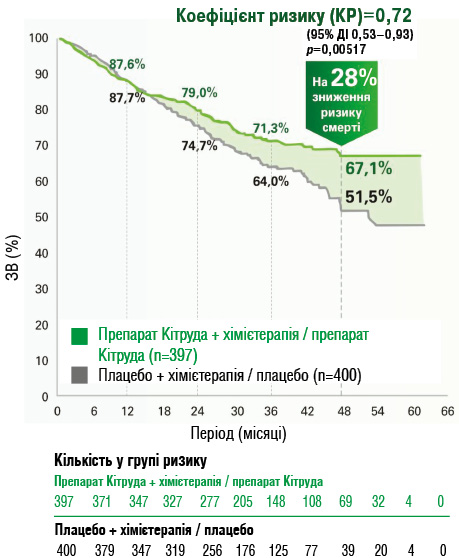
Рис. 6. Оцінка ЗВ за методом Каплана — Меєра згідно з дослідженням KEYNOTE-671
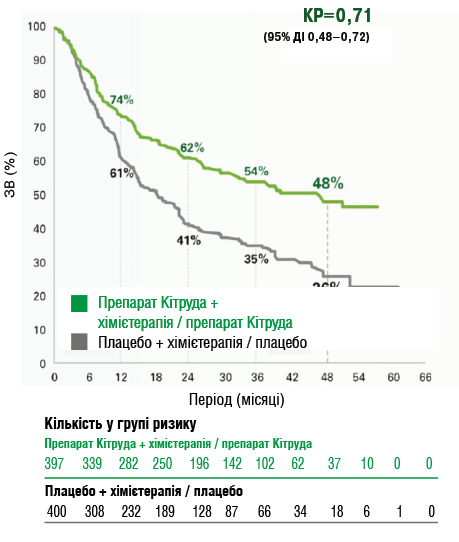
Рис. 7. Оцінка ВБП за методом Каплана — Меєра згідно з дослідженням KEYNOTE-671
Обмеження: статистичний аналіз для ВБП було завершено під час першого проміжного аналізу, тому формальний статистичний тест під час другого проміжного аналізу не проводився (рис. 8).

Рис. 8. Медіана ВБП у групах препарат Кітруда + хімієтерапія / препарат Кітруда та плацебо + хімієтерапія / плацебо за даними дослідження KEYNOTE-671 [14]
Статистично значуща різниця патологічної відповіді
Основна патологічна відповідь (ОПВ) за результатами першого проміжного аналізу (медіана спостереження — 25,2 міс) відмічалася у 120 (30,2%; 95% ДІ 25,7–35,0) учасників групи пембролізумабу та 44 (11,0%; 95% ДІ 8,1–14,5) пацієнтів групи плацебо (різниця 19,2; 95% ДІ 13,9–24,7; p <0,00001). Патологічну повну відповідь (ППВ) зафіксовано у 72 (18,1%; 95% ДІ 14,5–22,3) осіб групи пембролізумабу та 16 (4,0%; 95% ДІ 2,3–6,4) учасників групи плацебо (різниця 14,2; 95% ДІ 10,1–18,7; p <0,00001) [16] (рис. 9).
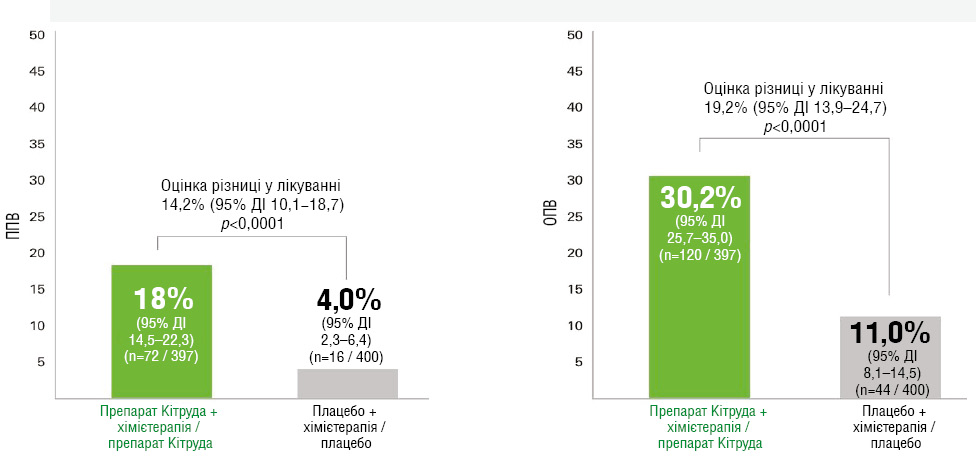
Рис. 9. ППВ та ОПВ за результатами першого проміжного аналізу (медіана спостереження — 25,2 міс) у учасників обох груп [16]
Оцінка різниці в лікуванні 14,2% (95% ДІ 10,1–18,7):
- p <0,0001;
- 18,1% (95% ДІ 14,5–22,3) (n=72 / 397);
- 4,0% (95% ДІ 2,3–6,4) (n=16 / 400);
- оцінка різниці в лікуванні 19,2% (95% ДІ 13,9–24,7);
- р <0,0001;
- 30,2% (95% ДІ 25,7–35,0; n=120/ 397);
- 11,0% (95% ДІ 8,1–14,5) (n=44 / 400);
- Вісь у: ППВ. Вісь у: ОПВ;
- препарат Кітруда + хімієтерапія / препарат Кітруда;
- плацебо + хімієтерапія / плацебо.
Профіль безпеки
Аналіз побічних реакцій окремо за фазами дослідження KEYNOTE-671 доступний також за результатами першого проміжного аналізу (медіана спостереження — 25,2 міс) (табл. 2).
| Неоад’ювантна / хірургічна фаза | Ад’ювантна фаза |
|
|
6,3% (n=25 / 397) пацієнтів, які отримували препарат Кітруда поєднано з хімієтерапією, та 4,2% (n=17 / 400) хворих, які отримували плацебо у комбінації з хімієтерапією, не змогли пройти хірургічне втручання через виникнення побічних ефектів [16].
Режими введення
Існують різні варіанти дозування препарату Кітруда у пацієнтів з НДКРЛ як у неоад’ювантному, так і ад’ювантному режимах лікування. Так, препарат Кітруда може бути введений у дозі 200 мг кожні 3 тиж чи в дозі 400 мг кожні 6 тиж (рис. 10).
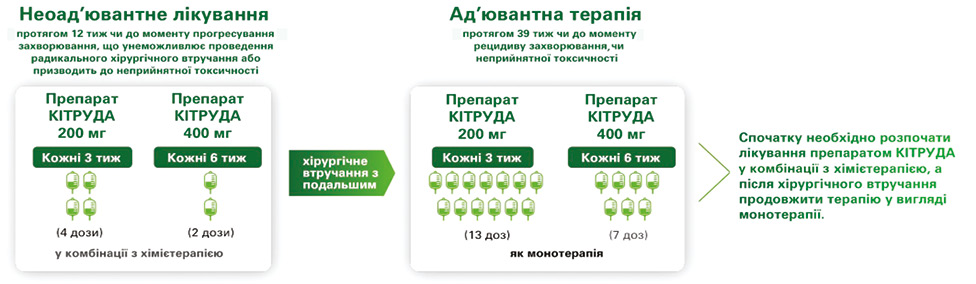
Рис. 10. Схема періопераційного застосування Кітруди
Висновок
Отже, додавання пембролізумабу до неоад’ювантної хімієтерапії сприяло значному підвищенню ЗВ, ВБП, ППВ та ОПВ порівняно з лише неоад’ювантною хімієтерапією. Переваги ефективності препарату Кітруда в періопераційний період не зумовили довгострокового зниження якості життя, пов’язаної зі здоров’ям, і при додатковому спостереженні не з’явилося нових сигналів щодо безпеки. Ці результати підтверджують, що пембролізумаб у періопераційний період є стандартним варіантом лікування пацієнтів з резектабельним НДКРЛ II–IIIB (N2) стадій.
Список використаної літератури
1. Hendriks, L. E. L., Remon, J., Faivre-Finn, C., Garassino, M. C., Heymach, J. V., Kerr, K. M., … Reck, M. (2024). Non-small-cell lung cancer. Nat. Rev. Dis. Primers., 10(1), 71. doi: 10.1038/s41572-024-00551-9.
2. Annex I. Summary of product characteristics. Keytruda 25 mg/mL concentrate for solution for infusion. Retrieved from http://www.ema.europa.eu/en/documents/
product-information/keytruda-epar-product-information_en.pdf. Accessed 23.06.2025.
3. Aredo, J. V., & Wakelee, H. A. (2024). Top advances of the year: Perioperative therapy for lung cancer. Cancer, 130(17), 2897–2903. doi: 10.1002/cncr.35357.
4. Wolf, E., Sacchi de Camargo Correia, G., Li, S., Zhao, Y., Manochakian, R., & Lou, Y. (2025). Emerging Immunotherapies for Advanced Non-Small-Cell Lung Cancer. Vaccines, 13(2), 128. doi: doi.org/10.3390/vaccines13020128.
5. Merck & Co., Inc. (2017). European Commission Approves
KEYTRUDA® (pembrolizumab) for First-Line Treatment of Patients with Metastatic Non-Small Cell Lung Cancer (NSCLC) Whose Tumors Have High PD-L1 Expression with No EGFR or ALK Positive Tumor Mutations. News release. Retrieved from http://www.merck.com/news/european-commission-approves-
keytruda-pembrolizumab-for-first-line-treatment-of-patients-with-metastatic-non-small-cell-lung-cancer-nsclc-whose-tumors-have-high-pd-l1-expression-with-no-egfr. Accessed 23.06.2025.
6. Reck, M., Rodríguez-Abreu, D., Robinson, A. G., Hui, R., Csőszi, T., Fülöp, A., … Brahmer, J. R.; KEYNOTE-024 Investigators (2016). Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. N. Engl. J. Med., 375(19), 1823–1833. doi: 10.1056/NEJMoa1606774.
7. EMA (2025). Keytruda. Authorisation details. Retrieved from http://www.ema.europa.eu/
en/medicines/human/EPAR/keytruda#authorisation-details. Accessed 23.06.2025.
8. ESMO (2025). Long-term follow up data confirms the benefits of perioperative
pembrolizumab in early-stage NSCLC. Retrieved from dailyreporter.esmo.org/esmo-immuno-
oncology-congress-2024/highlights-from-the-esmo-immuno-oncology-
congress/long-term-follow-up-data-confirms-the-benefits-of-perioperative-pembrolizumab-in-early-stage-nsclc. Accessed 23.06.2025.
9. Pignon, J. P., Tribodet, H., Scagliotti, G. V., Douillard, J. Y., Shepherd, F. A., Stephens, R. J., … Le Chevalier, T.; LACE Collaborative Group (2008). Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group. J. Clin. Oncol., 26(21), 3552-9. doi: 10.1200/JCO.2007.13.9030.
10. Chouaid, C., Danson, S., Andreas, S., Siakpere, O., Benjamin, L., Ehness, R., … Kontoudis, I. (2018). Adjuvant treatment patterns and outcomes in patients with stage IB-IIIA non-small cell lung cancer in France, Germany, and the United Kingdom based on the LuCaBIS burden of illness study. Lung Cancer,124, 310–316. doi: 10.1016/j.lungcan.2018.07.042.
11. Hardavella, G., Frille, A., Theochari, C., Keramida, E., Bellou, E., Fotineas, A., … Karampinis, I. (2020) Multidisciplinary care models for patients with lung cancer. Breathe (Sheff),16(4), 200076. doi: 10.1183/20734735.0076-2020.
12. Riely, G. J., Wood, D. E., Ettinger, D. S., Aisner, D. L., Akerley, W., Bauman, J. R., … Hang, L. (2024). Non-Small Cell Lung Cancer, Version 4.2024, NCCN Clinical Practice Guidelines in Oncology. J. Natl. Compr. Canc. Netw., 22(4), 249–274. doi: 10.6004/jnccn.2204.0023.
13. Eberhardt, W. E., & Stuschke, M. (2015). Multimodal treatment of non-small-cell lung cancer. The Lancet, 386(9998), 1018-20. doi: 10.1016/S0140-6736(15)61083-2.
14. Spicer, J. D., Garassino, M. C., Wakelee, H., Liberman, M., Kato, T., Tsuboi, M., … Gao, S.; KEYNOTE-671 Investigators (2024). Neoadjuvant pembrolizumab plus chemotherapy followed by adjuvant pembrolizumab compared with neoadjuvant chemotherapy alone in patients with early-stage non-small-cell lung cancer (KEYNOTE-671): A randomised, double-blind, placebo-controlled, phase 3 trial. The Lancet, 405(10344), 1–11. doi: doi.org/10.1016/S0140-6736(24)00394-1.
15. Amin, M. B., Edge, S. B., Greene, F. L., Byrd, D. R., Brookland, R. K., Washington, M. K., … Meyer, L. R. (Eds.). (2017). AJCC cancer staging manual (8th ed.). Springer. doi: doi.org/10.1007/978-3-319-40618-3.
16. Wakelee, H., Liberman, M., Kato, T., Tsuboi, M., Lee, S. H., Gao, S., … Spicer, J. D.; KEYNOTE-671 Investigators (2023). Perioperative Pembrolizumab for Early-Stage Non-Small-Cell Lung Cancer. N. Engl. J. Med., 389(6), 491–503. doi: 10.1056/NEJMoa2302983.
Ірина Неміш















Leave a comment