Останні досягнення імунотерапії в лікуванні онкологічних пацієнтів: застосування імунотерапії при недрібноклітинному раку легені
Резюме. У цьому десятилітті імунотерапія стала найперспективнішим напрямком пошуку нових шляхів у лікуванні пацієнтів зі злоякісними новоутвореннями. Основною метою імунотерапії є відновлення імунного контролю над клітинами злоякісної пухлини. У пацієнтів з метастатичним та поширеним недрібноклітинним раком легені впровадження в клінічну практику сучасних імунотерапевтичних методів лікування дозволить змінити прогноз і — що найбільш значимо — досягти тривалої і стійкої ремісії у частини з них, при задовільному профілі токсичності.
Одержано 06.12.2018
Прийнято до друку 07.12.108
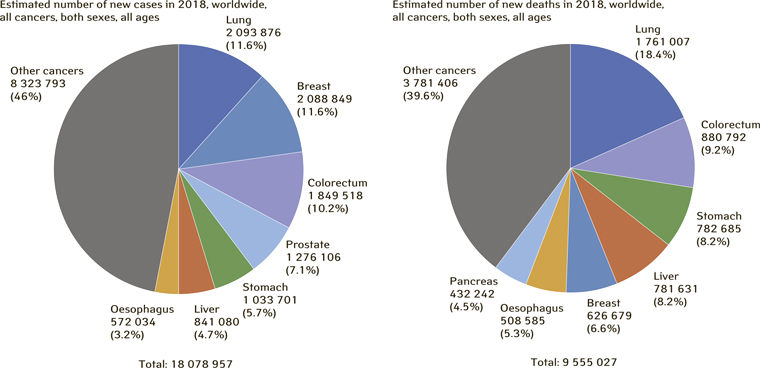
Рак легені (РЛ) є найчастішою онкологічною патологією сучасності — за прогнозами, у 2018 р. у світі зареєструють близько 2,0 млн нових випадків цього захворювання, при цьому смертність від РЛ досягне 1,7 млн, що становитиме майже п’яту частину (18,4%) всіх випадків смерті від злоякісних новоутворень у цьому році (рис. 1) [1].
Недрібноклітинний рак легені (НДКРЛ) становить близько 80–90% усіх випадків карциноми легені, натомість захворюваність на дрібноклітинний РЛ знижується протягом останніх двох десятиліть у більшості країн світу [2]. Дані глобальних статистичних досліджень показують, що за останні 25 років змінився також і розподіл гістологічних типів НДКРЛ: так, у Сполучених Штатах знижується частота плоскоклітинної карциноми легені, яка раніше переважала в структурі захворюваності на НДКРЛ, натомість зростає частота виявлення аденокарциноми як у чоловіків, так і у жінок. В Європі аналогічні тенденції спостерігаються серед чоловіків, натомість у жінок реєструється підвищення захворюваності на НДКРЛ обох гістологічних типів. Таким чином, аденокарцинома на сьогодні є домінуючим гістологічним типом НДКРЛ [3, 4]. Але, на жаль, навіть у розвинених країнах приблизно у 65% пацієнтів із карциномою легені захворювання діагностується в пізніх стадіях [4].
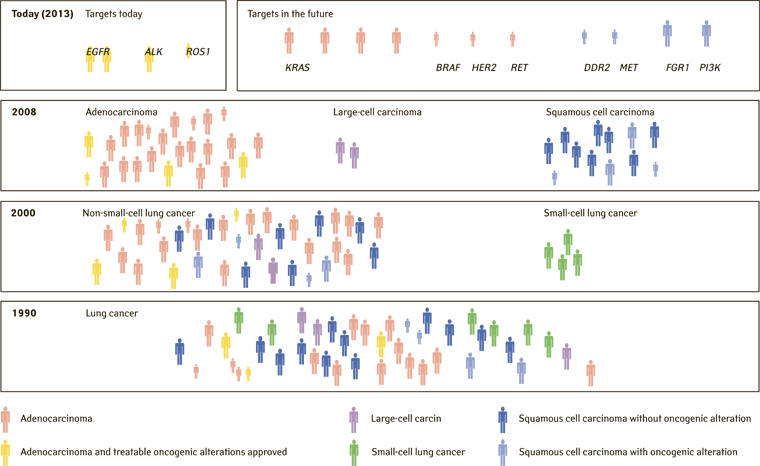
Рис. 2 ілюструє еволюцію гістологічних типів РЛ протягом останніх трьох десятиліть, а також розподіл драйверних мутацій серед пацієнтів із РЛ [4].
Важливо розуміти, що одна і та сама нозологічна форма об’єднує два біологічно різних захворювання — РЛ, індукований тютюнопалінням, і РЛ у некурців. Кожен із цих різновидів РЛ має характерні молекулярні особливості, які значною мірою визначають перебіг захворювання та тактику системного лікування пацієнтів. РЛ у некурців характеризується підвищенням частоти мутацій в генах EGFR, ALK, ROS1, а також RET, MET і BRAF — для кожної з цих тирозинкіназ існують ефективні терапевтичні інгібітори. Вищезазначені генетичні пошкодження суттєво рідше трапляються у курців [4–11]. РЛ, який виникає у курців, характеризується значною кількістю мутацій, які формуються внаслідок дії канцерогенів тютюнового диму, на відміну від карцином, що розвиваються у некурців та/або асоційовані з мутаціями EGFR або ALK, яким притаманна мала кількість мутацій. Рівень мутаційного навантаження зумовлює імуногенність пухлини. Внаслідок цього імовірність відповіді на терапію інгібіторами контрольних точок значною мірою залежить від сукупної кількості мутацій (tumor mutation burden — TMB). Таким чином, серед пацієнтів з НДКРЛ частота EGFR мутації становить 10–15%, ALK — 3–5%, ROS1 — 1% та BRAF — 1–3% [12].
Незважаючи на успіхи таргетної терапії РЛ, до останнього часу основною терапевтичною опцією для більшості пацієнтів із НДКРЛ на пізніх стадіях була системна хіміотерапія (ХТ). Ефективність ХТ у хворих на НДКРЛ доведено у значній кількості великих рандомізованих досліджень, метааналіз яких виявив покращення показників загальної виживаності (HR=0,77; 95% CI 0,71–0,83), що відповідає підвищенню однорічної виживаності хворих на НДКРЛ у середньому з 20 до 29% [13]. Стандартом першої лінії ХТ є платиновмісні режими в комбінації з цитостатиками третього покоління (паклітаксел, гемцитабін, вінорельбін, пеметрексед, доцетаксел) [14]. Варто зазначити, що частка пацієнтів із поширеним НДКРЛ, які отримали другу та третю лінії терапії, коливається, за даними різних досліджень, від половини до третини — тобто в середньому менше половини пацієнтів продовжують системну терапію. Основними причинами відмови від призначення наступних ліній ХТ, за даними різних авторів, є погіршення загального стану, похилий вік пацієнта, а також токсичність проведеного лікування [15]. Тому у цієї категорії хворих впровадження в клінічну практику сучасних імунотерапевтичних методів лікування дозволить змінити прогноз і — що найбільш значимо — досягти тривалої і стійкої ремісії у частини з них, при задовільному профілі токсичності [14].
У цьому десятилітті імунотерапія стала найперспективнішим напрямком пошуку нових шляхів у лікуванні пацієнтів зі злоякісними новоутвореннями. Основною метою імунотерапії є відновлення імунного контролю над клітинами злоякісної пухлини. На сьогодні імунотерапевтичні засоби для лікування меланоми, НДКРЛ та інших видів злоякісних новоутворень зареєстровано в США Управлінням з контролю за харчовими продуктами та лікарськими засобами (Food and Drug Administration — FDA), в країнах Європейського Союзу — Європейським агентством з лікарських засобів (European Medicines Agency — EMEA) та іншими регуляторними інстанціями у світі.
Згідно з останніми клінічними рекомендаціями Європейського товариства з медичної онкології (European Society for Medical Oncology — ESMO), Національної загальної онкологічної мережі (National Comprehensive Cancer Network — NCCN) та Американського товариства клінічної онкології (American Society of Clinical Oncology — ASCO), вибір першої лінії терапії у хворих на поширений НДКРЛ ґрунтується на наявності генетичних аберацій, таких як сенсибілізуюча мутація в гені рецептора епідермального фактора росту (EGFR) і транслокація ALK. Проте у більшості пацієнтів з НДКРЛ пухлини не несуть цих мутацій. Приблизно у 23–28% пацієнтів із поширеним НДКРЛ пухлини характеризуються високим рівнем експресії ліганда PD-L1 сигнального шляху програмованої клітинної смерті PD-1 (programmed cell death pathway). Високий рівень PD-L1 визначається як експресія PD-L1 на мембрані принаймні 50% пухлинних клітин, незалежно від інтенсивності забарвлення. Використовуючи PD-1 сигнальний шлях, клітини пухлини уникають контролю та знищення імунною системою, пригнічуючи та виснажуючи Т-клітинну ланку протипухлинної імунної відповіді [18]. Так, дослідження І фази KEYNOTE-001 та дослідження ІІІ фази KEYNOTE-010 показали, що пацієнти з поширеним НДКРЛ, у яких рівень PD-L1 становив ≥50%, мали кращу відповідь на терапію пембролізумабом порівняно з хворими, які мали нижчий рівень PD-L1 (пембролізумаб — це високоселективне, високоафінне, гуманізоване моноклональне антитіло IgG4-k до PD-1 рецептора, що перешкоджає PD-1 залучати PD-L1 та PD-L2 та пригнічувати протипухлинну імунну відповідь) [16, 17, 19].
Дослідження III фази KEYNOTE-024 визначило роль пембролізумабу як опцію терапії першої лінії у нелікованих пацієнтів із поширеним НДКРЛ, що характеризується експресією PD-L1 на мембрані ≥50% пухлинних клітин при відсутності мутацій EGFR та транслокації ALK. У дослідженні KEYNOTE-024 скриновано 1934 пацієнти, серед яких у 500 (30%) виявлено пухлини з PD-L1 експресією ≥50%, 305 із них було включено у дослідження. Пацієнтів рандомізовано у співвідношенні 1:1 у групу пембролізумабу в дозі 200 мг кожні 3 тиж до прогресування або розвитку токсичності (154 хворих) та в групу платиновмісної ХТ за вибором лікаря: карбоплатин + гемцитабін, цисплатин + гемцитабін, карбоплатин + паклітаксел або карбоплатин/цисплатин в поєднанні з пеметрекседом кожні 3 тиж 4–6 курсів (151 хворий). У випадку прогресії хворі в групі ХТ могли отримувати пембролізумаб в якості терапії другої лінії [20]. Показники ефективності виявили перевагу пембролізумабу порівняно зі стандартною ХТ. Так, частота об’єктивної відповіді в групі пембролізумабу становила 45% порівняно з групою ХТ — 28%. Призначення пембролізумабу знижує ризик прогресування в два рази (HR=0,5; 95% CI 0,37–0,68; p<0,001) [21]. Подальше спостереження підкреслило перевагу пембролізумабу порівняно зі стандартною ХТ, при цьому медіана загальної виживаності збільшилася у два рази у хворих, які отримували пембролізумаб, порівняно з пацієнтами, у яких проводили ХТ, і становила 30 та 14 міс відповідно (рис. 3).
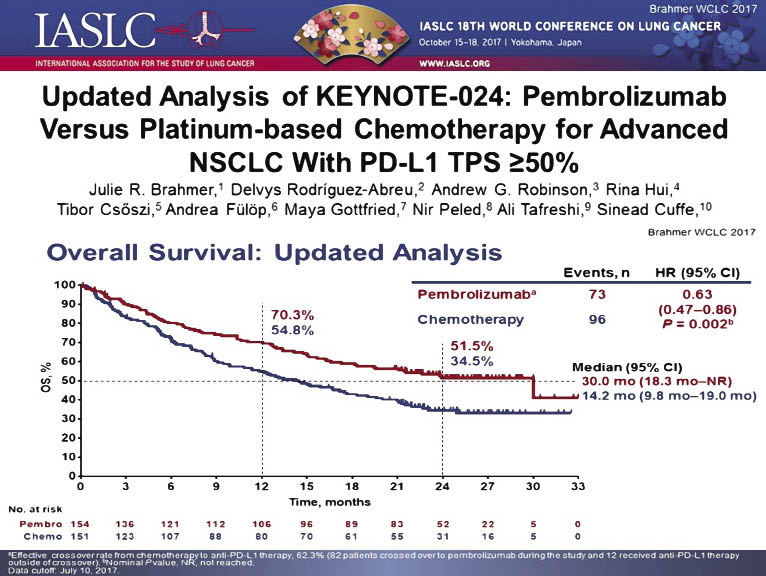
Рис. 3. Показники загальної виживаності в групах пембролізумабу та ХТ у дослідженні KEYNOTE-024 (липень 2017 р.) [21]
Частота небажаних явищ III–IV ступеня сягала 53,3% в групі ХТ і 31,2% — у групі пембролізумабу. Найчастішими небажаними явищами були діарея (22%), слабкість (16%) і лихоманка (16%) в групі пембролізумабу та анемія (66%), нудота (65%) і слабкість (43%) — у групі ХТ.
В інших дослідженнях KEYNOTE-042 та CheckMate 026 вивчали ефективність інгібіторів PD-1 пембролізумабу та ніволумабу відповідно у пацієнтів із поширеним НДКРЛ з різним рівнем експресії PD-L1 у клітинах пухлини.
Недавні результати дослідження ІІІ фази KEYNOTE-042 продемонстрували покращення загальної виживаності у пацієнтів з НДКРЛ з PD-L1 ≥1%, які отримували пембролізумаб, порівняно з групою ХТ. Стратифікація за рівнем PD-L1 була наступною: ≥50%, ≥20% і ≥1%. Призначення пембролізумабу знизило ризик смерті в 1,4 (HR=0,69), 1,3 (HR=0,77) та в 1,2 раза (HR=0,81) відповідно порівняно зі стандартною ХТ. У цілому найбільші переваги від призначення пембролізумабу отримали пацієнти з НДКРЛ з експресією PD-L1 ≥50% [22].
У дослідженні CheckMate 026 неліковані пацієнти з НДКРЛ та експресією PD-L1 ≥1% (аналіз дослідження базувався на рівні PD-L1 ≥5%) були рандомізовані в групу ніволумабу або платиновмісної ХТ [23]. У дослідженні не показано переваг ніволумабу порівняно зі стандартною ХТ щодо безрецидивної та загальної виживаності. Але ретроспективно проаналізовано вплив рівня мутаційного навантаження на користь від призначення ніволумабу у пацієнтів з НДКРЛ. Серед пацієнтів, які отримали лікування в рамках протоколу CheckMate 026, у 312 (58% рандомізованих хворих) було достатньо зразків пухлинної тканини для проведення повного геномного секвенування. Так, у хворих, у пухлинах яких виявлено найвищий рівень мутаційного навантаження (>243 missense не синонімічних соматичних мутацій на зразок), частота об’єктивної відповіді в групі ніволумабу становила 47% проти 28% в групі ХТ, що також відобразилося на рівні безрецидивної виживаності. Так, у пацієнтів з високим мутаційним навантаженням, які отримували ніволумаб, ризик рецидиву зменшувався в середньому на 40% (HR=0,62; 95% CI 0,38–1,0) порівняно з групою ХТ. Натомість, серед пацієнтів із середнім та низьким рівнем мутаційного навантаження частота об’єктивної відповіді на терапію була кращою в групі ХТ порівняно з групою ніволумабу: 33% проти 23% відповідно [14, 23].
Недавні результати досліджень ІІІ фази KEYNOTE-189 (пембролізумаб), IMpower150 (атезолізумаб) та IMpower132 (атезолізумаб) розширили показання до призначення інгібіторів контрольних точок у пацієнтів з поширеним НДКРЛ, EGFR- та ALK-негативним, незалежно від PD-L1 статусу. На основі отриманих результатів FDA в США та ЕМЕА в країнах Європейського Союзу зареєстрували пембролізумаб та атезолізумаб в комбінації зі стандартною ХТ у якості терапії першої лінії пацієнтів з поширеним НДКРЛ, при відсутності геномних аберацій EGFR і ALK.
Підсумовуючи вищесказане, варто зазначити, що результати досліджень KEYNOTE-024, IMpower150, KEYNOTE-189, IMpower132, CheckMate 227, KEYNOTE-407 та IMpower131 свідчать, що впровадження імунотерапії стане стандартним новим підходом у більшості пацієнтів із вперше виявленим НДКРЛ.
Список використаної літератури
- http://globocan.iarc.fr/old/FactSheets/cancers/lung-new.asp
- Jemal A., Bray F., Center M.M. et al. (2011) Global Cancer Statistics. CA Cancer J. Clin., 61: 69–90.
- Forman D., Bray F., Brewster D. (2013) Cancer Incidence in Five Continents. Lyon: IARC Press.
- Reck M., Heigener D.F., Mok T. et al. (2013) Management of non-small-cell lung cancer: recent developments. Lancet, 382: 709–719.
- Rosell R., Carcereny E., Gervais R. et al. and the Spanish Lung Cancer Group in collaboration with Groupe Français de Pneumo-Cancérologie and Associazione Italiana Oncologia Toracica (2012) Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positivenon-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol., 13: 239–246.
- Kwak E.L., Bang Y.J., Camidge D.R. et al. (2010) Anaplastic lymphoma kinase inhibition in non-small-cell lung cancer. N. Engl. J. Med., 363: 1693–1703.
- Iwama E., Okamoto I., Harada T. et al. (2014) Development of anaplastic lymphoma kinase (ALK) inhibitors and molecular diagnosis in ALK rearrangement-positive lung cancer. Onco Targets Ther., 7: 375–385. doi: 10.2147/OTT.S38868. eCollection 2014
- Leonetti A., Facchinetti F., Rossi G. et al. (2018) BRAF in non-small cell lung cancer (NSCLC): Pickaxing another brick in the wall. Cancer Treat. Rev., 66: 82–94.
- Lin J.J., Shaw A.T. (2017) Recent advances in targeting ROS1 in lung cancer. J. Thorac. Oncol., 12(11): 1611–1625.
- Schildhaus H.U., Schultheis A.M., Rüschoff J. et al. (2015) MET amplification status in therapy-naive adeno- and squamous cell carcinomas of the lung. Clin. Cancer Res., 21(4): 907–915.
- Imyanitov Е. (2018) Molecular targets in lung cancer: current status. Practical Oncology, 19(2): 93–104.
- Forde P.M., Chaft J.E., Smith K.N. et al. (2018) Neoadjuvant PD-1 Blockade in resectable lung cancer. N. Engl. J. Med., 378(21): 1976–1986.
- NSCLC Meta-Analyses Collaborative Group (2008) Chemotherapy in addition to supportive care improves survival in advanced non-small-cell lung cancer: a systematic review and meta-analysis of individual patient data from 16 randomized controlled trials. J. Clin. Oncol., 26: 4617–425.
- Planchard D., Popat S., Kerr K. et al. (2018) Metastatic non-small cell lung cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol., 29(Issue Suppl. 4): iv192–iv237.
- Davies J., Patel M., Gridelli C. et al. (2017) Real-world treatment patterns for patients receiving second-line and third-line treatment for advanced non-small cell lung cancer: A systematic review of recently published studies. PLoS ONE ,12(4): e0175679. https://doi.org/10.1371/journal.pone.0175679
- Herbst R.S., Baas P., Kim D.W. et al. (2016) Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial. Lancet, 387: 1540–1550.
- Garon E.B., Rizvi N.A., Hui R. et al. (2015) Pembrolizumab for the treatment of non-small-cell lung cancer. N. Engl. J. Med., 372: 2018–2028.
- Pardoll D.M. (2012) The blockade of immune checkpoints in cancer immunotherapy. Nat. Rev. Cancer, 12(4): 252–264.
- Chatterjee M., Turner D.C., Felip E. et al. (2016) Systematic evaluation of pembrolizumab dosing in patients with advanced nonsmall-cell lung cancer. Ann. Oncol., 27: 1291–1298.
- Reck M., Rjdriguez-Abreu D., Robinson A.G. et al. (2016) Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer. N. Engl. J. Med. (published ahead October 9, 2016).
- Brahmer J., Rodríguez-Abreu D., Robinson A. et al. (2017) OA 17.06 updated analysis of KEYNOTE-024: pembrolizumab vs platinum-based chemotherapy for advanced NSCLC with PD-L1 TPS 50%. J. Thorac. Oncol., 12: S1793–S1794.
- Lopes G., Wu Y.-L., Kudaba I. et al. (2018) Pembrolizumab (pembro) versus platinum-based chemotherapy (chemo) as first-line therapy for advanced/metastatic NSCLC with a PD-L1 tumor proportion score (TPS) ≥ 1%: Open-label, phase 3 KEYNOTE-042 study. J. Clin. Oncol., 36(18 Suppl.): LBA4.
- Carbone D.P., Reck M., Paz-Ares L.et al. (2017) First-line nivolumab in stage IV or recurrent non-small-cell lung cancer. N. Engl. J. Med., 376: 2415–2426.
Последние достижения иммунотерапии в лечении онкологических пациентов: применение иммунотерапии при немелкоклеточном раке легкого
Национальный институт рака, Киев
Резюме. В этом десятилетии иммунотерапия стала самым перспективным направлением поиска новых путей в лечении пациентов со злокачественными новообразованиями. Основной целью иммунотерапии является возобновление иммунного контроля над клетками злокачественной опухоли. У пациентов с метастатическим и распространенным немелкоклеточным раком легкого внедрение в клиническую практику современных методов лечения позволит изменить прогноз и — что наиболее значимо — достичь длительной и стойкой ремиссии у части из них, при удовлетворительном профиле токсичности.
рак легкого; химиотерапия; иммунотерапия.
Адреса:
Верьовкіна Наталія Олегівна
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
Тел.: +38 (044) 257-93-64
E-mail: 15a78nataliia@gmail.com
Correspondence:
Verovkina Natalia
33/43 Lomonosova str., Kyiv 03022
National Cancer Institute
Tel.: +38 (044) 257-93-64
E-mail: 15a78nataliia@gmail.com
Настоящая публикация издана при поддержке компании MSD
Настоящая информация предоставлена компанией MSD в качестве профессиональной поддержки специалистам здравоохранения. Информация, относящаяся к любому продукту(-ам), может не совпадать с инструкцией по применению препарата.
Пожалуйста, ознакомьтесь с полным текстом инструкции для получения точной информации или данных по продуктам, рассматриваемым в настоящей публикации, до назначения.
ONCO-1278251-0000














Leave a comment