Досвід застосування брентуксимабу ведотину в комбінації з хімієтерапією при IV стадії лімфоми Ходжкіна в Україні
Крячок І.А.1, Титоренко І.Б.1, Мороз Ю.В.1, Алексик О.М.1, Каднікова Т.В.1, Пастушенко Я.В.1, Рудюк Т.О.1, Буртна А.С.1, Шокун Н.В.1, Ходак В.П.2, Назар Р.Я.3, Карнабеда О.А.4, Михальска Л.В.5, Крутогуз А.С.6, Прохач А.В.7
- 1Державне некомерційне підприємство «Національний інститут раку», Київ, Україна
- 2Державна установа «Інститут медичної радіології та онкології ім. С.П. Григор’єва Національної академії медичних наук України», Харків, Україна
- 3Державне некомерційне підприємство «Львівське територіальне медичне об’єднання «Клінічна лікарня планового лікування, реабілітації та паліативної допомоги», Україна
- 4Онкологічна клініка «Інновація», с. Лютіж, Україна
- 5Клінічна лікарня «Феофанія», Київ, Україна
- 6Комунальне підприємство «Дніпровський обласний клінічний онкологічний диспансер», Україна
- 7Дніпровський державний медичний університет, Україна
Резюме. Лімфома Ходжкіна (ЛХ) IV стадії залишається значною терапевтичною проблемою, особливо у пацієнтів з несприятливими прогностичними факторами. Включення таргетних препаратів, таких як брентуксимабу ведотин, до схем першої лінії лікування відкриває нові можливості для поліпшення результатів. Мета роботи: оцінити ефективність та безпеку застосування брентуксимабу ведотину в комбінації з хімієтерапією за схемою A + AVD у пацієнтів з IV стадією ЛХ в Україні. Встановлено, що застосування брентуксимабу ведотину в схемі A + AVD у пацієнтів з ЛХ IV стадії зумовлює обнадійливі результати в реальній клінічній практиці України та є перспективним напрямом у лікуванні поширених форм ЛХ.
Одержано 19.05.2025
Прийнято до друку 2.06.2025
DOI: 10.32471/clinicaloncology.2663-466X.34613
ВСТУП
 Класична ЛХ — це гематологічне злоякісне захворювання, яке переважно уражує осіб молодого віку від 15 до 30 років, з вторинним піком, що відмічається після 55 років та становить від 15 до 25% усіх лімфом [1].
Класична ЛХ — це гематологічне злоякісне захворювання, яке переважно уражує осіб молодого віку від 15 до 30 років, з вторинним піком, що відмічається після 55 років та становить від 15 до 25% усіх лімфом [1].
За даними Національного канцер-реєстру України захворювання має найбільшу питому вагу серед онкологічних захворювань у пацієнтів молодого віку (15–29%), що становить понад 28% усіх злоякісних новоутворень. За даними, у 2021 р. захворюваність на ЛХ становить 2,2 на 100 тис. населення, смертність — 0,5 на 100 тис. населення. Понад 85% цих пацієнтів охоплені спеціальним лікуванням, яке весь час перебуває у стані динамічного розвитку.
Протягом десятиліть прогноз для пацієнтів із класичною ЛХ покращувався завдяки впровадженню нових стратегій лікування [2], що зумовило високий рівень виліковності. На ранніх стадіях патології 5-річна загальна виживаність (ЗВ) коливається в межах 96,0–99,4% для пацієнтів із несприятливим та сприятливим прогнозом відповідно (p <0,001) [3]. У випадках виявлення захворювання на пізній стадії 5-річна ЗВ становить 56–89% [4]. Незважаючи на ці досягнення, зберігаються занепокоєння щодо гострої та довгострокової токсичності, пов’язаної з лікуванням, включно з пошкодженням легень, викликаним блеоміцином, та підвищеною смертністю порівняно із загальною популяцією.
Нещодавні дослідження в цьому напрямку змістили парадигму в бік розробки стратегій лікування, адаптованих до позитронно-емісійної / комп’ютерної томографії (ПЕТ / КТ), у них виявлено безпеку деескалації лікування для пацієнтів з негативними проміжними результатами ПЕТ / КТ та інтенсифікації терапії для тих, хто має позитивні результати.
Так, у дослідженнях AHL2011 і RATHL застосовували ПЕТ / КТ з 18F-фтордезоксиглюкозою (FDG-PET) для виявлення пацієнтів, які можуть отримати користь від інтенсифікації або деескалації терапії [5, 6]. У дослідженні AHL2011 хворих проспективно рандомізували між такими, які отримували 6 циклів BEACOPP, та тими, що отримували ПЕТ-адаптовану терапію після 2 курсів BEACOPP: пацієнтам з негативним результатом контрольного ПЕТ / КТ призначали 4 курси ABVD, а пацієнтам з позитивним результатом контрольного ПЕТ / КТ додатково ще 4 курси BEACOPP. Після тривалого періоду спостереження безпрогресивна виживаність (БПВ) та ЗВ були подібними в обох групах [5]. У дослідженні RATHL пацієнти отримували 2 цикли ABVD з подальшим проміжним ПЕТ- / КТ-дослідженням. Пацієнтів із негативним результатом рандомізували на отримання ще 4 курсів ABVD або AVD (виключення блеоміцину). Пацієнти з позитивним результатом ПЕТ / КТ отримували інтенсифікацію терапії за схемою BEACOPP-14 або BEACOPPesc. У пацієнтів із негативним проміжним ПЕТ- / КТ-дослідженням 7-річна БПВ та ЗВ у групах ABVD і AVD була подібною. Висновком цієї частини дослідження стало те, що виключення блеоміцину зі схеми ABVD після негативного проміжного ПЕТ-дослідження не знижує ефективність лікування. У осіб із позитивним проміжним ПЕТ / КТ ескалація лікування за схемою BEACOPP була ефективною та безпечною, без підвищення ризику вторинних злоякісних новоутворень [6]. Ризик-, або відповідь-адаптовані підходи до лікування здебільшого ґрунтуються на інтенсифікації або деескалації хімієтерапії.
У відкритому рандомізованому паралельно-груповому дослідженні III фази HD18 встановлено можливість зменшення сумарної кількості курсів BEACOPPesc з 6 до 4, за умови ПЕТ-негативного статусу після 2 курсів. Пацієнти з негативним проміжним ПЕТ / КТ, рандомізовані до отримання 8 курсів BEACOPPesc або 6 курсів BEACOPPesc (n=504) чи 4 курсів BEACOPPesc (n=501), мали 5-річну БПВ на рівні 90,8% (95% довірчий інтервал (ДІ) 87,9–93,7) та 92,2% (95% ДІ 89,4–95,0) відповідно (різниця — 1,4%, 95% ДІ −2,7–5,4). Схема 4 курсів BEACOPPesc асоціювалася з меншою кількістю тяжких форм інфекцій (40 (8%) з 498 проти 75 (15%) з 502) та органотоксичних проявів (38 (8%) з 498 проти 91 (18%) з 502) порівняно зі схемами 8 × BEACOPPesc або 6 × BEACOPPesc у пацієнтів з негативним проміжним ПЕТ / КТ [7].
Новітні стратегії поєднують інноваційну імунотерапію, зокрема брентуксимабу ведотин (BV) і моноклональні антитіла проти PD-1, з метою зниження ризику рецидиву та токсичності, пов’язаної з хімієтерапією. BV, кон’югат антитіла з препаратом монометилауристатин, який селективно спрямовується на пухлинні клітини, що експресують антиген CD30, спочатку додавався до ABVD, а згодом замінив блеоміцин, щоб уникнути легеневої токсичності [8].
Схема BV-AVD стала опцією лікування на основі результатів клінічного дослідження III фази ECHELON-1 [9–11]. Початкові результати цього дослідження свідчать, що схема BV-AVD забезпечувала кращу БПВ порівняно з ABVD у першій лінії лікування пацієнтів із захворюванням III–IV стадій [10, 11]. У цьому дослідженні пацієнтів із вперше виявленою класичною ЛХ III або IV стадії було рандомізовано в групи ABVD (n=670) або BV-AVD (n=664) [10]. Пацієнти отримували 6 курсів хімієтерапії без корекції лікування на основі проміжного рестадіювання. У даних 5-річного спостереження підтверджено, що перевага БПВ схеми BV-AVD порівняно з ABVD відмічалася у всіх підгрупах пацієнтів незалежно від стадії захворювання, віку та показника за Міжнародною прогностичною шкалою (International prognostic scale — IPS) [10].
Хоча частота легеневої токсичності була нижчою в групі BV-AVD через виключення блеоміцину, зафіксовано вищу частоту периферичної нейропатії (19% проти 9% у групі ABVD) і фебрильної нейтропенії (19% проти 11% у групі ABVD), що зумовило необхідність застосування факторів росту в цій схемі терапії [9, 10]. Крім того, рівень легеневої токсичності в контрольній групі не відображає сучасного підходу до лікування, оскільки блеоміцин може бути виключений у переважній більшості пацієнтів після перших 2 курсів.
Міжнародне рандомізоване дослідження III фази GHSG HD21 було спрямоване на мінімізацію пов’язаної з лікуванням токсичності у дорослих пацієнтів віком ≤60 років з класичною ЛХ поширених стадій за допомогою застосування BrECADD — модифікованої схеми BEACOPPesc. 1500 пацієнтів були рандомізовані для отримання 4–6 циклів ПЕТ-адаптованої терапії за схемою BrECADD або BEACOPPesc. У 64% пацієнтів як у групі BrECADD, так і у BEACOPPesc виявлено негативні результати ПЕТ / КТ після другого курсу, унаслідок чого вони отримали лише 4 цикли лікування. При медіані спостереження 48 міс 4-річна ВБП для всієї когорти була вищою у групі BrECADD порівняно з BEACOPPesc (94,3% проти 90,9% відповідно; p=0,035; відношення ризиків (ВР) для стадії III — 0,65; ВР для стадії IV — 0,79). Чотирирічні показники ЗВ були подібними між групами (98,6% проти 98,2% відповідно). Лікування за схемою BrECADD супроводжувалося значно нижчою захворюваністю, пов’язаною з лікуванням, ніж BEACOPPesc (42% проти 59% пацієнтів відповідно; p <0,0001) [12].
Лікування за схемою BrECADD із застосуванням ПЕТ-адаптованих підходів зумовило несподівано високу ефективність та кращу переносимість лікування, суттєво перевершуючи показники при застосуванні BEACOPPesc. Завдяки індивідуальному підходу з використанням ПЕТ-адаптованого підходу та скороченої тривалості лікування схема BrECADD проявляє сприятливий профіль співвідношення ризик / користь для більшості пацієнтів [12].
У рандомізованому дослідженні III фази SWOG S1826 встановлено, що схема N-AVD, основною перевагою якої є застосування PD1-інгібітора ніволумабу, забезпечує довшу ВБП порівняно з BV-AVD у пацієнтів з класичною ЛХ поширеної стадії. Перевага за показником ВБП була відзначена у всіх вікових групах та при всіх показниках IPS. Дворічні показники виживаності без подій (ВБП) та ЗВ становили 90 та 99% у групі N-AVD порівняно з 81 та 98% у групі BV-AVD відповідно (ВБП: ВР смерті — 0,50; 95% ДІ 0,36–0,71; ЗВ: ВР смерті — 0,39; 95% ДІ 0,15–1,03) [13].
Враховуючи переваги, представлені в дослідженнях, а саме клінічно значуще підвищення БПВ, задовільну переносимість схеми ВRECADD та N-AVD, можливість уникнення потенційно токсичної консолідувальної променевої терапії, ці схеми було включено до рекомендацій Національної мережі багатопрофільних онкологічних закладів США (National Comprehensive Cancer Network — NCCN) у першій лінії терапії дорослих пацієнтів із III–IV стадіями класичної ЛХ.
Схема ABVD залишається також варіантом лікування з використанням ПЕТ / КТ на основі кількох рандомізованих клінічних досліджень, в яких не доведено переваг виживаності для більш інтенсивних схем лікування [14–17].
У рекомендаціях Європейського товариства медичної онкології (European Society For Medical Oncology — ESMO), затверджених у 2018 р., схема BEACOPPesc залишається потенційною опцією терапії III–IV стадій ЛХ на основі рандомізованого дослідження ІІІ фази HD15. Це дослідження свідчить про вищу ефективність та зниження токсичності при застосуванні 6 курсів BEACOPPesc порівняно з 8 курсами лікування за схемою BEACOPP14 [18].
МАТЕРІАЛИ ТА МЕТОДИ
Завдяки програмі допомоги пацієнтам компанії «Такеда в Україні» хворі на ЛХ мали можливість отримати сучасне лікування із застосуванням новітньої схеми A + AVD. З 22 листопада 2021 р. до програми залучено 106 хворих на ЛХ IV стадії.
Проведено проміжний аналіз ефективності та токсичності лікування у 60 хворих на ЛХ, які отримували терапію за цією схемою в 5 центрах України. Хворі мали гістологічно підтверджену ЛХ (за класифікацією Всесвітньої організації охорони здоров’я). Усі пацієнти мали IV стадію захворювання за Анн — Арбор (враховуючи, що в Україні на той час було зареєстровано тільки показання для застосування брентуксимабу ведотину в комбінації з хімієтерапією у первинних хворих тільки для IV стадії захворювання).
Усі пацієнти отримували лікування за схемою A + AVD (брентуксимабу ведотину — 1,2 мг/кг маси тіла, доксорубіцину — 25 мг/м2 площі поверхні тіла, вінбластину — 6 мг/м2 та дакарбазину — 375 мг/м2) внутрішньовенно в 1-й та 15-й дні кожного 28-денного циклу, до 6 циклів. З метою профілактики нейтропенії хворі отримували філграстим (згідно з локальними рекомендаціями).
Відповідь та прогресування оцінювали за переглянутими критеріями відповіді на терапію через злоякісну лімфому (Критерії оцінки відповіді на лікування у пацієнтів із злоякісними лімфомами, згідно з рекомендаціями Лугано, 2014). КТ проводили під час скринінгу, наприкінці 3-го циклу, після введення останнього курсу терапії та протягом періоду спостереження. ПЕТ-сканування проводилося при скринінгу та в кінці лікування. Результатами з точки зору безпеки були випадки виникнення небажаних явищ (визначених відповідно до Медичного словника з регуляторної діяльності (Medical Dictionary for Regulatory Activities — MedDRA), версія 19.0, та Загальних критеріїв термінології для класифікації побічних реакцій Національного інституту раку США (National Cancer Institute, NCI) — CTCAE, версія 4.03) і зміни основних ознак життєдіяльності та результатів лабораторних досліджень.
Вік пацієнтів варіював у діапазоні 18–75 років, медіана віку — 38,5 року (75% хворих були молодші 45 років). Загалом 27 (43%) становили чоловіки та 33 (57%) жінки. 96,7% мали В-симптоми (втрату маси тіла, нічне підвищене потовиділення і гарячку). Залучення в патологічний процес кісткового мозку було діагностовано у 20 (33,3%) пацієнтів. Більше ніж 1 екстранодальна ділянка ураження розвивалася у 30 (50%) пацієнтів. За шкалою ECOG 0 балів було у 9 пацієнтів, 1 бал — у 12 осіб, 2 бали — у 33 хворих, 3 — у 6 пацієнтів.
Загальна кількість курсів, яку отримали хворі, становила 293, середня кількість курсів — 4,78.
РЕЗУЛЬТАТИ
Ефективність була оцінена у 55 осіб, які завершили лікування. Серед хворих, які отримували лікування за схемою А + АVD, ЗВ становила 92,72% (51 хворий), 42 (76,36%) пацієнтів досягли повної відповіді, 9 (16,36%) — часткової, у 4 (7,27%) хворих зафіксовано прогресування патології під час лікування та до 3 міс після завершення терапії. У 5 хворих (9,09%) розвинувся рецидив після 3 міс від моменту завершення лікування. ПЕТ / КТ було оцінено у 31 хворого. ПЕТ-оцінку за шкалою Довіль, що дорівнює 1 чи 2 після завершення первинної терапії, зафіксовано у 23 (41,81%), ПЕТ-оцінку за шкалою Довіль, що дорівнює 3 після завершення первинної терапії, — у 8 осіб (14,54%).
У групі зафіксовано 4 випадки смерті. Підсумок летальних випадків під час лікування та спостереження: 1 пацієнт помер після 1 блоку 1 курсу поліхімієтерапії, причиною смерті стала фебрильна нейтропенія. У 3 пацієнтів причиною смерті стало прогресування захворювання.
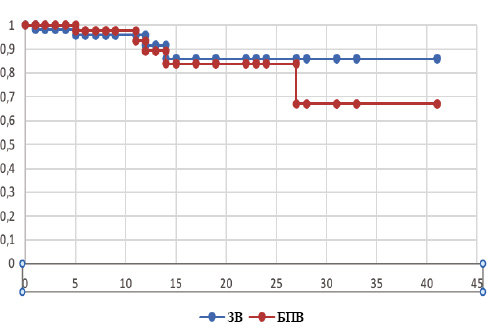
Проведено аналіз віддалених результатів лікування. Медіана спостереження становила 24,9 міс (у діапазоні 0–49,3 міс). 2-річна БПВ становила 83,76%. 2-річна ЗВ становила 85,9% (рисунок).
Найбільш клінічно значущими побічними ефектами, що розвивалися в ході лікування, стали гематологічна токсичність та полінейропатія (таблиця). Токсичність оцінювалася у 60 хворих, які отримували лікування за цією схемою.
| Побічний ефект | Ступінь n, (%) | |
| будь-який | ≥3 | |
| Нейтропенія | 34 (56,66) | 22 (33,33) |
| Анемія | 20 (33,33) | 8 (13,33) |
| Тромбоцитопенія | 14 (23,33) | 2 (8,9) |
| Фебрильна нейтропенія | 14 (23,33) | |
| Периферична нейропатія | 17 (28,33) (відновилася у 6) |
6 (10) |
| Оборотна автономна нейропатія шлунково-кишкового тракту, індукована поліхімієтерапією | 1 (1,66) | |
| Блювання | 3 (5) | |
| Гепатотоксичність | 3 (5) | |
| Шлунково-кишковий тракт | 2 (8,9) | |
| Стоматит | 4 (17,6) | |
| Нудота | 2 (3,33) | |
| Тривожно-депресивний розлад | 1 (1,66) | |
Нейтропенія будь-якого ступеня тяжкості розвивалася у 56,66% пацієнтів, III ступеня та більше зафіксована у 33,3% хворих. Анемію виявлено у 33,33% хворих, але ≥III ступеня тяжкості, що потребувала гемотрансфузій, — у 13,33% пацієнтів. Тромбоцитопенія розвинулася у 23,33% осіб, III та IV ступеня — лише у 8,9% пацієнтів. Частота розвитку фебрильної нейтропенії протягом лікування становила 23,33%. Частота відміни через нейтропенію або фебрильну нейтропенію становила 1%.
Периферична нейропатія виникала у 28,33%. Периферичну нейропатію ≥III ступеня тяжкості зафіксовано у 10% хворих. Відміни препарату брентуксимабу ведотин у зв’язку з нейротоксичністю не виявлено.
Про гепатотоксичність повідомлялось у 5% випадків, токсичність з боку шлунково-кишкового тракту — у 8,9% пацієнтів, стоматит виникав у 17,6%, тривожно-депресивний розлад — у 1,66%, нудота III ступеня тяжкості — у 3,33%, у 1 пацієнта зафіксовано оборотну автономну нейропатію шлунково-кишкового тракту, індуковану поліхімієтерапією.
ВИСНОВКИ
У нашому дослідженні аналізу реальних випадків надано результати, порівняні з дослідженням ECHELON-1 щодо ефективності лікування А-AVD, незважаючи на застосування цієї схеми тільки у хворих IV стадії через затверджене показання BV-AVD протягом періоду дослідження.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Jaffe, E. S., Harris, N. L., Vardiman, J., Arber, D. A., & Campo, E. (2010). Hematopathology e-book. Elsevier Health Sciences.
2. Connors, J. M. (2003) Hodgkin’s lymphoma: the hazards of success. Journal of Clinical Oncology, 21(18), 3388–90. doi: 10.1200/JCO.2003.07.001.
3. Klimm, B., Goergen, H., Fuchs, M., von Tresckow, B., Böll, B., Meissner, J., … Borchmann, P. (2013). Impact of risk factors on outcomes in early-stage Hodgkin’s lymphoma: an analysis of international staging definitions. Annals of Oncology, 24(12), 3070–3076. doi: 10.1093/annonc/mdt413.
4. Hasenclever, D., & Diehl, V. (1998). A prognostic score for advanced Hodgkin’s disease. International Prognostic Factors Project on Advanced Hodgkin’s Disease. New England Journal of Medicine, 339(21),1506–1514 . doi: 10.1056/NEJM199811193392104.
5. Casasnovas, R. O., Bouabdallah, R., Brice, P., Lazarovici, J., Ghesquieres, H., Stamatoullas, A., … Rossi, C. (2022). Positron Emission Tomography-Driven Strategy in Advanced Hodgkin Lymphoma: Prolonged Follow-Up of the AHL2011 Phase III Lymphoma Study Association Study. Journal of Clinical Oncology, 40(10), 1091–1101. doi: 10.1200/JCO.21.01777.
6. Luminari, S., Fossa, A., Trotman, J., Molin, D., d’Amore, F., Enblad, G., … Johnson, P. W. M. (2024). Long-Term Follow-Up of the Response-Adjusted Therapy for Advanced Hodgkin Lymphoma Trial. Journal of Clinical Oncology, 42(1),13–18. doi: 10.1200/JCO.23.01177.
7. Borchmann, P., Goergen, H., Kobe, C., Lohri, A., Greil, R., Eichenauer, D. A., … Engert, A. (2017). PET-guided treatment in patients with advanced-stage Hodgkin’s lymphoma (HD18): final results of an open-label, international, randomised phase 3 trial by the German Hodgkin Study Group. Lancet, 390(10114), 2790–2802. doi: 10.1016/S0140-6736(17)32134-7.
8. Younes, A., Connors, J. M., Park, S. I., Fanale, M., O’Meara, M. M., Hunder, N. N., … Ansell, S. M. (2013). Brentuximab vedotin combined with ABVD or AVD for patients with newly diagnosed Hodgkin’s lymphoma: a phase 1, open-label, dose-escalation study. Lancet Oncology, 14(13), 1348–56. doi: 10.1016/S1470-2045(13)70501-1.
9. Straus, D. J., Długosz-Danecka, M., Alekseev, S., Illés, Á., Picardi, M., Lech-Maranda, E., … Gallamini, A. (2020). Brentuximab vedotin with chemotherapy for stage III/IV classical Hodgkin lymphoma: 3-year update of the ECHELON-1 study. Blood, 135(10), 735–742. doi: 10.1182/blood.2019003127.
10. Straus, D. J., Długosz-Danecka, M., Connors, J. M., Alekseev, S., Illés, Á., Picardi, M., … Radford, J. (2021). Brentuximab vedotin with chemotherapy for stage III or IV classical Hodgkin lymphoma (ECHELON-1): 5-year update of an international, open-label, randomised, phase 3 trial. Lancet Haematology, 8(6), e410–e421. doi: 10.1016/S2352-3026(21)00102-2.
11. Ansell, S. M., Radford, J., Connors, J. M., Długosz-Danecka, M., Kim, W. S., Gallamini, A., … Straus, D. J. (2022). ECHELON-1 Study Group. Overall Survival with Brentuximab Vedotin in Stage III or IV Hodgkin’s Lymphoma. New England Journal of Medicine, 387(4), 310–320. doi: 10.1056/NEJMoa2206125.
12. Borchmann, P., Ferdinandus, J., Schneider, G., Moccia, A., Greil, R., Hertzberg, M., & Diehl, V. (2024). Assessing the efficacy and tolerability of PET-guided BrECADD versus eBEACOPP in advanced-stage, classical Hodgkin lymphoma (HD21): a randomised, multicentre, parallel, open-label, phase 3 trial. Lancet, 404(10450), 341–352. doi: 10.1016/S0140-6736(24)01315-1.
13. Herrera, A. F., LeBlanc, M., Castellino, S. M., Li, H., Rutherford, S. C., Evens, A. M., … Friedberg, J. W. (2024). Nivolumab+AVD in Advanced-Stage Classic Hodgkin’s Lymphoma. New England Journal of Medicine, 391(15), 1379–1389. doi: 10.1056/NEJMoa2405888.
14. Gordon, L. I., Hong, F., Fisher, R. I., Bartlett, N. L., Connors, J. M., Gascoyne, R. D., … Horning, S. J. (2013). Randomized phase III trial of ABVD versus Stanford V with or without radiation therapy in locally extensive and advanced-stage Hodgkin lymphoma: an intergroup study coordinated by the Eastern Cooperative Oncology Group (E2496). Journal of Clinical Oncology, 31(6), 684–91. doi: 10.1200/JCO.2012.43.4803.
15. Canellos, G. P., Anderson, J. R., Propert, K. J., Nissen, N., Cooper, M. R., Henderson, E. S., … Peterson, B. A. (1992). Chemotherapy of advanced Hodgkin’s disease with MOPP, ABVD, or MOPP alternating with ABVD. New England Journal of Medicine, 327(21), 1478–84. doi: 10.1056/NEJM199211193272102.
16. Merli, F., Luminari, S., Gobbi, P. G., Cascavilla, N., Mammi, C., Ilariucci, F., … Federico, M. (2016). Long-Term Results of the HD2000 Trial Comparing ABVD Versus BEACOPP Versus COPP-EBV-CAD in Untreated Patients With Advanced Hodgkin Lymphoma: A Study by Fondazione Italiana Linfomi. Journal of Clinical Oncology, 34(11), 1175–81. doi: 10.1200/JCO.2015.62.4817.
17. Viviani, S., Zinzani, P. L., Rambaldi, A., Brusamolino, E., Levis, A., Bonfante, V., … Gianni, A. M. (2011). ABVD versus BEACOPP for Hodgkin’s lymphoma when high-dose salvage is planned. New England Journal of Medicine, 365(3), 203–12. doi: 10.1056/NEJMoa1100340.
18. Engert, A., Haverkamp, H., Kobe, C., Markova, J., Renner, C., Ho, A., … Diehl, V. (2012). Reduced-intensity chemotherapy and PET-guided radiotherapy in patients with advanced stage Hodgkin’s lymphoma (HD15 trial): a randomised, open-label, phase 3 non-inferiority trial. Lancet, 379(9828), 1791–9. doi: 10.1016/S0140-6736(11)61940-5.
Адреса для листування:
Крячок Ірина Анатоліївна
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: irina.kryachok@gmail.com
Correspondence:
Iryna Kryachok
33/43 Yulii Zdanovskoi str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: irina.kryachok@gmail.com














Leave a comment