Необоротна електропорація як альтернативний метод лікування в онкології: біофізичні та молекулярні механізми, технічні аспекти та сучасні можливості методу (огляд наукової літератури)
Мовчан В.І., Стаховський Е.О., Войленко О.А., Вітрук Ю.В., Стаховський О.Е., Кононенко О.А., Романенко О.В.
Резюме. Необоротна електропорація (НОЕ; англ. irreversible electroporation — IRE) є сучасним методом фокальної нетермічної абляції пухлин, що дозволяє чинити безпосередній руйнівний вплив на клітини пухлини. Технологія базується на застосуванні короткотривалих високовольтних електричних імпульсів, що спричиняють формування перманентних нанорозмірних пор у клітинній мембрані, ініціюючи загибель клітини, не викликаючи пошкодження навколишніх тканин. У цій статті на основі огляду медичної літератури проаналізовано базові біофізичні та молекулярні механізми дії НОЕ, технічні аспекти виконання процедури, показання та протипоказання до її використання. Окрема увага приділяється імунологічним ефектам НОЕ та перспективі поєднання з імунотерапією.
Одержано 15.08.2025
Прийнято до друку 8.09.2025
DOI: 10.32471/clinicaloncology.2663-466X.34868
Вступ
НОЕ належить до методів нетермічної абляції та постає як достойна альтернатива термічним методам фокальної терапії, що дозволяє досягати селективного руйнування пухлинної тканини без суттєвого впливу на прилеглі здорові тканини, особливо у випадках локалізації пухлин поблизу життєво важливих структур (судин, нервів, жовчовивідних протоків та ін.).
Ефективність НОЕ залежить від параметрів, таких як амплітуда, тривалість імпульсу, напруга на сантиметр та частота повторення електричних імпульсів, що виникають між парами електродів. Ці параметри мають вирішальне значення для досягнення максимальної абляції та уникнення небажаних побічних реакцій. Також вагомий вплив на результат процедури має техніка встановлення електродних зондів.
Абляція з використанням НОЕ також індукує системну імунну відповідь організму, а ключовим моментом у її вищій ефективності порівняно з іншими методами абляції є збереження васкуляризації зони впливу, що, своєю чергою, підкріплює каскад реакцій імуноопосередкованої клітинної смерті [1]. Крім того, інтеграція методу НОЕ з імунотерапією представляє потенційний шлях для посилення його терапевтичних ефектів.
НОЕ наразі використовується для абляції пухлин різноманітної органоприналежності, найбільш активно — передміхурової залози [2], нирок [3] та печінки. Існують джерела, що описують результати використання методу при пухлинах шийки матки, яєчників, молочної залози [4] та головного мозку [5].
Хоча НОЕ пропонує значні переваги при лікуванні пухлин, залишаються проблеми, такі як неповна абляція, та завжди є ризики рецидиву. Нетеплова природа техніки та здатність зберігати навколишні структури роблять її перспективним варіантом, але необхідні подальші дослідження для оптимізації протоколів та розширення її клінічного використання.
Біофізичні та молекулярні механізми НОЕ
Фізіологічно всі цитоплазматичні мембрани людини мають напругу спокою від −70 мВ до −30 мВ, що в нормі забезпечується активним і пасивним транспортом Na+ і K+ через мембрану. Коли клітина піддається впливу зовнішнього імпульсного електричного поля, при досягненні критичної різниці потенціалів на мембрані (>0,2–1 В) викликається процес утворення нанорозмірних пор у фосфоліпідному бішарі клітинної мембрани (рис. 1), що сприяє підвищенню проникності фосфоліпідів мембрани.

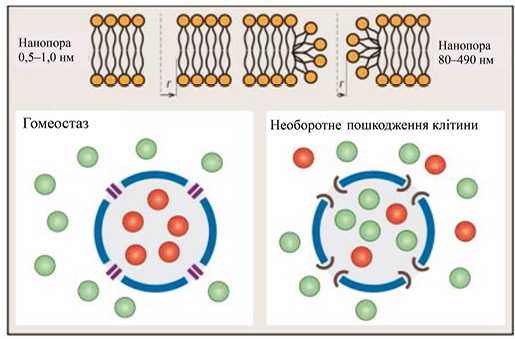
Електропорація може бути розподілена на оборотну (reversible electroporation — RE) і необоротну (irreversible electroporation — IRE), а щільність утворюваних пор і здатність клітинної мембрани до відновлення її цілісності залежать від тривалості та напруженості імпульсного електричного поля. Коли імпульсне електричне поле контролюється на певному рівні (напруга 50–1000 В), порожнини стають оборотними, і цей метод стає оборотною електропорацією. При збільшенні напруженості електричного поля до певного рівня (напруга до 1500–3000 В) нанопори на клітинній мембрані зазнають необоротних змін.
Зараз існує багато робіт, де досліджується, яким саме шляхом відбувається загибель клітини залежно від параметрів електричного імпульсного поля, зокрема тривалості імпульсів (мілі-, мікро-, наносекундні) [7, 8]. Тож на сьогодні вже відомо, що клітинна загибель при використанні НОЕ опосередкована не лише апоптозом. Серед інших механізмів виділяють некроз, некробіоз, піроптоз [9]. Усі ці механізми можуть взаємоіснувати та переходити з одного в інший [10].
Основні реакції та механізми, що призводять до клітинної загибелі:
- Пермеабілізація мембрани. Пошкодження мембрани клітини, утворення пор та їхня стабілізація — це основний рушійний механізм [10].
- Втрата цілісності мембрани через НОЕ призводить до нерегульованого потоку іонів і води в клітину, що призводить до набряку клітини та її розриву. Цей процес характерний для некрозу.
- Активне надходження в клітину іонів кальцію (Ca²+). Підвищення внутрішньоклітинної концентрації кальцію відіграє вирішальну роль в ініціації шляхів загибелі клітин. Підвищений рівень кальцію може активувати протеази, такі як кальпіни, які руйнують клітинні компоненти і спричиняють запуск апоптозу або некрозу.
- Деполяризація потенціалу мембран мітохондрій. Крім плазматичної мембрани, НОЕ впливає також на внутрішньоклітинні органели, такі як мітохондрії. Використання електричних імпульсів викликає деполяризацію потенціалу мембрани мітохондрій, що є ключовим показником мітохондріальної дисфункції [10].
- Виснаження запасів аденозинтрифосфату (АТФ) відбувається через порушення функції мітохондрій та нерегульованого потоку іонів через клітинну мембрану. Ця енергетична криза змушує клітину переходити на анаеробний метаболізм, який є неефективним і в кінцевому підсумку призводить до її загибелі [10, 11].
- Використання електричних імпульсів під час НОЕ генерує активні форми кисню (АФК) як побічний продукт клітинного метаболізму. Також підвищений викид активних кисневих радикалів відбувається при порушенні цілісності мембран мітохондрій. АФК можуть пошкодити клітинні компоненти, включно з ліпідами, білками та ДНК [12].
- Пошкодження ДНК викликає активацію проапоптичних білків та запускає процес апоптозу.
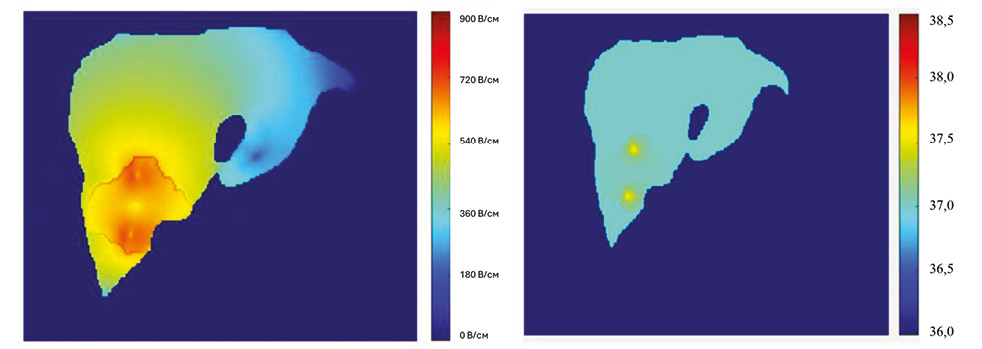
При радіочастотній та мікрохвильовій абляції відмічається ефект «тепловідводу», тобто коли тканина-мішень прилягає до великої кровоносної судини (внутрішній діаметр ≥3 мм), ламінарний потік крові забирає частину тепла, що може призводити до неповної абляції. Незважаючи на те що НОЕ не є термічною методикою абляції, деякий локальний елемент тепловиділення поблизу електродів може відбуватися через перетворення кінетичної енергії електронів (ефект Джоуля, або явище електричного джоулевого нагріву), ризик цього мінімальний завдяки короткій тривалості імпульсів, низькій частоті повторення імпульсів та короткому часу взаємодії з тканиною [11]. У такий спосіб зберігаються тканинні структури, прилеглі до ураженої ділянки, у тому числі багатий на білки позаклітинний матрикс та інші чутливі структури, з яких складаються кровоносні судини, нерви, протоки [13]. Дослідження, проведене Xu C. та Zhang Y. та опубліковане в Journal of Physics, 2021 р. [14], свідчить, що підвищення температури відбувалося лише локально на обмежених ділянках, які контактували безпосередньо з електродами, та не перевищувало 0,5 °C (рис. 2).
Технічні аспекти (обладнання, параметри, налаштування) для забезпечення НОЕ
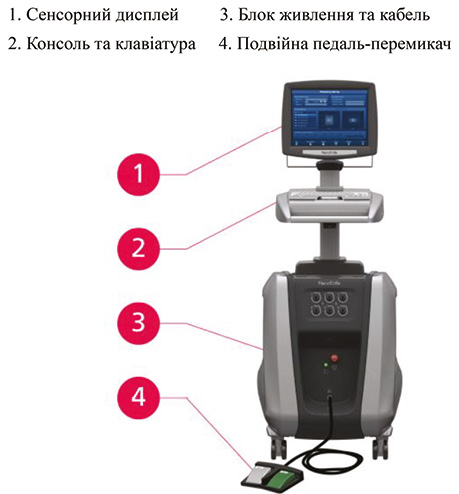
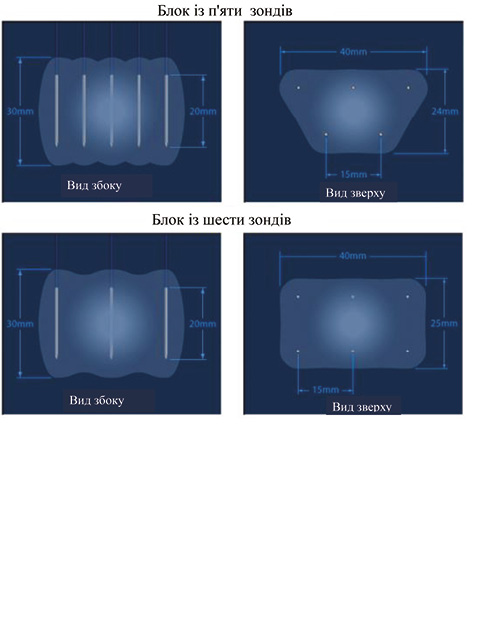
На сьогодні NanoKnife® System (AngioDynamics, США) є єдиною системою генераторів і електродів для абляції тканин людини, схваленою Управлінням з контролю за харчовими продуктами і лікарськими засобами США (Food and Drug Administration — FDA). Пристрій складається з 3 компонентів: генератора високовольтного струму (максимум 3000 В, 50 А), електродів (2–6 монополярних зондових голок), системи ЕКГ-синхронізації (AccuSync) — необхідна для запобігання виникненню імпульсно-індукованих аритмій (рис. 3).
Зона абляції при НОЕ приблизно обмежена між зондами з електродами. Кількість електродів визначається розміром пухлини. Генератор допускає максимум 6 електродів. При ураженнях <2 см у діаметрі по периферії ураження розміщують 3 електроди; при ураженнях від 2 до 3 см — 4 електроди; при ураженнях >3 см — від 4 до 6 електродів; при ураженнях >4 см — 6 електродів (рис. 4). При використанні пари електродів оптимальна відстань між 2 електродами становить 0,7–2,9 см. Зонди необхідно вводити паралельно один одному з максимальним кутом нахилу 10°, аби уникнути їх зближення або розходження, що забезпечить рівномірне доставлення енергії та мінімізує гетерогенні зони абляції.
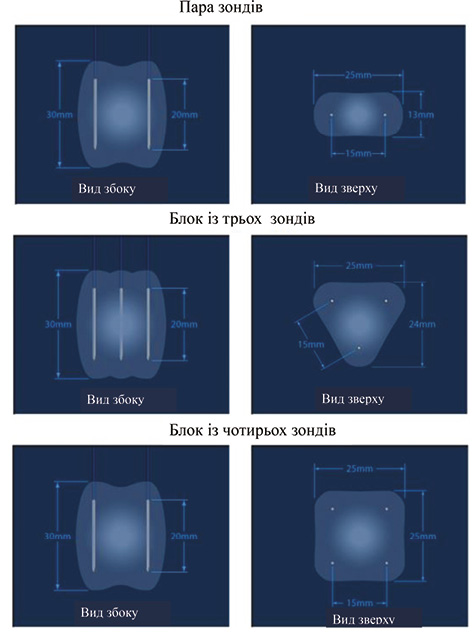
Довжина активного електрода не повинна перебільшувати 2,5 см, оскільки довші електроди спричиняють більший струм і підвищують ризик відсікання високого струму (рис. 5).

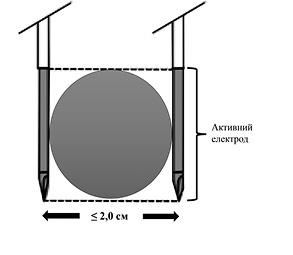
Якщо мішень більша за довжину електрода, яка піддається впливу, спочатку завжди слід обробляти найглибшу частину мішені. Електроди можна переставляти для кожної наступної обробки з метою забезпечення адекватного перекриття на стику двох зон впливу.
Вільний від пухлини край має бути не менше 0,5 см.
Генератор автоматично відображає 2-вимірне зображення пухлини та вибрану кількість електродів. У випадку з парою електродів лікар спочатку вводить відстань між електродами пари і обирає бажану напругу на сантиметр (В/см), зазвичай від 1200 до 1800 В/см. Потім генератор подає низьковольтний високоенергетичний постійний струм через кінчики електродних зондів у вигляді серії мікросекундних (мкс) імпульсів з частотою повторення 1 імпульс за секунду. Електричні імпульси повинні подаватися з напругою в діапазоні 1500–3000 В, оскільки напруга <1000 В фактично призводить до оборотної електропорації. Тривалість імпульсу завжди повинна бути встановлена на рівні 70–90 мкс (табл. 1) [15].
| Процедурні параметри | Налаштування |
| Відстань між зондами: | |
| мінімальна допустима | 1,0 см |
| максимальна допустима | 2,3 см |
| типовий використовуваний діапазон | 1,5–2,0 см |
| Довжина активного електрода: | |
| мінімальна рекомендована | 1,0 см |
| максимальна рекомендована | 2,5 см |
| рекомендована початкова довжина для більшості м’яких тканин | 1,5 см |
| рекомендована початкова довжина для тканин з високою електропровідністю (наприклад м’язова тканина) | 1,0 см |
| рекомендована максимальна довжина для тканин з високою електропровідністю | 1,5 см |
| Тривалість імпульсів: | |
| системне налаштування за замовчуванням | 90 мкс |
| мінімальна рекомендована величина | 70 мкс |
| максимальна величина | 100 мкс |
| типовий діапазон | 70–90 мкс |
| Кількість імпульсів на пару зондів: | |
| системне налаштування за замовчуванням |
70 |
| максимальна величина | 100 |
| типовий діапазон для цієї величини | 70–90 |
| типова загальна кількість імпульсів на пару зондів (після декількох циклів) | 140–270 |
| Напруга на сантиметр (В/см): | |
| системне налаштування за замовчуванням |
1500 |
| типовий діапазон | 1400–2000 |
| Напруга (В): | |
| системне налаштування за замовчуванням |
показник для стандартного налаштування напруги базується на відстані між зондами, щоб досягти 1500 В/см |
| мінімальна величина | 500 В |
| максимальна величина | 3000 В |
| Величина сили струму на пару електродів: | |
| максимальна допустима сила струму | 50 А |
| типовий показник при проведенні тестових проб |
20–35 А |
Примітки:
1. Під час проведення тестових проб на провідність система подаватиме 1 імпульс з напругою близько 400 В.
2. Сила струму зазвичай зростає під час подачі імпульсів.
Генератор може забезпечити максимальний струм на рівні 50 А, при цьому струм можна цілеспрямовано підвищувати з 20 А на базовій лінії до 35–40 А під час проведення НОЕ. Якщо струм недостатньо зростає від базового рівня, його можна підвищити, подаючи додаткові імпульси або збільшуючи тривалість експозиції. Останнє пов’язане з ризиком абляції нормальних навколишніх тканин. Постійно надмірний струм від електрода (електродів) потребує репозиції або видалення електрода. Для мінімізації ризиків компанія AngioDynamics рекомендує проводити початкову перевірку серії з 10–20 імпульсів на кожен електрод, аби переконатися, що струм, який генерується, не буде надмірним.
В Україні Інститутом електрозварювання ім. Є.О. Патона в рамках комплексної тематики Національної академії наук України (а саме теми 0118Г100521 «Розробка та дослідження новітньої електротермохірургічної апаратури, інструментів і технологій для з’єднання і обробки патологічно змінених тканин») розроблено та виготовлено дослідний зразок — апарат АВІ-3501 (апарат високочастотний імпульсний) для виконання пухлинної деструкції із використанням необоротної електропорації.
«АВІ-3501 дозволяє проводити нетеплову абляцію накладанням імпульсних електричних полів високої напруженості. Це руйнує клітини пухлин завдяки проникненню в них через зовнішню мембрану іонів, що порушують обмінні процеси між онкологічною клітиною та навколишнім середовищем. При цьому злоякісні новоутворення руйнуються, розпадаються на окремі фрагменти, які зазвичай швидко поглинаються іншими клітинами без запальної реакції. Проведені попередні дослідження на видалених біологічних тканинах свідчать про перспективність використання цього апарату в онкології. Найближчим часом планується оцінка відповідності вказаного вище пристрою вимогам Технічного регламенту щодо медичних виробів, що буде включати проведення клінічних досліджень із оформленням відповідного протоколу», — зазначив Олександр Романенко, кандидат технічних наук, завідувач відділу № 17 Інституту електрозварювання ім. Є.О. Патона «Зварювальні та споріднені технології в медицині та екології».
Проведення процедури НОЕ
Операція виконується під загальним знеболенням з ендотрахеальною інтубацією, моніторингом електрокардіограми (ЕКГ) та інвазивним моніторингом артеріального тиску в режимі реального часу. У процесі проведення операції слід ретельно контролювати частоту серцевих скорочень, ЕКГ та зміни артеріального тиску пацієнта, а також повинні бути наявними дефібрилятор та досвідчений анестезіолог [15].
Під час проведення операції необхідно забезпечити максимальну міорелаксацію, щоб уникнути надмірного скорочення м’язів після електричної імпульсної стимуляції, що може призвести до пошкодження тканин та зміщення голки електрода.
Точний розмір і локалізацію пухлини-мішені визначають за допомогою комп’ютерної томографії (КТ), позитронно-емісійної комп’ютерної томографії (ПЕТ-КТ) та магнітно-резонансної томографії (МРТ). КТ є більш поширеним методом через його здатність створювати мультипланарні реконструкції в реальному часі, дозволяє виміряти фактичні відстані між голками. Необхідно виконати інтрапроцедурну КТ-візуалізацію в тому положенні, в якому планується проведення процедури. При встановленні електродних зондів також можна користуватися ультразвуковим дослідженням (УЗД).
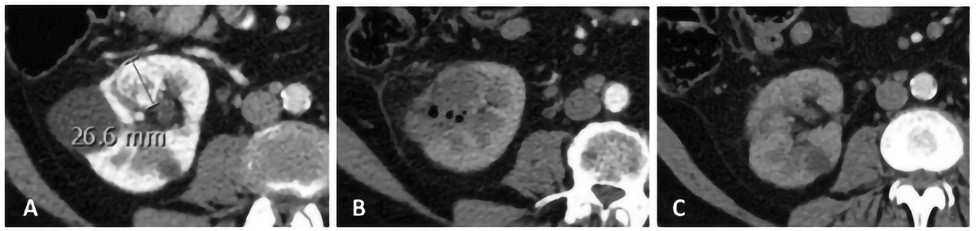
Після завершення процедури необхідно виконати контрольну КТ з внутрішньовенним контрастним підсиленням задля підтвердження повного покриття мішені та зони абляції. Одразу після процедури НОЕ абляційна ділянка виглядає як гіпоатенуйована зона, яка чітко корелює із зоною загибелі клітин. Поширеними знахідками є бульбашки газу, скупчення рідини і кільце гіпоатенуації на периферії зони абляції. Це кільце корелює з гребенем реактивної гіперемії, який зникає через близько 1 міс, і його не слід плутати із залишковою пухлиною. Радіологічні знахідки необхідно корелювати з клінічною картиною з метою диференціації типових післяопераційних змін та можливих ранніх післяопераційних ускладнень. Одразу після процедури зона абляції може виходити за межі початкової пухлини. З часом характерне значне зменшення початкового об’єму абляції; запально-набрякові зміни зменшуються, відбувається очищення від клітинних залишків, чому сприяє збережена васкуляризація. Зменшення до 1/3 початкового об’єму можна відмічати за 6–12 міс. У деяких випадках початкову зону новоутворення стає важко ідентифікувати на пізніх візуалізаційних контрольних дослідженнях, навіть може фіксуватися деяка регенерація тканин (рис. 6).
Показання та протипоказання до проведення НОЕ, можливі ускладнення
НОЕ набула популярності в якості органозберігальної альтернативи хірургії або термічній абляції. Випадки використання наведено в табл. 2.
| Локалізація пухлини | Стадія / умови | Мета використання |
| Нирка | T1a (особливо інтраренальні), множинні пухлини, високі ризики нефректомії, єдина нирка [3] | Збереження здорової ниркової паренхіми |
| Передміхурова залоза | Неметастатичний рак передміхурової залози (T1c-T2с, GG1–3, простат-специфічний антиген <20 нг/мл) [2] | Фокальна терапія з мінімізацією побічних ефектів |
| Печінка | Первинні / метастатичні пухлини <5 см, <1 см від судин або протоків [15] | Органозбереження при складній локалізації |
| Надниркові залози | Олігометастази, розташування пухлини поблизу критичних структур | Мінімально інвазивне лікування уражень із високими ризиками для відкритої хірургії |
Абсолютні протипоказання:
- наявність кардіостимулятора або імплантованого кардіовертера-дефібрилятора;
- шлуночкові аритмії в анамнезі, особливо гемодинамічно значущі;
- бал за Американським товариством анестезіологів >3 (American Society of Anesthesiologists — ASA);
- металеві сторонні тіла в ділянці взаємодії або в безпосередній близькості;
- порушення згортання крові, що не коригуються;
- перенесений інфаркт міокарда протягом останніх 6 міс.
Відносні протипоказання:
- неконтрольована артеріальна гіпертензія;
- активна ішемічна хвороба серця;
- виражений стеноз судин поблизу зони абляції;
- епілепсія або інші неврологічні порушення в анамнезі;
- вагітність (через недостатню доказову базу безпеки).
Серед ускладнень, які можуть виникати у пацієнтів внаслідок проведення НОЕ, можуть відмічатися аритмії (екстрасистолії, шлуночкові тахікардії, тріпотіння / фібриляція передсердь), гіпертензивний криз, біль / набряк у зоні абляції, кровотеча / гематома, гематурія, піурія, орхоепідидиміт, утворення фістули, перфорації порожнистих органів, утворення стриктур, затримка / нетримання сечі.
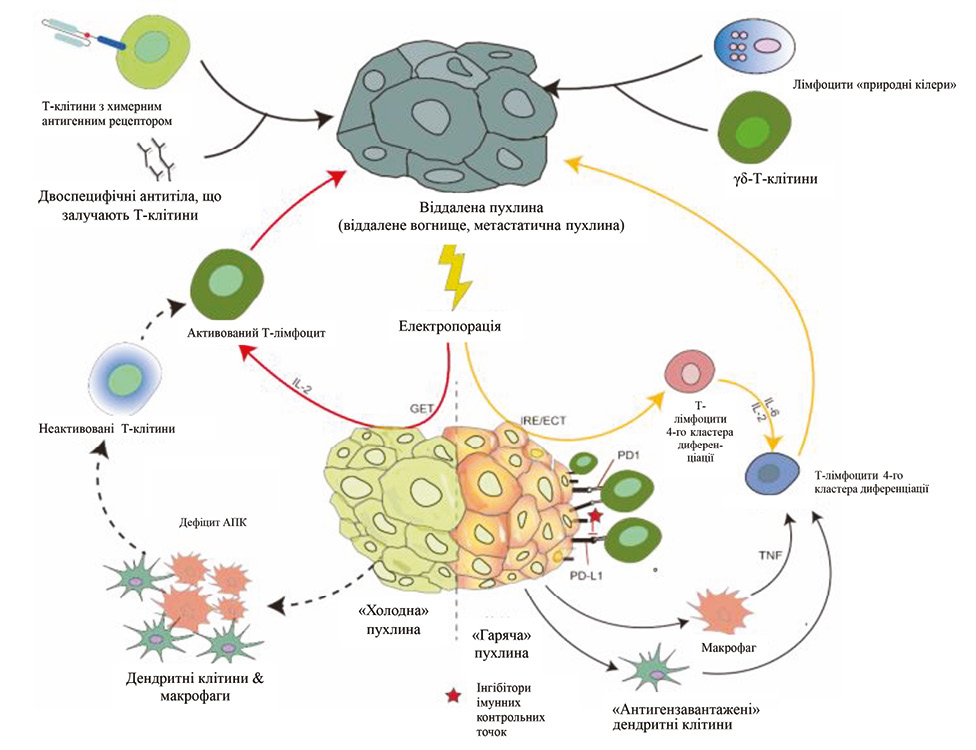
Імунологічні ефекти НОЕ
НОЕ пов’язують з імунною активацією, підвищеною інфільтрацією Т-клітин і макрофагів у зоні лікування та посиленою активністю протиракових імунних клітин [16, 17].
П’ять ключових подій, що пов’язані з ефективною активацією Т-клітин при дії НОЕ:
1) вивільнення пухлиноасоційованих антигенів (tumor-associated antigens — TAAs);
2) вивільнення молекулярних патернів, пов’язаних з пошкодженням (damage-associated molecular patterns — DAMPs);
3) поглинання та обробка ТААs клітинами, що презентують антиген (антигенпрезентувальні клітини — АПК; antigen-presenting cells — APCs);
4) презентація антигену АПК наївним Т-клітинам і, нарешті;
5) активація та проліферація CD8+ Т-клітин, специфічних до онкопатології.
Властивості НОE, які дійсно підвищують ймовірність активації імунної системи проти пухлинних клітин:
1) збереження більших судин і підвищення щільності мікросудин дозволяють АПК проникати в оброблену ділянку, переносити антигени пухлини до лімфатичних вузлів і активувати адаптивну імунну систему та подальшу імунну інфільтрацію;
2) АПК можуть поглинати великі кількості пухлинних антигенів, що вивільняються. Ці антигени добре зберігають свою структуру порівняно з обробкою за допомогою теплових методів абляції;
3) вивільнення DAMPs, включно з АТФ, цитокіновим білком HMGB1 (high-mobility group box 1 protein), HSP70 (група білків теплового шоку (70 kilodalton heat shock proteins)) та кальретикуліном, з пухлинних клітин є життєво важливим для індукції імуноопосередкованої клітинної смерті. Крім того, встановлено, що HMGB1, який вивільняється з пухлинних клітин, оброблених НОЕ, перепрограмовує пухлиноасоційовані макрофаги з імуносупресивних (M2) на імунопромоційні (M1) фенотипи, тим самим збільшуючи співвідношення M1 / M2 в пухлинному мікрооточенні та периферії;
4) імуносупресії можна протидіяти за допомогою зниження рівня регуляторних Т-клітин та супресорних клітин мієлоїдного походження як у периферичних тканинах, так і пухлинному мікрооточенні;
5) модуляція строми пухлини може підвищити інфільтрацію імунних клітин за допомогою підвищення щільності мікросудин і зниження жорсткості позаклітинного матриксу. Ці властивості, а також абскопальні ефекти (здатність впливати на віддалені вогнища поза зоною обробки), можуть бути використані в доклінічних умовах мікрометастатичного або метастатичного захворювання, оскільки дослідження вказують на значну імунну відповідь, зокрема посилену імунну пам’ять. У дослідженнях імунокомпетентних та імунодефіцитних мишей виявлено, що чутлива імунна система є життєво важливою для оптимальної ефективності НОЕ. У пухлинах, оброблених НОЕ, зафіксовано підвищене інфільтрування CD30-позитивних клітин, що свідчить про наявність лімфоцитів після первинної алоантигенної стимуляції та недиференційованих плюрипотентних стовбурових клітин. Це свідчить про посилення імунної відповіді через активацію Т-клітин пухлиноасоційованими антигенами або залучення стовбурових клітин залишковими пухлинними клітинами.
Встановлено, що рівні цитокінів IL-2, IL-6 та IL-10 підвищуються до 7 днів після НОE, у той же час рівні IL-2 та IL-10 знижуються через 3–21 день після НОЕ. IL-2 пов’язаний з властивостями інгібування пухлин шляхом модуляції проліферації та функції лімфоцитів. IL-10 може відігравати імуносупресивну роль у пухлинному мікрооточенні через підвищену експресію B7-H4 на макрофагах і PD-L1 на моноцитах. IL-6 пов’язаний з підвищенням ангіогенезу та подальшим пухлиноутворенням через різні шляхи [18]. Наразі незрозуміло, чи зумовлює комбінований ефект рівнів цитокінів розвиток пухлин. Це може залежати від відношення доз, змін рівнів у часі та взаємодії з іншими цитокінами та транскрипційними факторами.
Перспективи поєднання НОЕ з імунотерапією
Повідомляється, що НОЕ посилює терапію інгібіторами контрольних точок та перенесенням імунних клітин у низці пухлин. НОЕ поєднано з анти-CTLA-4 сприяло інтенсивній інфільтрації пухлиноспецифічних CD8+ Т-клітин як локально, так і системно в моделі раку передміхурової залози у мишей. В інших доклінічних дослідженнях комбінована терапія НОE + анти-PD-L1 + агоністи TLR3 і TLR9 спільно індукувала інфільтрацію пухлин CD4+ і CD8+ клітин як локально, так і периферично [17]. Крім того, комбінована терапія модулювала пухлинне мікросередовище за допомогою збільшення кількості імуногенних макрофагів M1 і типових дендритних клітин 1-го типу та зменшення — імунотолерантних Т-регуляторних клітин, мієлоїдних супресорних клітин і плазмоцитоїдних дендритних клітин, що сприяло 100% повної ремісії як у моделях лімфоми, так і раку молочної залози, а також значно підвищило результати моно- або подвійної терапії. Останнім часом клінічні дослідження, що вивчають комбінацію НОE та інгібіторів контрольних точок, зосереджувалися переважно на запущених формах новоутворень підшлункової залози. У ретроспективному дослідженні, що охопило 85 пацієнтів із тяжкими формами раку підшлункової залози, встановлено середню тривалість життя 44 міс у групі, що отримувала НОE та торипалімаб (інгібітор анти-PD-1). Варто зазначити, що лише 15 із 85 пацієнтів отримували комбіновану терапію. У дослідженні також виявлено, що комбінована терапія стабільно збільшувала кількість клітин CD4+ і CD8+, специфічних до пухлини, та циркулювальних цитокінів, таких як IL-4, IL-5 та інтерферон-гамма. Подібні результати були також отримані у осіб з раком передміхурової залози та гепатоцелюлярною карциномою (рис. 7).
Також повідомлялося про поєднання алогенних NK-клітин з НОE для лікування раку підшлункової залози та первинної онкопатології печінки. У недавньому рандомізованому контрольованому дослідженні пацієнти з прогресуючим раком підшлункової залози, які отримували НОE поєднано з алогенними NK-клітинами, мали вищі показники загальної виживаності та виживаності без прогресування порівняно з пацієнтами, що отримували лише НОE (медіана загальної виживаності — 14,5 проти 11 міс; медіана виживаності без прогресування — 11 проти 8,5 міс). В іншому ретроспективному дослідженні 40 пацієнтів з гепатоцелюлярною карциномою IV стадії встановлено середню загальну виживаність 10,9 міс серед 20 хворих, які отримували НОE + терапію перенесенням NK-клітин, порівняно з 8,9 міс, зафіксованих у групі НОE. Отже, є дані, що комбінація НОE та імунотерапії посилює протипухлинну імунну відповідь та зумовлює сприятливі результати виживання.
Висновки
НОЕ є новітнім мінімально інвазивним методом фокальної терапії злоякісних новоутворень, який поєднує високу локальну ефективність із низьким рівнем ускладнень. Її нетермічний механізм дії забезпечує збереження архітектури критично важливих структур (судин, нервів, жовчних протоків), що робить НОЕ унікальною серед інших методів фокальної терапії.
Окрім локального впливу, НОЕ має виражений імуномодулювальний ефект та потенційно підвищує ефективність імунотерапії. Проте окремі експериментальні моделі вказують на можливість стимуляції метастазування через індукцію IL-6, що потребує подальших досліджень та контролю.
Порівняно з іншими абляційними методиками (RFA, MWA, кріоабляцією, HIFU), НОЕ зумовлює найвищу точність, безпеку при розташуванні біля критично важливих структур та високу імуногенність, що робить її однією з найбільш перспективних технологій у персоналізованій онкотерапії.
НОЕ має потенціал стати важливою складовою мультидисциплінарного підходу до лікування пацієнтів з локалізованими пухлинами — як у фокальній монотерапії, так і комбінованих схемах майбутнього.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТЕРИ
1. Gong, X., Chen, Z., Hu, J. J., & Liu, C. (2022). Advances of Electroporation-Related Therapies and the Synergy with Immunotherapy in Cancer Treatment. Vaccines, 10(11), 1942. doi: 10.3390/vaccines10111942.
2. Venyo, A. K. G. (2022). Irreversible Electroporation of Carcinoma of the Prostate Gland with a Focus on Localized Carcinoma of the Prostate Gland: A Review and Update. Journal of Clinical Research and Reports, 10(5). doi: 10.31579/2690-1919/239.
3. Wang, Z., Huang, W., Liu, J., Liu, Q., Wang, Q., Wu, Z., … Wang, Z. (2024). Percutaneous irreversible electroporation of renal cell carcinomas in an acquired solitary kidney: A primary study. Journal of Cancer Research and Therapeutics, 20, 1997–2003. doi: 10.4103/jcrt.jcrt_16_24.
4. Georgiev, T., & Todorov, G. (2023). Irreversible Electroporation for Cancer Treatment: A Review. Journal of IMAB, 29(4), 5286–5290. doi: 10.5272/jimab.2023294.5286.
5. Piecuch, D., Hańczyk, E., Sobota, W., & Piskorz, P. (2024). Application of irreversible electroporation ablation in oncology — a narrative review. Quality in Sport, 29, 55489. doi: 10.12775/QS.2024.29.55489.
6. Jürgens, J. H. W., Liehr, U.-B., & Wendler, J. J. (2016). Irreversible Elektroporation – ein neues Therapieverfahren auf dem Prüfstand. Interventionelle Radiologie Scan, 04(1), 69–86. doi: 10.1055/s-006-31303.
7. Kim, S. H., Kang, J. M., Park, Y., Kim, Y., Lim, B., & Park, J.-H. (2024). Effects of bipolar irreversible electroporation with different pulse durations in a prostate cancer mouse model. Scientific Reports, 14(1), 9902. doi: 10.1038/s41598-024-60413-y.
8. Malakauskaitė, P., Želvys, A., Zinkevičienė, A., Mickevičiūtė, E., Radzevičiūtė-Valčiukė, E., Malyško-Ptašinskė, V., … Novickij, V. (2024). Mitochondrial depolarization and ATP loss during high frequency nanosecond and microsecond electroporation. Bioelectrochemistry, 159, 108742. doi: 10.1016/j.bioelechem.2024.108742.
9. Peng, W., Polajzer, T., Yao, C., & Miklavčič, D. (2023). Dynamics of Cell Death Due to Electroporation Using Different Pulse Parameters as Revealed by Different Viability Assays. Annals of Biomedical Engineering, 52, 22–35. doi: 10.1007/s10439-023-03309-8</div.
10. Razakamanantsoa, L., Rajagopalan, N. R., Kimura, Y., Sabbah, M., Thomassin-Naggara, I., Cornelis, F. H., & Srimathveeravalli, G. (2023). Acute ATP loss during irreversible electroporation mediates caspase independent cell death. Bioelectrochemistry, 150, 108355. doi: 10.1016/j.bioelechem.2022.108355.
11. Lee, E. W., Thai, S., & Kee, S. T. (2010). Irreversible electroporation: A novel image-guided cancer therapy. Gut and Liver, 4(1), S99–S104. doi: 10.5009/gnl.2010.4.S1.S99.
12. Szlasa, W., Kiełbik, A., Szewczyk, A., Rembiałkowska, N., Novickij, V., Tarek, M., … Kulbacka, J. (2020). Oxidative effects during irreversible electroporation of melanoma cells — in vitro study. Molecules, 26(1), 154. doi: 10.3390/molecules26010154.
13. Rubinsky, B. (2007). Irreversible electroporation in medicine. Technology in Cancer Research & Treatment, 6(4), 255–259. doi: 10.1177/153303460700600401.
14. Xu, C., & Zhang, Y. (2021). Multi Physical Field Simulation of Irreversible Electroporation. Journal of Physics: Conference Series, 1861, 012058. doi: 10.1007/978-3-319-55113-5_3.
15. Alonso-González, R., Abadal Villayandre, J. M., Gálvez González, E., Álvarez Perez, M. J., Méndez Alonso, S., & de Gregorio Ariza, M. A. (2024). Irreversible electroporation: Beyond the limits of tumor ablation. Radiología (English Edition), 66(1), 47–56. doi: 10.1016/j.rxeng.2023.04.002.
16. Justesen, T. F., Orhan, A., Raskov, H., Nolsoe, C., & Gögenur, I. (2022). Electroporation and Immunotherapy—Unleashing the Abscopal Effect. Cancers, 14, 2876. doi: 10.3390/cancers14122876.
17. Zhang, N., Li, Z., Han, X., Zhu, Z., Li, Z., Zhao, Y., … Lv, Y. (2022). Irreversible electroporation: An emerging immunomodulatory therapy on solid tumors. Frontiers in Immunology, 12, 811726. doi: 10.3389/fimmu.2021.811726.
18. Hirata, T., Sugimoto, K., Soya, R., Kikuchi, Y., Kodama, Y., Ogawa, M., … Kakimi, K. (2025). Comparative analysis of systemic immune responses and metastatic risks in tumor ablation: An animal study of radiofrequency ablation and irreversible electroporation with immune modulation. Cardiovascular and Interventional Radiology, 48(4), 524–535. doi: 10.1007/s00270-024-03938-z.
Адреса для листування:
Мовчан Валентина Іванівна
03022, Київ, вул. Юлії Здановської, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: valyalimma@gmail.com
Correspondence:
Valentyna Movchan
Nonprofit Organization National Cancer Institute
33/43 Yulii Zdanovskoi str., Kyiv, 03022
E-mail: valyalimma@gmail.com














Leave a comment