Мультифокальний ріст недрібноклітинного раку легень як доказ джерела розвитку зі стовбурових клітин
Болгова Л.С., Мед В.В., Борисюк Б.О.
Резюме. Недрібноклітинний рак легень (НДКРЛ) є найбільш смертоносним злоякісним захворюванням у світі, що спонукає дослідників до поглибленого вивчення проблем його розвитку для підвищення ефективності лікування. Мета. Визначити особливості росту НДКРЛ за клінічними, макроскопічними і гістологічними дослідженнями операційного матеріалу. Матеріали і методи дослідження. Вивчені клінічні, макроскопічні особливості операційного матеріалу і гістологічна структура у 30 хворих (15 — залозистий і 15 — плоскоклітинний тип раку легень (РЛ)), яких обстежували і лікували в ДНП «Національний інститут раку». Використані моноклональні антитіла для визначення проліферативної активності клітин. Результати дослідження. Виявлено, що обидва гістологічні типи РЛ ростуть у вигляді декількох вузлів (40–53%), часто не мають чітких периферичних контурів у паренхімі легень і характеризуються поширеністю росту в 67%. У препаратах усіх 30 хворих виявлені ділянки бронхіолоальвеолярного РЛ та ріст пухлини від базальної мембрани альвеоли до її центру. Висновки. Установлено багатовузловий поширений ріст НДКРЛ та розвиток його зі стовбурових клітин (СК) від базальної мембрани альвеол до їх центру, описаний нами вперше в науковій літературі, і пояснює можливість мультицентричного, безсимптомного початку росту в одній чи декількох частках легень. Результати дослідження обґрунтовують необхідність пошуку удосконалення морфологічної діагностики і сучасної адекватної терапії.
Одержано 5.09.2025
Прийнято до друку 15.09.2025
DOI: 10.32471/clinicaloncology.2663-466X.34932
ВСТУП
Вивчення проблем РЛ є актуальним завданням учених усіх країн світу. Адже до цих пір залишається частою пізня діагностика на III–IV стадіях у 60–70% пацієнтів, що передбачає низьку ефективність лікування і високу смертність від цього захворювання [1, 5, 20]. Останніми роками з’явилися статті зарубіжних авторів, в яких вчені констатують швидкі рецидиви після хірургічного лікування навіть при І клінічній стадії РЛ [10, 21, 23, 25]. Ситуація, що склалася, потребує подальшого вивчення різних питань клінічного прояву і визначення адекватної терапії та профілактики. Слід нагадати, що 2 гістологічні типи РЛ, які найбільш часто трапляються в клінічній практиці — залозистий і плоскоклітинний, загальновизнано називати недрібноклітинним. Така об’єднана назва, мабуть, має під собою вагоме клінічне підґрунтя, а з боку морфолога, який вивчає питання гістогенезу РЛ, може свідчити про одне джерело їх розвитку.
Відомі окремі дані медичної літератури про гетерогенність структури РЛ, що може свідчити про одне джерело його розвитку [18].
Вивчення результатів фундаментальних досліджень авторів різних країн світу дозволило вияснити, що в легенях існує СК, якою є альвеолоцит ІІ типу (АТІІ) [2–4, 6, 7, 9, 11, 16]. Інші автори стверджують, що ці клітини розгалужуються впродовж усього бронхіального епітелію до кінцевих термінальних бронхіол [19]. Але в науковій літературі за результатами численних експериментальних і патологоанатомічних досліджень, присвячених питанням гістогенезу РЛ, до цього часу не існує обґрунтованої думки про визначене джерело розвитку РЛ [8, 12, 15, 22, 23].
Для уточнення морфологічних аспектів росту РЛ ми провели спеціальне дослідження.
Мета — визначити особливості росту НДКРЛ за клінічними, макроскопічними і гістологічними дослідженнями операційного матеріалу.
МАТЕРІАЛи та МЕТОДИ ДОСЛІДЖЕННЯ
Вивчені клінічні, патологоанатомічні (макроскопічні) особливості операційного матеріалу і гістологічна структура у 30 хворих (15 — залозистий тип і 15 — плоскоклітинний тип РЛ), яких обстежували і лікували в ДНП «Національний інститут раку» у 2023–2024 рр. У разі вивчення макроскопічних досліджень операційного матеріалу звертали увагу на локалізацію і кількість пухлинних вузлів, їх розмір, чіткість периферичних контурів, відношення пухлинного вузла до бронхів, наявність екзофітного росту РЛ у бронхах, відстань від периферичного краю пухлинного вузла до найближчого бронха, ураження вісцеральної плеври, наявність метастазів і їх локалізацію. За гістологічною структурою визначали наявність в одному пухлинному вузлі ділянок різних гістологічних типів РЛ — залозистого, плоскоклітинного та бронхіолоальвеолярного. Вивчали також напрямок росту РЛ в альвеолах від базальної мембрани до її центру. Гістологічні препарати забарвлювали гематоксиліном і еозином, за методом Папаніколау, проводили реакції з моноклональними антитілами (фірми Dako) — Кi-67, ядерним антигеном проліферувальних клітин (Proliferating Cell Nuclear Antigen — PCNA) для визначення ступеня проліферації клітин. Результати макроскопічних і гістологічних даних зіставили з характером і об’ємом оперативних втручань. Оцінка гістологічних типів РЛ проводилася згідно із сучасною Міжнародною гістологічною класифікацією Всесвітньої організації охорони здоров’я (ВООЗ) [24].
РЕЗУЛЬТАТИ ДОСЛІДЖЕННЯ й ОБГОВОРЕННЯ
Вивчали матеріали хворих, яких обстежували й оперували в плановому порядку в ДНП «Національний інститут раку». Хворі були у віковому діапазоні 41–77 років. Середній вік хворих на залозистий рак становив 57,3±2,7, плоскоклітинного — 61,8±2,3 року. Залозистий РЛ виявлений у 11 чоловіків і у 4 жінок, а плоскоклітинний — у 14 чоловіків і у 1 жінки.
Виявлені численні клінічні, патологоанатомічні (макроскопічні) і гістологічні особливості, а також визначена їх частота у хворих з НДКРЛ і для зручності сприйняття представлені в таблиці.
| Клініко-морфологічна ознака | Залозистий рак, n=15 | Плоскоклітинний рак, n=15 | ||
| n | % | n | % | |
| Ураження легені: | ||||
|
12 | 80,0 | 9 | 60,0 |
|
3 | 20,0 | 6 | 40,0 |
| Оперативне втручання: | ||||
|
11 | 73,3 | 12 | 80,0 |
|
4 | 26,7 | 2 | 13,3 |
|
– | – | 1 | 6,7 |
| Наявність екзофітного росту в бронхах | 4 | 26,7 | 2 | 13,3 |
| Відстань ракової пухлини від бронхів (0,5–3,5 см) | 4 | 26,7 | 9 | 60,0 |
| Наявність багатовузлової пухлини | 8 | 53,3 | 6 | 40,0 |
| Проростання пухлини в плевру | 7 | 46,7 | 6 | 40,0 |
| Наявність метастазів у: | ||||
|
8 | 53,3 | 6 | 40,0 |
|
– | – | 1 | 6,7 |
|
– | – | 1 | 6,7 |
| Поширеність злоякісного процесу | 10 | 66,7 | 10 | 66,7 |
Як зазначено в таблиці, отримані абсолютні та відсоткові дані показників ураження правої легені, виконаної білобектомії та наявність екзофітного росту частіше відмічалися у хворих із залозистою карциномою. Інші показники досить близькі за частотою в обох гістологічних типах РЛ. Звертають на себе увагу однакові показники метастатичного ураження (по 53%) і поширеності ракового процесу (по 67%) у хворих на залозистий і плоскоклітинний типи РЛ, що опосередковано може підтверджувати 1 джерело їх розвитку і близькі клінічні прояви. Важливо підкреслити, що наявність багатовузлової структури і в залозистому, і плоскоклітинному РЛ свідчить про множинні джерела початку розвитку обох гістологічних типів новоутворень. Цими джерелами можуть бути СК, які розгалужуються по всій паренхімі легень [19]. Давно також визначено, що всі патологічні процеси в легенях починаються з термінальної бронхіоли, тому логічно констатувати, що РЛ — одна із форм захворювань легень. Це положення затверджено Міжнародною номенклатурою IUPAC.
Завдяки аналізу виконаних квантитативних досліджень виявлено багатовузлові ураження (53%), наявність екзофітного росту в бронхах (27%) порівняно з відповідними даними (40 і 13%) у разі плоскоклітинного раку свідчить про більш агресивний клінічний перебіг у хворих на залозистий РЛ (див. таблицю).
Гістологічні дослідження НДКРЛ дозволили виявити низку особливостей.
Так, у гістологічних препаратах залозистої карциноми (рис. 1, 2) різного ступеня диференціювання у 2 (13,3%) хворих установлений аденосквамозний тип РЛ. За макроскопічними даними у 2 (13,3%) хворих пухлинні вузли «зливалися» між собою, тобто не мали чітких периферичних контурів, ще у двох (13,3%) — визначався беззаперечний дифузний ріст залозистого РЛ. Крім того, в усіх гістологічних препаратах 15 хворих визначені ділянки бронхіолоальвеолярного типу РЛ. Імуногістохімічні дослідження з моноклональними антитілами (Кі-67 і PCNA) дозволили підтвердити початок росту НДКРЛ від базальної мембрани (рис. 3, 4).
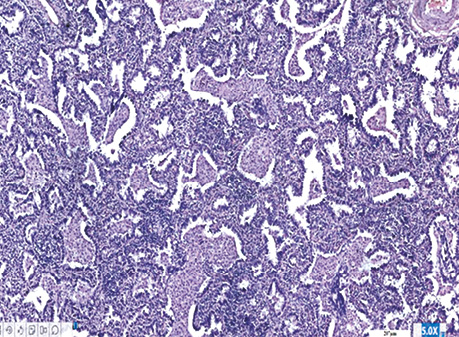
Рис. 1. Залозистий рак. Характерна гістологічна структура в альвеолах і поза ними. Гістологічний препарат, гематоксилін і еозин, ×200
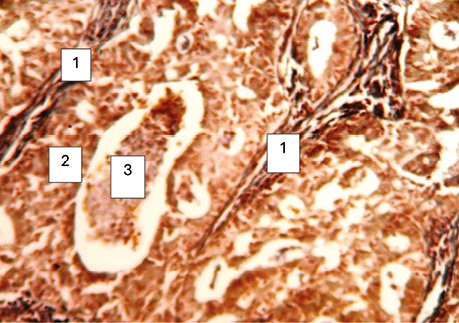
Рис. 2. Залозистий рак. Ріст пухлини в альвеолах: міжальвеолярні перетинки (1); ріст пухлини в альвеолі (2); некротичні маси (як наслідок патоморфозу раку) (3). Гістологічний препарат, Howell W., Black D., ×1000
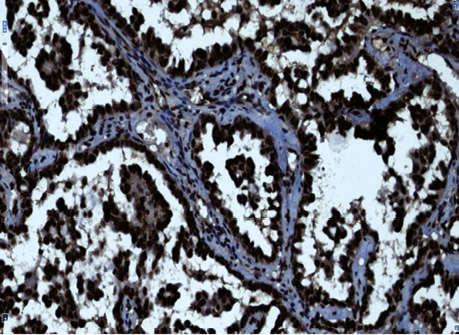
Рис. 3. Залозистий рак. Позитивна імуногістохімічна реакція з PCNA в базальних клітинах пухлини, яка росте в альвеолах. Гістологічний препарат, ×400
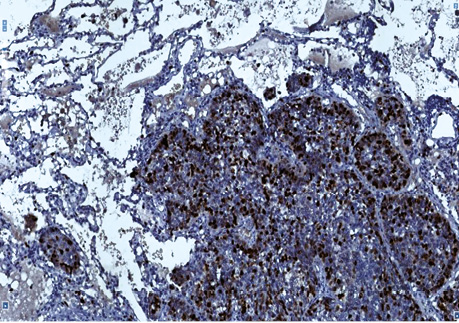
Рис. 4. Плоскоклітинний рак. Позитивна імуногістохімічна реакція з Кі-67 в базальних клітинах пухлини, яка росте в альвеолах. Гістологічний препарат, ×400
Аналіз гістологічного дослідження плоскоклітинного РЛ різного ступеня диференціювання також дозволив виявити деякі структурні особливості (рис. 4–6). У 1 хворого встановлено поширений пухлинний процес — виявлені пухлинні вузли в усіх 3 видалених під час операції частках правої легені, ще у 1 хворого новоутворення було без чітких периферичних контурів. За біопсійним матеріалом 1 хворого встановлений плоскоклітинний РЛ, а за операційним — аденосквамозний тип. Крім того, детальне вивчення гістологічної структури плоскоклітинного РЛ у всіх 15 хворих дозволило виявити ділянки з ростом пухлини в альвеолах з характерним напрямком росту від базальної мембрани до її центру.
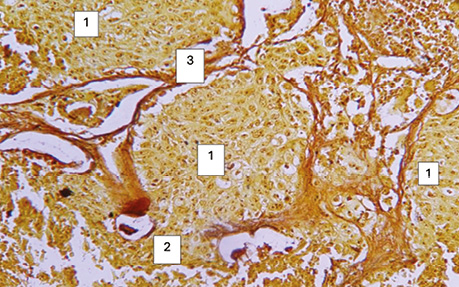
Рис. 5. Помірнодиференційований плоскоклітинний рак легень. Ріст пухлини в альвеолах (1), проростання базальної мембрани і подальший солідний її ріст (2), міжальвеолярні перетинки (3). Гістологічний препарат, забарвлення за Howell W., Black D., ×1000
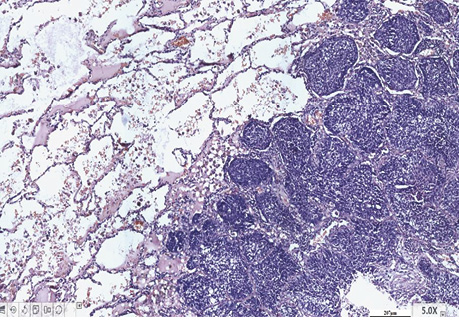
Так, детальне вивчення гістологічної структури обох типів РЛ дозволило виявити ділянки бронхіолоальвеолярного типу, а також ріст пухлини від базальної мембрани до центру альвеол, що підтверджується численними структурними та імуногістохімічними ознаками, свідчить про подібні морфологічні особливості обох гістологічних варіантів РЛ і підтверджує обґрунтованість і об’єднаність їх назви — недрібноклітинний тип. Виявлення численних морфологічних подібних структурних ознак у гістологічних препаратах залозистого і плоскоклітинного типів РЛ дозволяє підтвердити їх один генез.
Доречно згадати про результати вчених, які на експериментальних моделях довели, що місце переходу базального епітелію бронхів в альвеолярний є найменш стійким до шкідливих подразників і може бути тою локалізацією, де бере свій початок РЛ [12–14, 17]. Проведені нами дослідження збігаються за ідеологією наукових пошуків названих авторів і підтверджуються нашими морфологічними даними.
Виявлені нами макроскопічні та гістологічні структурні ознаки залозистого і плоскоклітинного РЛ дозволили підтвердити, що згадані типи РЛ характеризуються не тільки класичними гістологічними ознаками, за якими згідно з Міжнародною гістологічною класифікацією ВООЗ [24] установлюється гістологічний тип РЛ, але зафіксовані й структурні ознаки, які свідчать про схожість цих 2 типів РЛ. У той же час виявлені близькі структурні ознаки, які можуть свідчити про одне джерело їх розвитку, яким є СК легень.
ВИСНОВКИ
1. Завдяки макроскопічному дослідженню операційного матеріалу 30 хворих на НДКРЛ ідентифіковано значне поширення пухлинного процесу (67%) по паренхімі легень.
2. Виявлені багатовузлові ураження у хворих на залозистий рак у 8 (53%) і на плоскоклітинний — у 6 (40%), які свідчать про мультифокальний початок їх розвитку.
3. Зважаючи на те що СК знаходяться у всіх альвеолах легень, яких в організмі людини налічується 300–400 млн, цей достовірний факт може пояснити мультифокальний розвиток РЛ, що ми спостерігали у виконаних дослідженнях.
4. Результати наших досліджень доповнили відомі дані наукової літератури, але вперше продемонстрували на гістологічних та імуногістохімічних препаратах напрямок росту НДКРЛ від базальних клітин альвеоли до її центру і таким чином розкрили сутність безсимптомного початку, пролонгації та фатального клінічного перебігу захворювання.
5. Проведені нами дослідження збігаються з результатами фундаментальних даних учених різних країн світу про наявність СК у легенях, які є джерелом розвитку РЛ в будь-якій частці та навіть у декількох з них одночасно.
6. Результати проведених досліджень підтверджують можливість ураження СК в усіх частках легень, що обґрунтовує необхідність перегляду підходів до удосконалення морфологічної й рентгенологічної діагностики, раціонального лікування і створення нових програм профілактики РЛ.
CПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Верьовкіна, Н. О. (2018). Останні досягнення імунотерапії в лікуванні онкологічних пацієнтів: застосування імунотерапії при недрібноклітинному раку легені. Клінічна онкологія, 4(32), 228–231. [Veryovkina, N. O. (2018). Recent advances in immunotherapy in the treatment of cancer patients: the use of immunotherapy in non-small cell lung cancer. Clinical oncology, 4(32), 228–231. Ukrainіan].
2. Загорулько, А. К., & Аскари, Т. А. (2002). Атлас ультраструктурной морфологии респираторного отдела легких. Симферополь: «AZ — PRESS» — «СОНАТ». [Zagorulko, A. K., & Askary, T. A. (2002). Atlas of ultrastructural morphology of the respiratory department of the lungs. Simferopol: «AZ — PRESS» — «SONAT». Ukrainіan].
3. Туганова, Т. Н, & Болгова, Л. С. (2011). Сравнительные данные цитогенетических показателей альвеолярного эпителия и опухолевых клеток при плоскоклеточном раке легкого. Клиническая онкология, 3(3), 102–106. [Tuganova, T. N. & Bolhova, L. S. (2011). Comparative data of cytogenetic indicators of alveolar epithelium and tumor cells in squamous cell lung cancer. Clinical oncology, 3(3), 102–106. Ukrainіan].
4. Туганова, Т. Н., Болгова, Л. С., & Ярощук, Т. М. (2011). Исследования
ядрышковых организаторов хромосом и эпителия паренхимы легкого для
уточнения гистогенеза железистого рака. Онкология, 13(1), 17–21.
[Tuganova, T. N., Bolhova, L. S., & Yaroschuk, T. M. (2011).
Studies of nuclear organizers of chromosomes and lung parenchyma epithelium to
clarify the histogenesis of glandular cancer. Oncology, 13(1), 17–21. Ukrainіan].
5. Федоренко, З. П., Сумкіна, О. В., Горох, Є. Л., & Гулак, Л. О. (2023). Рак в Україні, 2021–2022. Захворюваність, смертність, показники діяльності онкологічної служби. Бюлетень Національного канцер-реєстру України (Vol. 24). Кропивницький: Поліум. [Fedorenko, Z. P., Sumkina, O. V., Gorokh, E. L., & Hulak, L. O. (2023). Cancer in Ukraine, 2021–2022. Incidence, mortality, indicators of oncological service activity. Bulletin of the National Cancer Registry of Ukraine (Vol. 24). Kropyvnytskyi: Polium. Ukrainіan].
6. Beers, M. Y., & Moodley, Y. (2017). When Is an Alveolar Type 2 Cell an Alveolar Type Cell? А Conundrum for Lung Stem Cell Biology and Regenerative Medicine. American Journal of respiratory cell and molecular biology, 57, 118–127. doi.org/10.1165/rcmb.2016-0426PS.
7. Bertoncello, I. (2015). Stem Cells in the Lung. Development, Repair and Regeneration. Springer.
8. Bolgova, L., Shypko, A., Tuganova, T., Alekseenko, O., Smolanka, I., Ponomarenko, A., & Bilko, N. (2023). New data on histogenesis and histological structure of lung cancer. Experimental oncology, 45(1), 62–69. doi.org/10.15407/exp.- oncology.2023.01.062.
9. Desai, T. J., Brownfield, D. G., & Krasnow, M. A. (2014). Alveolar progenitor and Stem cells in lung development, renewal and cancer. Nature, 507(7491), 190–194.
10. Eguchi, T., Warth, A., Yeh, Y. C., Nitadori, J. I., Woo, K. M., Chou, T. Y., … Adusumilli, P. S. (2019). Procedure-specific risk prediction for recurrence in patients undergoing lobectomy or sublobar resection for small (<2 cm) lung adenocarcinoma: an international cohort analysis. Journal of Thoracic Oncology, 14(1), 72–86. doi: 10.1016/j.jtho.2018.09.008.
11. Eramo, A., Lotti, F., & Sette, G. (2008). Identification and expansion of the tumorigenic lung cancer stem cell population. Cell Death & Differentiation, 15(3), 504–514.
12. Ferone, G., Lee, M. C., Sage, J., & Berns, A. (2020). Cells of origin of lung cancers: lessons from mouse studies. Genes & Development, 34(15–16), 1017–1032. doi: 10.1101/gad.338228.120.
13. Frank, D. B., Penkala, I. J., Zepp, J. A., Sivakumar, A., Linares-Saldana, R., Zacharias, W. J., … Morrisey, E. E. (2019). Early lineage specification definesalveolar Epithelial ontogeny in the murine lung. Proceedings of the National Academy of Sciences of the United States of America, 116(10), 4362–4371. doi.org/10.1073/pnas.1813952116.
14. Hanna, J. M., & Onaitis, M. W. (2013). Cell of origin of lung cancer. Journal of Carcinogenesis and Mutagenesis, 12, 6. doi: 10.4103/1477-3163.109033.
15. Have-Opbroek, A. A., Benfield, J. R., van Krieken, J. H., & Dijkman, J. H. (1997). The alveolar type II cell in the genesis of human adenocarcinomas and squamous cell carcinomas. Histopathology, 12, 319–336.
16. Heng, W. S., Gosens, R., & Kruyt, F. (2019). Lung cancer stem cells: origin, features, maintenance mechanisms and therapeutic targeting. Biochemical Pharmacology, 160, 121–133. doi.org/10.1016/j.bcp.2018.12.010.
17. Hogan, B. L., Barkauskas, C. E., Chapman, H. A., Epstein, J. A., Jain, R., Hsia, C. C., … Morrisey, E. E. (2014). Repair and Regeneration of the Respiratory System: Complexity, Plasticity, and Mechanisms of Lung Stem Cell Function. Cell Stem Cell, 15(2), 123–138. doi.org/10.1016/j.stem.2014.07.012.
18. Lin, M. W., Su, K. Y., Su, T. J., Chang, C. C., Lin, J. W., Lee, Y. H., … Hsieh, M. S. (2018). Clinicopathological and genomic comparisons between different histologic components in combined small cell lung cancer and non-small lung cancer. Lung Cancer, 125, 282–290. doi: 10.1016/j.lungcan.2018.10.006.
19. Navarro, S., & Driscoll, B. (2017). Regeneration of the Aging Lung: A Mini-Review. Gerontology, 63(3), 270–280. doi.org/10.1159/00045108.
20. Sung, H., Ferlay, J., Siegel, R. L., Laversanne, M., Soerjomataram, I., Jemal, A., & Bray, F. (2021). Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. Cancer Journal for Clinicians, 71(3), 209–249. doi.org/10.3322/caac.21660.
21. Toyokawa, G., Yamada, Y., Tagawa, T., Kozuma, Y., Matsubara, T., Haratake, N., … Maehara, Y. (2018). Significance of spread through air spaces in resected pathological Stage I lung adenocarcinoma. Annals of Thoracic Surgery, 105, 1655–1663. doi: 10.1016/j.athoracsur.2018.01.037.
22. Travis, W., Nicholson, S., & Hirsch, F. R. (2004). Pathology and genetics of Tumours of the Lung, Pleura, Thymus and Heart. IARC Press.
23. Travis, W. D., Eisele, M., Nishimura, K. K., Aly, R. G., Bertoglio, P., Chou, T. Y., … Asamura, H. (2024). The International Association for the Study of Lung Cancer (IASLC) Staging Project for Lung Cancer: Recommendation to Introduce Spread Through Air Spaces as a Histologic Descriptor in the Ninth Edition of the TNM Classification of Lung Cancer. Analysis of 4061 Pathologic Stage I NSCLC. Journal of Thoracic Oncology, 9(7), 1028–1051. doi: 10.1016/j.jtho.2024.03.015.
24. World Health Organization (2021). Publication of the WHO Classification of Tumours (5th ed.), V. 5. Retrieved from http://www.iarc.who.int/news-events/ publication-of-the-
who-classification-of-tumours- 5th-edition-volume-5-thoracic-tumours.
25. Yi, E., Bae, M., Cho, S., Chung, J. H., Jheon, S., & Kim, K. (2018). Pathological prognostic factors of recurrence in early stage lung adenocarcinoma. ANZ Journal of Surgery, 88(4), 327–331. doi: 10.1111/ans.14033.
Адреса для листування:
Болгова Лідія Севастянівна
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: bolgova2006@ukr.net
Correspondence:
Lidiya Bolgova
33/43 Yulii Zdanovskoi str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: bolgova2006@ukr.net














Leave a comment